II. Квантово-механическое представление в органической химии
| Вид материала | Реферат |
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 425.07kb.
- Утверждаю, 318.85kb.
- Методы органической химии, 158.45kb.
Содержание:
| I. | Введение……….……………………………………..…………..………………………. | |
| II. | Квантово-механическое представление в органической химии….......................... | |
| 1. | Квантово-механическое представление в органической химии……………………..... | |
| 2. | Химические связи…………………………………………………………………..…….. | |
| III | Углеводороды………………………………………………...……................................. | |
| 1. | Классификации углеводородов, реакций, разрывов связей и реагентов………….…. | |
| 2. | Изомерия…………………………………………………………………………......…… | |
| 3. | Алканы……………………………………………………………………………………. | |
| IV. | Спирты…………………………………………………………...……...……………….. | |
| V. | Простые эфиры…….…………….………………………….………………..…………. | |
| VI. | Альдегиды и кетоны (карбонильная группа)…………...…………………………….. | |
| VII. 1. 2. | Органические кислоты………………………………………………………………… Примеры органических кислот…………………….…………………………………… Карбоновые кислоты………………………………………………..…….……………… | |
| VIII. 1. 2. 3. | Сложные эфиры…..………………………………………………….….………………. Сложные эфиры….………………………………………………………..……………… Жиры, масла и их поверхностно-активные свойства…………..……………………… Воска………………………………………………………………………………………. | |
| IX. | Амины…………………………………………………………………………………...... | |
| X. | Амиды…………………………………………………………………………………….. | |
| XI. | Гетероциклические соединения азота……………………………………………….. | |
| XII. | Белки……………………………………………………………………………………… | |
| XIII. | Углеводы (сахара)…...………………………………………………………………….. | |
| XIV. | Полимеры……………………………………………………………………………….. | |
| XV. | Топливо…………………………………………………………………………………... | |
| XVI. | Органические методы очистки воды…………….………………………………….. | |
| XVII. | Многостадийные задачи в органической химии…………………………………… | |
I. Введение
Органическая химия – химия, углеводородов и их соединений.
В современном понимании, Фридрих Веллер разделил органическую и неорганическую химию. Он первый получил органическое вещество (мочевину) из неорганических веществ.
Опыт Веллера:
NH3+HCl→NH4Cl
NH3+HOCN→NH4OCN (цианид аммония)
NH4OCN↔(NH2)2CO (мочевина)
В 40-е годов XIX в. была сокрушена теория Витализма*. Появился органический синтез. На сегодняшний день количество органических соединений превышает 20 млн.
С увеличение количества органических веществ возникла необходимость в их классификации. Проводя органический синтез, ученые обнаруживали все больше закономерностей при переходе одного вещества в другое. Как следствие этого, понадобились способы классификации органических веществ. Начали возникать различные теории. Например, теория группировки и радикальная теория. По последней предполагали, что радикалы не изменяются а переходят из одного соединения в другое.
Пример.
C2H5OH;
C2H5Cl; (гидрохлорид этерина)
C2H5 – O – C2H5;
Здесь C2H5 – радикал. А также спирт и эфир являлись гидроксид этерином.
Пример.




 O O
O OC
 6H5 – C → C6H5 – C
6H5 – C → C6H5 – C H OH
Но эта теория не могла объяснить тот факт, что возможна замена радикала на другие атомы, а природа вещества остается той же.
Пример.

 O
OC
 H3 – C (уксусная кислота)
H3 – C (уксусная кислота)OH

 O
OC
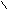 l – CH2 – C (хлоруксусная кислота)
l – CH2 – C (хлоруксусная кислота)OH
В дальнейшем теорию радикалов сменила теория Типов. По этой теории одно и тоже вещество могло быть отнесено к одному из пяти различных типов:
- Водород;
- Вода;
- Метан;
- Хлористый водород;
- Аммиак.
Пример.
CH4→ СН3 – H → к водороду
CH3OH → CH3 – O – H → к воде
Так как одно и то же вещество можно было отнести сразу к нескольким типам, то это приводило к разночтениям и позволяло описывать только простые вещества. Решил эту проблему систематизаций органических веществ Бутлеров.
Теория Бутлерова (1868)
Теория Бутлерова содержит в себе шесть положений:
1положение. Атомы в молекулах соединены в определенной последовательности так, что свободных валентностей не остается.
2положение. Последовательность, по которой соединены атомы, отражает химическое строение молекулы.
3положение. Свойства веществ зависят не только от числа и природы атомов, входящих в состав молекулы вещества, но и от химической структуры.
4положение. Вещества, имеющие одинаковый качественный и количественный состав, т.е. одинаковую молекулярную формулу, но различное химическое строение, поэтому обладающие различными свойствами, называются изомерами.
5положение. Атомы в молекулах оказывают друг на друга определенное влияние. При чем влияют не только непосредственно связанные (соседние) атомы, но и дистанцированные атомы.
6положение. Химическое строение вещества можно определить по результатам химических реакций. И наоборот, по строению вещества можно прогнозировать реакции.
Следствие. Каждое вещество должно иметь одну химическую формулу, отражающую его строение.
Пример.
C2H6O
СH3 – CH2 → Oδ-← Hδ+ – этиловый спирт.
Это вещество жидкость, т.к. есть положительно поляризованный атом водорода.
C2H5 – O δ-← Hδ+
•
•
•
O ← C2H5
|
H
CH3 – O – CH3 – диэтиловый эфир. А это уже газ.
- Квантово-механическое представление
в органической химии
- Квантово-механическое представление в органической химии
Строение атома углерода и других биогенных элементов
Все многообразие органических соединений может быть объяснено только особенностями электронного строения атома углерода, его способностью образовывать прочные электронные связи между собой и другими химическими элементами.
Углерод – самый маленький из четырехвалентных атомов. Поэтому облака углеродов перекрывают друг друга в достаточной степени для образования связи между собой. Это является причиной появления мощной области электронной связи.
6С12
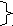 1p+=6 Ядро 1s2 2s2 2p2
1p+=6 Ядро 1s2 2s2 2p2




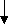
 1n0=6
1n0=6 e–=6
В обычном (стационарном) состоянии в атоме углерода два неспаренных электрона. Следовательно, углерод в этом состоянии двухвалентен.
С*: 1s2 2s1 2p3





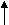
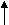
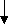
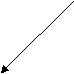
При сообщении атому дополнительной энергии, он переходит в возбужденное состояние (С*). Эта энергия затрачивается на разъединение 2s2 электронов и на переход одного из них на 2p орбиталь.







 Y E
Y E2
 py
py 
 2pz
2pzLсв.




 X
X∆E r
E – энергия
 2px Emin r – радиус
2px Emin r – радиусZ ∆E – энергия связи
Энергия связи – энергия, которая выделяется при образовании связи. Система с меньшей энергией более стабильна. Связанная система обладает меньшей энергией.


+ е– е– +


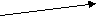
+ е– е– +


 е–
е– 
 + +
+ +е–

 -оптимальное расстояние, соответствующее минимальной энергии.
-оптимальное расстояние, соответствующее минимальной энергии. + + При дальнейшем сближении электроны будут отталкиваться.
Характеристики связей: энергия связи, длина, полярность, угол между связями.
Если бы атом углерода образовывал четыре ковалентных связи (СН4) с помощью исходных атомных орбиталей, то все связи были бы не равноценны по своим характеристикам. Но опыт показывает, что все связи в атоме углерода равноценны. Этот феномен может быть объяснен с точки зрения гибридизации. В результате этого процесса из исходных орбиталей, различающихся по форме и положению в пространстве, образовываются гибридные атомные орбитали.
Валентные состояния четырех валентного углерода:
I валентное состояние (Sp3-гибридизация)
(S+px+pz+py)
Sp3+ Sp3+ Sp3+ Sp3
 …2(Sp3)4
…2(Sp3)4






 СН4
СН4




 109°28’
109°28’





Области перекрывания равны.

Из-за направления связей молекула выглядит так:





Sp3 могут перекрываться с орбиталями других форм, образуя одну область перекрывания, расположенную по оси, соединяющей ядра атомов (осевое перекрывание). Как следствие – одинарная связь (σ).
II валентное состояние (Sp2-гибридизация)
(S+px+pz)+py
S
 p2+ Sp2+ Sp2+p
p2+ Sp2+ Sp2+p 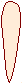 …2(Sp2)32р1
…2(Sp2)32р1
σ

 +π π связь – только не
+π π связь – только не 


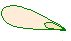 гибридизованные орбитали.
гибридизованные орбитали.









120°
Это плоская молекула.
Две области перекрывания расположены по обе стороны от оси
(параллельно друг другу).
π связь образуется только между уже связанными атомами.
Она накладывается на имеющуюся связь и образует кратную связь.
Пример.
С2Н4
Н2С=СН2




















3 валентное состояние (Sp-гибридизация)
(S+px)+pz+py
Sp+ Sp+ p+p
…2(Sp)2(р)2
 Sp менее вытянута, чем Sp3.
Sp менее вытянута, чем Sp3.

S

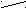
 py Spz
py Spz Sp
 S + π + π
S + π + π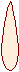





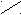




 Пространственная плоская линейная структура
Пространственная плоская линейная структура Sp 180° Пространственная конфигурация молекул обусловлена направлением в
пространстве атомных орбиталей, образующих связь.
Пример.
С2Н2
Н – С ≡ С – Н