II. Квантово-механическое представление в органической химии
| Вид материала | Реферат |
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 425.07kb.
- Утверждаю, 318.85kb.
- Методы органической химии, 158.45kb.
3. Алканы (СnH2n+2)
Нефть. Фракционная перегонка сырой нефти.
Сырая нефть состоит примерно из 150 соединений. Они плохо горят. Сырую нефть подвергают фракционной перегонке.
| Название фракции | Температура кипения (°С) | Число атомов водорода | Использование |
| Газ | 20 | 1-4 | Топливо. |
| Пертолейный эфир | 20-100 | 5-7 | Растворители. |
| Бензин | 35-205 | 5-12 | Горючее для двигателей внутреннего сгорания. |
| Керосин | 175-300 | 12-18 | Горючее для реактивных двигателей. |
| Солярное масло (газойль) | 200-400 | 14-25 | Испаряется с трудом.
|
| Смазочное масло | труднолетучее | 20-34 | Смазка. |
| Парафин | твердая часть, выделяющаяся из масел | 25-40 |
|
| Битум | остаток | от 30 | Покрытие дорог. |
Из фракций перегонки нефти получают пластмассы, краски, растворители, резины, моющие и лекарственные средства и многое другое.
Физические свойства алканов:
- Электроотрицательность;
Э.О. (С) = 2,5
Э.О. (Н) = 2,1
Следовательно, Сδ – ← Нδ+
Имеют небольшой дипольный момент. Смещение электронной плотности к атому углерода. Из-за небольшого дипольного момента силы Ван-дер-Ваальса малы, и поэтому:
низшие алканы – газы;
с С5 по С17 – жидкости;
с С18 и выше – твердые тела.
Линейные молекулы высших гомологов могут располагаться относительно друг друга так, что дипольные силы Ван-дер-Ваальса действуют по всей длине. А, следовательно, происходит сцепление молекул.
- Алканы легче воды и с ней не взаимодействуют, т.к. не могут образовать водородные связи.
∆G > 0 – энергетически не выгодно.
Реакции
- Горение;
СН4↑ + 2О2↑ → СО2↑ + 2Н2О + 890кДж
∆Н = – 890кДж/Моль
Жидкие алканы горят только в виде паров.
С8Н18 + 12,5О2 → 8СО2 + 9Н2О
∆Н = – 5510кДж/Моль (эта реакция протекает в двигателе внутреннего сгорания)
При недостатки кислорода вместо углекислого газа (СО2) выделяется угарный газ (СО). Атомы угарного газа, соединяясь с гемоглобином крови (красные кровяные тельца), образуют стабильный комплекс карбоксигемоглобина. В результате чего, гемоглобин перестает переносить кислород.
В двигателях внутреннего сгорания сжатие воздушной смеси может привести к детонации. По этой причине используют топливо с антидетонационными свойствами, т.е. изооктан (2,2,4 триметилпентан).
СН3 СН3
| | (октановое число = 100)
СН3 – С – СН2 – СН – СН3
|
СН3
У гептана октановое число = 0, так как он легко воспламеняется.
Октановое число бензина получают, сравнивая его антидетонационные свойства со свойствами смеси изооктан + гептан.
Если значение октанового числа 95, то это означает, что антидетонационные свойства такие же как у смеси из 95% изооктана и 5% гептана.
2) Крекинг;
Крекинг – расщепление высших алканов в низшие, при высокой температуре.
450°С

Al2O3 или SiO2
2СН3 – СН2 – СН3 СН4 + СН3 – СН = СН2 + С2Н4 + Н2↑
3) Алкилирование;
Алкилирование применяют для получения разветвленных алканов.
С
 Н3 – СН = СН – СН2 – СН3 + СН3 – СН – СН3 → СН3 – СН2 – СН – СН2 – СН3
Н3 – СН = СН – СН2 – СН3 + СН3 – СН – СН3 → СН3 – СН2 – СН – СН2 – СН3| |
СН3 СН3 – С – СН3
|
СН3
2,2-диметил 3-этил пентан
4) Риформинг;
Риформинг – превращение алканов в ароматические соединения.
500°С, 40атм.
 С6Н14 Al4O3 С6Н6 + 4Н2
С6Н14 Al4O3 С6Н6 + 4Н2 Если в качестве катализатора используют платину, тогда этот процесс называют платформингом.
Pt
С
 Н3 – (СН2)5 – СН3 С6Н5 – СН3 + 4Н2
Н3 – (СН2)5 – СН3 С6Н5 – СН3 + 4Н25) Галогенирование;
Данная реакция является цепной и фотохимической.
hν
 С6Н14 + Br2 С6Н13Br + HBr
С6Н14 + Br2 С6Н13Br + HBrЛюбая химическая реакция состоит из трех стадий:
- Инициирование;
Под действием света молекула галогена распадается на два радикала.
hν
 Br2 2Br •
Br2 2Br •- Рост цепи;
hν

hν
С6Н14 + Br• С6Н13Br + H•
 С6Н14 + Br• С6Н13 • + HBr
С6Н14 + Br• С6Н13 • + HBr- Обрыв цепи.
Взаимодействие двух радикалов.
hν
 С6Н13 • + Н• С6Н14
С6Н13 • + Н• С6Н14 6) Нитрование;
kat, 400°C
С
 2Н6 + HNO3 С2Н5NO2 + H2O
2Н6 + HNO3 С2Н5NO2 + H2O IV. Спирты
Классификации
По количеству радикалов:
- Первичные; 2) Вторичные; 3) Третичные.
H R2 R2
| | |
R – C – OH; R1 – C – OH R1 – C – OH
| | |
H Н R3
По количеству ОН групп:
- Двухатомные;
Пример.
СН2 – СН2
| | Применяется в качестве растворителя и антифриза для
ОН ОН заливки в радиаторы автомобиля.
Этиленглюколь
2) Трехатомные.
Пример.
СН2 – СН – СН2
| | | Применяется для производства взрывчатого вещества.
ОН ОН ОН
Глицерин
Пример.
Н2SO4 (к)
С
 Н2 – СН – СН2 + 3HNO СН2 – СН – СН2 + 3Н2О
Н2 – СН – СН2 + 3HNO СН2 – СН – СН2 + 3Н2О| | | | | |
ОН ОН ОН ОNO2 ОNO2 ОNO2
Ароматические спирты
СН2 – ОН
| Бензиловый спирт

Задание.
Назовите соединение:
С6Н5 – СН2 – СН2 – ОН
Ответ: 2 фенил-этанол.
Ароматические спирты по своим свойствам близки к алифатическим.
Фенолы
ОН
| С6Н5 ОН

Константа диссоциации (равновесия) (Kg).
Константа диссоциации фенолов меньше чем у спиртов.
Пример.
С6Н5ОН → С6Н5О¯ + Н+
Kg =
 [С6Н5О¯ ] [Н+]
[С6Н5О¯ ] [Н+] [С6Н5 ОН]
Если отщепляется ион водорода, то – константа кислотности (Кк)
У фенолов Kg в 106 раз больше, чем у спиртов.
Kg (спирт) = 10-16
Kg (вода) = 10-14
Спирт как кислота более слабый, чем вода.
Ферментативный синтез этанола (при брожении сахаров)
- Из глюкозы (процесс вызывается ферментами);
Фрукты содержат глюкозу (С6Н12О6).
Дрожжи – живые одноклеточные организмы, содержащие фермент – зимазу (катализатор реакции). Они являются ферментами (катализаторами) при брожении.
В вине около 12% С2Н5ОН, так как при увеличение концентрации дрожжи гибнут и брожение прекращается.
дрожжи
С
 6Н12О6 С6Н5 ОН + СО2↑
6Н12О6 С6Н5 ОН + СО2↑(водный)
- Из крахмала.
В качестве источника этанола используют крахмал, содержащийся в картофеле и зерне. Путем ферментативного гидролиза из крахмала получают глюкозу.
Схема методов получения спиртов (С2Н5ОН)
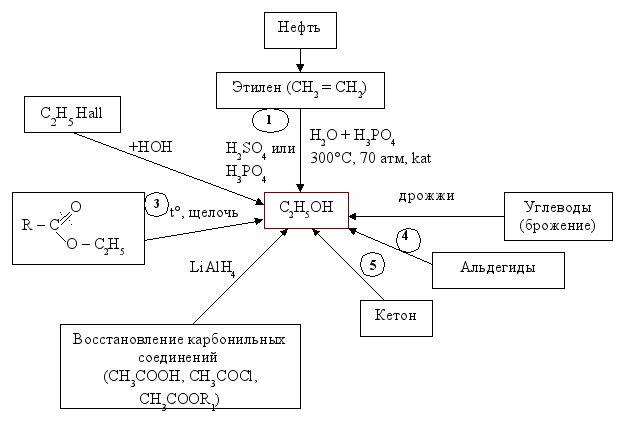
LiAlH4 – самый сильный восстановитель.
Реакции к схеме:

 HO O HOH
HO O HOH 1



 ) CH2 = CH2 + S CH3 – CH2 – O – SO3H C2H5OH + H2SO4
) CH2 = CH2 + S CH3 – CH2 – O – SO3H C2H5OH + H2SO4НО О (алкилгидросульфит)
Ni, t°, p
2

Cr2O3, I2O, t°, p
) СH4 + H2O CO + 3H2
 CO + 2H2 CH3OH
CO + 2H2 CH3OH3) При кипячении сложного эфира с разбавленной кислотой/щелочью образуется карбоновая кислота/соль и спирт.
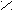
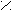
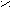
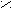
 O t° O
O t° OC


 H3 – C + K OH CH3 – C + C2H5OH
H3 – C + K OH CH3 – C + C2H5OHO – K
O – C2H5
4) Для получения первичных спиртов используют реактив Гриньяра (RMgHall).
H2O
H
 δ+– C δ¯= Oδ¯+ Rδ+(MgHall)δ¯→ Rδ+– C δ¯H2– O – [MgHall] δ¯ R – CH2 – OH + Mg(OH)Hall
δ+– C δ¯= Oδ¯+ Rδ+(MgHall)δ¯→ Rδ+– C δ¯H2– O – [MgHall] δ¯ R – CH2 – OH + Mg(OH)Hall| Rδ+ R
 H δ+ | H2O |
H δ+ | H2O | 5
 ) H3C – C – CH3 + Rδ+[Mg 2+Br –]δ – *→ H3C – Cδ¯– CH3 H3C – C – CH3 + Mg(OH)Br
) H3C – C – CH3 + Rδ+[Mg 2+Br –]δ – *→ H3C – Cδ¯– CH3 H3C – C – CH3 + Mg(OH)Br|| | |
Oδ¯ O δ+– [MgBr]δ¯ OH
Схема реакций спиртов
О
 бычно R – OH. Но в некоторых случаях R – O – H.
бычно R – OH. Но в некоторых случаях R – O – H.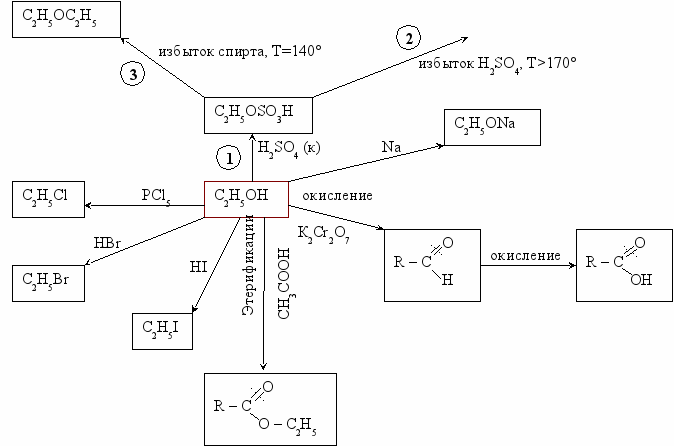
СH2=CH2

Вторичные спирты окисляются до кетонов.
Реакции к схеме: Третичные спирты к окислению устойчивы.
- C2H5OH + H2SO4 → C2H5SO3H + H2O
↑170° ↑170°
- C

 2H5SO3H + H2O C2H5OSO3H CH2 = CH2 + H2SO4
2H5SO3H + H2O C2H5OSO3H CH2 = CH2 + H2SO4
140° 140°
- C

 2H5OSO3H + H2O C2H5OSO3H + C2H5OH C2H5OC2H5 + H2SO4
2H5OSO3H + H2O C2H5OSO3H + C2H5OH C2H5OC2H5 + H2SO4

Вторичные спирты при Т >170° образуют смесь алкенов:
300°, Al2O3
2
 CH3 – СH – CH2 – CH3 CH2 = CH – CH2 – CH3 + CH3 – CH = CH – CH3 +2Н2О
CH3 – СH – CH2 – CH3 CH2 = CH – CH2 – CH3 + CH3 – CH = CH – CH3 +2Н2О|
OH
Схема взаимодействия между спиртами, галогеналканами, алканами и алкинами.
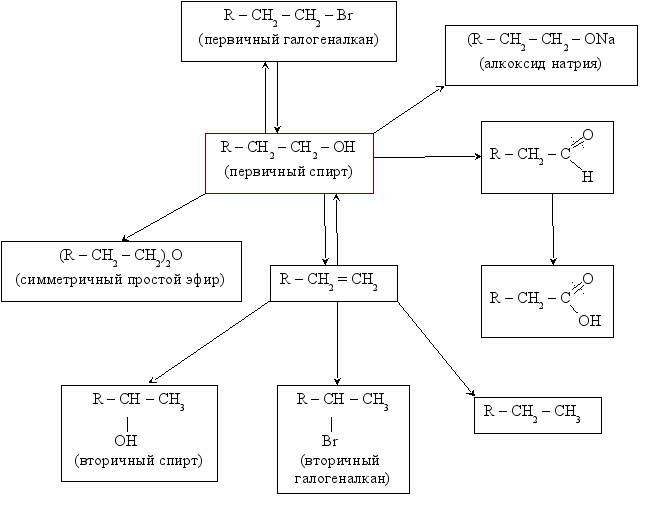
Реакции к схеме:
- R – CH2 – CH2 – Br + NaOH (НОН) → R – (CH2)2 – OH + NaBr
H2SO4 (k) избыток спирта, t°
- R

 – (CH2)2 – OH R – (CH2)2OSO3H [R – (CH2)2]2O
– (CH2)2 – OH R – (CH2)2OSO3H [R – (CH2)2]2O
- R – (CH2)2 – OH + Na → R – (CH2)2 – ONa
избыток кислоты
- R
 – (CH2)2 – OH + H2SO4 (k) → R– (CH2)2OSO3H R – CH=CH2
– (CH2)2 – OH + H2SO4 (k) → R– (CH2)2OSO3H R – CH=CH2
 K2Cr2O7 O K2Cr2O7
K2Cr2O7 O K2Cr2O75

 ),6) R – (CH2)2 – OH R – CH2 – C R – CH2 – COOH
),6) R – (CH2)2 – OH R – CH2 – C R – CH2 – COOHH
- R – CH2 = CH2 + H2 → R – CH2 – CH3
Br
|
- R – CH2 = CH2 + H+Br¯→ R – CH – CH3
- R – CH2 = CH2 + H+OH ¯→ R – CH – CH3
|
OH
Схема реакций фенола.
Фенолы –– слабые кислоты –– слабее угольной кислоты, но сильнее спиртов.
- При наличии в фенольном кольце электронно-акцепторных групп кислые свойства фенолов повышаются.
Пример.
 O H+
O H+
 NO2 | NO2
NO2 | NO2
|
NO2
- Электро-донорные группы (СН3) понижают кислотность фенолов. Следовательно, реакция этерификации протекает труднее, чем у спиртов.
- Замещение гидроксильной группы галогенфенолов также протекает труднее.
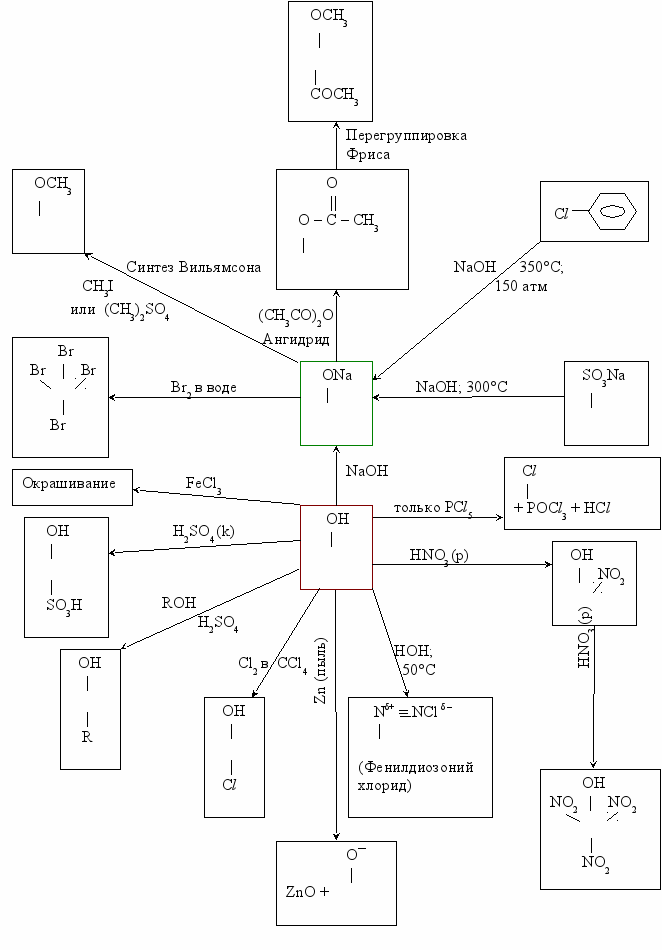
Сравнение свойств этилового спирта и фенола.
| Реагент | Этиловый спирт | Фенол |
| Комнатная температура | Жидкость | Твердое вещество |
| Вода | Смешивается во всех соотношениях | Ограниченно растворим в воде |
| PCl5 | Энергично взаимодействует. → С2H5Сl + POCl3 + HCl | Медленно взаимодействуют. Выход С6Н5Сl мал. |
| Na (металлический) | С2Н5ONa + H2 | С6Н5ONa + H2 |
| Реакция этерификации (гидрид и ангидрид кислоты) | Легко реагирует с образованием сложного эфира | |
| НHall | С2Н5Hall | – |
| HNO3 (водная) | – | Нитрофенол и т.д. |
| H2SO4 (к) | Т>170°С; дегидротация C2H4 | OH |  | SO3H (сульфирование) |
| Br2 в воде | – | Легко Br Br     Br (трибромфенол) |
| Zn (пыль) | – | Бензол |
| FeCl3 | Цвет не меняется | Окрашивается в фиолетовый цвет* |
