II. Квантово-механическое представление в органической химии
| Вид материала | Реферат |
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 425.07kb.
- Утверждаю, 318.85kb.
- Методы органической химии, 158.45kb.
Керосин
CmHnOz
Керосин – совокупность углеродов различного строения (предельных, непредельных цикличных и ароматических).
Керосин – фракция нефти, отгоняющаяся при температуре 150 ÷ 300°С.
Элементный весовой состав:
Углерод ― 86,76%
Водород ― 12,76%
Кислород ― 0,48%
Преимущества керосина:
- Высокая теплотворная способность (~ 43 кДж/г);
- Большой удельный вес (0,819 г/см3);
- Широкий температурный интервал жидкого состояния (от –60° до +150°);
- Коррозионно не активен по отношению к конструкционным материалам.
В крылатых ракетах большое значение придается созданию более легких и компактных двигательных установок, работающих на борсодержащих эмульсионных топливах. Применение такого топлива позволяет уменьшать габариты ракеты и увеличивать их боевые характеристики по показателю дальности.
В ЖРД с вытеснительной системой подачи в качестве компонентов топлива используют гидрозин (N2H4) и четырехокись азота (N2O4). В двигателях на верхних ступенях, рассчитанных на многократное использование, для обеспечения необходимой энергетической характеристики, требуется использование топливной пары: жидкий водород и жидкий кислород.
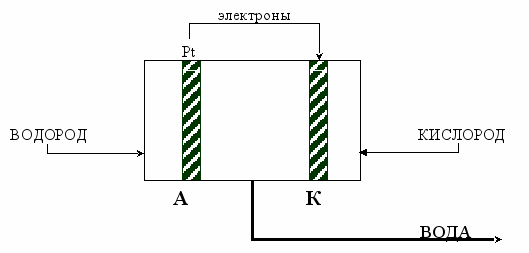
А: ½ Н – 1е → Н+
К: О2 + 4е + 4Н+ → 2Н2О
Плюсы:
- Получаем воду, которую в дальнейшем используют в системе жизнеобеспечения;
- Экологическая чиста компонентов.
Минусы:
- Взрывоопасность водорода;
- В качестве катализатора и переносчика электронов используют платину, которая очень дорогим материалом.
Стехиометрические и термохимические расчеты процессов горения химического топлива
Стехиометрический расчет
Процесс горения – окислительно-восстановительная реакция.
Продукты процесса – высшие оксиды элементов, входящие в состав горючего (СO2, H2O). А азот и галогены выделяются в свободном виде (N2, Br2, Cl2).
 CO2
CO2C
 6H5NO2 N2
6H5NO2 N2H2O
Пример.
Рассмотрим горение топливной смеси, состоящей из диэтиламина и азотной кислоты.
11 + x
2
1 + x
2
(C2H5)2NH + x HNO3 → 4 CO2 + H2O + N2
горючее окислитель
Метод расчета по материальному балансу кислорода:
- Принимаем за Х количество ркислителя;
- Уравниваем углерод;
- Уравниваем азот;
- Считаем кислород:
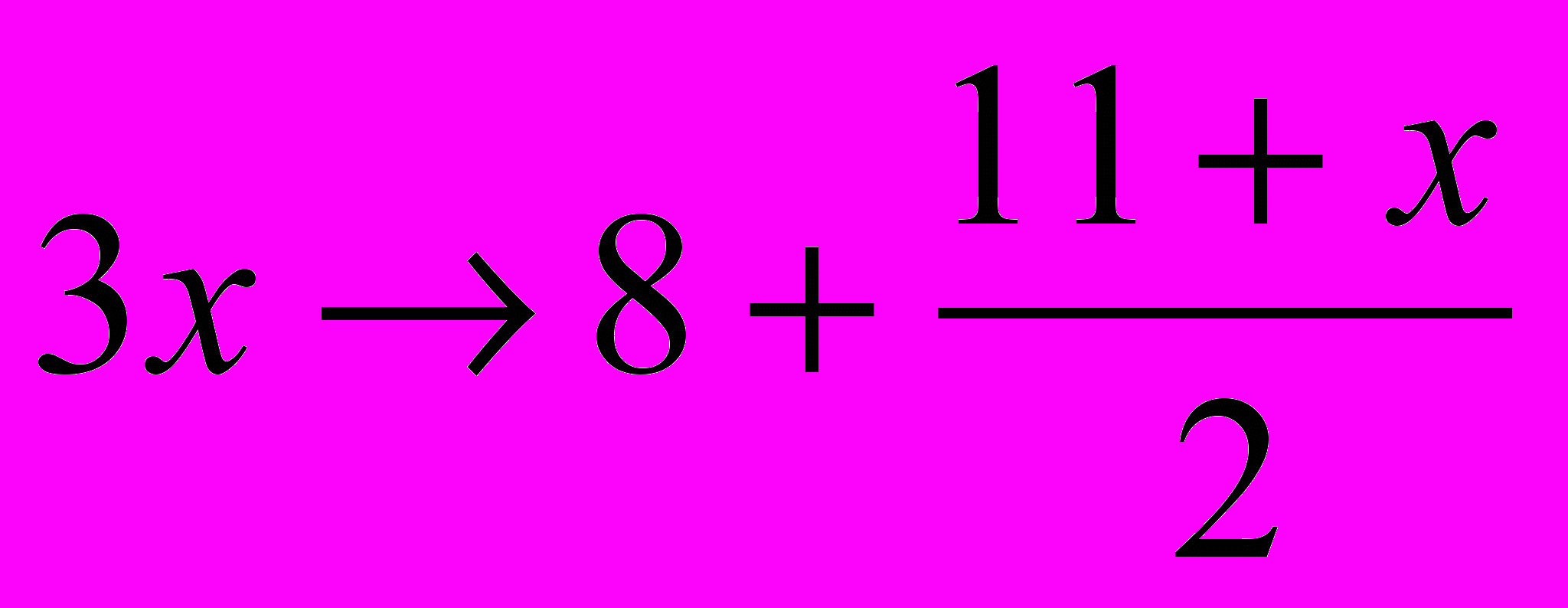
х = 5,4
Физико-химические и технические свойства топлива
Физико-химические и технические свойства топлива зависят от состава топлива, который выражают в процентах, мольных долях и массовых долях компонента.
- Расчет процентного состава топливной смеси;
% (C4H11N) =
× 100%
 Mr (C4H11N)
Mr (C4H11N) Mr (горючего) + Mr (окислителя)
% (C4H11N) =
× 100%
 Mr (C4H11N)
Mr (C4H11N) Mr (C4H11N) + 5,4×Mr (HNO3)
% (HNO3) =
× 100%
 Mr (HNO3)
Mr (HNO3) Mr (C4H11N) + 5,4×Mr (HNO3)
- Мольные доли;

n =
Число молей данного компонента
 Сумма числа молей смеси
Сумма числа молей смесиn (C4H11N) = = 0,16 = 16 Мольных %
1
 6,4
6,4n (HNO3) = 0,84 = 84 Мольных %
- Массовые доли элементов.

gэл =
атомная масса элемента × число атомов в молекуле исходного вещества
 суммарная масса топлива
суммарная масса топливаm (топлива) = Mr (C4H11N) + 5,4×Mr(HNO3)
gc = = 0,116
12×4

gN = = 0,217
413,2
 14×6,4
14×6,4413,2
gн = = 0,04
(11 + 5,4)×1
 413,2
413,2go = = 0,627
 16×5,4×3
16×5,4×3 413,2
Термохимический расчет
Различают высшую и низшую теплотворную способность топлива.
Высшая теплотворная способность (Qв) – количество тепла, которое выделяется при сгорании 1кг (1м3) топлива при нормальном давлении (105Па) и условии, что продукты реакций охлаждаются до стандартной температуры (25°С, 298°К).
Низшая теплотворная способность (Qн) – количество тепла, которое выделяется при сгорании единицы массы или объема топлива при нормальном давлении и условии, что продукты реакций охлаждаются до стандартной температуры (25°С), но без учета теплоты конденсации паров воды..
Qн = Qв – λimi
λi – теплоты парообразования соответствующего оксида (кДж/кг);
mi – количество этих оксидов в продуктах реакции (кг).
В двигателях температура продуктов сгорания, покидающих камеру сгорания, выше температуры концентрации водных паров. Следовательно чаще рассчитывают низшую теплотворную способность.
Чтобы рассчитать в общем случае необходимо учитывать законы Гесса.
Q =
 ∆H°р-ии
∆H°р-ии ∑ni × Mri
ni – коэффициенты;
Mri – молярная масса топлива;
∑ni × Mri – вес топлива;
∆H°р-ии – тепловой эффект реакции (рассчитывают либо по первому, либо по второму следствию Гейзенберга). Для его расчета используют формулу, по которой тепловой эффект реакции равен разность сумм теплот образования продуктов и исходных веществ, с учетом стехиометрических коэффициентов, стоящих в уравнении реакции.
∆H°р-ии = ∑nj × ∆Н°j – ∑ni × ∆Н°i
∆H°р-ии = ∑ni × ∆Н°сгор.i – ∑nj × ∆Н°сгор.j
XVI. Органические методы очитки воды
За счет наличия водородных связей вода обладает рядом аномальных свойств.
Аномальные свойства воды
- Вода – единственный минерал, который в твердом состоянии легче, чем в жидком.
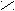 Н
Н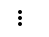
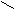
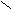 О Н
О Н 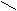

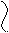 Н Н О Водородная связь слабее ковалентной.
Н Н О Водородная связь слабее ковалентной.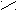 О ••• Н ― О ••• Н
О ••• Н ― О ••• НН |
Н
В твердом состоянии расстояние между молекулами больше, чем в жидком. Так как в жидком состоянии часть водородных связей разрушается.
- Вода (и Hg) обладает самым высоким значением поверхностного натяжения. А следовательно в космосе и на поверхности она находится в виде капле.
у детей – 80% воды;
у взрослых – 60% воды.
- Вода обладает большим значением теплоемкости. Поэтому моря и океаны являются тепловыми аккумуляторами. А человек может без вреда для здоровья переходить из более теплой среды в более холодную.
- Вода – единственный минерал, который может одновременно существовать в одной точке диаграммы состояния во всех трех агрегатных состояниях (твердом, жидком и газообразном).
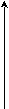 Р
Р


Т
- У воды аномально высокая температура кипения по сравнению с аналогами: H2Se, H2Te.
- Вода обладает измеряемой электропроводностью.
Kw = [H3+O] [OH ¯ ] = 10 – 14
[H3+O] – ион гидроксония
H+ + H2O → H3+O
Нейтральная среда: Щелочная среда: Кислая среда:
pH = 7; pH > 7; pH < 7
[H3+O] = [OH ¯ ]; [H3+O] < [OH ¯ ]; [H3+O] > [OH ¯ ]
– p = – lg
pH = – lg [H+] (считают по количеству ионов водорода)
CH+ = 10– 10
lg 10– 10 = 10
pH = 10
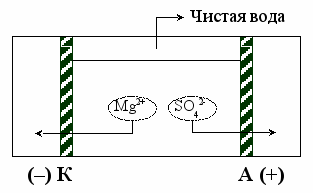
Электродиализная очистка жидкости
Используют в СОЖ для очистки конденсата выдыхаемого космонавтом газа и урины, MnSO4, раствор, H2O.
При электролизе:
(
 −) K: Mn2+ + 2e → Mg° φ° = – 2,37 в
−) K: Mn2+ + 2e → Mg° φ° = – 2,37 в2H2O + 2е → Н2 + 2ОН ¯ φ° = – 0,83 в (менее электроотрицательный)
(
 +) A: 2SO42- + 2e → 2S2O82- φ° = 2,01 в
+) A: 2SO42- + 2e → 2S2O82- φ° = 2,01 в2H2O2- – 4e → O2 + 4H+ φ° = 1,223 в
XVII. Многостадийные задачи в органической химии
- Число атомов углерода в исходном и конечном продукте одинаково и углеродный скелет идентичен.
Пример.
Из бутана-1 получить вторичный бутил-амин.
170°; H2SO4
1
 ) CH3 – CH2 – CH2 – CH2OH CH3 – CH2 – CH = CH2 + H2O
) CH3 – CH2 – CH2 – CH2OH CH3 – CH2 – CH = CH2 + H2O2) CH3 – CH2 – CH = CH2 + HBr → CH3 – CH2 – CH – CH3
|
Br
3) CH3 – CH2 – CH – CH3 + NH3 → CH3 – CH2 – CH – CH3 + HBr
| |
Br NH2
Пример.
Из хлорпропана получить пропаналь.
спирт
1
 ) CH3 – CH – CH3 + NaOH CH3 – CH = CH2 + NaCl + H2O
) CH3 – CH – CH3 + NaOH CH3 – CH = CH2 + NaCl + H2O|
H2O2
Cl
2
 ) CH3 – CH = CH2 + HBr CH3 – CH2 – CH2Br
) CH3 – CH = CH2 + HBr CH3 – CH2 – CH2BrИз-за H2O2 реакция идет против правила Марковникова.
3) CH3 – CH2 – CH2Br + NаОH (в) → CH3 – CH2 – CH2 OH + NaBr

 O
O 4) CH3 – CH2 – CH2 OH + [O] → CH3 – CH2 – C
H
- В конечном продукте на один атом углерода больше, чем в исходном.
Пример.
Из пропенового альдегида получить α-оксиизомасленную кислоту.
H3C

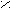

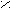 O | O
O | O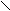 CH3 – CH2 – C → H3C – C – C
CH3 – CH2 – C → H3C – C – C H | OH
OH
Cпособы решения задачи:
- R

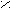

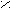 – Hall + KCN → R – CN + KHall O O
– Hall + KCN → R – CN + KHall O O
- R
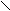
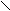 – Hall + Mg → R – MgHall + CO2 → R – C + H3O+ → R – C
– Hall + Mg → R – MgHall + CO2 → R – C + H3O+ → R – C
OMgHall OH
- CaC2 + 2H2O → C2H2 + Ca(OH)2
C2H2 + H2 (или Pd) → CH2 = CH2
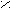 O
O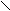
 CH2 = CH2 + O3 → HC
CH2 = CH2 + O3 → HCH
или

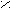
H2O; Zn; CH3COOH
O
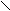
LiAlН4
 СH2 = CH2 HC
СH2 = CH2 HC 
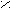 O H
O H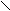
 HC H3COH
HC H3COHH
- В конечном продукте на один атом углерода меньше, чем в исходном.
Способы решения задачи:
1) Реакция сплавления солей карбоновых кислот с щелочами:
R – COONa + NaOH → Na2CO3 + R – H
- Перегруппировка Гофмана:

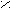 O
O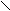 R – C + 4NaOH(k) + Br2 → R – NH2 + 2NaBr + Na2CO3 + 2H2O
R – C + 4NaOH(k) + Br2 → R – NH2 + 2NaBr + Na2CO3 + 2H2ONH2
- В конечном продукте в двое больше атомов углерода, чем в исходном.
Способы решения задачи:
- Синтез с использованием реактива Греньяра;
- Альдольно-кротоновая конденсация;
- Димиризация ацетилена.
- Число атомов углерода в исходном и конечном продукте одинаково, но изменяется структурна формула вещества (изомеризация).
П
tº; AlCl3
ример.
C
 H3 – CH2 – CH2 – CH3 CH3 – CH – CH3
H3 – CH2 – CH2 – CH3 CH3 – CH – CH3|
CH3


* Сторонники теории Витализма считали, что все органические вещества образовываются в живых организмах.
1 La, за ним идет 10 Лантаноидов, для которых в формуле принципиально писать 5d1 и дальше по списку. Если элемент не относят ни к Лантаноидам, ни к Актиноидам, то 5d1 писать не нужно. В этом случае пишут 6s2 4f 14 5d10 и т.д.
* Реально там δ¯, т.к. [+2(от Mg) + (-1) (от Br)] = (+1).
* Качественная реакция на фенол.
* Также в состав природных жиров входит пальмитолеиновая кислота (C15H29COOH, 1 двойная связь).
* Аминокислоты, получаемые в готовом виде вместе с пищей (незаменимые). К ним еще относят лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин; а также аргинин и гистидин — незаменимые для детей.
* Аминокислоты, получаемые в готовом виде вместе с пищей (незаменимые). К ним еще относят лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин; а также аргинин и гистидин — незаменимые для детей.
* Также к ним относятся фруктоза, галактоза и манноза.
* Также изомальтоза и лактоза, которая состоит из галактозы и фруктозы.
