II. Квантово-механическое представление в органической химии
| Вид материала | Реферат |
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 425.07kb.
- Утверждаю, 318.85kb.
- Методы органической химии, 158.45kb.
Ионная химическая связь
Молекулы, в которых существует ионная связь, встречаются реже, чем молекулы с ковалентной связью. Такая связь возникает за счет электростатического взаимодействия разноименно заряженных ионов, которые образуются при смещении электрона от одного атома к другому.
Разность электроотрицетельности (∆Х) двух элементов является мерой ионности между ними. При ∆Х > 2,5 связь условно считается ионной.
Ионная связь из-за электростатического характера взаимодействия является не насыщенной и не обладает преимущественной направленностью в пространстве. Следовательно, соединения с большой долей ионной связи представляют собой не отдельные молекулы, а твердое тело с ионным кристаллическим строением.
При ионной связи происходит переход электрона с орбитали одного атома (Na) на орбиталь другого (Cl).
Изучение поляризации позволило определить эффективные заряды атомов в молекуле.
Пример.
Na+0,8Cl-0,8
Mg+0,9Cl2-0,45
Однако, при решении ряда вопросов (окислительно-восстановительные реакции, горение топлива) используются гипотетические заряды атомов, вводя представление об окислительном числе.
Водородная связь
Водородная связь – это дополнительная связь, осуществляется атомами водорода, ковалентно соединенными в молекуле с атомами электроотрицательного элемента. Большая плотность положительного заряда, из-за очень малого радиуса и отсутствия электронов у протонированного атома водорода, способствует взаимодействию атомов водорода с электроотрицательными атомами чужой или даже своей молекулы.
Пример.
Нδ+ Оδ- – Нδ+
| |
Нδ+ – Оδ- ••• Нδ+
Водородная связь менее прочная, чем ковалентная. Ее энергия меньше 10 кДж/Моль.
Образование водородных связей в молекуле приводит к тому, что при обычных условиях вода является жидкостью.
Межмолекулярные связи (силы Ван-дер-Ваальса)
Силы Ван-дер-Ваальса имеют электростатическую природу. Под названием сил Ван-дер-Ваальса объединяют три вида взаимодействия:
- Ориентационное взаимодействие.
Полярные молекулы при сближении ориентируются относительно друг друга противоположно заряженными диполями. Такое взаимодействие сильно зависит от температуры.
- Индукционное взаимодействие.
Под влиянием электростатического поля полярной молекулы в неполярной молекуле возникает временный дипольный момент, а затем обе молекулы взаимодействуют как диполи. Энергия индукционного взаимодействия растет с ростом поляризуемости молекул.
- Дисперсное взаимодействие.
Данный вид взаимодействия проявляется в неполярных молекулах (Н2, Cl2, СН4).
Из-за движения электронов изменяется симметричность распределения зарядов положительного и отрицательного электричества, в следствие чего появляются мгновенные диполи.
Т.к. силы Ван-дер-Ваальса имеют электростатическую природу, то они характеризуются отсутствием насыщаемости и специфичности. Такие силы малопрочны. Их энергия на порядок меньше энергии ковалентной связи. Энергия равна отношению единицы к радиусу в седьмой степени.
Донорно-акцепторная связь
Донорно-акцепторная связь образуется при взаимодействии двух атомов, у одного из которых имеется неподеленная пара электронов (спаренные электроны квантовой ячейки), а у другого- свободная атомная орбиталь (незаполненная квантовая ячейка).
Донорно-акцепторная связь является разновидностью ковалентной связи, но отличается образованием. Число связей атома могут превышать его ковалентность.
Пример.
Со
4s2 3d7
n = 4
l = 0,1,2,3
s,p,d,f
внутренняя связь

 ионная связь
ионная связьв

 нешняя сфера
нешняя сфера  [Co2+(NH3) 4 ] Cl2 внешняя сфера
[Co2+(NH3) 4 ] Cl2 внешняя сфера 
донорно-акцепторная связь
Co2+ – центральный атом, комплексообразователь;
Наиболее характерные комплексообразователи: ионы d-элементов (Cu, Pt, Fe, Co, Ag), атомы неметаллов (B, Si), нейтральные атомы металлов ([Ni(CO)4]).
NH3 – лиганды (адденды).
Лигандами обычно бывают: отрицательно заряженные ионы (Cl −,P −,OH −,CN −), нейтральные молекулы (Н2О, СО).
 4 – координационное число.
4 – координационное число. Обычно оно обычно в два раза больше чем заряд комплексообразователя. Как правило координационное число равно 2, 4, 6. Считают его по числу лиганд в комплексном ионе.
- Углеводороды
- Классификации, реакций, разрывов связей и реагентов
Алифатические углеводороды
Насыщенные углеводороды (алканы (СnH2n+2))
Углеводороды – соединения, в состав которых входят только углерод и водород.
Номенклатура (UPAK)
- Выделяют и называют наиболее длинную неразветвленную цепь;
- Называют заместители;
- Номеруют положения, в которых находятся заместители. При этом номер замещенного положения должен иметь наименьшее значение;
- Заместители перечисляют в алфавитном порядке.
Пример.

СН3 – СН2 – СН2 – СН – СН3
| 4 метилгептан
С3Н8
Задание.
Назовите соединение.
СН3 – СН – СН2 – СН – СН3
| | 2-бром 4-хлоргексан
Сl Br
Задание.
Назовите соединение.
СН3 – СН – СН2 – СН – СН3
| | 4-метил 2,3-дихлоргексан
Сl СН3
Получают смесь углеводородов путем первичной нефтеперегонки.
Изомерия алканов
Изомерия – это явление существования разных соединений с одинаковой молекулярной формулой, но с разной структурой.
Пример.
СН3 – СН – СН3 СН3 – СН2 – СН2 – СН3
|
СН3 Бутан
Изобутан или 2 метил пропан (Ткип. = – 0,5°С)
(Ткип. = – 12°С)
Ненасыщенные углеводороды (алкены (СnH2n), алкины (СnH2n–2))
Пример.
Алкены Алкины
С2Н4 – этилен С2Н2 – ацетилен
С3Н6 – пропен С3Н4 – пропин
Номенклатура
Направление нумерации главной цепи выбирается таким образом, чтобы лакант, указывающий положение кратной связи имел наименьшее значение. А затем определяется положение лакантов-заместителей.
Если есть двойные и тройные связи, то преимущество в получении наименьшего лаканта отдается двойным связям. Двойная связь придает молекуле повышенную реакционную способность по сравнению с алканами.
Пример.
СН3 – СН = СН – СН3
Бутен 2
Пример.
СН3 – СН = СН – С ≡ СН
Пент – 2-ен – 4-ин
Алициклические углеводороды
П
 римеры
римеры 
С
 Н2 – СН2
Н2 – СН2 СН2
Циклопропан Циклогексан
Ароматические углеводороды (арены)
 СН3
СН3| С6Н5 – фенильная группа
С
 С6Н6 – бензол;
С6Н6 – бензол;С6Н5СН3 – толуол;
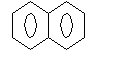 С10Н8 – нафталин.
С10Н8 – нафталин.Функциональные группы СnH2n+2
| Название | Формула |
| Алкильная группа | R – |
| Спирты | R – OH |
| Альдегиды |   O OR  – C – C H |
| Кетоны | R1 – C – R2 || O |
| Карбоновые кислоты | 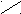 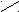 O OR  – C – C ОH |
| Простые эфиры | С 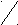 Н3 – СН3 Н3 – СН3  или R1 – О – R2 или R1 – О – R2О |
| Сложные эфиры |  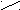 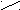 O OR 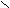 1– C 1– C О – R2 |
| Ангидриды | 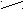 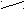 O OR  1 – C 1 – C 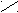 О ОR 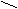 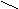 2 – C 2 – C О |
Общие типы реакций
- Замещение;
С2Н5Cl + NaOH → С2Н5OH + NaCl
- Присоединение;
СН2=СН2 + Br2 → СН2 – СН2
| |
Br Br
- Отщепление;
t°, kat
 С2Н5OH СН2= СH2 + Н2О (дегидротация)
С2Н5OH СН2= СH2 + Н2О (дегидротация) - Превращение;
Типы разрыва связей
- Гемолитический разрыв (гомо — одинаковый);
При разрыве сохраняется по одному электронному радикалу.
СН3 – СН2 – СН3 → СН3 – СH2 • + • СH3
1 молекула → 2 радикала
hν
Сl2 2Сl2 •
- Гетеролитический разрыв (гетеро — разный);
Электронная пара остается на одном из атомов и образуется анион
(СН3)3ССl → (СН3)3 C+ + Сl ¯
 (анион)
(анион)СН3
|
СН3 – С – Сl
|
СН3
Типы реагентов
1) Нуклеофильные (отрицательные ионы);
Нуклеофильные реагенты – вещества, имеющие неподеленную пару электронов или отрицательно заряженные ионы (ОН ¯ ), которые атакуют положительно заряженный конец полярной ковалентной связи.
- Электрофильные.
Электрофильные реагенты – атакуют отрицательно заряженный конец полярной ковалент-
ной связи (SO3, NO2+).
2. Изомерия
- Структурная;
Структурная форма показывает последовательность соединения атомов. Изомерия цепи появляется, если два соединения построены с помощью различных цепей углеродных атомов. При этом они имеют одинаковые функциональные группы и принадлежат к одному гомологическому ряду.
Пример.
CH3 – CH – CH3
 С4Н8 |
С4Н8 |Бутан CH3
2 метилпропан
- Позиционная;
Молекулы различаются положением функциональных групп.
Примеры.
CH3 – CH2 – CH2 – СH2ОН CH3 – CH – CH2 – CH3
и |
ОН
Сl Сl Cl
| Cl | |

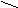

 Cl
Cl 
|
Cl
ОРТО – МЕТА – ПАРА –
В случае позиционной изомерии изомеры могут принадлежать к различным гомологическим рядам, т.е. могут иметь различные функциональные группы.
Примеры.
- Соединение C2H6О может быть как спиртом (C2H5ОН – этиловый спирт), так и простым эфиром (CH3 – О – C2H6 – диметиловый эфир) .
- А соединение с формулой C3H6О может быть представлен как пропаналь, так и как кетон.
(CH3 – C – CH3).
||
О
- Таутомерия;
Два изомерных соединения могут существовать в динамическом равновесии друг с другом. Отличаются они положением атома водорода.
Кето-енольная таутомерия
Пример.
CH3 – C – CH3 ↔ CH3 – C = CH2
|| |
О ОН
- Стереоизомерия.
Соединения имеют одинаковые молекулы и структурные формулы. Различаются они только положением связей в пространстве.
-
-
-
-
-
- 4.1. Геометрическая
Н
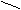
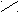 ООC COOH
ООC COOH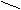
 C = C ЦИС–бутендионовая кислота
C = C ЦИС–бутендионовая кислота H H (малеиновая) (Тпл. = 135°С)
Н
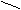
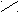 ООC H
ООC H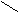
 C = C ТРАНС–бутендионовая кислота
C = C ТРАНС–бутендионовая кислотаH СООH (Фумаровая кислота. Ее кристаллы имеют фруктовый вкус)
(Тпл. = 287°С)
Невозможность вращения вокруг двойной связи приводит к появлению ЦИС – ТРАНС изомерии. Свойства двух таких соединений различны: растворимость, дипольные моменты, температура плавления.
Пример.
 О
О Н

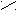
 С H O
С H O 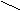 С О Н t = 160°C C – C
С О Н t = 160°C C – C 
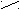 || || O + Н2О
|| || O + Н2О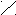
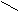
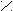
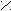
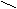
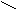
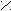 С О C – C (ангидрид)
С О C – C (ангидрид)Н
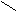 С H O
С H OОН
При нагревании 160°С малеиновая кислота образует ангидрид.
ТРАНС – кислота ангидрида при нагревании не дает.
- 4.2. Конформационная;
Циклогексан может быть в виде:
C

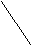


 H2 CH2 CH2 CH2
H2 CH2 CH2 CH2CH2

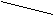 CH2 – CH2 и CH2
CH2 – CH2 и CH2 CH2 CH2 CH2 CH2
CH2 CH2 CH2 CH2«Ванна» «Кресло»
- 4.3. Оптическая.
-
Оптическая активность – способность вращать плоскость поляризации плоско-поляризованного света. Положительным вращением считают вращение по часовой стрелке, а отрицательным – против.
Оптически активные вещества хиральны (их молекулы не имеют плоскости, оси и центра симметрии). Такие вещества образуют два типа молекул, которые относятся друг к другу как предмет и его зеркальное отображение. Эти молекулы называются энантиомерами.
Пример.
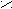
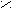 О
ОC
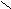 H3 – СН – C
H3 – СН – C | ОН 2(α)-гидрокси (окси) пропионовая кислота (молочная)
ОН (имеет 3 формы)
Молочная кислота является рацемической смесью, которая содержит оптически неактивные молекулы (число положительно направленных молекул равно числу отрицательно направленных), т.к. содержит эквимолярную смесь положительных и отрицательных энантиомеров (содержится в кислом молоке). Положительные энантиомеры есть только в живых тканях. Отрицательных энантиомеров в природе не существует. Все три формы молочной кислоты имеют одинаковые химические свойства, а положительно и отрицательно направленные – одинаковые физические свойства.
Задание.
Назовите соединение:



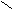
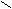 О О
О О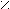 С – СН – СН – НС
С – СН – СН – НС HО | | ОН
ОН ОН
Ответ: 2,3 дигидроксибутадионовая кислота (винная).
