II. Квантово-механическое представление в органической химии
| Вид материала | Реферат |
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 425.07kb.
- Утверждаю, 318.85kb.
- Методы органической химии, 158.45kb.
К таблице:
••
- H – N – R R – N – NO
| |
+ HNO2 → + H2O (нитроза аммония)
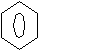
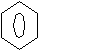
- N(СН2)2 N(СН2)2
| |
+
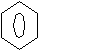 HNO2 →
HNO2 → 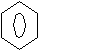 + Н2О
+ Н2О • |
• |NO
активирует это положение
- Реакция нитрования (HNO3);
Перед нитрованием амины ацитилируют (например, уксусным альдегидом), чтобы создать бензольное кольцо либо в орто- либо в пара- активном положении.
Пример.
О
||
NH2 H – N – C – CH3 HNCOCH3 NH2
•
HNO3(k) или H2SO4(k)
NO2
H2O
H+
NO2
| | | |

(CH3CO)2O (ангидрид)
ацетилирование
аминогруппы


• (ортонитроанилин)
NHCOCH3
HNCOCH3 NH2
| |

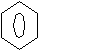
| | (паранитроанилин)
NO2 NO2

 O
OП
 ри ацетилировании аминов образуются амиды (R – C ).
ри ацетилировании аминов образуются амиды (R – C ).NH2
В реакцию ацетилирования вступают только первичные и вторичные амины, которые имеют подвижный атом водорода.
- Замещение в ароматическом кольце у аренов;
- 4.1. Галогенирование;
Пример.
Br
Br
NH2 NH2
| |
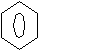
+ 3Br2 →

+ 3HBr
|
Br
Для получения монобромных производных анилин ацетилируют:
NH2 HNCOCH3 HNCOCH3 NH2
+ (СH3CO)2O →
Br2
HOH;
(H2SO4)
| | | |


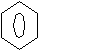
| |
Br Br
- 4.2. Сульфирование.
-
- Пример.
NH2 NH2
180°C
| |
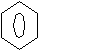
+ H2SO4

+ H2O
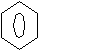
|
SO3H
(4 аминобензолсульфа кислота)
- Качественные реакции на амины.
Первичные амины при нагревании с хлороформом в присутствии щелочи образуют изонитрилы, обладающие характерным неприятным запахом.
Пример.
CH3NH3 + CHCl3 + 3KOH → CH3N
 C + 3KCl + 3H2O
C + 3KCl + 3H2O(синильная кислота
или изотрил [плохой запах])
Задание.
Написать реакцию:
H H
| |
H3C – N: + HOH → H3C – N+ – H + ОН ¯
| |
H H
Четвертичные аммониевые соли
Природная четвертичная аммониевая соль (ацетилхолин) играет важную роль в живых организмах. Она участвует в передаче нервного импульса от одной клетки к другой. После выполнения своей функции она гидролизуется до холина и уксусной кислоты:
CH3COO – CH2 – CH2 – N+[(CH3)3Cl]¯ + H2O → CH3COOH + HO – CH2 – CH2 – N+(CH3)Cl¯
(катализуется ферментом холинэстераза)
Холинэстераза «узнает» свой субстрат (ацетилхолин), так как последний подходит к ней как «ключ к замку». Однако некоторые вещества, похожие по структуре с ацетилхолином, могут ошибочно «узнаваться» холинэстеразой и связываться с ней. При этом фермент ингибируется, и передача нервного импульса нарушается.
Природное вещество кураре обладает подобным свойством. Действие нервнопаралитических газов основано также на этом механизме.
Схема использования аминов в органическом синтезе
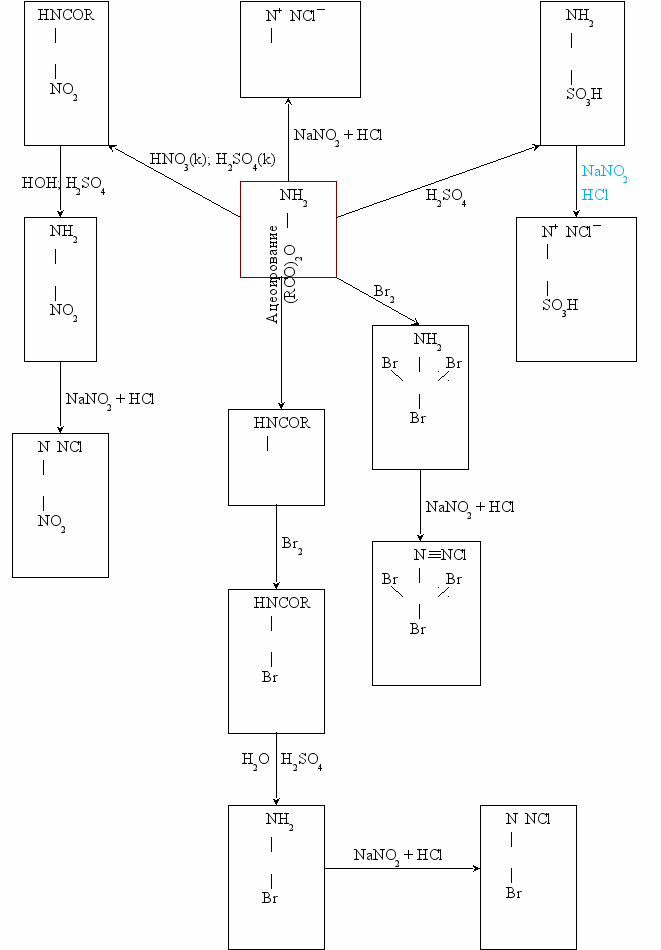
Соли диазония ([AN
 N]+X ¯; А – либо Ar, либо гетероциклический радикал) образуются при взаимодействии азотистой кислоты и ароматических аминов.
N]+X ¯; А – либо Ar, либо гетероциклический радикал) образуются при взаимодействии азотистой кислоты и ароматических аминов.Соли диазония являются очень реакционно способными веществами и используются в качестве исходных веществ в синтезе многих органических соединений. По причине того, что группа (N
 N) легко замещается на другие группы.
N) легко замещается на другие группы.Группы, на которые происходит замена
- На ОН ¯;
Пример.
N
 NCl
NCl|

OH
|

↑10°C; H2SO4 (p)
+ HOH

+ НCl + N2
- На Hall¯ или CN ¯;
Пример.
N
 NCl
NCl|

Br
|

CuBr2
+ HBr

+ НCl + N2
- Восстановление солей диазония;
3.1.
Пример.
N
 NCl
NCl|

HN – NH2
|

[H+]
+ SnCl2

Фенилгидразин (ракетное топливо)
3.2.
Пример.
N
 NCl
NCl|

H3PO4


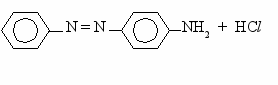
- Азосочитание (получение красителей).
Пример.

N
 NCl + H2N
NCl + H2N
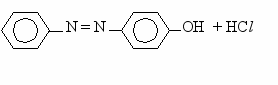
Пример.

N
 NCl + C6H5OH
NCl + C6H5OH
Получение аминов
Получение RCH2NH2
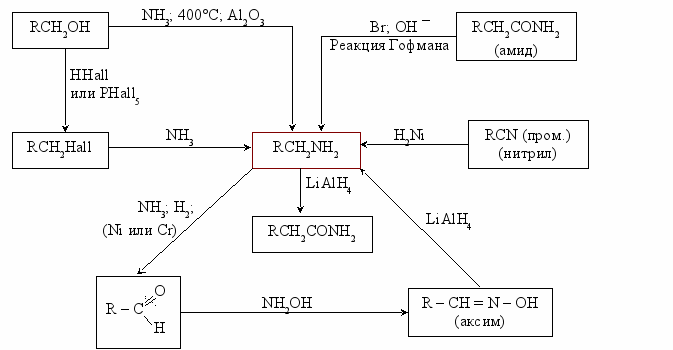
Первый вариант
NH3 + RHall → RNH3Hall
Смесь первичных, вторичных, третичных аминов и четвертичных аммониевых солей разделяют фракционной перегонкой.
Второй вариант. Восстановление кислородосодержащих соединений
R
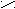
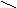 1 R1 H
1 R1 H 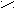
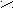
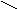
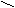 C = O + NH3 + H2 → C
C = O + NH3 + H2 → C R2 R2 NH2
 Реакция Гофмана
Реакция Гофмана
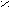
 O
OC
 H3 – C + Br2 + NaOH (k) → Na2CO3 + 2H2O + CH3 – NH2 + 2NaBr
H3 – C + Br2 + NaOH (k) → Na2CO3 + 2H2O + CH3 – NH2 + 2NaBrNH2
(амид уксусной кислоты)
Промышленное получение анилина
NH2
|

NO2
|

Cl
|

Fe + H+ или
Sn + H+

NH3; 200°C; 50атм

Задание.
Н
O
||
H – N – C – CH3
| Сl

аписать реакцию ацелирования.
NH2
| Сl


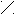

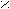
 O
O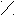
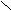
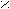 H3C – C O
H3C – C O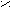
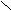
 + O + H3C – C
+ O + H3C – C H3C – C OH
H3C – C OHO
X. Амиды


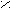 О
О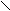 R – C
R – C NH2


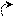
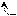 Оδ¯
Оδ¯А
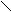 миды не являются основаниями, так как R – С сильный электро-акцептор, оттягивающий атом азота. NH2
миды не являются основаниями, так как R – С сильный электро-акцептор, оттягивающий атом азота. NH2 Имеют два подвижных атома, которые легко образуют водородные связи. Следовательно, большинство амидов являются твердыми веществами.
Амиды получают из карбоновых кислот и аммиака.
O
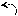
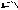
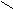
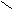 ••
••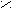 C – N – H2
C – N – H2R
Механизм каталитического действия ферментов на примере фермента урмазы (глобулярный белок)
Молекула мочевины плоская. При температуре тела человека (36,6°) энергии активации уменьшается на 5,3кДж/Моль и гидролиз мочевины ускоряется в 10 раз.
П

 ри денатурации фермента теряется его каталитическая активность и фермент не функционирует.
ри денатурации фермента теряется его каталитическая активность и фермент не функционирует. O
В
 промежуточной стадии образуется аммониевая соль [R – C ] NH4+.
промежуточной стадии образуется аммониевая соль [R – C ] NH4+.O¯

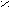
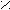

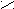
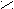
200°C
O О O
C

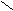

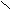 H3 – C + NH3 [R – C ]NH4+ → CH3 – C + Н2О
H3 – C + NH3 [R – C ]NH4+ → CH3 – C + Н2ОOH О¯ NH2
Химические реакции амидов
- Гидролиз;
Идет до образования кислоты при длительном нагревании с растворами к щелочи.
Н3+; длительный нагрев;
ОН ¯; длительный нагрев



 O O
O O R

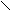
 – C + H2O R – C + NH4
– C + H2O R – C + NH4NH2 OH
- Дегидротация;
Р4О10
перегонка

 O
O R

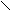 – C R – С
– C R – С  N + Н2О
N + Н2ОNH2 (нитрил)
- Действие азотистой кислоты;
Н3+; длительный нагрев;
ОН ¯; длительный нагрев



 O O
O O R

 – C + HNO2(в) R – C + N2 + H2O
– C + HNO2(в) R – C + N2 + H2ONH2 OH
- Восстановление амидов;
LiAlH4
эфир

 O
O R

 – C R – СH2 – NH2
– C R – СH2 – NH2NH2
Амиды → Амины
- Реакция Гофмана (уменьшение углеродного скелета на один атом углерода).

 O
O R
 – C + Br2 + 4NaOH → R– NH2 + 2NaBr + Na2CO3 + 2H2O
– C + Br2 + 4NaOH → R– NH2 + 2NaBr + Na2CO3 + 2H2ONH2
Схема реакций амидов
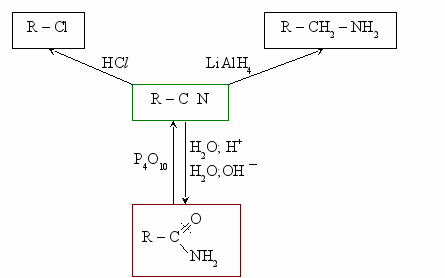
HCN + CuCN
A
 r – C
r – C  N Ar – N
N Ar – N  NCl
NClO
R1 – C
OR2
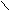

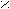
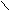

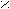
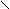

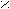
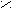
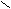
O
R – C
Cl
O
+ NH3 → R – C
NH2
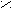
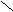
O
CH3 – C
O
CH3 – C
O
XI. Гетероциклические соединения азота
Пиридин
Н
|
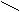
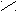
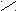 C Пиридин выглядит как бесцветная жидкость.
C Пиридин выглядит как бесцветная жидкость.HC CH Пиридин – основание. В кислом растворе присоединяет протон и образует
| || ион пиридиния [C5H5NH+].
H
 C CH Пиридин токсичен, опасен для окружающей среды, огнеопасен.
C CH Пиридин токсичен, опасен для окружающей среды, огнеопасен.N
••
