II. Квантово-механическое представление в органической химии
| Вид материала | Реферат |
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 425.07kb.
- Утверждаю, 318.85kb.
- Методы органической химии, 158.45kb.
2. Жиры, масла и их поверхностно-активные свойства
Жиры и масла являются глицериновыми эфирами жирных кислот.

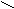 O
O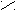 C – (CH2)14 – CH3
C – (CH2)14 – CH3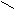 O
O H2C – OH CH2
| |
HC – OH + 3HOOC – (CH2)14 – CH3 → HC – OOC – (CH2)14 – CH3 + Н2О
| (пальмитиновая кислота) |
H2C – OH H2C – OOC – (CH2)14 – CH3
(глицерин) (трипальминад глицерина)
Если жир содержит три жирнокислотные группы, то его называют триглицеридом. Содержание глицеринов в плазме крови служит одним из показателей здоровья.
Сложный эфир глицерина и олеиновой кислоты называется триамид. Он является компонентом оливкового масла.
Чистые жиры обладают высокой калорийностью (теплота сгорания 37,6 кДж/г).
Обычно человек получает за счет жиров около ⅓ от общего количества энергии. Жиры более концентрированный источник энергии, чем углеводы.
Состав природных жиров
- Насыщенные кислоты;
- Миристиновая кислота;
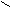
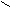 O
O C – (CH2)12 – CH3
C – (CH2)12 – CH3HO
1.2. Пальмитиновая кислота;
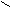
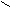 O
O  C – (CH2)14 – CH3
C – (CH2)14 – CH3 HO
1.3. Стеариновая кислота.
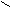
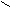 O
O C – (CH2)16 – CH3
C – (CH2)16 – CH3HO
- Ненасыщенные кислоты*.
- Олеиновая кислота;
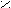
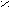 O
OC
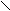 H3 – (CH2)7 – CH = CH – (CH2)7 – C
H3 – (CH2)7 – CH = CH – (CH2)7 – COH
- Линолевая кислота;
CH3 – (CH2)4 – CH = CH – CH2 – CH = CH – (CH2)7 – CООН
или
CH3 – (CH2)3 – (СН2 – CH = CH)2 – (CH2)7 – CООН
- Линоленовая кислота;
CH3 – (CH2 – CH=CH)3 – (CH2)7 – COOH.
- Арахиди(о)новая кислота.
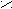
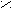 O
OC
 H3 – (CH2)4 – (CH = CH – CH2)4 – (CH2)2 – C
H3 – (CH2)4 – (CH = CH – CH2)4 – (CH2)2 – C OH
Жиры являются исходным сырьем в производстве масла.
Твердые жиры животного происхождения являются эфирами преимущественно насыщенных кислот. А жидкие растительные масла имеют в своем составе группы НС = СН.
Ненасыщенные (с двойной связью) жирные кислоты имеют ЦИС-конфигурацию относительно двойных связей. Следовательно, углеродная цепь обладает изогнутой конфигурацией, и цепи не могут плотно прилегать друг к другу. По этой причине температура плавления падает, и полиненасыщенные жиры при комнатной температуре являются жидкостями (масла).
Растительные жиры превращают в твердые жиры (маргарин) методом гидрогенизации (+Н2 к двойной связи).
Ненасыщенные масла усваиваются лучше и уменьшают уровень холестерина в крови. Также они окисляются кислородом из воздуха (растительное масло портится именно из-за окисления).
Диссимиляция – окисление жиров в организме. Во время этого процесса происходит отщепление двух атомов углерода в виде СН3 – СООН.
Пример.
CH3 – (CH2)16 – COOH + O2 → CH3 – (CH2)14 – COOH + CH3 – COOH
Поверхностные активные вещества
Омыление – метод щелочного гидролиза жиров. Этим методом получают глицерин и натриевые соли жирных кислот – твердое мыло.
Пример.
C17H35COO – CH2 H2C – OH
| |
C17H35COO – CH + 3NaOH → HC – OH + 3C17H35COONa
| | (стеарат натрия)
C17H35COO – CH2 H2C – OH
(тристеарат глицерина)
При использовании КОН получают калиевую соль – жидкое мыло.
Пример.
Н3C – (СН2)14 – COO – CH2 H2C – OH
| |
Н3C – (СН2)14 – COO – CH + 3NaOH → HC – OH + 3CН3 – (СН2)14 – СOONa
| |
Н3C – (СН2)14 – COO – CH2 H2C – OH
Мыло – эффективное моющее средство. Оно может превращать жиры и масла в водные эмульсии. Твердое мыло переводит жиры и масла в мельчайшие капельки, которые смачиваются водой. Грязь удерживается на ткани тонким слоем жиров и масел, которые нужно удалить.
Пример.
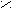
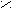 O
OС
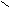 17Н35 – С
17Н35 – С ONa
или
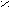
 O
OC
 H3 – (CH2)16 – C
H3 – (CH2)16 – C ONa
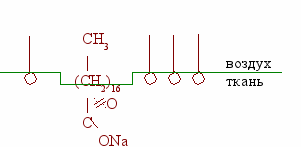
Адсорбция – концентрирование вещества на границе раздела фаз.
Эмульгирующее свойство моющих средств связано с наличием в их молекулах гидрофильных (полярных) [COONa (карбоксилат ион)] и липофильных (неполярных) групп [R (углеродная цепь)]. Подобное растворяет подобное (масло – неполярно).
=
=
=
=
=
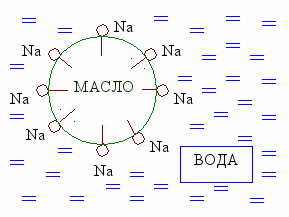
При стирке загрязненной ткани молекулы моющего средства окружают каплю масла. Таким образом липофильные группы «растворяются» в масле, а гидрофильные – в воде. Образуется мицелла. Так как поверхности мицелл заряжены отрицательно, то они не «слипаются» между собой и не образуют больших комков. Мицеллы уносятся с током воды с поверхности ткани.
В настоящее время существует много синтетических моющих средств: натриевые соли сульфокислот и органических моноэфиров серной кислоты.
Пример.
CH3 – (CH2)10 – CH2 – SO3 – ONa
Эта натриевая соль додецил-серной кислоты является одним из примеров синтетических моющих средств.
Современное синтетическое средство вместо карбоксильной группы [COO¯ ] содержится сульфитную группу [SO3¯ ].
Преимущество синтетических средств: они могут использоваться в жесткой воде, т.к. их кальциевые и магниевые соли растворяются в воде. А простое мыло образует в жесткой воде осадок – кальциевые соли жирных кислот.
Недостаток синтетических средств: они могут накапливаться в окружающей среде и загрязнять ее. В отличии от карбоновых сульфокислот синтетические моющие средства не разлагаются микроорганизмами и накапливаются в водоемах, что приводит к гибели живых организмов.
Поверхностные явления
Адсорбция
Любая поверхность твердого тела обладает избыточной энергией.
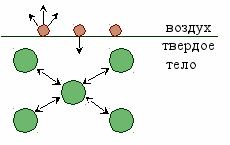
У частиц, находящихся внутри кристалла, силы притяжения и отталкивания со стороны окружающих частиц скомпенсированы. А у частиц, находящихся на поверхности, часть сил не скомпенсирована. Поэтому, поверхность обладает свободной поверхностной энергией (∆Gпов).
При адсорбции (концентрации вещества на поверхности раздела фаз) возникает связь между молекулами, находящихся на поверхности твердого тела (адсорбат) и молекулами поглощаемого вещества. При этом ∆Gпов уменьшается.
Виды адсорбции:
1 вид. Физическая адсорбция.
При физической адсорбции связь между молекулами адсорбента и адсорбата возникает за счет действия сил Ван-дер-Ваальса.
2 вид. Химическая адсорбция.
При химической адсорбции связь между молекулами адсорбента и адсорбата возникает за счет действия химической связи.
Количественная характеристика адсорбции
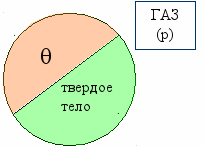
р – парциальное давление;
θ – степень заполнения (доля поверхности твердого тела, заполненной мономолекулярным слоем молекул поглощенного вещества);
(1 – θ) – доля свободной поверхности.
При равновесии:
Vадс = Vдес;
V = KCAa CBb
V
 адс = Kvад р (1 – θ) 1/Kдес
адс = Kvад р (1 – θ) 1/KдесV
Kадс
Kдес
дес = Kvад θ 1/Kдес
(1 – θ) = θ

Kpp (1 – θ) = θ

Уравнение Лэнгмюра
Kpp
1+ Kpp
= θ

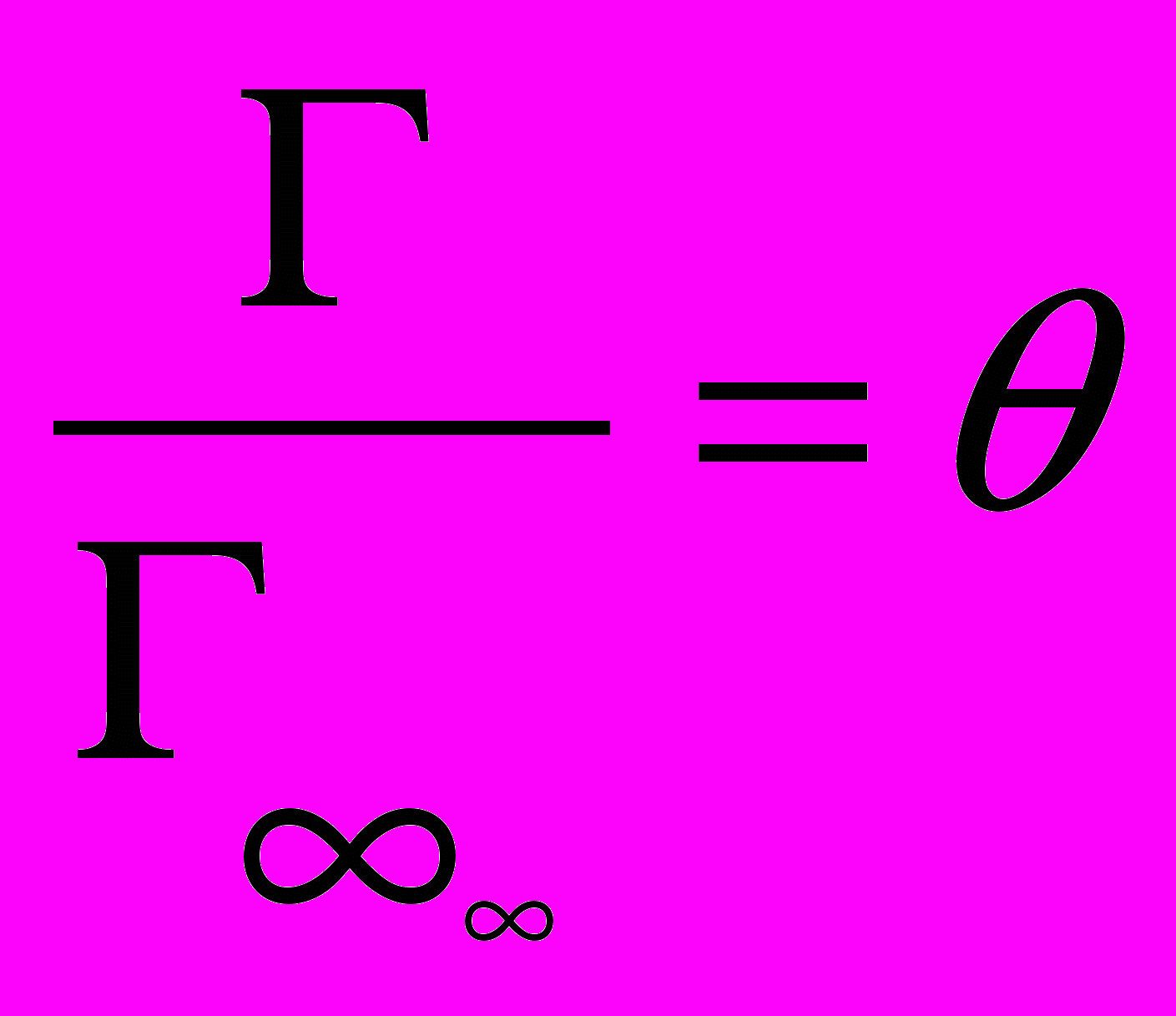
Г – адсорбция в данный момент времени.
Г∞ – адсорбция при максимальном заполнения поверхности адсорбата.
θ - степень заполнения
θ
Т1 > Т2



Т1
1
Т2

 р
рИонно-обменная хроматография
Ионно-обменная хроматография является одним из способов очистки воды.
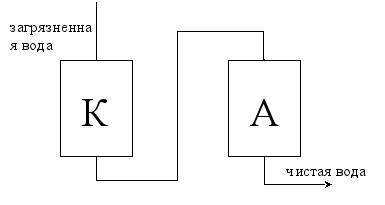
K
 – катионид – (R – H)
– катионид – (R – H) высоко молекулярные смолы
А
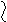 – анионид – (R – OH)
– анионид – (R – OH) - R – H + NaCl ↔ R – Na + H+ + Cl¯
- R
 – OH + H+ + Cl¯ → R – Cl + H+ + OH¯
– OH + H+ + Cl¯ → R – Cl + H+ + OH¯
H2O
Десорбция
Десорбция, также как и диффузия, обусловлена тепловым движением молекул. Следовательно, с повышением температуры процесс десорбции усиливается (только для физической десорбции). При десорбции с течением времени наступает момент динамического равновесия, при котором скорость десорбции равна скорости адсорбции:
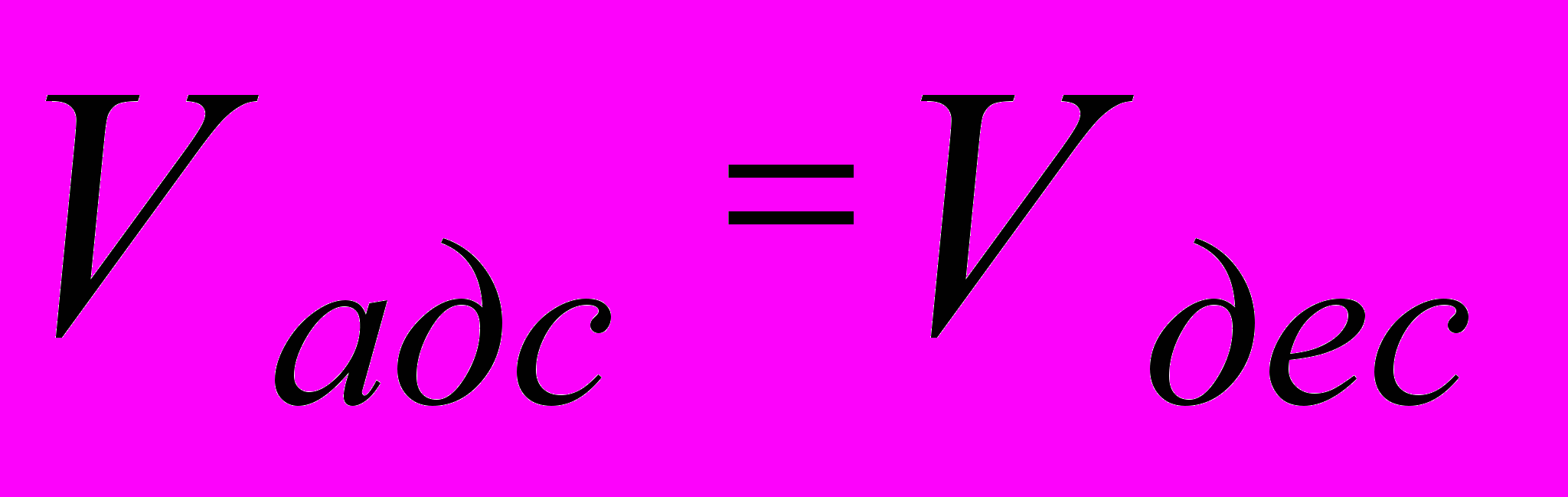
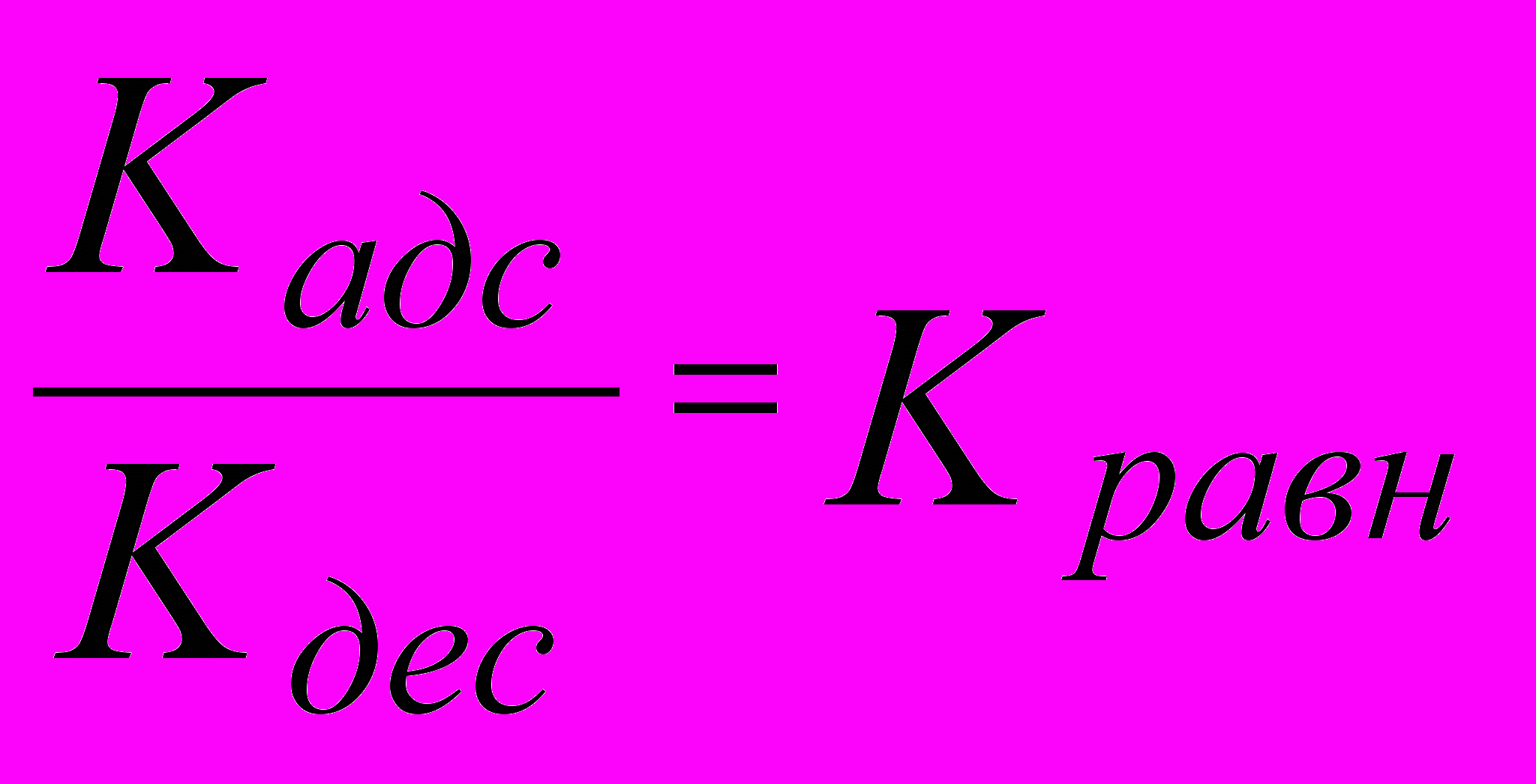

V = K (C = 1 Моль/л)
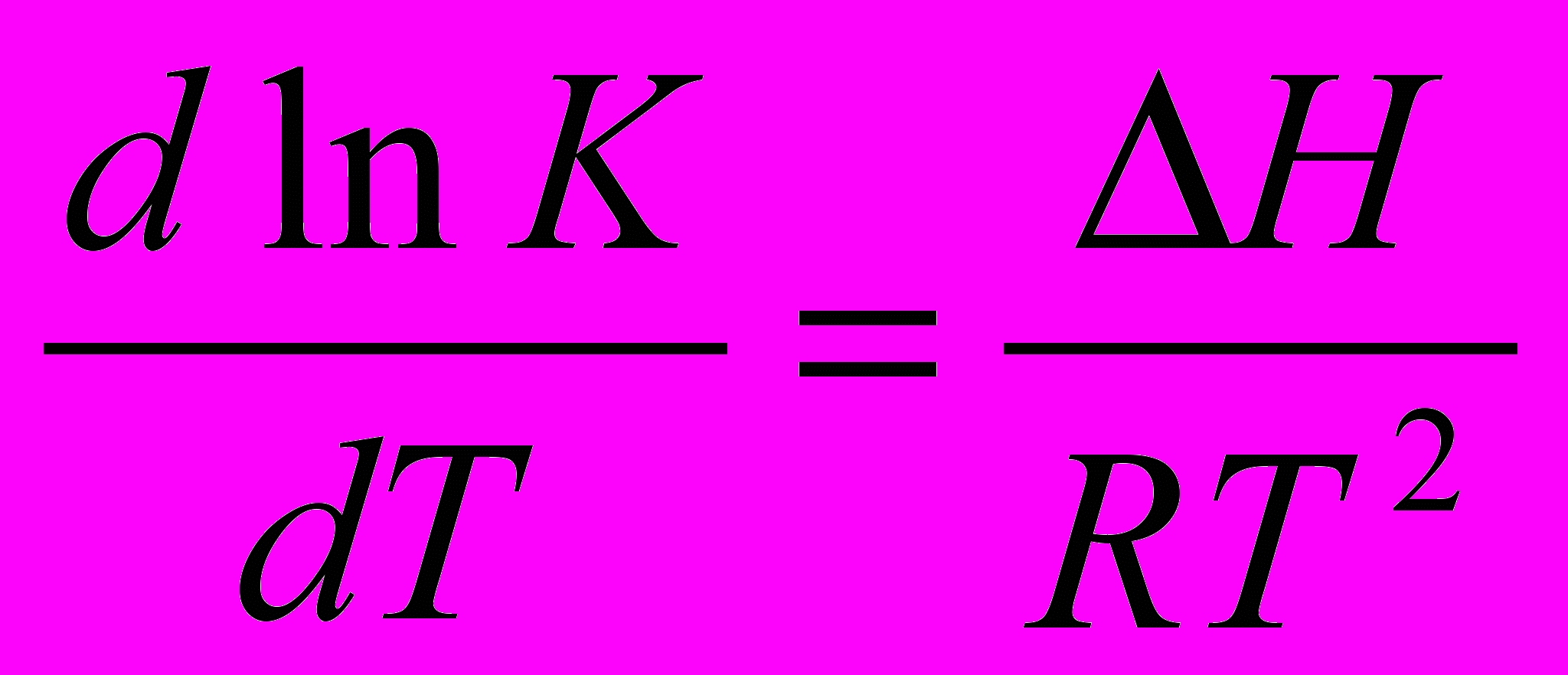 ; ∆H – теплота адсорбции (выделение теплоты – самопроизвольный процесс).
; ∆H – теплота адсорбции (выделение теплоты – самопроизвольный процесс).∆Gпов = σS;
σ – поверхностное натяжение;
S – площадь поверхности раздела фаз;
∆Gпов – максимальная полезная работа, затраченная на отрыв единицы поверхности раздела фаз.
Все самопроизвольные процессы стремятся понизить запас энергии Гиббса.
3. Воска
Воск – сложные эфиры жирных кислот и спиртов, отличных от глицерина.
Пчелиный воск – состоит из миристил-пальмитата.
С30Н61ОН – миристиловый спирт.
IX. Амины
Амины – органические производные аммиака (NH3).
 Амины
АминыПервичные; Вторичные; Третичные
NH2 – R R1 – NH – R2 R2 – N – R3
|
R1
Пример.
C6H5 – NH2 – NH2
бензиламин
Примеры.
NH2
|
 фениламин (анилин).
фениламин (анилин).СН3 – NH
|
 метиланилин.
метиланилин.Нахождение в природе
- Амины широко распространены в живой природе.
- Амины – основание ДНК.
- Аминокислоты являются составляющими белковых молекул.
- Многие биологические вещества такие как наркотики, яды, галлюциногены также являются аминами.
Физические свойства аминов
- Связь NH полярнее связи СН, но менее полярна, чем связь ОН. Поэтому молекулярные связи в аминах слабее, чем в спиртах. По этой же причине низшие амины, содержащие до трех атомов углерода в скелете, являются газами (при t˚=20˚С).
- Низшие амины хорошо растворимы в воде, так как образуют водородные связи с молекулами воды.
- Амины с большими углеводородными группами (например, анилин) хорошо растворимы в органических растворителях и плохо растворимы в воде.
Например, анилин хорошо растворяется в жировых тканях. По этой причине он легко проникает через кожу, что приводит к отравлению организма.
- Амины образуются при разложении белков.
Ди- и триметиламины образуются при гниении рыбы. А высшие амины образуются при гниении мяса.
Мочевина ((NH2)2CO) – диамид угольной кислоты – важнейший продукт обмена белков в организме. Это первое соединение, которое было получено в лаборатории из неорганических веществ.
Основность аминов
Основание – электро-донорный реагент, который обладает сродством к протону.
Из этого определения следует, что, взаимодействуя с кислотами, амины образуют соли. Так газообразный метиламин (СH3NH2) при взаимодействии с соляной кислотой (HCl) образует твердую соль – хлоридметил аммония.
Метиламин можно получить в виде основания. (CH3)3N+ образует соль (CH3)3NBr (бромистый триметил аммония). А анилин образует C6H5NH3I.
Алифатические амины в водных растворах являются более сильными основаниями, чем NH3 (аммиак). Причина этого заключается в том, что алкильные группы являются донорами электронов, что приводит к частичной делокализации по отношению к атому углерода.
Во вторичных и третичных аминах в делокализации участвуют 2 и 3 атома углерода, поэтому основность увеличивается к третичным аминам.
п
 ервичный C2H5NH2
ервичный C2H5NH2 C2H5
|
вторичный CH3 – CH2 – CH2 – NH
третичный CH3 – CH2 – N – C2H5
|
CH3
Также амины способны к образованию водородных связей.
 H
H
 Н ••• O
Н ••• OH
R
 – N
– N 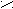 H
H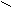 H ••• O
H ••• OH
Комбинация этих двух факторов приводит к тому, что по основности амины распределяются так:
вторичные > первичные > третичные > NH3
Ароматические амины более слабые основания, чем алифатические.
NH2 ••
| и C2H5 N H2

В этом случае неподеленная пара электронов атома азота частично делокализована по ароматическому кольцу. В результате чего происходит сопряжение с электронами бензольного кольца. Поэтому эта пара электронов менее доступна для координации с протоном.
Электро-донордные группы ОН ¯ усиливают основность. А электро-акцепторные группы NO2¯, Cl¯ уменьшают.
Химические реакции аминов
- Алкилирование аминов (RHall);
RHall
N
 H3 HHall + RNH2
H3 HHall + RNH2 R2Hall
R3Hall
R4Hall
R4
|
R


 1NH2 R1 – N – R2 R1 – N – R2 R1 – N – R2Hall
1NH2 R1 – N – R2 R1 – N – R2 R1 – N – R2Hall| |
R3 R3
четвертичная аммониевая соль
В четвертичной аммониевой соли азот является четырехвалентным [(CH3)4N+Br¯ ].
Галоген-арены практически не вступают в эту реакцию.
- Реакции аминов с азотной кислотой;
| | Первичные амины | Вторичные амины | Третичные амины | |||
| Алифатические | Ароматические | Алифатические | Ароматические1 | Алифатические | Ароматические2 | |
| Формула | RNH2 | ArNH2 | R2 – N – H | R1 | R – N – H | 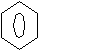 | R2 – N – R3 | R1 | R1 – N – R2 | 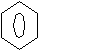 |
| Реакция получения |       NaNO2 + HCl → R – N+ NCl¯ или ArN NCl NaNO2 + HCl → R – N+ NCl¯ или ArN NCl (соль диазония) (для ароматических) | |||||
| Возможны реактивы | ROH, RCl, CnH2n и т.д. | |||||
| Формула продукта | R – N+  NCl¯ NCl¯ | Ar – N+  Cl¯ Cl¯ | (R)2N – N = O | (Ar)2N – N = O | (R)3N+HNO2 | HN+(R)2Cl¯ | 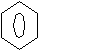 |
| Продукт | Соли диазония R+ + N2 | Устойчивые соли диазония | Нитрозоамины | Соли | Нитрозопроизводные | |
| Визуальный эффект | Выделения газа (N2) | Качественная реакция с фенолами дает азокрасители | Появляется желтое масло | Видимых изменений не происходит | Соли желтого цвета |
