II. Квантово-механическое представление в органической химии
| Вид материала | Реферат |
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 425.07kb.
- Утверждаю, 318.85kb.
- Методы органической химии, 158.45kb.
Строение вещества
Двойственная структура микрочастиц
Современная квантово-механическая теория строения атомов и молекул учитывает как корпускулярные, так и волновые свойства электронов и других микрообъектов. Дифракция составляет волновые свойства. Фотоэлектронная эмиссия – корпускулярные.
Принцип непрерывности Гейзенберга
Невозможно одновременно с достаточной точностью определить положение электрона и его скорость.
∆Х∆рх ≥ h
Квантовая механика заменяет классическое понятие точного места нахождения частицы понятием статистической вероятности нахождения электрона в данной точке пространства или в элементе объема атома dV.
Уравнение Шредингера
Движение микрочастиц описывается уравнением Шредингера, которое играет роль подобную роли законов Ньютона в классической механике. Он полностью описывает положение электрона в атоме.
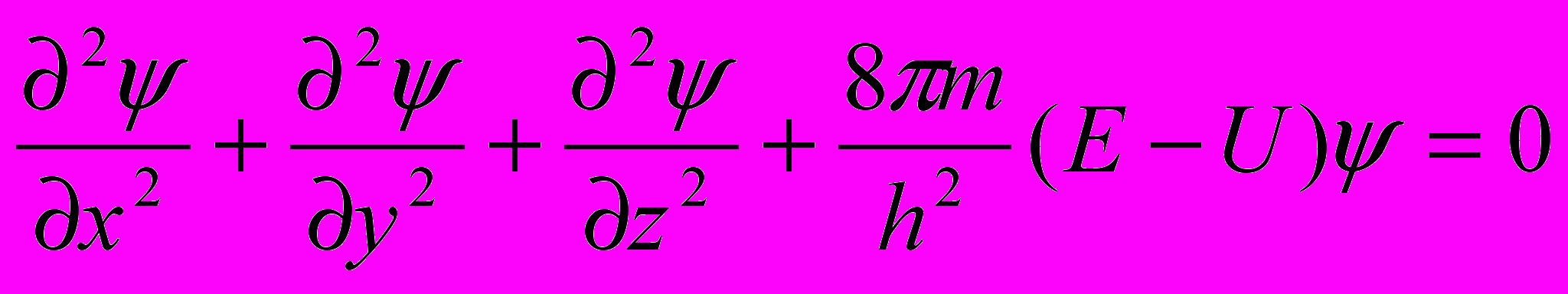
где ψ – волновая функция (полностью описывает положение электрона в атоме (орбиталь));
Е – полная энергия;
U – потенциальная энергия.
Физический смыл ψ
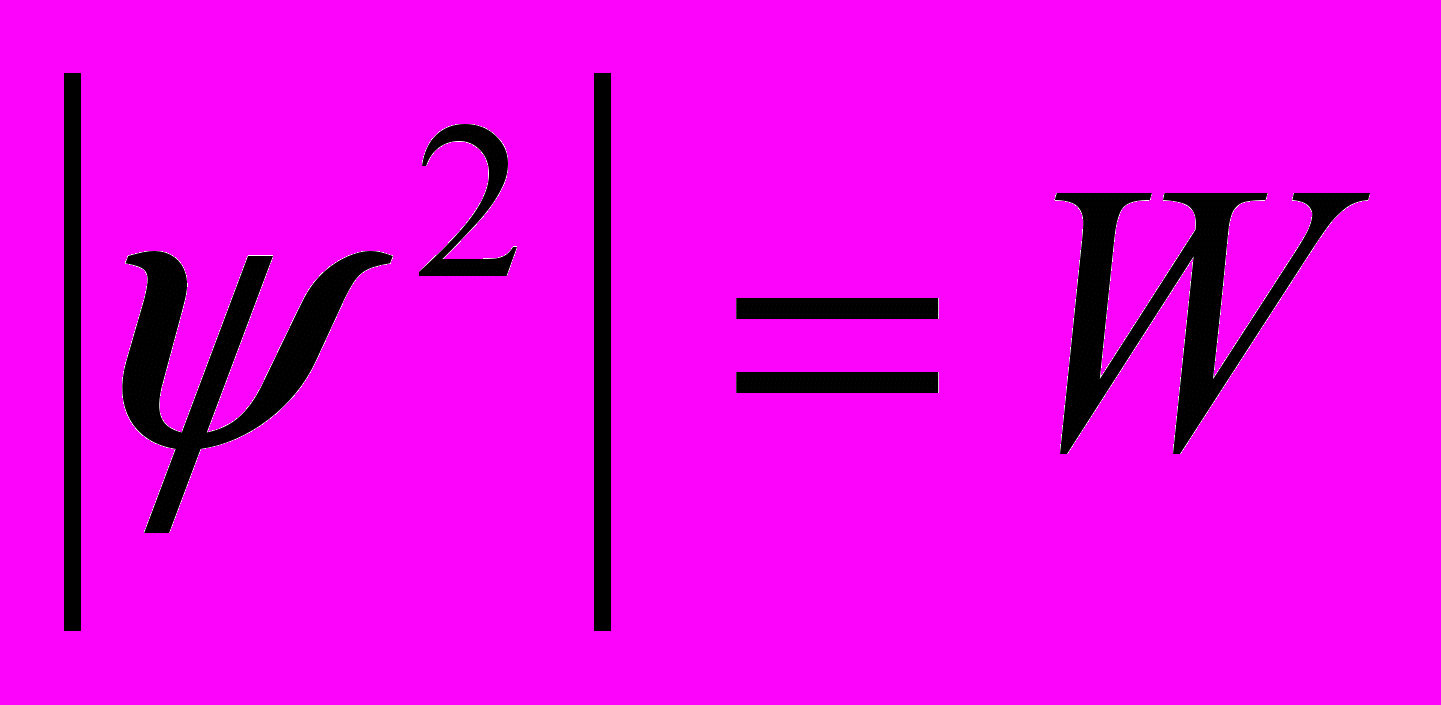
где W – плотность вероятности нахождения электрона в точке с координатами x,y,z в момент времени τ.
Вероятностное описание движения электрона приводит к представлению о том, что электрон как бы «размазан» вокруг ядра и образует той или иной формы электронное облако, плотность которого в разных точках определяется вероятностью пребывания электрона в них.
М
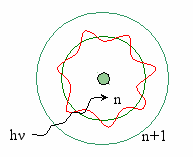 одель Бора
одель БораБор считал, что электроны движутся по стационарным орбитам, номера которых равны числу полуволн (волновые свойства электрона). Находятся эти атомные орбитали на расстоянии радиуса Бора, так как в этом случае плотность вероятности пребывания электрона максимальна.
Корпускулярные свойства

Свойства уравнения Шредингера таковы, что оно может быть решено только для некоторого дискретного значения полной энергии. Эти решения пропорциональны ряду целых чисел.
Квантовые числа:
1) Главное квантовое число (n)
Определяет энергетический уровень.
n=1,2,3,…,n
2) Орбитальное квантовое число (l)
Определяет энергетический подуровень и форму электронного облака.
l=0,1,…,n+1
3) Магнитное квантовое число (m)
Определяет ориентацию электронного уровня в магнитном поле.
m = –l,…,0,…l
4) Спиновое квантовое число(s)
Определяет направление вращения электронов вокруг собственной оси.
s= ± ½
Форма электронного облака определяется вероятностью нахождения электрона в объеме dV.
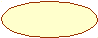
Для s-электронов
ψ2dV зависит только от радиуса, образуя сферическую симметрию.
 ψ2dV Поэтому облако одного 1s электрона имеет форму, изображаемую
ψ2dV Поэтому облако одного 1s электрона имеет форму, изображаемую
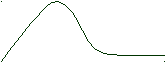

 окружностью.
окружностью.r◦ r
dS
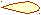
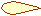
Для p-электронов

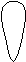
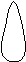
 Y Электронное облако изображается тремя линейно независимыми
Y Электронное облако изображается тремя линейно независимыми эквивалентными «восьмерками».
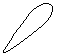

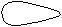
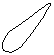 X
XZ
Многоэлектронные атомы
Движение каждого электрона в атоме зависит не только от влияния ядра, но и от влияния других электронов.
Эффект экранирования состоит в уменьшении воздействия на электрон положительного заряда ядра в связи с наличием между рассматриваемым электроном и ядром других электронов. Этот эффект приводит к тому, что энергия электронов, обладающих равными n, но разными l различна. Следовательно, энергия электронов в многоэлектронных атомах определяется как n, и так и l. Чем больше электронов, тем более заметна зависимость энергии электронов от l. Заполнение электронами в многоэлектронных атомах осуществляется по принципу Паули.
Принцип Паули:
В любом атоме или молекуле не может быть двух электронов с одинаковым набором значений четырех квантовых чисел.
С ростом заряда на единицу, в поле заряда попадает электрон в наименьшее электронное состояние, т.е. состояние с наименьшим значением n + l.
Следствия:
- Максимальное значение числа электронов в уровне равно 2n2;
- Максимальное значение числа электронов на подуровне равно 2(2l+1).
Последовательность заполнения электронами уровней в многоэлектронном атоме идет по следующему принципу:

1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d11<4f 14<5dот2до10<6p<7s<6d1<5f 14<6d2
Пример.
Bi 83
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f 14 5d10 6p3
S–элементы – элементы, атомы которых заполняются одним или двумя электронами s подуровня внешнего уровня, при наличии в предпоследнем уровне двух или восьми электронов.
У p–элементы – электронами заполняется p подуровень внешнего уровня.
У f–элементы – электронами заполняется f подуровень n–2 уровня.
У d–элементы – электронами заполняется d подуровень предпоследнего n–1 уровня. А на внешнем уровне находятся один или два s-электрона.
Разница между ожидаемым числом электронов в многоэлектронных атомах и реальным числом электронов (проскоки электронов) объясняется тем, что уравнение Шредингера строго может быть решено только для изолированного атома водорода, где энергия электрона определяется только n.
Для заполнения квантовых ячеек используют правило Гунда.
Правило Гунда:
В данном подуровне заполнение электронных оболочек происходит таким образом, чтобы суммарный спин был максимальным.
Задание.
Написать строение Sm 62
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f 5
Задание.
Найти элемент, у которого на внешнем уровне 5d4.
Ответ: W
Валентность (ковалентность)
Валентность – определяется числом ковалентных связей, которые образует атом. Образовывать ковалентные связи могут только неспаренные электроны, т.е. они и определяют валентность.
Переход электрона на более высокий энергетический уровень осуществляется тогда, когда затрата энергии на возбуждение компенсируется энергией, выделяющейся при образовании химической связи. В случае инертных газов для возбуждения атомов требуется очень большая энергия затраты. Это и объясняет их инертность.
Валентность атомов выражает одно из свойств ковалентной связи – насыщаемость.
| Элемент | Электронная формула | 1s | 2s | 2p | Число неспаренных электронов | Число электронов в возбужденном состоянии | ||
| x | y | z | ||||||
| Li | 1s2 2s1 | ↑↓ | ↑ | | | | 1 | 1 |
| Be | 1s2 2s2 | ↑↓ | ↑ 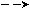 ↓ ↓ | 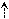 | | | 0 | 2 |
| Cl | 1s2 2s2 2p1 | ↑↓ | ↑ 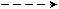 ↓ ↓ | ↑ | 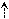 | | 1 | 3 |
| C | 1s2 2s2 2p2 | ↑↓ | ↑ 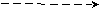 ↓ ↓ | ↑ | ↑ |  | 2 | 4 |
| N | 1s2 2s2 2p3 | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | 3 | - |
| O | 1s2 2s2 2p4 | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | 2 | - |
| F | 1s2 2s2 2p5 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | 1 | - |
| Ne | 1s2 2s2 2p6 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | 0 | - |
Свойства атомов, меняющихся периодически
Для элементов в свободном виде (Ni, Fe, Au) характерны:
- ковкость;
- твердость;
- плотность;
- коэффициенты расширения и присоединении;
- стандартные и окислительно-восстановительные электродные потенциалы;
- Высокие температуры кипения и плавления;
- ? ∆H(плавления), ∆H(испарения), ∆H(сублимации);
- тепло- и электропроводность.
Рассмотрим как в таблице Менделеева происходит изменение атомных и ионных радиусов электронов.
1) Атомные и ионные радиусы;
Рассмотрим как в таблице Менделеева происходит изменение атомных и ионных радиусов электронов.
Атомный радиус – расстояние, которое разделяет центры двух соседних атомов одного элемента. Радиус атома точно не определяется, т.к. электроны не строго локализованы, и электронное распределение может меняться из-за влияние соседних атомов.
 Радиус атома, соответствующий электронам 1 периода, уменьшается слева направо,
Радиус атома, соответствующий электронам 1 периода, уменьшается слева направо,т.к. с ростом заряда ядра, растет сила притяжения.
2) Потенциал ионизации;
Энергия ионизации (I) – энергия, которую необходимо затратить для отрыва электрона от атома, находящегося в нормальном состоянии.
Na→Na++1e; [эВ]
Энергия ионизации зависит от удаленности электрона от ядра, заряда ядра, эффекта экранирования, проникновения электронов к ядру, взаимного отталкивания электронов, принадлежащих одному и тому же слою.
Согласно квантовой механики электрон может находиться а любой точке атома, то есть даже внешние электроны некоторое время могут находиться в области, близкой к ядру.
S-электроны являются самыми проникающими. Эффект проникновения увеличивает прочность связи.
увеличение энергии ионизации

 Li Be B C N O F Ne
Li Be B C N O F Ne5,39 9,32 9,30 11,26 14,53 13,61 14,72 21,56
Cs = 3,89
Рост по периодам объясняется увеличением заряда ядра при одном и том же количестве электронных слоев.
3) Сродство к электрону;
Сродство к электрону определяется энергией, которая выделяется при захвате атомом электрона с образованием аниона.
Пример.
Cl0 + e = Cl–
Для многих атомов энергия притяжения дополнительного электрона к ядру превосходит энергию отталкивания электрона от электронных оболочек. Квантово-механический расчет показывает, что при присоединении двух и более электронов, энергия отталкивания больше энергии притяжения, поэтому одноатомные многозарядные ионы в свободном состоянии существовать не могут.

F – 3,62 эВ
Cl – 3,71 эВ Максимальное сродство к электрону у галогенов.
Br – 3,49 эВ
I – 3,19 эВ
4) Электроотрицательность (Э.О.);
Электроотрицательность – арифметическая полусумма энергии ионизации и сродство к электрону.
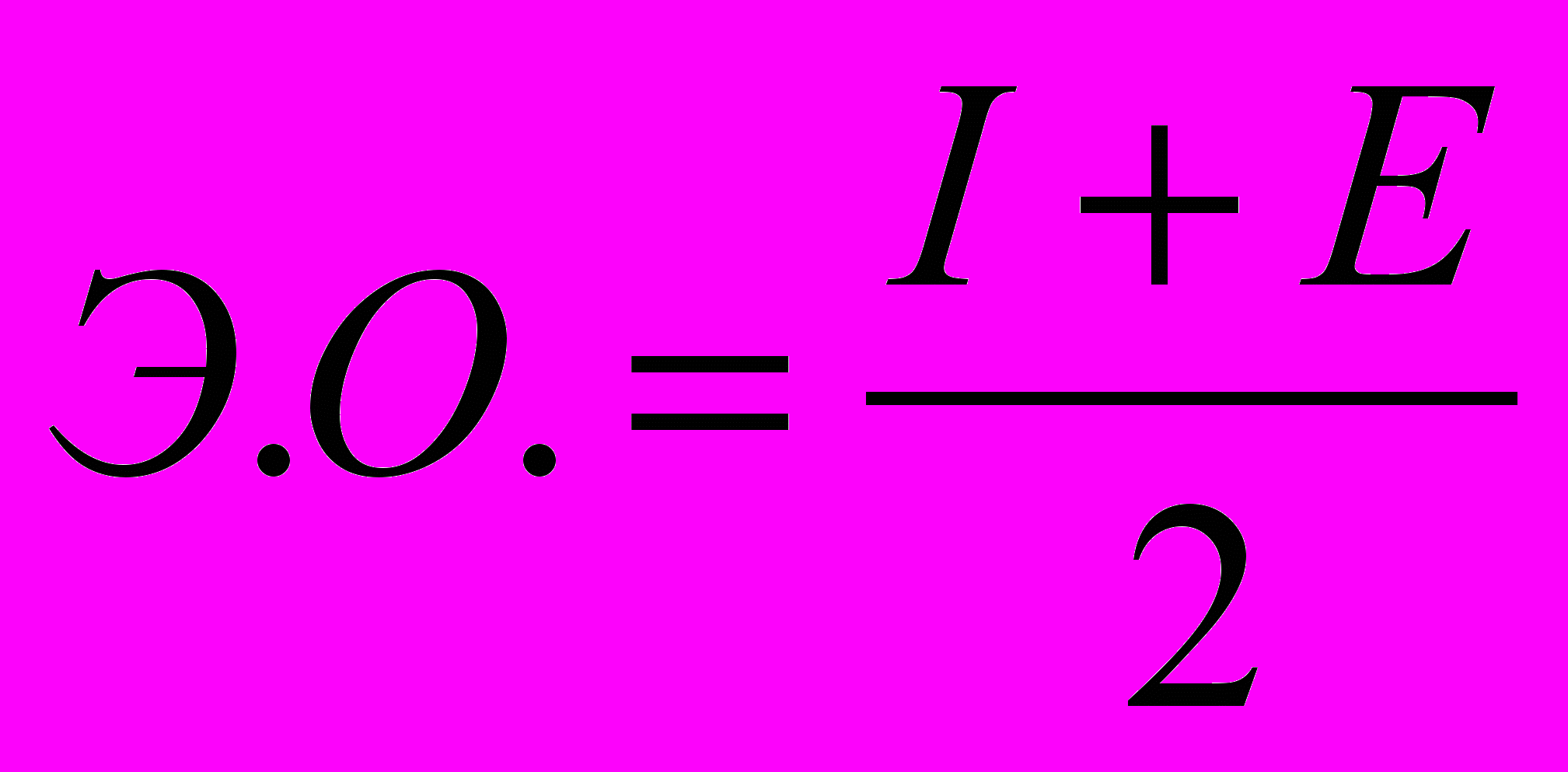 где I – энергия ионизации;
где I – энергия ионизации; Е – сродство к электрону.
L

 i Be B C N O F
i Be B C N O F1,0 1,5 2 2,5 3 3,5 4
Na
0,9
K Электроотрицательность характеризует стремление
0,8 данного атома к присоединению электронов
при образовании химических связей.
Cs
0,7
5) Степень окисления;
6) Оптические и магнитные свойства.
Полярные и неполярные молекулы
Когда зона максимальной электронной плотности суммарного электронного облака симметрично расположена относительно ядер обоих атомов. Такая связь называет неполярной (гомополярной).
Молекула, состоящая из атомов разных элементов, называется полярной (гетерополярной). Смещение электронной плотности происходит в сторону более электроотрицательного атома. Такая молекула представляет собой диполь.
Дипольный момент (μ) – мера полярности. Он равен произведению заряда электрона на расстояние между центрами тяжести положительного и отрицательного заряда.
[μ]=[Дебай]
LiF BeF2 BF3 CF4 NF3 OF2 F2
доля ковалентная связь

 доля ионная связь
доля ионная связьПоляризация ионов
Влияние друг на друга близко размещенных, противоположно заряженных ионов вызывает их взаимную поляризацию. При сближении ионов происходит смещение электронов по отношению к ядру и возникает наведенный (индукционный) дипольный момент (μинд). С одной стороны μинд равно произведению заряда электрона на расстояние между центрами тяжести положительного и отрицательного заряда. С другой – произведению напряженности на поляризуемость.
Для простоты будем считать, что поляризация иона обусловлена только деформацией внешних электронных оболочек. При равных зарядах и близких радиусах минимальная поляризация наблюдается у ионов с конфигурацией благородных газов, а максимальная поляризация – у ионов с 18 внешними электронами. Ионы оказывают интенсивное поляризующее воздействие.
μинд = е · l
μинд = E · α
где е – заряд электрона
E – напряженность
α ~ r 3 – поляризуемость
Задание.
Пользуясь законом Кулона, оценить напряженность электрического поля на расстоянии
r = 10Å = 10-7см;
|е| = 4,8·104эл.ед.
2. Химические связи
Ковалентная связь
Ковалентная связь возникает между двумя атомами, если неспаренные электроны, находящиеся на внешних электронных уровнях двух атомов, обладают противоположном направленными спинами неспаренных электронов. При этом два электрона образуют общую (поделенную) пару электронов.
Ковалентная связь не затрагивает электроны во внутренних слоях атома.
Анализ квантово-механического расчета взаимодействия двух атомов водорода показывает, что антипараллельность спинов двух электронов приводит к перекрыванию электронных облаков обоих атомов. В результате возникает электронное облако с наибольшей плотностью отрицательного заряда между атомами. При этом изменяется потенциальная энергия системы, т.е. возникает химическая связь.
При антипараллельности спинов их волновые функции складываются. В этом случае электронная плотность (определяющаяся ψ2) больше суммы электронной плотности двух электронных облаков изолированных атомов.
При антисимметричной волновой функции, которая характеризует электроны с параллельными спинами, плотность электронного облака падает до нуля, т.е. электроны выталкиваются из пространства между ядрами двух атомов, и химическая связь не образуется.
Метод молекулярных орбиталей
(квантово-механическое объяснение ковалентной связи).
Этот метод основан на том, что в поле ядер атомов, составляющих молекулу, имеется разрешенное состояние электронов, т.е. молекулярные орбитали, которые заполняются обобщенными электронами двух атомов.
Пример.
 σ*св.
σ*св. ↑ ↓ H↑ ↓Н
↑ ↓ H↑ ↓НH · · H 1s 1s








 ↑ ↑ Атомные орбитали
↑ ↑ Атомные орбитали H · · H σсв ↑↓
H · · H σсв ↑↓ Молекулярные орбитали
Молекулярные орбитали(образование ковалентной связи)
Пример.
Не
1s2
σ*св В следствие этого Не – инертный газ и не существует Не2.
 Hе↑ ↓Не
Hе↑ ↓Не
 1s ↓↑ 1s
1s ↓↑ 1s 


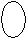

 ↑↓ ↑↓
↑↓ ↑↓ 

 σсв ↑↓
σсв ↑↓Молекулярные орбитали
- Каждый электрон в молекуле находится на определенной молекулярной орбитале, описанной соответствующей волновой функцией.
- Каждой молекулярной орбитале отвечает определенная энергия.
- На одной молекулярной орбитале могут находиться только два электрона с противоположно направленными спинами.
- Волновая функция ψ, характеризующая движение всех рассматриваемых электронов в молекуле, рассматривается как произведение волновых функций отдельных электронов.
ψ = ψ1· ψ2·…· ψn
- Межмолекулярные одноэлектронные волновые функции берутся как линейные комбинации волновых функций электронов в атомах, из которых образована молекула.
ψмo = C1ψАО+ C2ψАО1 +…+ CnψАОn
ψмo – волновая функция электрона на молекулярной орбите.
ψАО – волновая функция электрона на атомной орбитале.
- σ-орбиталь, характеризующаяся меньшим запасом энергии, чем атомная орбиталь изолируемого атома, называется связующей.
В этом случае, при сложении атомных волновых функций, величины ψ в пространстве между ядрами возрастают. Появляется зона высокой электронной плотности, которая притягивает электроны, и образуется химическую связь.
- σ*разр – это орбиталь, которая является энергетически менее выгодным состоянием, чем состояние отдельных атомных орбиталей.
В этом случае происходит вычитание отдельных электронных плотностей атомных орбиталей, вследствие чего электронная плотность между ядрами снижается, что приводит к отталкиванию ядер.
- Молекулярные орбитали могут быть σs, πx, πy, πz.


 ↑ ↓ А.О. М.О.
↑ ↓ А.О. М.О. А.О. • • •+ •
А.О. • • •+ • 

 σs
σs
 + –
+ – 


 • • + – – +
• • + – – +σp*









 Pz Pz
Pz Pzσz

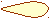





 – + + – – + –
– + + – – + ––





 + – + – + – + σ*
+ – + – + – + σ*Py
 + + +
+ + +  – – –
– – –При комбинации двух s атомных орбиталей образуется две молекулярные орбитали: связывающая и разрыхляющая.
Следовательно, из 6 р атомных орбиталей (по три каждого атома: 2px2py2pz) образуется 6 молекулярных орбиталей (3 связывающих и 3 разрыхляющих).
Ψ = С1Ψ1 + С2Ψ2
Если Сi = 0 – несвязывающая орбиталь;
Сi > 0 – разрыхляющая орбиталь;
Ci < 0 – связывающая орбиталь.
Метод молекулярных орбиталей позволяет оценить химическую связь не только электронных пар но и отдельных электронов. Согласно этому методу, нахождение электронов на разрыхляющих орбиталях не только не создает химическую связь, но и приводит к отталкиванию атомов.
С помощью метода молекулярных орбиталей можно описать молекулярных орбитали только для простых атомов:
σ1s < σ*1s < σ2s < σ*2s < σ2pz < π2px < π2py < π*2px < π2py < σ*2pz
Данный метод позволяет предсказать:
- Возможность существования молекулы.
Химическая связь возникает, если количество электронов на связующих орбиталях (Ne) больше, чем на разрыхляющих.
свNe > разр Nе
Существование молекулы гелия не возможно, так как σ1s = 2 и σ*1s = 2. Следовательно гелий существует в виде атомов.
- Кратность химической связи.
КРАТНОСТЬ =
свNe – разр Nе
2
- Магнитные свойства молекулы.
Н-Н является диамагнетиком, т.к. все электроны в молекуле спаренные.
Пример.
О2
1s2 2s2 2p4
| ↑↓ | ↑ | ↑ |
Заполнение молекулярных орбиталей выполняется по принципу Паули.
σp*z










 ↓ ↑
↓ ↑




↑





 ↓ ↓ ↓ ↑ ↑ ↑↓
↓ ↓ ↓ ↑ ↑ ↑↓z





 y x π2px π2py x y z
y x π2px π2py x y z 




 ↑↓ ↑↓
↑↓ ↑↓



 ↑↓
↑↓ σpz
σpz