Етодические особенности изучения органической химии место органической химии в школьном курсе химии
| Вид материала | Документы |
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Конспект урока химии в 10 классе Тема урока, 54.04kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Программа дисциплины дпп. Ф. 10 Органический синтез цели и задачи дисциплины, 143.71kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 318.85kb.
- Утверждаю, 425.07kb.
1 2
тема 14. мЕТОДИЧЕСКИЕ ОСОБЕННОСТИ ИЗУЧЕНИЯ
ОРГАНИЧЕСКОЙ ХИМИИ
1. Место органической химии в школьном курсе химии
В соответствии с образовательным стандартом понятия органической химии изучаются по концентрическому принципу: первый концентр – в рамках основного общего образования (в 9 классе), второй – на этапе среднего (полное) общего образования (в 10 или 11 классе).
Федеральный компонент содержит три стандарта по химии: для основного общего образования; для среднего (полного) общего образования на базовом уровне; для среднего (полного) общего образования на профильном уровне.
В 9 классе на изучение основ органической химии отводится различное число часов в зависимости от автора программы. (Минченков Е.Е. – 30 часов; Кузнецова Н.Е. – около 10 часов в составе темы "Неметаллические элементы; Шелинский Г.И. – 12 часов; Габриелян О.С. – 18 часов; Гузей Л.С. – 15 часов; Иванова Р.Г. – около 10 часов в составе темы "Неметаллы и их соединения").
Стандарт основного общего образования требует, чтобы учащиеся усвоили лишь элементарные знания о свойствах важнейших представителей основных классов органических веществ.
Более подробно органическая химия изучается в 11 классе (по программам Гузея Л.С. и Кузнецовой Л.М.) или в 10 классе – по программам других авторов.
По федеральному компоненту при изучении химии на базовом уровне на этот предмет в старших классах отводится 1 час в неделю; на профильном уровне – 3 часа в неделю. Региональные органы образования и сами школы могут в рамках своих возможностей увеличивать число часов, отводимых на изучение дисциплины. Кроме того, школы имеют возможность вводить в учебные планы элективные курсы и практикумы.
Изучение химии на базовом уровне предполагается в классах физико-математического, информационно-технологического, индустриально-технологического, социально-экономического, социально-гуманитарного, филологического, художественно-эстетического, психолого-педагогического профилей, а также при обучении в непрофильных классах или в так называемых классах универсального (общеобразовательного) профиля.
Изучение химии на профильном уровне предполагается осуществлять в классах физико-химического, химико-биологического, биолого-географического, агротехнологического профилей.
В классах социально-экономического, социально-гуманитарного, филологического, художественно-эстетического, психолого-педагогического профилей учебными планами предусматривается возможность включения химии (наряду с физикой и биологией) в состав курса «Естествознание», изучаемого по 3 часа в неделю в 10 и 11 классах.
Изучение органической химии направлено на достижение следующих целей: усвоение знаний о химической составляющей естественнонаучной картины мира, важнейших химических понятиях, законах и теориях; овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов; развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных; воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде; применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
2. Построение и содержание раздела органической
химии в 10-11 классах
Базовый уровень образовательного стандарта предполагает изучение следующих вопросов курса органической химии.
Классификация и номенклатура органических соединений. Химические свойства основных классов органических соединений.
Теория строения органических соединений. Углеродный скелет. Радикалы. Функциональные группы. Гомологический ряд, гомологи. Структурная изомерия. Типы химических связей в молекулах органических соединений.
Углеводороды: алканы, алкены и диены, алкины, арены. Природные источники углеводородов: нефть и природный газ.
Кислородсодержащие соединения: одно- и многоатомные спирты, фенол, альдегиды, одноосновные карбоновые кислоты, сложные эфиры, жиры, углеводы.
Азотсодержащие соединения: амины, аминокислоты, белки.
Полимеры: пластмассы, каучуки, волокна.
Профильный уровень образовательного стандарта предполагает изучение следующих вопросов курса органической химии.
Теория строения органических соединений. Углеродный скелет. Радикал. Функциональная группа. Гомологи и гомологический ряд. Структурная и пространственная изомерия. Типы связей в молекулах органических веществ и способы их разрыва. Типы реакций в органической химии. Ионный и радикальный механизмы реакций.
Алканы и циклоалканы. Алкены, диены. Алкины. Бензол и его гомологи. Стирол. Галогенопроизводные углеводородов.
Одноатомные и многоатомные спирты. Фенолы. Простые эфиры. Альдегиды и кетоны. Карбоновые кислоты. Функциональные производные карбоновых кислот. Сложные эфиры неорганических и органических кислот. Жиры, мыла.
Углеводы. Моносахариды, дисахариды, полисахариды.
Нитросоединения. Амины. Анилин.
Аминокислоты. Пептиды. Белки. Структура белков.
Пиррол. Пиридин. Пиримидиновые и пуриновые основания, входящие в состав нуклеиновых кислот. Представление о структуре нуклеиновых кислот.
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации.
Примечание: Курсивом в тексте выделен материал, который подлежит изучению, но не включается в Требования к уровню подготовки выпускников (ЕГЭ).
Стандартом определены также требования к уровню подготовки выпускников школы по химии.
В результате изучения химии на профильном уровне ученик должен знать/понимать:
роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, нуклиды и изотопы, атомные s-, p-, d-орбитали, химическая связь, электро-отрицательность, валентность, степень окисления, гибридизация орбиталей, пространственное строение молекул, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, комплексные соединения, дисперсные системы, истинные растворы, электролитическая диссоциация, кислотно-основные реакции в водных растворах, гидролиз, окисление и восстановление, электролиз, скорость химической реакции, механизм реакции, катализ, тепловой эффект реакции, энтальпия, теплота образования, энтропия, химическое равновесие, константа равновесия, углеродный скелет, функциональная группа, гомология, структурная и пространственная изомерия, индуктивный и мезомерный эффекты, электрофил, нуклеофил, основные типы реакций в неорганической и органической химии;
основные законы химии: закон сохранения массы веществ, периодический закон, закон постоянства состава, закон Авогадро, закон Гесса, закон действующих масс в кинетике и термодинамике;
основные теории химии: строения атома, химической связи, электролитической диссоциации, кислот и оснований, строения органических соединений (включая стереохимию), химическую кинетику и химическую термодинамику;
классификацию и номенклатуру неорганических и органических соединений;
природные источники углеводородов и способы их переработки;
вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, стекло, цемент, минеральные удобрения, минеральные и органические кислоты, щелочи, аммиак, углеводороды, фенол, анилин, метанол, этанол, этиленгликоль, глицерин, формальдегид, ацетальдегид, ацетон, глюкоза, сахароза, крахмал, клетчатка, аминокислоты, белки, искусственные волокна, каучуки, пластмассы, жиры, мыла и моющие средства;
ученик должен уметь: называть изученные вещества по «тривиальной» и международной номенклатурам; определять: валентность и степень окисления химических элементов, заряд иона, тип химической связи, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам органических соединений, характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии; характеризовать:
s-, p- и d-элементы по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов и кетонов, карбоновых кислот, аминов, аминокислот и углеводов);
объяснять: зависимость свойств химического элемента и образованных им веществ от положения в периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения; природу и способы образования химической связи; зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул;
выполнять химический эксперимент по: распознаванию важнейших неорганических и органических веществ; получению конкретных веществ, относящихся к изученным классам соединений;
проводить расчеты по химическим формулам и уравнениям реакций;
осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для понимания глобальных проблем, стоящих перед человечеством: экологических, энергетических и сырьевых; для объяснения химических явлений, происходящих в природе, быту и на производстве; экологически грамотного поведения в окружающей среде; для оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы; для безопасной работы с веществами в лаборатории, быту и на производстве; для определения возможности протекания химических превращений в различных условиях и оценки их последствий; для распознавания и идентификации важнейших веществ и материалов; для оценки качества питьевой воды и отдельных пищевых продуктов; для критической оценки достоверности химической информации, поступающей из различных источников.
Необходимо понимать, что стандарты определяют только нижнюю границу содержания образования по химии. Каждый автор имеет право на составление собственной программы и создание учебника, соответствующего этой программе. Любые авторские программы и учебники должны обязательно включать в себя минимум содержания образования, определенный стандартом. Авторы имеют право включать в программы и учебники дополнительный материал, объем которого (вместе с обязательным минимумом) не должен превышать возможностей, предоставляемых базисным учебным планом курсу химии для данной ступени и профиля обучения.
Руководители школ и учителя имеют право выбирать учебники только из числа учебников, указанных в этом Перечне.
3. Основные особенности и проблемы, возникающие при изучении органической химии
Особенности преподавания органической химии вытекают из специфики предмета и обусловлены возрастными факторами личности учащихся.
А. Некоторые черты специфики предмета:
1. Содержание органической химии включает изучение огромного числа соединений.
2. Для усвоения органической химии необходимо знать теорию строения органических веществ А.М. Бутлерова.
3. Усвоение органической химии невозможно без понимания электронного строения органических веществ, их номенклатуры и генетических связей между ними.
4. Построение курса органической химии основано на постепенном усложнении строения изучаемых веществ.
5. Методика учебного эксперимента по органической химии разработана недостаточно. Многие органические вещества обладают высокой физиологической активностью.
Б. Возрастные особенности учащихся также определяют особую тактику работы учителя химии.
1. Многие учащиеся уже определили круг своих будущих профессиональных интересов.
а) Выбор пал не на химию.
б) Ученик выбрал химию.
2. Уровень развития учащихся позволяет шире применять вербальные методы обучения и логические приемы.
3. Запас знаний и умений учащихся позволяет шире применять самостоятельные, творческие работы.
4. Завершается становление характера и личности ученика.
В целом методика обучения, требования к проведению учебного химического эксперимента, необходимость совершенствования своей работы и внедрения современных педагогических технологий не отличаются существенно от методики преподавания неорганической химии.
Современный школьный курс органической химии насыщен сложными терминами и понятиями. Повторим некоторые из них.
Алифатические соединения (ациклические соединения, соединения жирного ряда) – органические соединения, в молекулах которых атомы углерода связаны между собой с образованием открытых, незамкнутых, нециклических разветвленных или прямых углеродных цепей. К А. с. относятся многие углеводороды (алканы, алкены, алкины, алкадиены и др.) и их производные (альдегиды, карбоновые кислоты, спирты, амины и др.). Свойства А. с. определяется строением углеродного скелета молекулы (углеродной цепи), наличием кратных связей и природой функциональных групп, если таковые имеются в составе молекул вещества. Многие А. с. играют важную роль в природных процессах и имеют большое практическое значение.
Алициклические соединения (циклоалифатические соединения) – органические соединения, содержащие в молекуле один или несколько циклов, состоящих только из трех или более атомов углерода (за исключением ароматических соединений). К А. с. относятся углеводороды (циклоалканы, циклоалкены и др.) и их производные, напр., спирты, карбоновые кислоты, амины. По числу циклов в молекуле различают моно-, би-, три- и полициклические, а по характеру связей, соединяющих атомы углерода – насыщенные и ненасыщенные. Примеры алициклических соединений – циклопропан, циклогексан, циклогексанон, циклогексанол. В больших количествах содержатся в нефти. Наибольшее применение имеют циклогексан и его производные.
Алкадиены (диеновые углеводороды, диены) – ненасыщенные углеводороды с двумя двойными связями в составе молекулы, общей формулой СnН2n-2. Строение двойных связей такое же, как и в алкенах. Простейшие представители – пропадиен, бутадиен, пентадиен и т. д. А. так же легко, как и алкены, вступают в реакции присоединения, полимеризации, обесцвечивают бромную воду и раствор перманганата калия. В зависимости от взаимного расположения двойных связей различают А. с изолированными связями (Н2С=СН-(СН2)n-СН=СН2); с куммулированными связями (-СН=СН=С-); с сопряженными двойными связями (-СН=СН-СН=СН-). Наибольшее значение имеют А. с сопряженными двойными связями (бутадиен и его производные), которые, применяют в производстве каучуков.
Алканы (предельные углеводороды, насыщенные углеводороды, парафины) – углеводороды нециклического строения (с открытой прямой или разветвленной углеродной цепью). Общая формула СnН2n+2 (n³1). В молекулах А. атомы углерода связаны только одинарными связями, атомные орбитали углерода находятся в состоянии sp3-гибридизации, угол между связями составляет 109о28'. Длина связи С-С в А. равна 0,154 нм. Простейшие представители – метан, этан, пропан, бутан и т. д. Названия следующих членов гомологического ряда А., начиная с пятого, составляются из первого слога греческих числительных с добавлением суффикса –ан, напр., пентан, гексан, гептан, октан, нонан, декан, ундекан и т.д. Чтобы назвать А. с прямой (неразветвленной) углеродной цепью применяют прилагательное нормальный, напр., нормальный пентан (н-пентан). Первые четыре члена гомологического ряда при обычных условиях – газы без запаха; с пятого по пятнадцатый – жидкости с запахом; начиная с шестнадцатого – твердые вещества без запаха. С увеличением молярной массы температуры кипения и плавления увеличиваются. Все А. мало растворимы в воде. В связи с отсутствием в молекулах кратных связей А. относительно инертные вещества и не вступают в реакции присоединения, полимеризации, не обесцвечивают бромную воду и раствор перманганата калия. Для А. характерны реакции изомеризации, горения, крекинга (разложения), замещения, неполного окисления, которые протекают в жестких условиях (высокая температура, катализаторы). А. можно получить гидрированием алкенов и алкинов, синтезом на основе водяного газа (смесь СО и H2), реакцией Вюрца, сплавлением солей карбоновых кислот с твердыми щелочами. Входят в состав нефти и природного газа. Применяют в качестве горючего (метан, бутан-пропановая смесь, бензин, керосин, газойль и т. д.), смазочных масел, в составе мазута; для синтеза других органических веществ и материалов. Широкое применение А. находят в медицине (вазелин, парафин, хлороформ, иодоформ и др.)
Алкены (этиленовые углеводороды, олефины) – ненасыщенные углеводороды гомологического ряда этилена. Общая формула СnН2n (n³2). В молекулах А. присутствует одна двойная связь между двумя атомами углерода, у которых электронные орбитали находятся в состоянии sp2-гибридизации. Сигма-связь двойной связи >С=С< и сигма-связи С-Н лежат в одной плоскости под углами 120о. Пи-связь двойной связи >С=С< образуется р-электронами, не подвергшимися гибридизации, и расположена перпендикулярно по обе стороны указанной плоскости. Длина связи С=С равна 0,133 нм, т.е. меньше чем длина одинарной (простой) С-С связи. Следствием такого строения является отсутствие возможности свободного вращения атомов углерода вокруг С=С связи. Все это приводит к тому, что для А. характерна не только изомерия углеродной цепи, как у алканов, но и изомерия положения двойной связи, цис-транс-изомерия и межклассовая изомерия (изомерны циклоалканам). Названия А. образуются от названий алканов с заменой суффикса –ан на суффикс –ен. Простейшие представители – этен, пропен, бутен и т. д. В связи с наличием в молекулах двойных связей вступают в реакции: а) присоединения (реакции гидрогенизации с образованием алканов, галогенирования с образованием дигалогеналканов, гидратации с образованием предельных одноатомных спиртов, гидрогалогенирования с образованием галогеналканов (две последние реакции идут по правилу Марковникова); б) окисления (реакции горения или полного окисления с образованием CO2 и H2O, неполного каталитического окисления с образованием оксидов соответствующих А., окисление раствором KMnO4 при рН³7 с образованием гликолей (реакция Вагнера), окисление-расщепление раствором KMnO4 при рН<7 с образованием карбоновых кислот); в) полимеризации с образованием полимеров. Перечисленные реакции присоединения, присущие А., могут при определенных условиях протекать и в обратном направлении, что и служит основой для их получения. В связи с высокой реакционной способностью встречаются в составе нефти и природного газа в незначительных количествах. Применяются в производстве полимеров (полиэтилен, полипропилен и др.) и для получения других органических веществ и материалов.
Алкилирование – введение алкила в молекулу соединения, напр., А. бензола: С6Н5-Н + СН3Сl
 С6Н5-СН3 + HCl. В зависимости от вводимого алкила различают метилирование, этилирование и т.д. А. подвергаются атомы углерода, а также атомы азота (напр., у аминов и аминокислот), кислорода (напр., у фенола, углеводов и др.). В зависимости от этого различают С-, N-, О-алкилирование и т.д. Применяется для получения высокооктанового топлива, поверхностно-активных веществ, антиокислителей, инсектицидов и других соединений.
С6Н5-СН3 + HCl. В зависимости от вводимого алкила различают метилирование, этилирование и т.д. А. подвергаются атомы углерода, а также атомы азота (напр., у аминов и аминокислот), кислорода (напр., у фенола, углеводов и др.). В зависимости от этого различают С-, N-, О-алкилирование и т.д. Применяется для получения высокооктанового топлива, поверхностно-активных веществ, антиокислителей, инсектицидов и других соединений. Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды гомологического ряда ацетилена, имеющие в составе молекулы одну тройную связь. Общая формула СnН2n-2 (n ≥ 2). В молекулах А. электронные орбитали атомов углерода, соединенные тройной связью находятся в состоянии sp-гибридизации, а сама связь придает данному фрагменту молекулы линейное строение. Длина связи СºС равна 0,120 нм. А. присущи изомерия углеродной цепи, изомерия положения тройной связи, межклассовая изомерия (изомерны алкадиенам). Названия А. образуются из названий соответствующих алканов с заменой суффикса –ан на -ин, напр., этин, гептин и т.д. Простейшие представители – ацетилен (этин), пропин, бутин и т. д. В связи с наличием в молекулах тройных связей вступают в реакции присоединения, которые протекают в две стадии. Так, при гидрировании А. в качестве конечного продукта получают алканы; галогенирование приводит к тетрагалогеналканам; гидрогалогенирование приводит к дигалогеналканам (протекает по правилу Марковникова); гидратация ацетилена дает ацетальдегид, при гидратации гомологов ацетилена образуются кетоны (реакция Кучерова). Реакции окисления могут протекать по-разному, в зависимости от окислителя. При горении в кислороде наблюдается полное окисление с образованием CO2 и H2O, при недостатке кислорода – сопровождается обильным выделением сажи (копоти). При окислении ацетилена раствором KMnO4 образуется щавелевая кислота; гомологи ацетилена в аналогичных условиях окисляются с расщеплением, образуя карбоновые кислоты. Реакции полимеризации для А. нехарактерны, а только ди- и тримеризация. Ацетилен при димеризации дает винилацетилен. Циклотримеризация А. приводит к образованию аренов, ацетилен превращается в бензол. А., молекулы которых имеют концевую тройную связь (терминальные алкины), способны при определенных условиях образовывать соли – ацетилениды, напр., ацетиленид натрия однозамещенный НСºС-Na, метилацетиленид меди СН3-СºС-Cu. А. получают из алканов и алкенов в результате реакций дегидрогенизации. Одним из способом получения А. является дегидрогалогенирование (отщепление атомов водорода и галогена) дигалогеналканов с помощью спиртового раствора щелочи. Ацетилен получают в больших количествах термическим разложением метана, а также из карбида кальция. А. находят широкое применение в органическом синтезе, ацетилен используется при резке и сварке металлов.
Альдегиды – класс органических веществ, молекулы которых содержат функциональную группу атомов
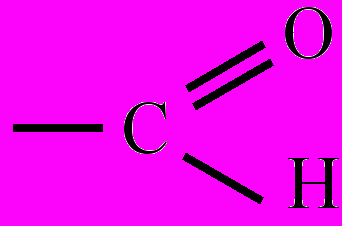 , соединенную с радикалом, входят в группу карбонильных соединений. Название "альдегид" составлено из начальных букв слов "алкоголь" и "дегидрирование" и отражает один из способов получения А. По строению радикала А. подразделяют на предельные (бутаналь, или масляный альдегид), непредельные (пропеналь, или акролеин), ароматические (бензальдегид) и др. Общая формула предельных альдегидов:
, соединенную с радикалом, входят в группу карбонильных соединений. Название "альдегид" составлено из начальных букв слов "алкоголь" и "дегидрирование" и отражает один из способов получения А. По строению радикала А. подразделяют на предельные (бутаналь, или масляный альдегид), непредельные (пропеналь, или акролеин), ароматические (бензальдегид) и др. Общая формула предельных альдегидов:  . Названия этих А. по правилам ИЮПАК составляются из наименования соответствующего алкана с добавлением суффикса –аль, напр., метаналь, этаналь, пропаналь, бутаналь и т.д. Широко используются в химии и тривиальные названия А., образованные из названий соответствующих карбоновых кислот: муравьиный альдегид, или формальдегид; уксусный альдегид; пропионовый альдегид; масляный альдегид и т.д. Для А. характерны виды изомерии, обусловленные радикалом и межклассовая изомерия (изомерны кетонам). При обычных условиях формальдегид – газ с резким запахом, следующие 11 членов гомологического ряда предельных альдегидов – жидкости, начиная с С12Н25СНО (тридеканаль) – твердые вещества. Метаналь, этаналь и пропаналь хорошо растворимы в воде. Химические свойства А. обусловлены свойствами радикала и присутствием в составе молекулы альдегидной группы, в которой атом углерода находится в состоянии sp2-гибридизации, поэтому σ-связи группы находятся в одной плоскости, а наличие электроотрицательного атома кислорода приводит к сильной поляризации двойной связи С=О:
. Названия этих А. по правилам ИЮПАК составляются из наименования соответствующего алкана с добавлением суффикса –аль, напр., метаналь, этаналь, пропаналь, бутаналь и т.д. Широко используются в химии и тривиальные названия А., образованные из названий соответствующих карбоновых кислот: муравьиный альдегид, или формальдегид; уксусный альдегид; пропионовый альдегид; масляный альдегид и т.д. Для А. характерны виды изомерии, обусловленные радикалом и межклассовая изомерия (изомерны кетонам). При обычных условиях формальдегид – газ с резким запахом, следующие 11 членов гомологического ряда предельных альдегидов – жидкости, начиная с С12Н25СНО (тридеканаль) – твердые вещества. Метаналь, этаналь и пропаналь хорошо растворимы в воде. Химические свойства А. обусловлены свойствами радикала и присутствием в составе молекулы альдегидной группы, в которой атом углерода находится в состоянии sp2-гибридизации, поэтому σ-связи группы находятся в одной плоскости, а наличие электроотрицательного атома кислорода приводит к сильной поляризации двойной связи С=О:  .
. Наиболее характерными для А. являются реакции присоединения по карбонильной группе и реакции окисления связи С-Н альдегидной группы. Реакции нуклеофильного присоединения можно изобразить схемой:
 . Так, протекают процессы присоединения синильной кислоты с образованием циангидринов, присоединения спиртов с образованием полуацеталей и ацеталей, присоединения гидросульфитов с образованием гидросульфитных производных альдегидов и т.д. В результате восстановления (присоединение водорода в присутствии катализатора) А. образуются спирты. Напр., при восстановлении пропаналя получается пропанол-1:
. Так, протекают процессы присоединения синильной кислоты с образованием циангидринов, присоединения спиртов с образованием полуацеталей и ацеталей, присоединения гидросульфитов с образованием гидросульфитных производных альдегидов и т.д. В результате восстановления (присоединение водорода в присутствии катализатора) А. образуются спирты. Напр., при восстановлении пропаналя получается пропанол-1:СН3СН2СНО + H2
 СН3СН2СН2ОН
СН3СН2СН2ОНОкисление А. по связи С-Н альдегидной группы соответствует схеме:
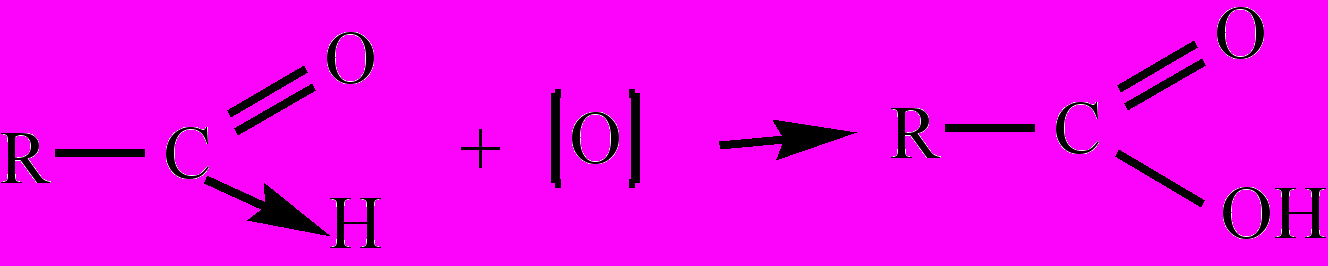 . Реакции окисления (приводят к образованию соответствующих кислот) можно легко осуществить раствором KMnO4 в кислой среде, аммиачным раствором оксида серебра (реакция "серебряного зеркала"), свежеосажденным гидроксидом меди (II). В ходе последней реакции голубой осадок Cu(OH)2 восстанавливается вначале в нерастворимый гидроксид меди (I) желтого цвета, который затем разлагается на оксид меди (I) красного цвета и воду (реакция также является качественной на А.):
. Реакции окисления (приводят к образованию соответствующих кислот) можно легко осуществить раствором KMnO4 в кислой среде, аммиачным раствором оксида серебра (реакция "серебряного зеркала"), свежеосажденным гидроксидом меди (II). В ходе последней реакции голубой осадок Cu(OH)2 восстанавливается вначале в нерастворимый гидроксид меди (I) желтого цвета, который затем разлагается на оксид меди (I) красного цвета и воду (реакция также является качественной на А.):R-CH=O + Cu(OH)2
 R-COOH + 2CuOH¯ + H2O
R-COOH + 2CuOH¯ + H2O 2CuOH ® Cu2O +H2O
Формальдегид в этих реакциях окисляется до CO2. При сгорании А. (полное окисление) образуются CO2 и H2O. Кроме того, А. вступают в реакции полимеризации и поликонденсации. Напр., при длительном хранении формалина в нем образуется параформальдегид; реакцией поликонденсации формальдегида с фенолом получают фенолформальдегидные смолы. А. реагируют с галогенами, при этом на галоген замещаются только атомы водорода при соседнем с альдегидной группой атоме углерода (сказывается влияние альдегидной группы), напр., при пропускании газообразного хлора через этаналь образуется трихлорэтаналь Cl3C-CHO.
Важнейшими способами получения А. являются: каталитическое окисление алкенов кислородом воздуха; окисление спиртов различными окислителями (О2, KMnO4, K2Cr2O7 и др.): R-СН2 ОН + [О] ® R-СНО + H2O; каталитическое дегидрирование первичных спиртов: R-СН2ОН
 R-СНО + H2. Формальдегид в промышленности получают каталитическим окислением метана при 500 оС; ацетальдегид – из ацетилена (реакция Кучерова). Применяют А. в производстве и синтезе полимеров, карбоновых кислот, спиртов и многих других материалов и соединений.
R-СНО + H2. Формальдегид в промышленности получают каталитическим окислением метана при 500 оС; ацетальдегид – из ацетилена (реакция Кучерова). Применяют А. в производстве и синтезе полимеров, карбоновых кислот, спиртов и многих других материалов и соединений.Аминокислоты (аминокарбоновые кислоты) – органические соединения, содержащие в составе молекул одновременно аминогруппы и карбоксильные группы, связанные с определенным радикалом. В зависимости от строения радикала А. можно отнести к алифатическим, ароматическим или гетероциклическим соединениям. По взаимному положению карбоксильной и аминогруппы классифицируют на α-, β-, γ-, δ-, ε-, ζ-аминокислоты (альфа-, бета-, гамма-, дельта,- э псилон-, дзета-аминокислоты) и т.д. Строчными буквами греческого алфавита обозначают положение аминогруппы в углеродной цепи, начиная с атома углерода, связанного с карбоксильной группой. Название А. составляется из названия соответствующей карбоновой кислоты с добавлением слова –амино, перед которым указывается буква греческого алфавита:


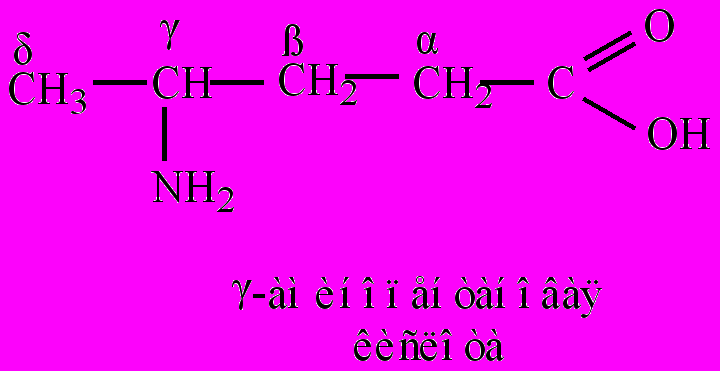
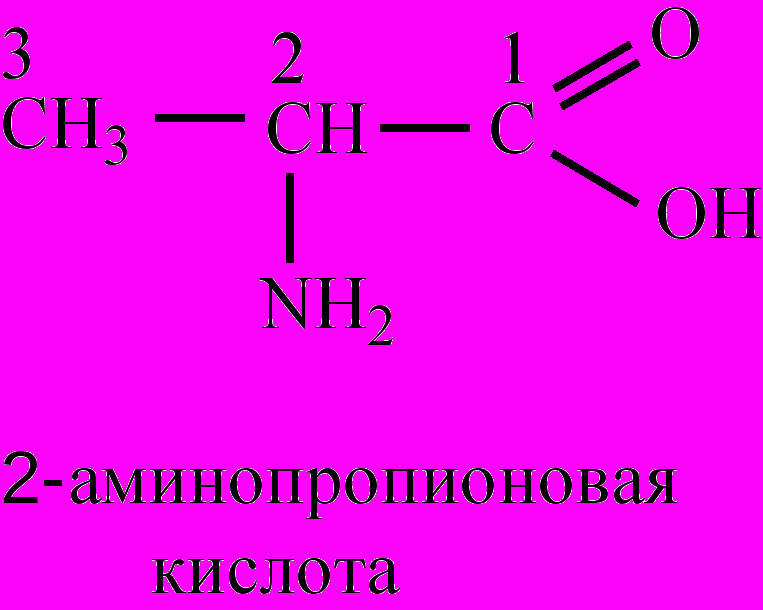
По систематической номенклатуре положение аминогруппы обозначают числами, нумеруя атомы углерода в углеродной цепи, начиная с атома карбоксильной группы:
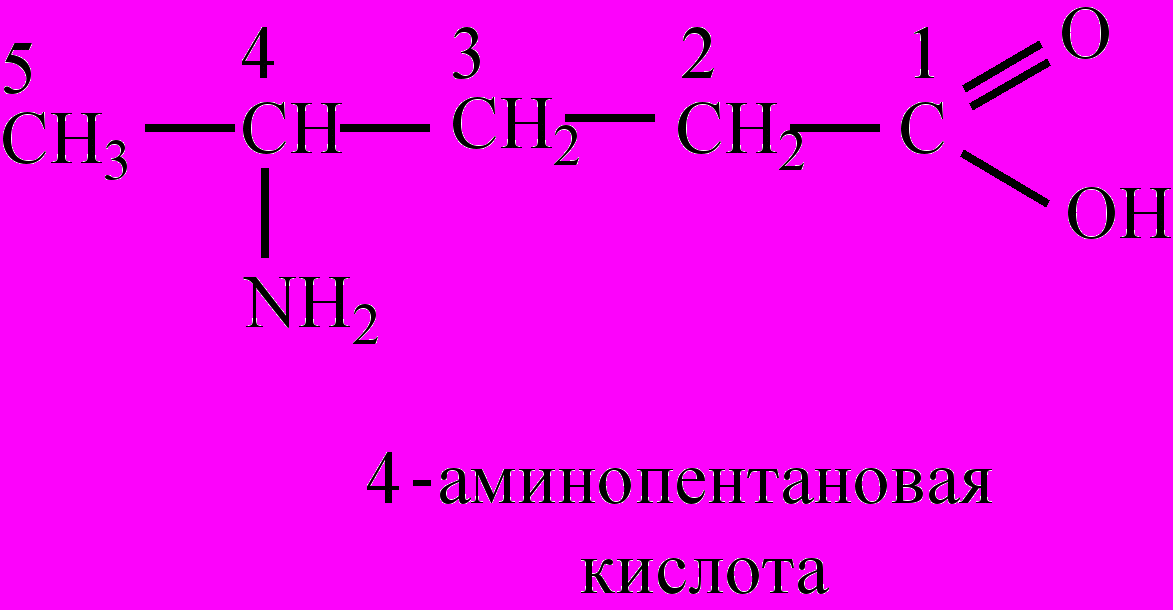
По числу функциональных групп А. подразделяют на моноаминомонокарбоновые кислоты:
 , напр., аминоуксусная кислота; моноаминодикарбоновые кислоты:
, напр., аминоуксусная кислота; моноаминодикарбоновые кислоты: 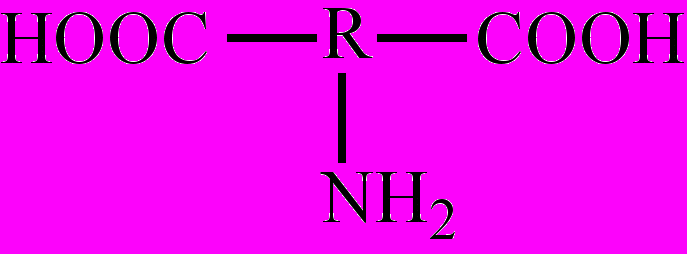 , напр., α-аминоянтарная кислота; диаминомонокарбоновые кислоты:
, напр., α-аминоянтарная кислота; диаминомонокарбоновые кислоты: 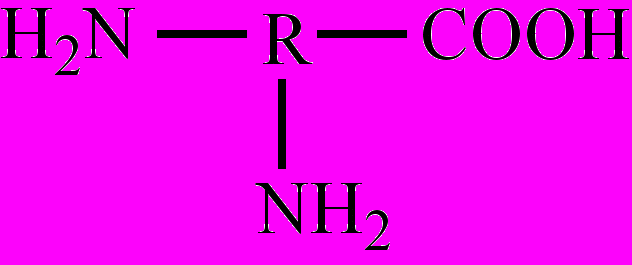 , напр., 2,6-диами-ногексановая кислота. Многие А. имеют и тривиальные названия. Для А. характерны различные виды изомерии, в том числе: изомерия углеродного скелета (радикала), изомерия положения функциональных групп, межклассовая изомерия с нитропроизводными алканов, оптическая изомерия и др. Большинство А. – бесцветные кристаллические вещества, плавятся при 230-300 оС с разложением. Многие имеют сладкий вкус. А. – хорошо растворимы в воде диссоциируют в водном растворе при определенном значении рН с образованием биполярного иона. Как кислоты А. реагируют со щелочами, спиртами и т. д., а как основания (амины) А. реагируют с кислотами, образуя соли. Таким образом, А. – это органические амфолиты. Важнейшее свойство А. – взаимодействие их между собой с образованием пептидов. Наибольшее значение имеют α-аминокислоты, входящие в состав белков всех живых организмов. Получают α-аминокислоты гидролизом белков (получаются соответствующие α-аминокислоты); в результате реакций замещения между α-галогензамещенными карбоновых кислот и аммиаком; взаимодействием альдегидов и аммиака в присутствии синильной кислоты.
, напр., 2,6-диами-ногексановая кислота. Многие А. имеют и тривиальные названия. Для А. характерны различные виды изомерии, в том числе: изомерия углеродного скелета (радикала), изомерия положения функциональных групп, межклассовая изомерия с нитропроизводными алканов, оптическая изомерия и др. Большинство А. – бесцветные кристаллические вещества, плавятся при 230-300 оС с разложением. Многие имеют сладкий вкус. А. – хорошо растворимы в воде диссоциируют в водном растворе при определенном значении рН с образованием биполярного иона. Как кислоты А. реагируют со щелочами, спиртами и т. д., а как основания (амины) А. реагируют с кислотами, образуя соли. Таким образом, А. – это органические амфолиты. Важнейшее свойство А. – взаимодействие их между собой с образованием пептидов. Наибольшее значение имеют α-аминокислоты, входящие в состав белков всех живых организмов. Получают α-аминокислоты гидролизом белков (получаются соответствующие α-аминокислоты); в результате реакций замещения между α-галогензамещенными карбоновых кислот и аммиаком; взаимодействием альдегидов и аммиака в присутствии синильной кислоты.α-Аминокислоты – представители аминокислот, в молекулах которых аминогруппа соединена с α-углеродным атомом:
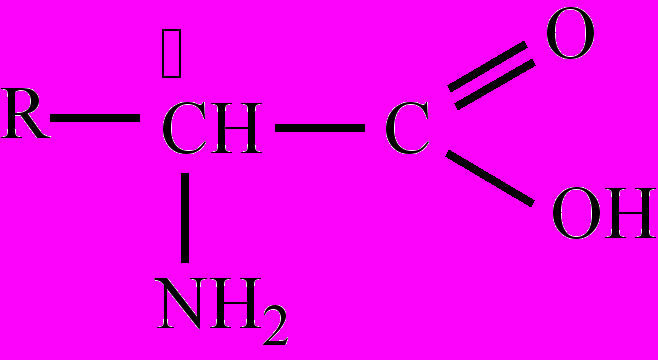 . В качестве радикала (R) могут быть: атом водорода (глицин), метил (α-аланин) и более сложные структуры (см. аргинин, аспарагиновая кислота, фенилаланин и др.). Выделение α-А. в особую группу из общего числа аминокислот связано с тем, что около 20 из них (по некоторым данным до 25) входят в состав белков, ферментов и других физиологически активных соединений, а также встречаются в свободном виде в клетках и тканях всех организмов. Для этих α-А. (их называют еще протеиногенными) применяют, как правило, тривиальные названия. Физические и химические свойства аналогичны общим свойствам аминокислот. Важнейшее свойство протеиногенных α-А. – способность соединятся между собой посредством пептидной связи с образованием пептидов (дипетидов, трипептидов, полипептидов), к которым и относятся соединения, играющие столь важную роль в живой природе. Протеиногенные аминокислоты делятся на заменимые, которые могут синтезироваться в организме человека и животных (α-аланин, аспарагиновая кислота, аспарагин, гистидин, глицин, глутаминовая кислота, глутамин, пролин, серин, тирозин) и незаменимые, которые не могут синтезироваться в организме животных и человека, а должны поступать в организм в составе белков пищи (аргинин, валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин, цистеин). Важнейшими способами получения являются гидролиз белков (БЕЛОК + nH2O
. В качестве радикала (R) могут быть: атом водорода (глицин), метил (α-аланин) и более сложные структуры (см. аргинин, аспарагиновая кислота, фенилаланин и др.). Выделение α-А. в особую группу из общего числа аминокислот связано с тем, что около 20 из них (по некоторым данным до 25) входят в состав белков, ферментов и других физиологически активных соединений, а также встречаются в свободном виде в клетках и тканях всех организмов. Для этих α-А. (их называют еще протеиногенными) применяют, как правило, тривиальные названия. Физические и химические свойства аналогичны общим свойствам аминокислот. Важнейшее свойство протеиногенных α-А. – способность соединятся между собой посредством пептидной связи с образованием пептидов (дипетидов, трипептидов, полипептидов), к которым и относятся соединения, играющие столь важную роль в живой природе. Протеиногенные аминокислоты делятся на заменимые, которые могут синтезироваться в организме человека и животных (α-аланин, аспарагиновая кислота, аспарагин, гистидин, глицин, глутаминовая кислота, глутамин, пролин, серин, тирозин) и незаменимые, которые не могут синтезироваться в организме животных и человека, а должны поступать в организм в составе белков пищи (аргинин, валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин, цистеин). Важнейшими способами получения являются гидролиз белков (БЕЛОК + nH2O 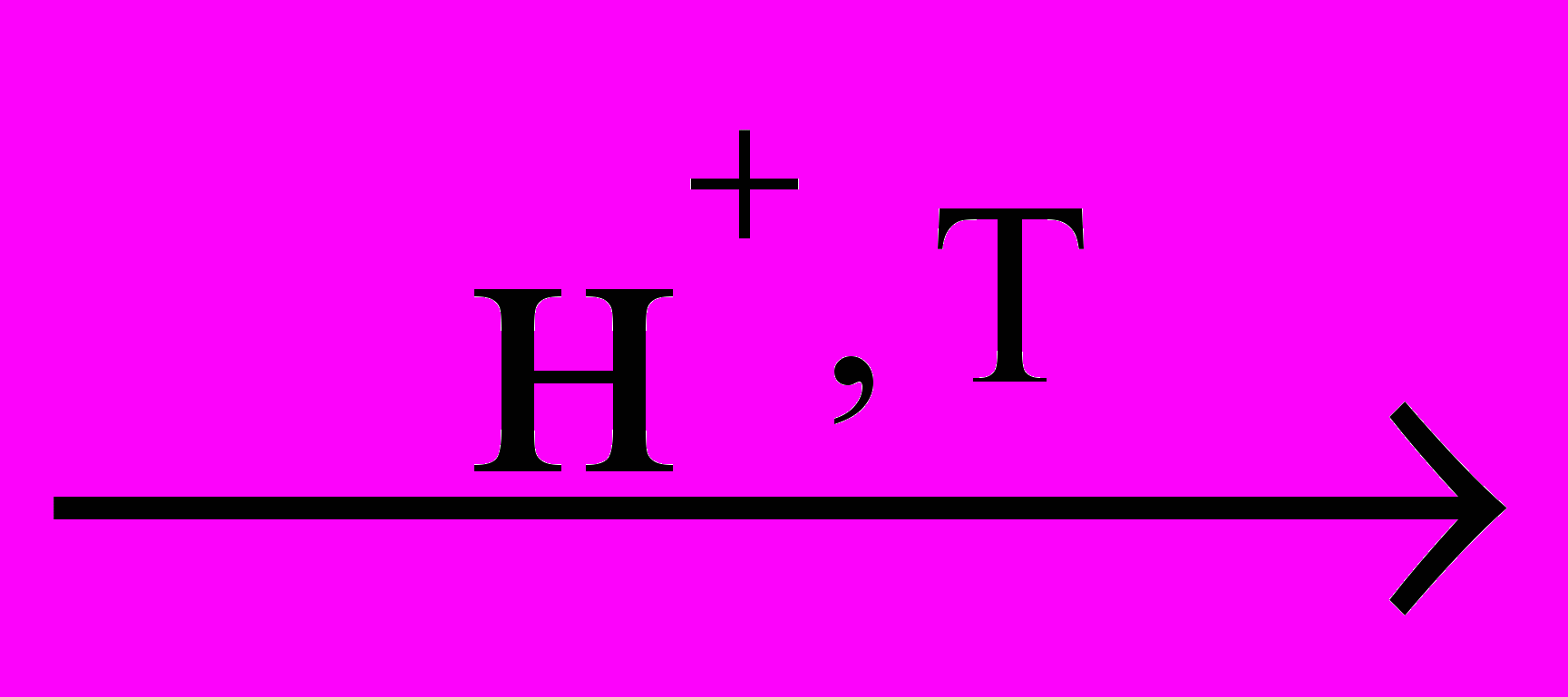 СМЕСЬ АМИНОКИСЛОТ), а также аммонолиз α-галогенкарбоновых кислот:
СМЕСЬ АМИНОКИСЛОТ), а также аммонолиз α-галогенкарбоновых кислот: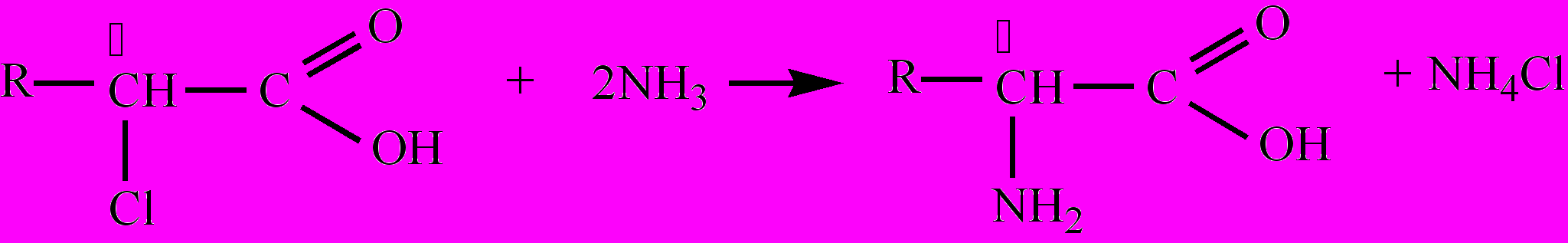
В промышленности для синтеза α-А. применяются методы микробиотехнологии. Используют в качестве пищевых и кормовых добавок, для синтеза пептидов и других соединений, в качестве лекарственных средств и т.д.
Амины – азотсодержащие органические вещества, которые можно рассматривать как производные аммиака, в молекуле которого один, два или все три атома водорода замещены на органические радикалы (R). По количеству замещенных атомов водорода А. делятся на первичные (RNH2), вторичные (R2NH) и третичные (R3N). В зависимости от строения радикала различают алифатические, напр., этиламин СН3-СН2-NH2; алициклические, напр.,циклогексиламин
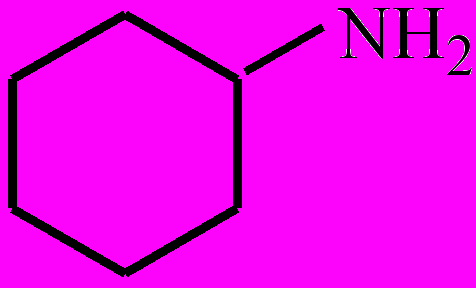 ; ароматические, напр., анилин
; ароматические, напр., анилин 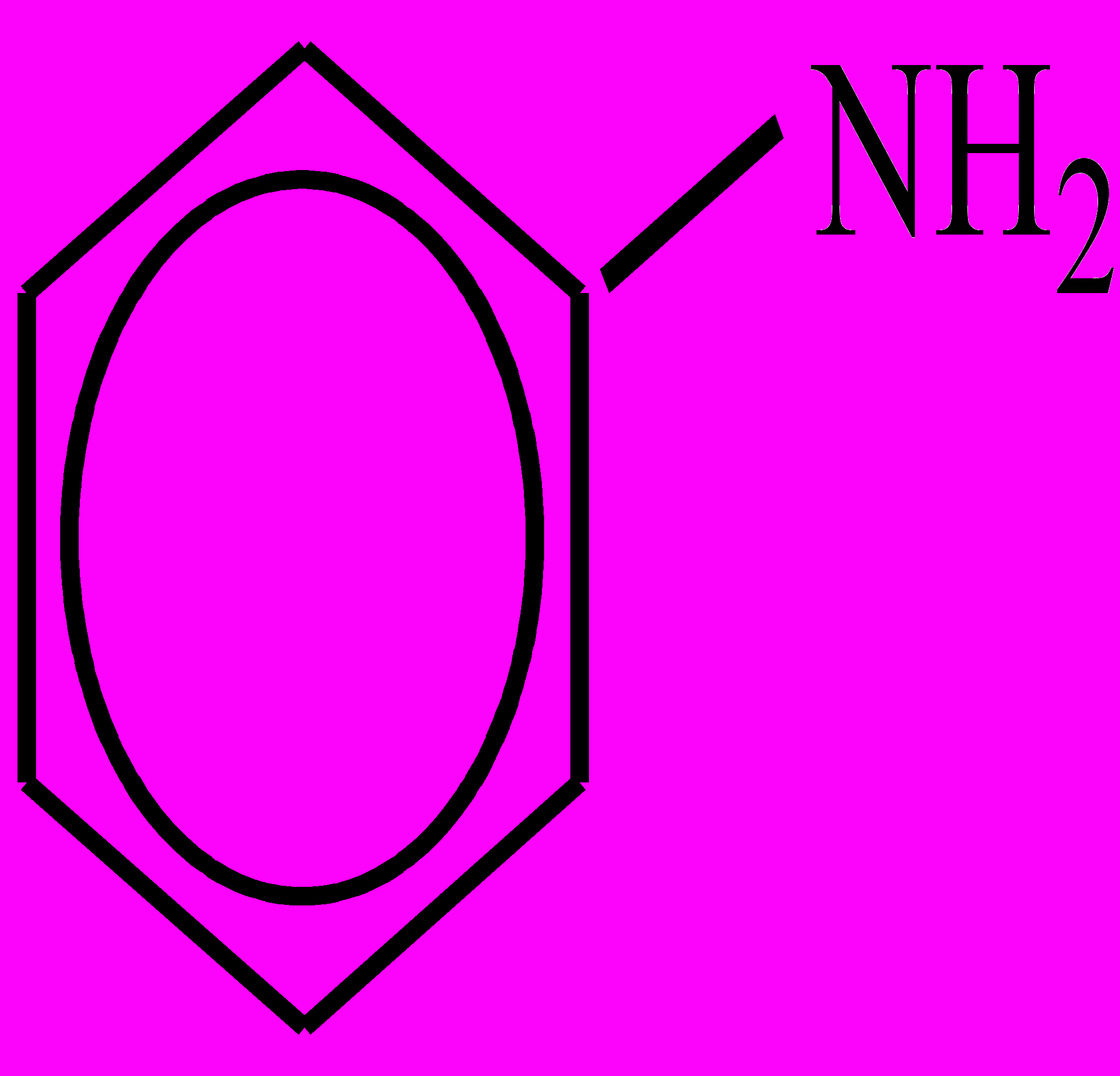 и т.д. Названия А. образуются от соответствующих названий радикалов с прибавлением окончания –амин; если радикалов несколько, то их перечисляют по алфавиту, если радикалы одинаковы, то используют приставки ди–, три-; применяются также тривиальные названия. Для А. характерны изомерия радикала, изомерия положения аминогруппы, изомерия первичных, вторичных и третичных А. с равным числом атомов углерода в молекуле; межклассовая изомерия ароматических А. (изомерны с гомологами пиридина). Низшие предельные А. – газообразные вещества с резким неприятным запахом (метиламин пахнет как аммиак), средние члены гомологического ряда – жидкости, высшие А. – твердые соединения. Простейшие А. хорошо растворимы в воде, с усложнением радикала растворимость падает. В связи с тем, что атом азота в аминогруппе имеет неподеленную пару электронов, А., как и аммиак, проявляют оснóвные свойства. Алифатические А. – более сильные основания, чем аммиак. Растворы А. в воде имеют щелочную реакцию среды:
и т.д. Названия А. образуются от соответствующих названий радикалов с прибавлением окончания –амин; если радикалов несколько, то их перечисляют по алфавиту, если радикалы одинаковы, то используют приставки ди–, три-; применяются также тривиальные названия. Для А. характерны изомерия радикала, изомерия положения аминогруппы, изомерия первичных, вторичных и третичных А. с равным числом атомов углерода в молекуле; межклассовая изомерия ароматических А. (изомерны с гомологами пиридина). Низшие предельные А. – газообразные вещества с резким неприятным запахом (метиламин пахнет как аммиак), средние члены гомологического ряда – жидкости, высшие А. – твердые соединения. Простейшие А. хорошо растворимы в воде, с усложнением радикала растворимость падает. В связи с тем, что атом азота в аминогруппе имеет неподеленную пару электронов, А., как и аммиак, проявляют оснóвные свойства. Алифатические А. – более сильные основания, чем аммиак. Растворы А. в воде имеют щелочную реакцию среды:СН3-NH2 + H2O
 [СН3-NH3]ОН
[СН3-NH3]ОН  [СН3-NH3]+ + ОН-
[СН3-NH3]+ + ОН-Метиламин Гидроксид метиламмония
При взаимодействии А. с кислотами образуются соли:
СН3-СН2-NH2 + H2SO4 ® [СН3-СН2-NH3]+HSO4-
Этиламин Гидросульфат этиламмония
2СН3-СН2-NH2 + H2SO4 ® [СН3-СН2-NH3]2+SO42-
Этиламин Сульфат этиламмония
При действии на соли А. растворами щелочей, вновь выделяются соответствующие амины:
[СН3-СН2-NH3]Cl + KOH ® СН3-СН2-NH2 + KCl + H2O
Хлорид этиламмония Этиламин
При горении А. образуются CO2, H2O и N2.
Получают А. восстановлением нитросоединений (см. Зинина реакция). Алифатические А. получают взаимодействием галогеналканов с аммиаком (реакция Гофмана); аммонолизом спиртов. В природе низшие алифатические А. являются продуктами жизнедеятельности некоторых микроорганизмов и растений; образуются при гниении белков. Используют А. для производства красителей, лекарственных веществ, исходных соединений для получения синтетических волокон.
Арены (бензоидные углеводороды, углеводороды бензольного ряда) – углеводороды гомологического ряда бензола, характеризующиеся наличием бензольного кольца (ядра), в котором атомы углерода находятся в состоянии sp2-гибридизации. Общая формула бензола и его гомологов СnН2n-6 (n≥6). Названия А. оканчиваются словом –бензол, перед которым записывают названия радикалов-заместителей. Если их несколько, то числами указывают их относительное расположение в бензольном ядре:
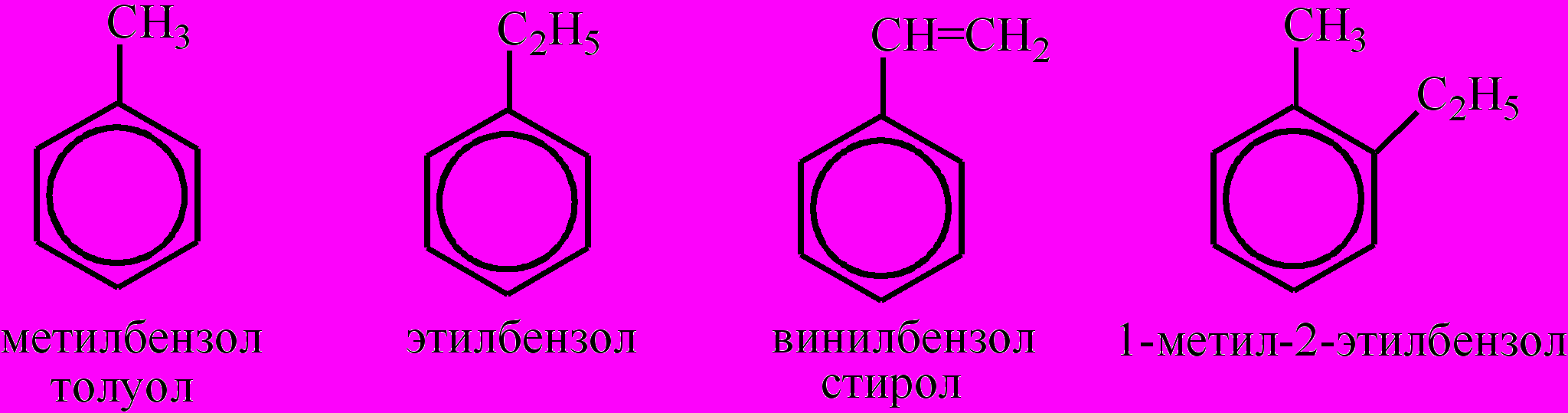
Для двух заместителей возможно три варианта их взаимного расположения: орто- (обозначается буквой о-), мета- (обозначается буквой м-), пара- (обозначается буквой п-):

Часто используются и тривиальные названия. Для А. характерны изомерия, связанная со строением радикала-заместителя; изомерия, обусловленная наличием разного числа заместителей различного строения; изомерия, вызванная положением двух заместителей относительно друг друга в ядре (орто-, мета-, пара-изомеры). Низшие А. – бесцветные жидкости с характерным запахом, легче воды и в ней не растворимы. Являются хорошими растворителями многих органических веществ. В молекулах гомологов бензола ярко выражено взаимное влияние бензольного ядра и радикала, находящегося в его боковой цепи, нарушается равномерность распределения электронной плотности в ядре (проявление мезомерного эффекта (М)). В зависимости от оказываемого мезомерного эффекта заместители делятся на две группы. Электронодонорные заместители (заместители 1-го рода) вызывают +М-эффект, повышая электронную плотность в сопряженной системе π-связей бензольного ядра, сосредотачивая ее при этом в орто- и пара-положениях:
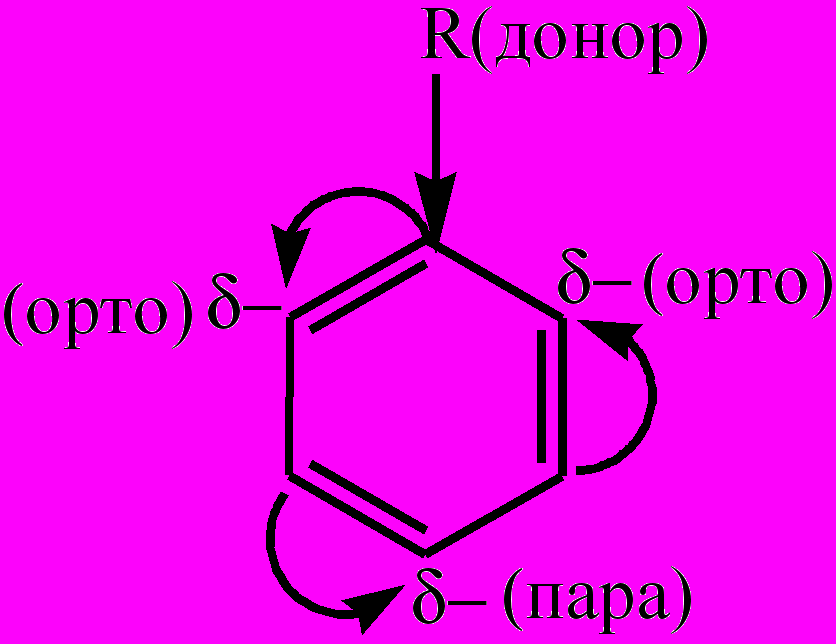 . К электронодонорным заместителям относятся алкилы, гидроксильная группа, аминогруппа, галогены, которые направляют новые заместители в реакциях замещения атомов водорода в бензольном ядре преимущественно в орто- и пара-положения. Все заместители 1-го рода (кроме галогенов) повышают реакционную активность бензольного ядра и облегчают следующие реакции замещения. Электроноакцепторные заместители (заместители 2-го рода) вызывают -М-эффект, снижая в целом и электронную плотность в сопряженной системе π-связей бензольного ядра, и его реакционную способность в реакциях замещения. Однако в меньшей степени электронная плотность снижается в мета-положениях:
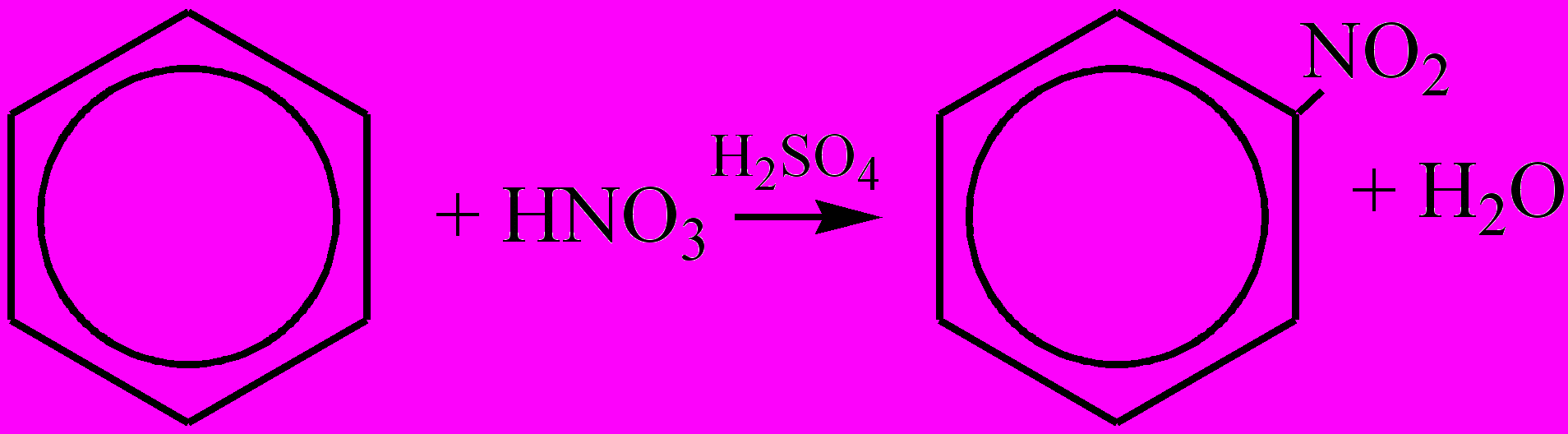
. К электронодонорным заместителям относятся алкилы, гидроксильная группа, аминогруппа, галогены, которые направляют новые заместители в реакциях замещения атомов водорода в бензольном ядре преимущественно в орто- и пара-положения. Все заместители 1-го рода (кроме галогенов) повышают реакционную активность бензольного ядра и облегчают следующие реакции замещения. Электроноакцепторные заместители (заместители 2-го рода) вызывают -М-эффект, снижая в целом и электронную плотность в сопряженной системе π-связей бензольного ядра, и его реакционную способность в реакциях замещения. Однако в меньшей степени электронная плотность снижается в мета-положениях: 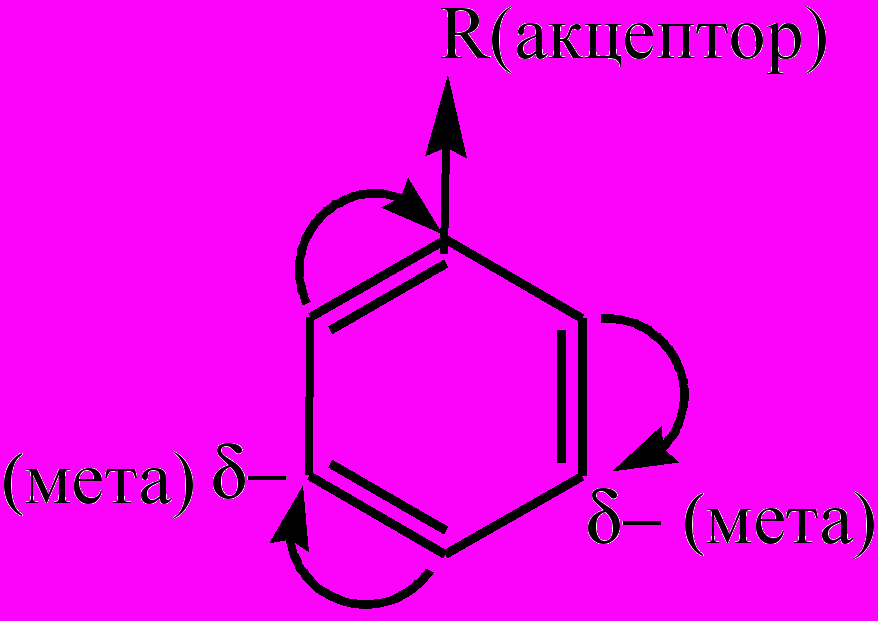 . К электроноакцеторным заместителям относятся альдегидная группа, карбоксильная группа, нитрогруппа, сульфогруппа (-SO3H, или -SO2ОH), которые направляют новые заместители в реакциях замещения атомов водорода в бензольном ядре преимущественно в мета-положения. Несмотря на значительную ненасыщенность атомов углерода в бензольном кольце А. не вступают в реакции присоединения, характерные для ненасыщенных соединений. Для гомологов бензола характерны реакции электрофильного замещения атомов водорода бензольного кольца, в том числе каталитическое галогенирование (при недостатке галогена получается смесь орто- и пара-изомеров, при избытке – трехзамещенные производные); нитрование (напр., при нитровании толуола действием смеси концентрированных HNO3 и H2SO4 образуется тротил); гидрирование А. в присутсвии катализаторов приводит к образованию циклоалканов. Из реакций А. с участием боковой цепи следует отметить галогенирование и окисление. Алкильные радикалы производных бензола взаимодействуют с галогенами подобно алканам. Реакции протекают на свету, при этом замещаются (последовательно) те атомы водорода, которые связаны с атомами углерода бензольного кольца. Реакции окисления в боковой цепи протекают легче, чем окисление алканов, и приводят к образованию кислот. Так, при окислении толуола образуется бензойная кислота. Простейшие представители А. – бензол, метилбензол (толуол), диметилбензол (ксилол) и др. Получают А. в основном при коксовании каменного угля и ароматизацией нефтепродуктов. А. находят применение в производстве красителей, лекарств, моющих средств, полимеров, взрывчатых веществ и др.
. К электроноакцеторным заместителям относятся альдегидная группа, карбоксильная группа, нитрогруппа, сульфогруппа (-SO3H, или -SO2ОH), которые направляют новые заместители в реакциях замещения атомов водорода в бензольном ядре преимущественно в мета-положения. Несмотря на значительную ненасыщенность атомов углерода в бензольном кольце А. не вступают в реакции присоединения, характерные для ненасыщенных соединений. Для гомологов бензола характерны реакции электрофильного замещения атомов водорода бензольного кольца, в том числе каталитическое галогенирование (при недостатке галогена получается смесь орто- и пара-изомеров, при избытке – трехзамещенные производные); нитрование (напр., при нитровании толуола действием смеси концентрированных HNO3 и H2SO4 образуется тротил); гидрирование А. в присутсвии катализаторов приводит к образованию циклоалканов. Из реакций А. с участием боковой цепи следует отметить галогенирование и окисление. Алкильные радикалы производных бензола взаимодействуют с галогенами подобно алканам. Реакции протекают на свету, при этом замещаются (последовательно) те атомы водорода, которые связаны с атомами углерода бензольного кольца. Реакции окисления в боковой цепи протекают легче, чем окисление алканов, и приводят к образованию кислот. Так, при окислении толуола образуется бензойная кислота. Простейшие представители А. – бензол, метилбензол (толуол), диметилбензол (ксилол) и др. Получают А. в основном при коксовании каменного угля и ароматизацией нефтепродуктов. А. находят применение в производстве красителей, лекарств, моющих средств, полимеров, взрывчатых веществ и др.Ароматические углеводороды – органические вещества, в структуру молекул которых входят одно или несколько циклических бензольных ядер, в которых валентные электроны, участвующие в образовании углерод-углеродных связей, образуют единую симметричную циклическую устойчивую сопряженную электронную оболочку, как в молекуле бензола. К А. у. относятся арены и их производные (ароматические спирты, ароматические кислоты, ароматические амины и т.д., полиядерные, или конденсированные углеводороды, содержащие несколько бензольных колец, в том числе, нафталин, антрацен
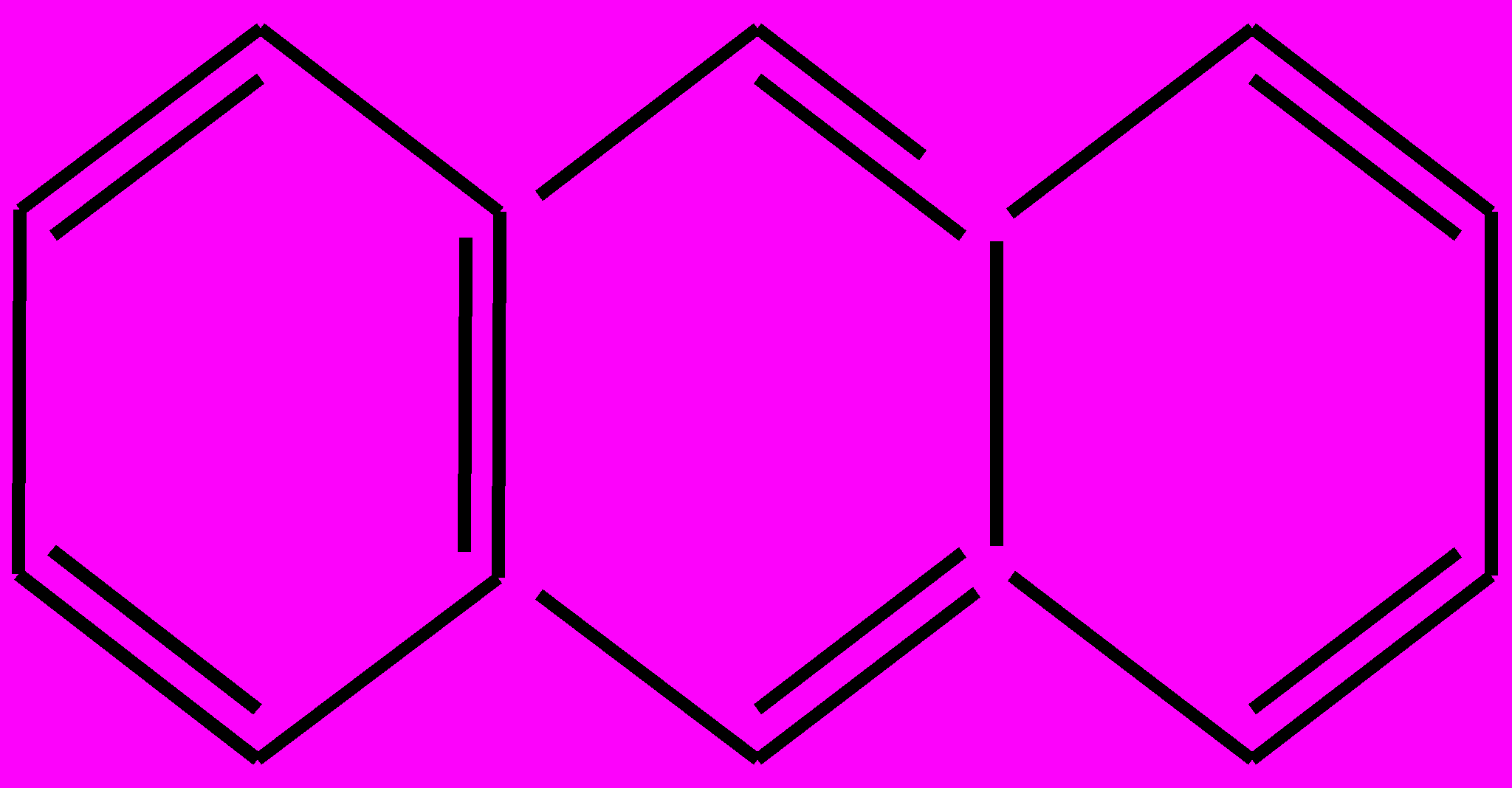 , и др.), а также ряд циклических углеводородов небензоидного строения, обладающих свойствами ароматических соединений, напр., инден
, и др.), а также ряд циклических углеводородов небензоидного строения, обладающих свойствами ароматических соединений, напр., инден  , азулен и др.
, азулен и др.Ацилирование – реакции замещения атома водорода или другого элемента органического соединения на ацильную группу (кислотный радикал карбоновой кислоты –
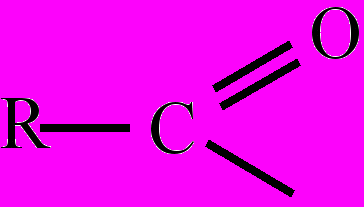 ). Ацилирующими агентами, те есть веществами, способными вводить ацильную группу в молекулу соединения, могут служить карбоновые кислоты, ангидриды карбоновых кислот и др. В зависимости от природы кислоты ацильные группы называют: формил, ацетил, пропионил, бутирил, бензоил и т.д. Реакции А. называют соответственно, формилированием, ацетилированием, пропионилированием и т.д. Реакциями А. получают, напр., амиды карбоновых кислот, сложные эфиры и др. соединения.
). Ацилирующими агентами, те есть веществами, способными вводить ацильную группу в молекулу соединения, могут служить карбоновые кислоты, ангидриды карбоновых кислот и др. В зависимости от природы кислоты ацильные группы называют: формил, ацетил, пропионил, бутирил, бензоил и т.д. Реакции А. называют соответственно, формилированием, ацетилированием, пропионилированием и т.д. Реакциями А. получают, напр., амиды карбоновых кислот, сложные эфиры и др. соединения.Ацилирование – реакции замещения атома водорода или другого элемента органического соединения на ацильную группу (кислотный радикал карбоновой кислоты –
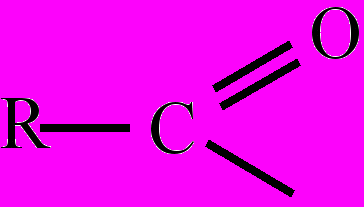 ). Ацилирующими агентами, те есть веществами, способными вводить ацильную группу в молекулу соединения, могут служить карбоновые кислоты, ангидриды карбоновых кислот и др. В зависимости от природы кислоты ацильные группы называют: формил, ацетил, пропионил, бутирил, бензоил и т.д. Реакции А. называют соответственно, формилированием, ацетилированием, пропионилированием и т.д. Реакциями А. получают, напр., амиды карбоновых кислот, сложные эфиры и др. соединения.
). Ацилирующими агентами, те есть веществами, способными вводить ацильную группу в молекулу соединения, могут служить карбоновые кислоты, ангидриды карбоновых кислот и др. В зависимости от природы кислоты ацильные группы называют: формил, ацетил, пропионил, бутирил, бензоил и т.д. Реакции А. называют соответственно, формилированием, ацетилированием, пропионилированием и т.д. Реакциями А. получают, напр., амиды карбоновых кислот, сложные эфиры и др. соединения.Взаимное влияние атомов – одно из основных положений теории химического строения, определяющее, наряду с другими положениями, свойства вещества. Примером В. в. а. могут служить химические свойства ароматического соединения – фенола сравнительно со свойствами бензола и спиртов. Так, фенол, в отличие от предельных одноатомных спиртов, реагирует с растворами щелочей, образуя феноляты. В отличие от бензола, фенол при обычных условиях реагирует с бромом в водном растворе, образуя трибромфенол. Очевидно, бензольное ядро увеличивает подвижность атома водорода в гидроксигруппе фенола; с другой стороны, гидроксигруппа обусловливает более легкое замещение в бензольном ядре трех атомов водорода. В. в. а. в сложных веществах, в состав которых входят элементы с различной электроотрицательностью, объясняется возникновением в молекулах этих веществ смещение электронной плотности простых и кратных химических связей – так называемых электронных эффектов (см. Индуктивный эффект; Мезомерный эффект). В рассматриваемом примере ОН-группа, являясь электронодонором, за счет сильно электроотрицательного атома кислорода с его неподеленными электронными парами вызывает смещение электронной плотности в системе π-связей бензольного кольца (+М-эффект) и смещение связи О-Н. Следствием этого является повышение электронной плотности на атомах углерода бензольного кольца в орто- и пара-положениях в результате чего облегчается замещение атомов водорода именно в этих положениях (см. Арены). Кроме того, увеличивается полярность связи О-Н, что в свою очередь усиливает кислотные свойства фенола по сравнению с первичными спиртами.
Г
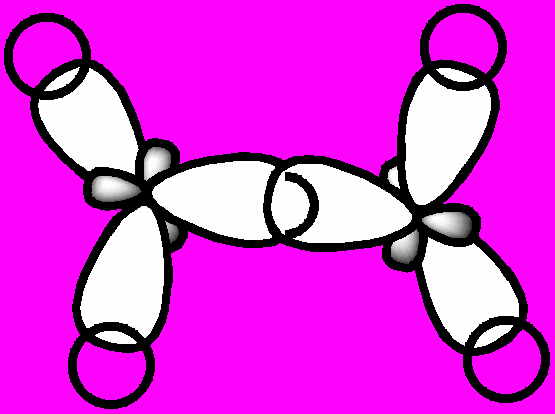
Перекрывание sp2-орбиталей в молекуле этилена с образованием σ-связей
 Перекрывание 2р-орбиталей в молекуле этилена с образованием
Перекрывание 2р-орбиталей в молекуле этилена с образованием π-связи
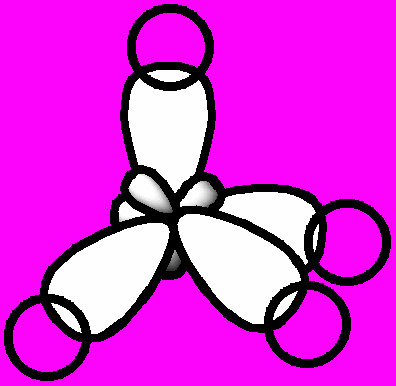 Перекрывание электронных облаков в молекуле метана
Перекрывание электронных облаков в молекуле метанаибридизация атомных орбиталей – преобразование нескольких различных орбиталей атома, в результате которого образуется столько же новых одинаковых по форме и равных по энергии гибридных орбиталей, способных к образованию ковалентных химических связей с другими атомами. Происходит Г. а. о. в процессе взаимодействия между атомами, которое приводит к образованию молекулы. Напр., при образовании атомом углерода четырех простых химических связей, орбитали его внешнего уровня принимают одинаковую форму несимметричных объемных восьмерок с углами между их осями равными 109°28΄ (форма тетраэдра). Ввиду того, что в процессе участвуют одна s- и три p-орбитали, это преобразование называется sp3-гибридизацией. При перекрывании гибридных sp3-орбиталей атома углерода s-орбиталями четырех атомов водорода (напр., в молекуле метана) образуется 4 σ-связи, угол между которыми также равен 109°28΄.
Молекула метана также имеет форму тетраэдра, в центре которого находится ядро атома углерода. При образовании атомом углерода двойных связей (напр., в молекуле этилена) происходит sp2-гибридизация, то есть только три орбитали (одна s- и две p-орбитали) из четырех преобразуются в три одинаковые sp2-гибридные орбитали, оси которых расположены в одной плоскости под углом 120о.
Эти гибридные орбитали перекрываются с орбиталями других атомов (напр., водорода) и образуют три равнозначные ковалентные σ-связи. Оставшиеся по одной у каждого атома углерода p-орбитали сохраняют форму симметричной объемной восьмерки с равномерным распределением облака по обе стороны ядра перпендикулярно плоскости σ-связей и перекрываются с образованием π-связи. Образование тройных связей между атомами углерода в молекуле ацетилена и его гомологов является случаем sp-гибридизации. При этом только две орбитали (одна s- и одна p-орбиталь) из четырех внешних преобразуются в две одинаковые sp-гибридные орбитали, оси которых расположены под углом 180о, то есть на прямой.
 Перекрывание 2р-орбиталей в молекуле ацетилена с образованием двух π-связей
Перекрывание 2р-орбиталей в молекуле ацетилена с образованием двух π-связей
Перекрывание sp-орбиталей в молекуле ацетилена с образованием σ-связей
Эти гибридные орбитали перекрываются с орбиталями других атомов (напр., водорода) и образуют две равнозначные ковалентные σ-связи. Оставшиеся по две у каждого атома углерода p-орбитали не гибридизуются, сохраняют форму симметричных объемных восьмерок с равномерным распределением электронных облаков и перекрываются с образованием двух перпендикулярно расположенных π-связей.
Ж
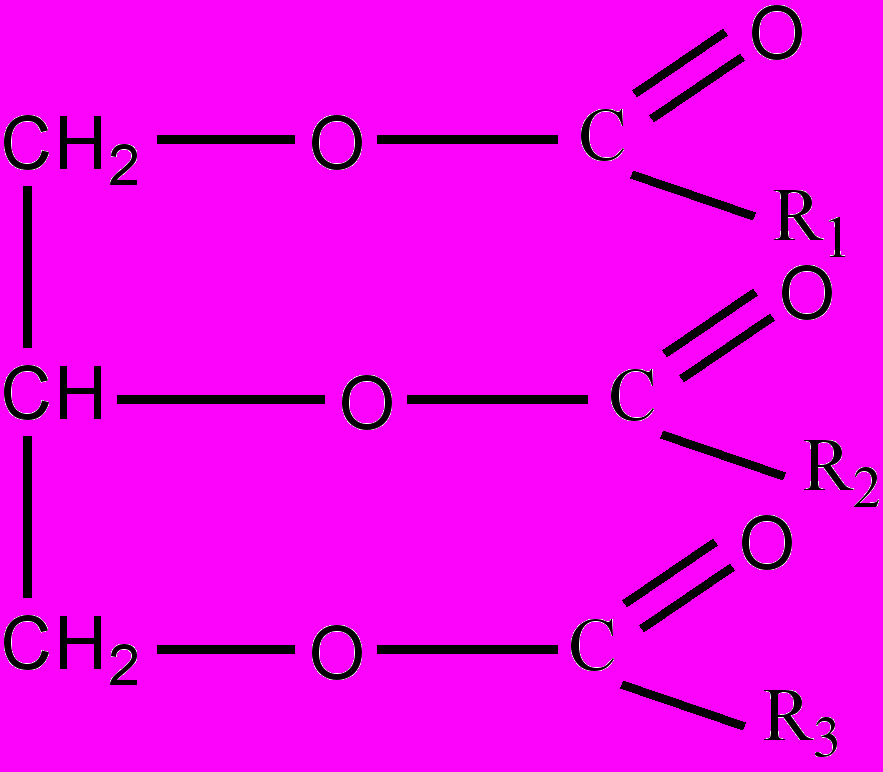
иры (триглицериды) – класс органических соединений, представляющих собой сложные эфиры глицерина и жирных одноосновных карбоновых кислот. В общей формуле триглицеридов R1, R2 и R3 – углеводородные радикалы предельных или непредельных алифатических кислот. Чаще всего в составе Ж. встречаются остатки следующих предельных кислот (пальмитиновой кислоты С15Н31СООН, стеариновой кислоты С17Н35СООН) и непредельных кислот (олеиновой кислоты С17Н33СООН, линолевой кислоты С17Н31СООН, линоленовой кислоты С17Н29СООН). Ж., в составе которых находятся остатки насыщенных (предельных) карбоновых кислот, являются при обычной температуре твердыми (преимущественно Ж. животного происхождения). Ж., в составе которых находятся остатки ненасыщенных (непредельных) карбоновых кислот, являются при обычной температуре жидкими (преимущественно Ж. растительного происхождения). Чаще всего в состав природных жиров входят триглицериды с остатками различных карбоновых кислот. В составе сливочного масла входят триглицериды, содержащие, кроме вышеуказанных кислот, остатки масляной кислоты. Различные природные жиры имеют плотность 900-970 кг/м3, не растворимы в воде, но хорошо растворяются в органических растворителях (бензин, хлороформ, бензол). При длительном хранении на воздухе Ж. прогоркают вследствие окисления входящих в них непредельных карбоновых кислот. При нагревании Ж. с растворами щелочей, происходит их омыление (см. Этерификации реакции) с образованием глицерина и солей карбоновых кислот (мылá). При сильном нагревании Ж. разлагаются с образованием слезоточивых неприятно пахнущих токсических веществ. При длительном использовании одной и той же порции жира для жаренья, в нем накапливаются канцерогенные вещества. В живой природе Ж. играют наряду с белками и углеводами важнейшую роль в обмене веществ. Гидрогенизацией растительных масел (высокое давление; никелевый катализатор) получают твердые жиры, идущие на изготовление маргарина и саломаса.
Замещения реакции – а) (в неорганической химии) химические реакции между сложным и простым веществами, в результате которых атомы простого вещества замещают атомы одного из элементов сложного соединения с образованием двух новых веществ – сложного и простого:
CuSO4 + Fe = Cu¯+ FeSO4
2KI + Cl2 = 2KCl + I2¯
б) (в органической химии) химические реакции между двумя веществами, в результате которых в исходном органическом соединении происходит замещение одних атомов другими. При этом чаще всего образуются два или несколько сложных веществ:
СН4 + Cl2 ® СН3Cl + HCl
Реакции замещения в органической химии в зависимости от механизма подразделяются на реакции нуклеофильного, электрофильного и радикального замещения. При нуклеофильном замещении нуклеофильный реагент (Хs - со свободной парой электронов) может замещать соответствующие атомы или функциональные группы у атомов углерода (R-Y). Замещение у первичного атома углерода, напр., изображается схемой:
Хs + R-Y ® [Х: R :Y ]s ® Х-R + Ys
