Етодические особенности изучения органической химии место органической химии в школьном курсе химии
| Вид материала | Документы |
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Конспект урока химии в 10 классе Тема урока, 54.04kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Программа дисциплины дпп. Ф. 10 Органический синтез цели и задачи дисциплины, 143.71kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 318.85kb.
- Утверждаю, 425.07kb.
1 2
В результате образуется нестабильное промежуточное соединение ([Х: R :Y ]s).
Реакции электрофильного замещения более характерны для ароматических углеводородов (нитрование, галогенирование, сульфирование и т.д.). При этом электрофильный реагент (часто образуется в присутствии катализатора: FeBr3(кат.) + Br2 ® Brr + [FeBr4]s) образует промежуточные комплексы по схеме:
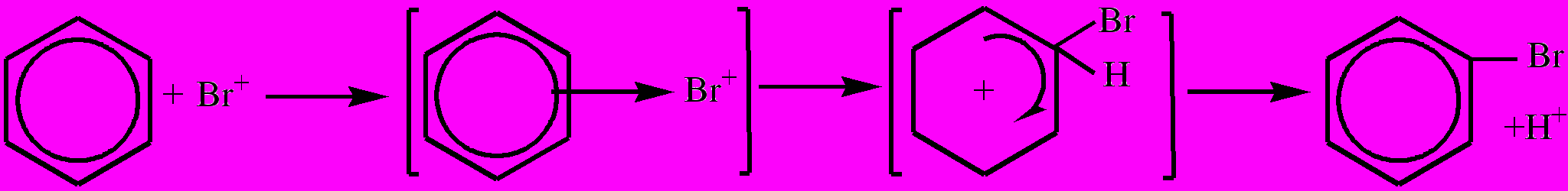 Бензол π-Комплекс σ-Комплекс Бромбензол
Бензол π-Комплекс σ-Комплекс БромбензолРеакции радикального замещения протекают в газовой фазе и относятся к цепным реакциям.
Изомерия – явление существования веществ одинакового состава, но с различным строением молекул (изомеров), и обладающих, поэтому различными физическими и химическими свойствами. И. наиболее характерна для органических веществ. Факт существования двух веществ состава AgСNО (цианат серебра и фульминат серебра) открыт в 1823 г. Ю Либихом. Термин И. ввел в науку Й.Я. Берцелиус Явление И. объяснено на основе теории химического строения веществ А.М. Бутлерова и стереохимического учения Я.Г Вант-Гоффа. Различают структурную И. и пространственную (стереоизомерию) И., которые в свою очередь подразделяются на несколько видов.
Структурная И. обусловливается: а) различием строения углеродного скелета молекулы (изомерия углеродной цепи), напр., н-пентан и диметилпропан;
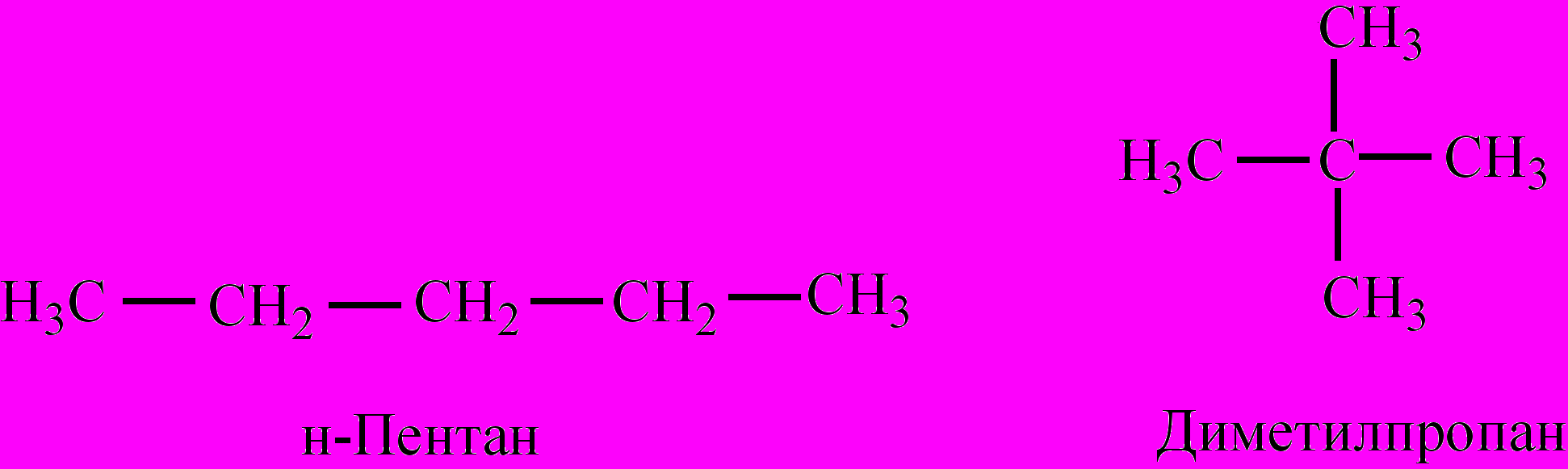
б) различным положением кратных связей, заместителя или функциональной группы в молекуле (изомерия положения и взаимного положения кратных связей, заместителей и функциональных групп) напр., бутен-1 и бутен-2, 1-хлорпропан и 2-хлорпропан, бутадиен-1,2 и бутадиен-1,3, 1,2-дибромпропан и 1,3-дибромпропан; в) принадлежностью к различным классам органических соединений (межклассовая изомерия) напр., гексен и циклогексан, этанол и диметиловый эфир.
СН3-СН2-СН=СН2
Бутен-1
СН3-СН=СН-СН3
Бутен-2
СН3-СН2-ОН
Этанол
Н3С-О-СН3
Диметиловый эфир
П
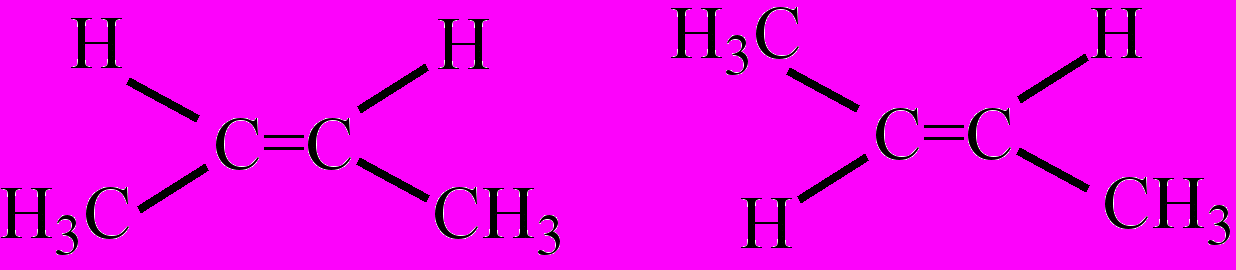 цис-Бутен -2 транс-Бутен-2
цис-Бутен -2 транс-Бутен-2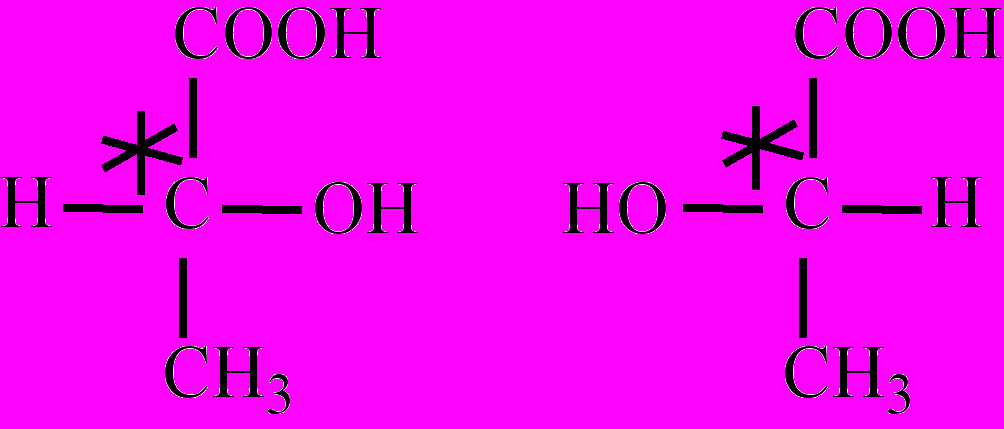 Оптические изомеры:
Оптические изомеры:D-молочная L-молочная
кислота кислота
ространственная И. обусловливается, во-первых, невозможностью свободного вращения атомов углерода, соединенных двойной связью (геометрическая изомерия). В связи с этим радикалы или заместители, соединенные с этими атомами углерода, могут быть расположены либо по одну сторону плоскости двойной связи (цис-изомерия), либо по разные стороны (транс-изомерия).
Примерами могут служить цис- транс-изомеры бутена-2, а также олеиновая кислота (цис-изомер) и ее транс-изомер – элаидиновая кислота. Во-вторых, существуют молекулы веществ, имеющие асимметрический центр, – атом углерода (обозначается звездочкой), связанный с четырьмя различными заместителями, для таких веществ характерна оптическая изомерия.
Оптические изомеры (зеркальные изомеры, оптические антиподы, энантиомеры) отличающиеся друг от друга, как предмет отличается от своего зеркального изображения, обладают способностью вращать плоскость линейно поляризованного света при прохождении его через слой вещества на один и тот же угол по часовой стрелке (вправо) или против часовой стрелки (влево). Напр., оптическими изомерами являются D-молочная кислота и L-молочная кислота. По другим физико-химическим свойствам энантиомеры не отличаются, однако химическая активность их в биохимических процессах может оказаться различной, особенно при взаимодействии с другими оптически активными соединениями. Такое явление называется стереоспецифичностью, ею отличаются многие реакции в организме. Одним из видов пространственной И. является конформационная И.
Индуктивный эффект (индукционный эффект) – смещение электронной плотности по цепи σ-связей в молекуле органического соединения, обозначается буквой I. И. э. вызывается атомами или группой атомов, электроотрицательность которых заметно отличается от электроотрицательности атома углерода. И. э. называют отрицательным (-I), если с атомом углерода связаны атом или группа атомов с большей электроотрицательностью (электроноакцепторы – -F, -Cl, -Br, -I, -OH, -NH2,
-NO2,
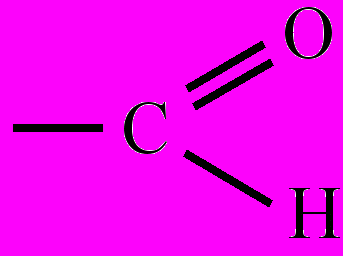 ,
, 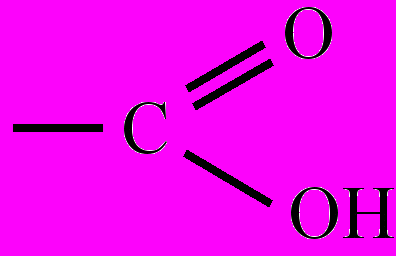 и др.). Указанные элктроноакцепторы оттягивают на себя электронную плотность σ-связей, в результате чего атомы углерода по цепи связей приобретают частичный положительный заряд (δ+ – дельта плюс). И. э. по мере его передачи от атома к атому в углеродной цепи постепенно затухает. Смещение электронной плотности в молекуле показывают стрелками с указанием частичных зарядов атомов в структурных формулах:
и др.). Указанные элктроноакцепторы оттягивают на себя электронную плотность σ-связей, в результате чего атомы углерода по цепи связей приобретают частичный положительный заряд (δ+ – дельта плюс). И. э. по мере его передачи от атома к атому в углеродной цепи постепенно затухает. Смещение электронной плотности в молекуле показывают стрелками с указанием частичных зарядов атомов в структурных формулах: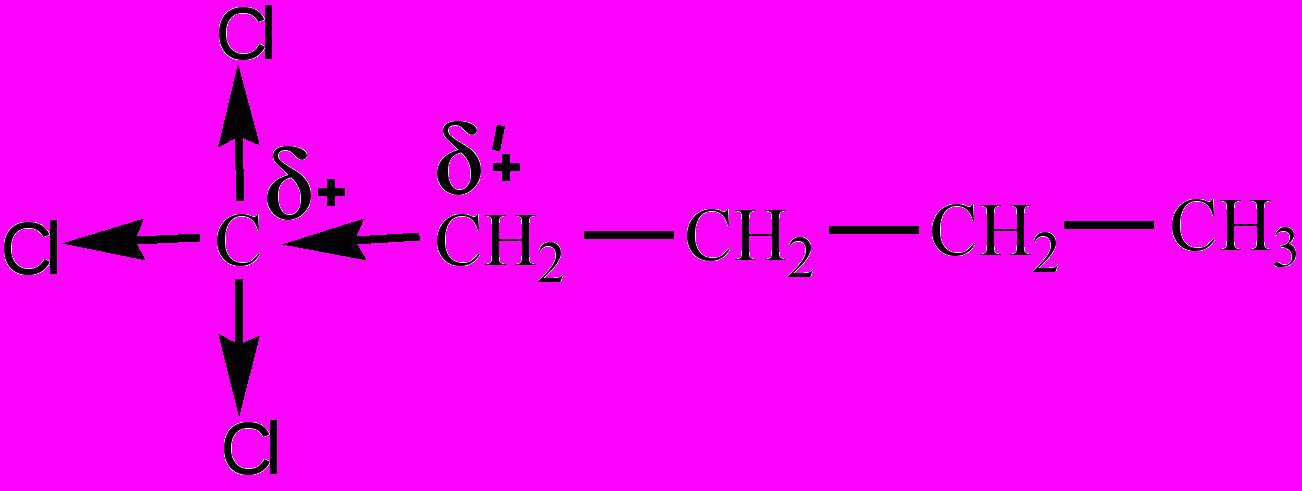
Атомы и группы атомов с меньшей, чем у углерода, электроотрицательностью (электронодоноры) отталкивают от себя электронную плотность в связях с углеродом, проявляя тем самым положительный индуктивный эффект (+I). Электронодонорными свойствами обладают группы: -СН3, -СН2-СН3, -СН(СН3), -С(СН3)3 и др. И. э. наряду с мезомерными эффектами, вызывающими перераспределение электронной плотности в молекулах соединений и появление частичных зарядов на отдельных атомах в значительной степени определяют химические свойства веществ.
Карбоксильная группа (
карбоксил) – функциональная группа, определяющая кислотные свойства карбоновых кислот. К. г. образована из карбонильной (>С=О) и гидроксильной (-ОН) групп, отсюда и название – карб + оксил. В К. г. происходит смещение электронной плотности в сторону карбонильного атома кислорода, что вызывает сильную поляризацию связи О-Н, в результате становится возможной кислотная диссоциация в водных растворах с образованием карбоксилат-анионов и катионов водорода: RCOOH
 RСОО- + Н+. В крбоксилат-анионе происходит делокализация π-связи карбонильной группы (С=О) и равномерное распределение отрицательного заряда между двумя атомами кислорода:
RСОО- + Н+. В крбоксилат-анионе происходит делокализация π-связи карбонильной группы (С=О) и равномерное распределение отрицательного заряда между двумя атомами кислорода: 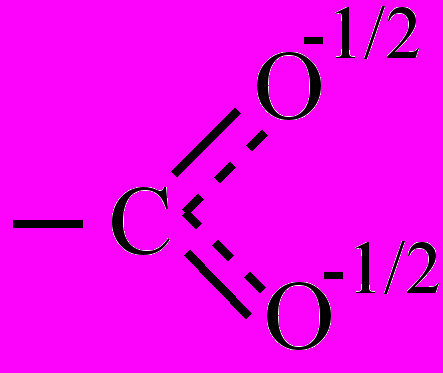 . В связи с этим для К., в отличие от альдегидной группы, не характерны реакции присоединения.
. В связи с этим для К., в отличие от альдегидной группы, не характерны реакции присоединения.К
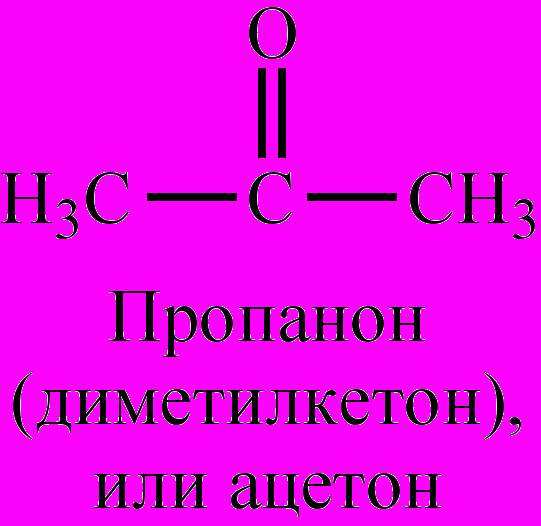
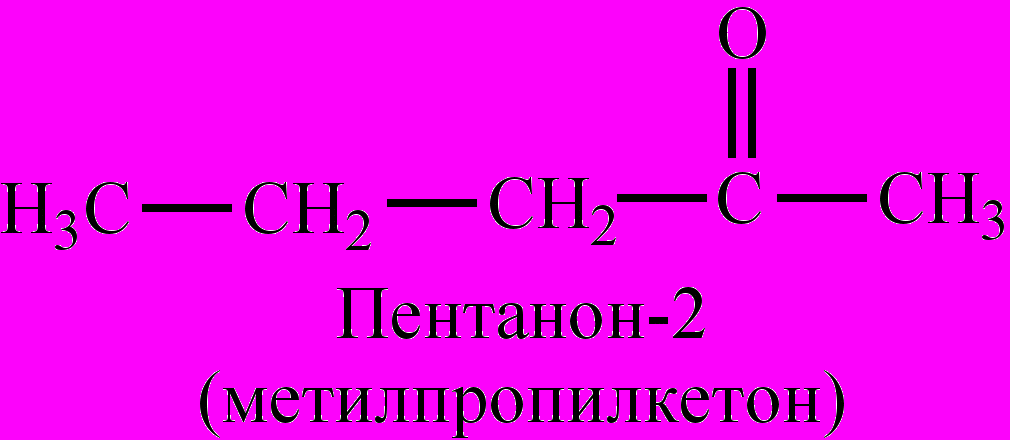
етоны – класс органических соединений, имеющих в составе молекул карбонильную группу (>С=О), связанную с двумя радикалами, которые могут быть насыщенными или ненасыщенными алифатическими, алициклическими, ароматическими. Если оба радикала одинаковы, К. называются симметричными. По номенклатуре ИЮПАК названия образуются от названия соответствующего углеводорода с добавление суффикса
–он, с указанием положения карбонильной группы в молекуле. Названия К. могут составляться также из названий радикалов с добавлением окончания –кетон. Применяются и тривиальные названия.
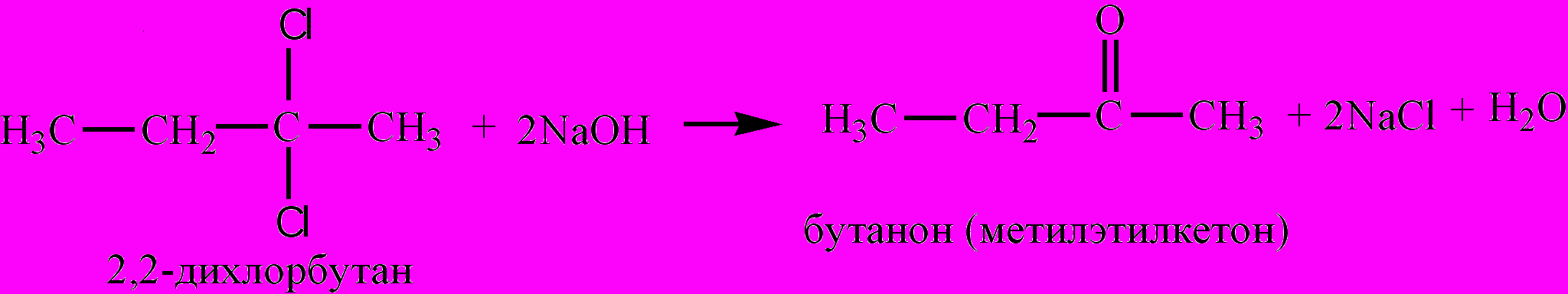
Общая формула гомологического ряда насыщенных алифатических К. – СnН2nО. Простейшим их представителем является пропанон (диметилкетон), или ацетон. Для К. характерны изомерия углеродной цепи, изомерия положения карбонильной группы, межклассовая изомерия (изомерны с альдегидами). Низшие К. – бесцветные жидкости с приятным запахом, растворимые в воде. Высшие – твердые нерастворимые в воде соединения. Получают окислением вторичных спиртов или с помощью Гриньяра реакций, каталитическим окислением алкенов, гидратацией алкинов, из дигалогеналканов, напр.,
По сравнению с альдегидами, К. менее активны в реакциях нуклеофильного присоединения; окисляются с большим трудом, при этом происходит расщепление углеродной цепи молекул; не реагируют с аммиачным раствором оксида серебра и гидроксидом меди (II). При гидрировании К. образуются вторичные спирты, при действии реактивов Гриньяра (R-MgBr) получаются третичные спирты. Наибольшее значение имеет ацетон, применяемый в производстве органических веществ и лекарственных средств, как растворитель красок, лаков, ацетатов целлюлозы и многих органических соединений. При сахарном диабете ацетон обнаруживается в моче как результат нарушения обмена веществ.
Конформации молекул – различные пространственные формы молекулы, которые она может принимать при изменении относительной ориентации отдельных атомов или групп атомов в пространстве, возникающие в результате их вращения вокруг простых связей. Такие различные формы молекул называют конформационными изомерами, однако выделить их в свободном виде не удается даже при температурах близких к абсолютному нулю. К. м. не вызывает изменения стереохимической конфигурации молекул вещества.
Мезомерный эффект (эффект сопряжения) – смещение электронной плотности по сопряженной системе π-связей; обозначается буквой М. Группы атомов или атомы (заместители) проявляя положительный М. э. (+М), смещают электронную плотность сопряженной кратной связи "от себя". К заместителям, вызывающим +М-эффект относятся алкильные радикалы (-СН3, -С2Н5 и др.), группы -ОН, -NH2, галогены -Cl, -Br. Для нитрогруппы, альдегидной и карбоксильной групп характерен отрицательный М. э. (-М). В отличие от индуктивного эффекта, М. э. передается по сопряженной цепи π-связей без затухания. Перераспределение электронной плотности в молекуле органического соединения в результате электронных эффектов, частным случаем которых является М. э., определяет закономерности направления многих химических реакций.
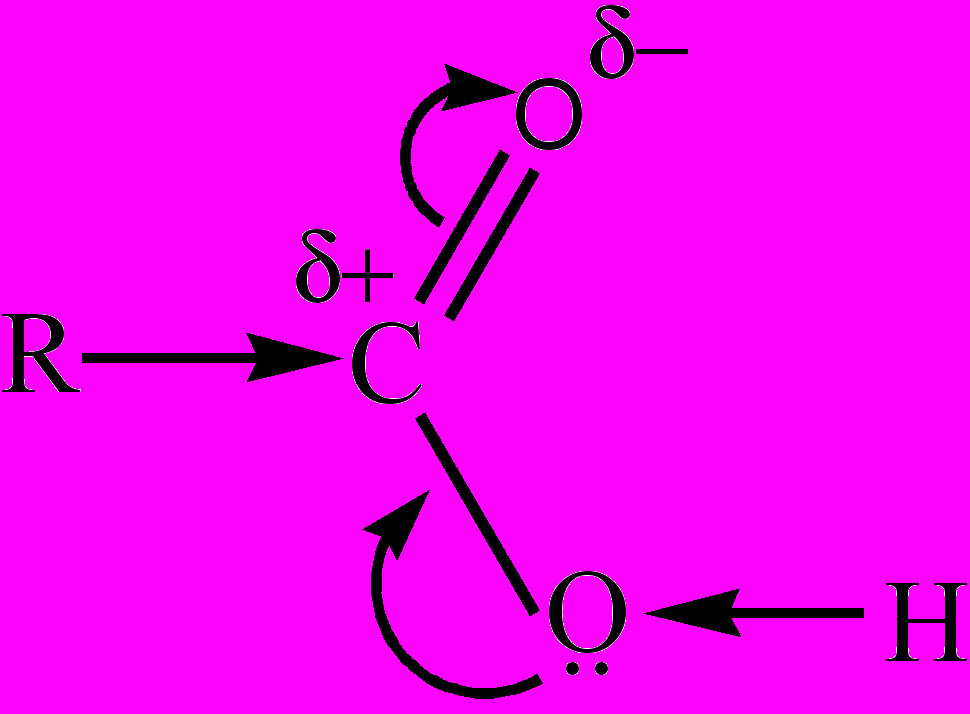
Нуклеофильные реакции – реакции, в которых имеет место присоединение нуклеофильной частицы к тому атому в молекуле второго реагента, на котором сосредоточен частичный положительный заряд (δ+). Подразделяются на реакции нуклеофильного присоединения (АN) и нуклеофильного замещения (SN). Примером первого типа Н. р. является реакции присоединения молекул типа НХ, содержащих нуклеофильные группы (Х-, ОН-, СN- и т.д.) к карбонильным соединениям по двойной связи С=О. Атом углерода карбонильной группы несет частичный положительный заряд, и является поэтому нуклеофильным центром, который на первой стадии реакции подвергается атаке нуклеофильных частиц. На второй стадии идет присоединение протона к образовавшейся отрицательно заряженной частице:
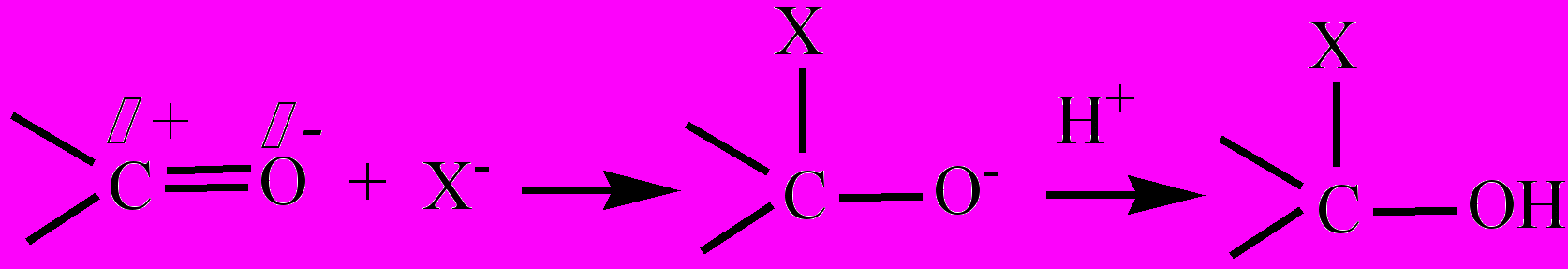
Примером реакции нуклеофильного замещения (SN) может служить процесс получения спиртов из галогенопроизводных действием водных растворов щелочей: СН3-Cl + NaOH ® СН3-ОН + NaCl. Атом углерода алкила несет частичный положительный заряд, и является поэтому нуклеофильным центром, который на первой стадии реакции подвергается атаке нуклеофильной частицей (-ОН) с образованием переходного состояния. На второй стадии идет отщепление иона галогена с образованием молекулы спирта:
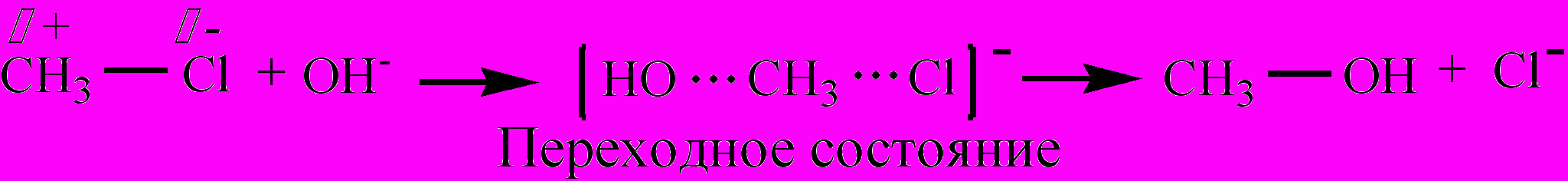
П
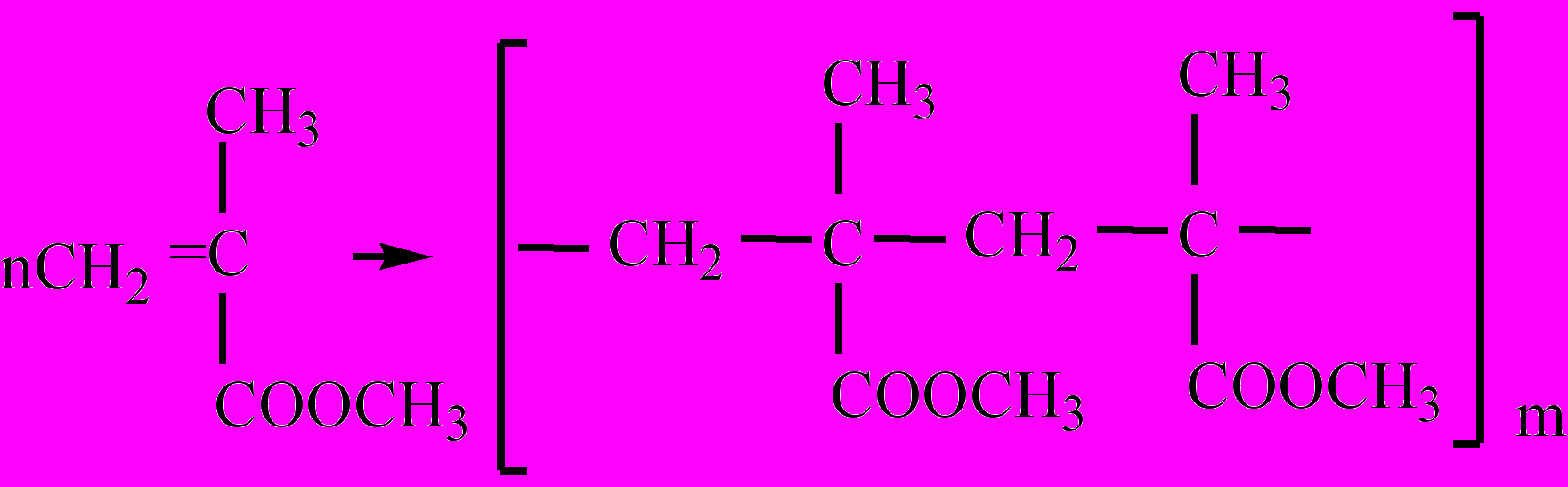
олиметилметакрилат – полимер, образующийся в результате реакции полимеризации метилового эфира метакриловой кислоты. П. – твердое, бесцветное прозрачное и светостойкое вещество, вследствие чего получил название "органическое стекло". Применяется для остекления транспортных средств, для производства линз и других изделий.
Присоединения реакции – (в органической химии) реакции между веществом, содержащим кратную химическую связь, с другим веществом. В ходе П. р. происходит разрыв пи-связей. В результате чего становится возможным присоединение атомов или групп атомов к исходному соединению по месту разрыва кратной связи посредством образуемых сигма-связей. Напр., Н2С=СН2+HCl®Н3С-СН2Cl. П. р. протекают по радикальному, нуклеофильному и электрофильному механизмам. Напр., по электрофильному типу происходят реакции присоединения галогеноводородов к несимметричным алкенам (АЕ), когда протон присоединяется к наиболее гидрированному атому углерода по месту двойной связи (по правилу Марковникова), напр.,:
СН3-Сδ+Н=Сδ-Н2 + H+Br- ® СН3-СНBr-СН3
Радикальные реакции – химические реакции, протекающие с участием свободных радикалов, образующихся в результате гомолитического разрыва ковалентной связи. Свободнорадикальные реакции протекают по цепному механизму в три стадии: инициирование реакции (образование свободных радикалов); развитие цепной реакции (цепь последовательных взаимодействий радикалов с неактивными молекулами с образованием новых радикалов и новых молекул); обрыв цепной реакции (взаимодействие радикалов между собой с образованием неактивных молекул, вызывающее прекращение развития цепной реакции). По механизму радикального замещения (SR) протекает, напр., цепная реакция галогенирования алканов: R-H+Cl2
 R-Cl+HCl. На первой стадии (инициирование цепи) под действием света или тепла происходит гомолитический распад молеклы галогена с образованием двух радикалов:
R-Cl+HCl. На первой стадии (инициирование цепи) под действием света или тепла происходит гомолитический распад молеклы галогена с образованием двух радикалов:Cl2
 Cl× + Cl×.
Cl× + Cl×. На второй стадии происходит взаимодействие свободных радикалов с молекулами с образованием новых радикалов и продуктов реакции (развитие цепной реакции): R-H + Cl× ® R× + HCl; R× + Cl2 ® R-Cl + Cl×.
На третьей стадии реакция обрывается за счет взаимодействия радикалов между собой с образованием неактивных молекул:
R× + R× ® R-R; R× + Cl× ® R-Cl; Cl× + Cl× ® Cl2.
Если галоген взят в избытке, то реакция не останавливается на образовании моногалогензамещенного продукта, а происходит дальнейшее замещение атомов водорода на атомы галогена.
Другим примером Р. р. является радикальное присоединение (АR) галогенов к алкенам, протекающее по типу цепной реакции: СН2=СН2+Br2
 СН2Br-СН2Br. На первой стадии (инициирование цепи) под действием света или тепла происходит гомолитический распад молеклы галогена с образованием двух радикалов: Br2
СН2Br-СН2Br. На первой стадии (инициирование цепи) под действием света или тепла происходит гомолитический распад молеклы галогена с образованием двух радикалов: Br2  Br× + Br×. Далее происходит взаимодействие свободных радикалов с молекулами с образованием новых радикалов и продуктов реакции (развитие цепной реакции):
Br× + Br×. Далее происходит взаимодействие свободных радикалов с молекулами с образованием новых радикалов и продуктов реакции (развитие цепной реакции): СН2=СН2 + Br × ® СН2Br-СН2×; СН2Br-СН2× + Br2 ® СН2Br-СН2Br + Br ×.
Сопряжение связей (π,π-сопряжение) – вид электронного эффекта, который наблюдается в молекулах органических соединений, содержащих кратные сопряженные связи. Одним из представителей подобных соединений является бутадиен-1,3 (СН2=СН-СН=СН2). В его молекуле все атомы углерода находятся в состоянии sp2-гибридизации, вследствие этого все σ-связи молекулы бутадиена находятся в одной плоскости. Негибридизованные р-орбитали π-связей располагаются перпендикулярно по обе стороны этой плоскости и, перекрываясь, образуют единое π-электронное облако. Таким образом, в сопряженных кратных связях электронная плотность всех π-связей распределена (делокализирована) по всей сопряженной системе. Поэтому все связи С-С в молекуле бутадиена-1,3 носят промежуточный характер между двойной и одинарной связями, что можно изобразить формулой:
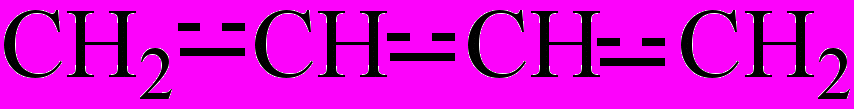 . Эффект С. с. проявляется также в аренах.
. Эффект С. с. проявляется также в аренах.Сопряженные кратные связи – кратные химические связи (двойные или тройные связи) в углеродном скелете молекулы органического соединения, разделенные одной одинарной (σ-связью) связью. С. к. с. имеются в молекулах бутадиена-1,3 СН2=СН-СН=СН2, бензола
 и т.д. См. Сопряжение связей.
и т.д. См. Сопряжение связей.Теория химического строения органических соединений – теория, обобщающая систему научных знаний и понятий о строении и свойствах органических веществ. Основы этой теории впервые сформулировал А.М. Бутлеров в 1861 году. Сущность теории сводится к следующему.
1.Атомы химических элементов связаны между собой в составе молекулы сложного вещества в определенной последовательности согласно их валентности. Углерод в органических соединениях четырехвалентен.
2.Свойства сложного вещества определяются:
- природой атомов, входящих в состав вещества (качественным составом вещества);
- числом атомов, входящих в состав молекулы вещества (количественным составом вещества);
- последовательностью соединения атомов в составе молекулы вещества (структурой молекулы и ее расположением в пространстве);
- взаимным влиянием отдельных атомов или групп атомов в молекуле сложного соединения.
3.Существование веществ (изомеров), обладающих одинаковым качественным и количественным составом, но различными физическими и химическими свойствами, объясняется и обусловливается неодинаковым химическим строением их молекул.
4.Строение молекул вещества и его химические свойства взаимосвязаны и взаимообусловлены. Знание свойств вещества позволяет делать заключение о его строении; и, наоборот, установив количественный и качественный состав вещества и строение его молекул можно прогнозировать его свойства.
Теория А.М. Бутлерова постоянно совершенствовалась и продолжает развиваться в направлениях изучения пространственного строения молекул и электронной природы химических связей в органических соединениях.
Формула химическая – принятая во всех странах условная запись, отображающая качественный и количественный состав (иногда и строение) химического соединения с помощью химических знаков и индексов. Различают формулы различных типов: молекулярные, эмпирические, структурные, общие и др. Каждый тип формул имеет свои особенности, достоинства, недостатки и может иметь несколько вариантов.
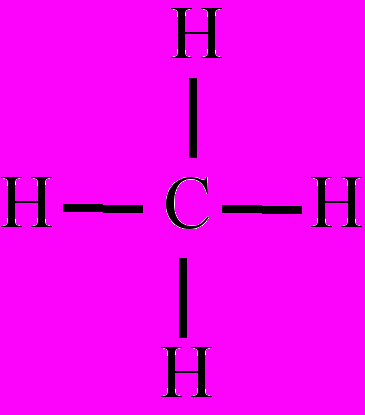
М
Структурные формулы метана и воды
 Н-О-Н
Н-О-Н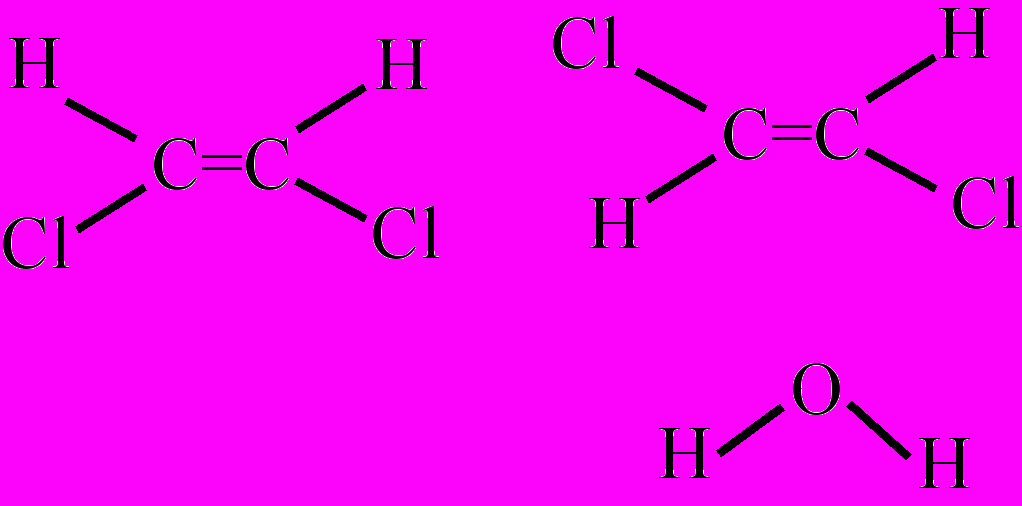
Стереохимические формулы цис-1,2-дихлорэтена транс-1,2-дихлорэтена и воды
олекулярные формулы отображают только число атомов элементов, входящих в молекулу, но не показывают порядок их соединения, напр., H2SO4, С6Н14. Молекулярные формулы называют еще брутто-формулами. Эмпирические (простейшие) формулы отражают лишь мольные отношения элементов в веществе, напр., эмпирическая формула оксида фосфора (V) – Р2О5, а молекулярная – P4O10. Эмпирическая формула ацетилена – СН, а молекулярная – С2Н2 и т.д. Состав веществ немолекулярного строения выражается чаще всего эмпирическими формулами, которые соответствуют лишь структурному фрагменту (формульной единице) этого вещества (NaCl, Fe2O3 и др.).
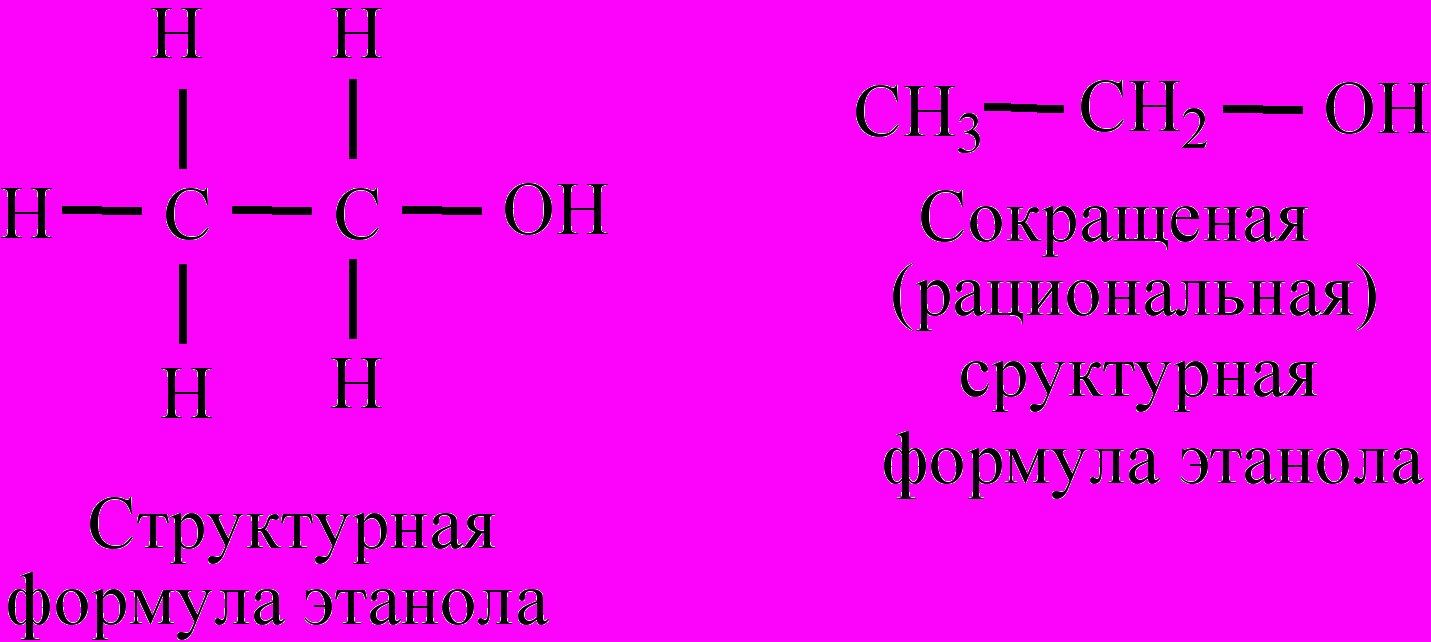
С
труктурные формулы отображают порядок соединения и валентность атомов в молекуле, как это показано на примере формул метана, воды и этанола. В свою очередь структурные формулы можно преобразовать в более упрощенный вариант (сокращенную, или рациональную формулу), как это показано на примере формулы этанола. В стереохимических формулах, как и в структурных, указывается порядок и последовательность соединения атомов в молекуле. Но, кроме этого, стереохимические формулы отображают углы между химическими связями и положение атомов или групп атомов в составе молекулы относительно положения двойных связей. Это наглядно видно на примере стереохимических формул 1,2-дихлорэтена (цис- и транс-изомеры) и воды. Для ароматических соединений и др. сложных по строению веществ часто применяют, так называемые, скелетные формулы, когда символы атомов углерода и водорода, а также штрихи-связи между ними опускаются, напр., формула бензола:

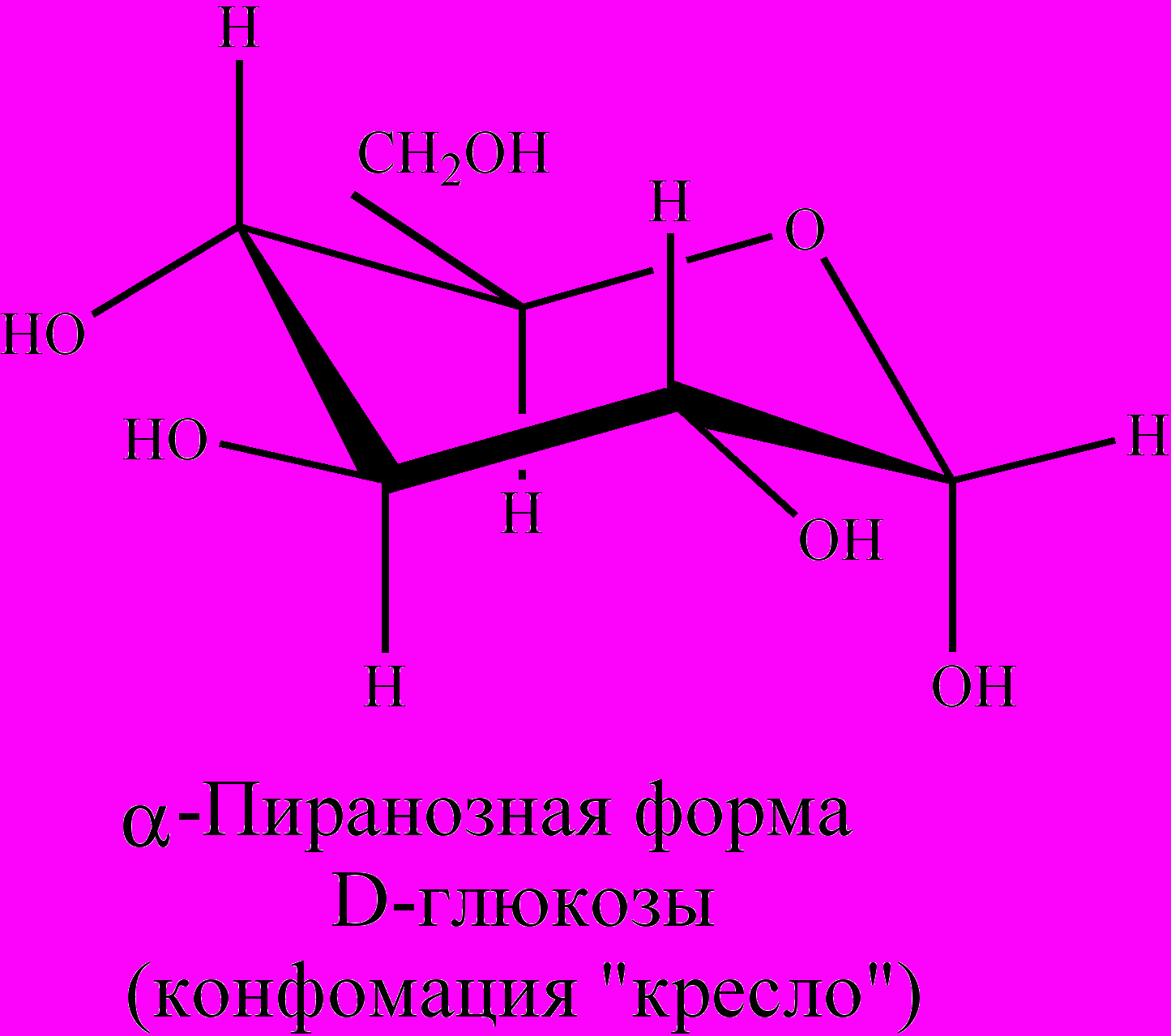
Для более точного отражения пространственного строения вещества используются конформационные формулы, показывающие положение отдельных атомов и групп атомов в пространстве относительно друг друга. Эти формулы позволяют указать на самые тонкие отличия в строении молекул очень близких по свойствам изомеров, напр., конформационная формула α-пиранозной формы D-глюкозы (форма "кресла").
Общие формулы отражают состав целого класса веществ, напр., углеводороды гомологического ряда этилена (алкены) имеют общую формулу СnН2n.
Кроме этого разработан еще ряд вариантов изображений и схем, позволяющих наглядно представлять состав и строение веществ.
Электрофильные реакции – химические реакции, протекающие с участием электрофильных частиц, взаимодействующих по месту расположения частичного отрицательного заряда на атоме или π-электронных облаков кратных связей. Различают реакции электрофильного замещения (SЕ) и электрофильного присоединения (АЕ), напр., присоединение бромоводорода к этилену: СН2=СН2 + НBr ® СН3-СН2Br. Реакция начинается с воздействия электрофила (Н+) на π-электронное облако двойной связи с образованием π-комплекса, затем – иона карбения и далее – бромэтана:
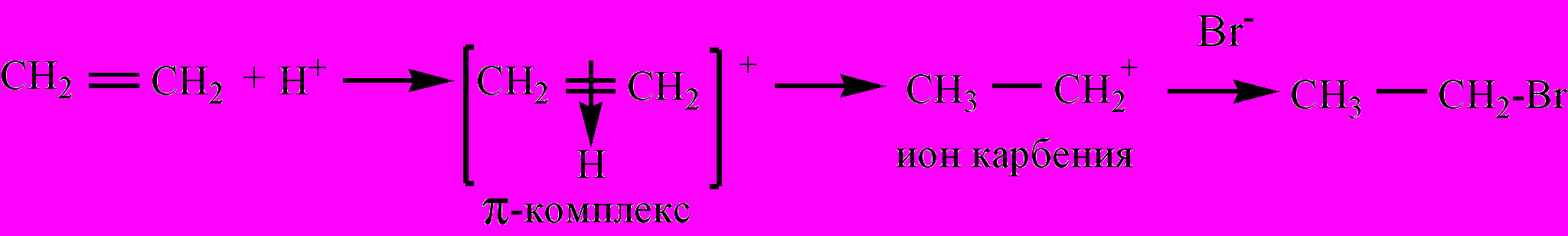
Элементный состав человеческого организма – в теле человека массой 70 кг содержится в среднем (в различных литературных источниках значения могут значительно отличаться между собой): кислорода – 43 кг (61,4%), углерода – 16 кг (22,86%), водорода – 7,0 кг (10,0%), азота – 1,8 кг (2,57%), кальция – 0,98 кг (1,4%), фосфора – 0,77 кг (1,1%), серы и калия по 140 г (по 0,2%), натрия – 98 г (0,14%), хлора – 95 г (0,136%), магния – 19 г (0,027%), железа - 4,2 г (0,006%), фтора – 2,6 г (0,0037%), цинка – 2,5 г (0,0033%), рубидия – 680 мг (0,0009%), стронция – 320 мг (0,00045%), брома – 260 мг (0,00037%), свинца – 120 мг (0,00027%), меди – 72 мг, алюминия – 61 мг, кадмия – 50 мг, бария – 22 мг, иода – 12-20 мг, мышьяка – 18 мг, кобальта и селена – по 14 мг, марганца – 12 мг, никеля и циркония – по 1 мг, лития – 0,67 мг, ванадия – 0,11 мг, бериллия – 0,036 мг (всего 32 элемента). Достоверные данные по содержанию других химических элементов в теле человека в литературе отсутствуют.
Ф
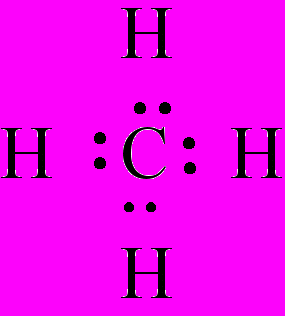
Метан
ормула электронная – а) условная запись строения электронной оболочки химического элемента, напр., Ф. э. натрия – 1s22s22p63s1; б) условная запись, с указанием общих электронных пар в ковалентных соединениях, напр., Ф. э. метана выглядит следующим образом.
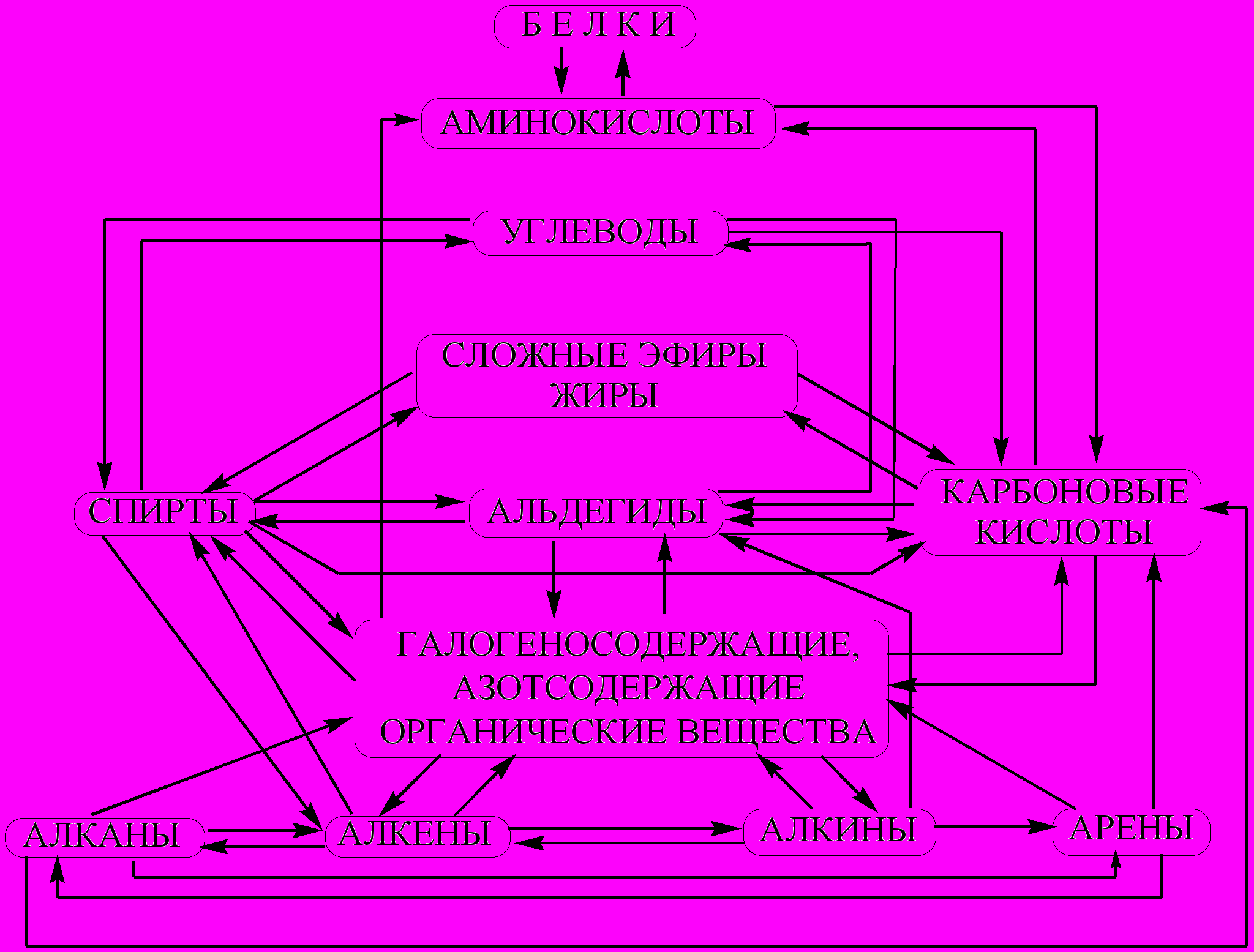
Генетическая связь между классами органических соединений – связи между органическими соединениями, раскрывающие направления получения соединений одного класса из соединений другого или других классов. Эти связи между веществами в упрощенном виде можно изобразить схемой.
Анализируя перечень понятий и терминов органической химии, можно разделить их на несколько групп (определите и запишите их):
а) б) в)
г) д)
Формируя наиболее сложные понятия можно рекомендовать следующий алгоритм объяснения.
1. Показать учащимся современное состояние вопроса или темы.
2. Поставить проблему: "Как объяснить указанные факты?"
3. Объяснить последовательно отдельными блоками в виде цепочки рассуждений переход от известного ученикам материала к решению проблемы.
Рассмотрим алгоритм рассуждения учителя на примере объяснения понятия «гибридизация атомных орбиталей».
Учитель (после объявления темы, вводного слова) предлагает рассмотреть рисунки и модели молекулы метана (рис. на правой части доски):
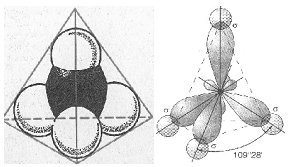
Далее учитель говорит, что строение молекулы метана (установлено специальными методами) тетраэдрическое, углы между связями 109о 28/ и ставит вопрос: "Как объяснить этот факт? Ведь строение атома углерода не предполагает образование тетраэдрической структуры".
Для объяснения строения молекул метана рассмотрим строение атома углерода. Его можно изобразить, по крайней мере, четырьмя способами.
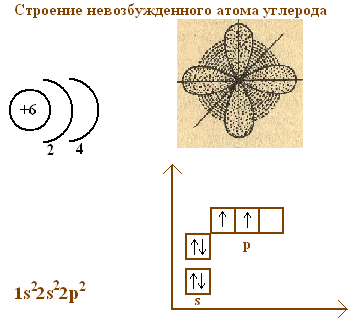
Обсудив строение невозбужденного атома углерода, ученики должны САМИ сделать вывод, что от этого состояния перейти к молекуле метана невозможно, так как в невозбужденном состоянии атом углерода не может образовывать соединения, проявляя при этом валентность равную четырем.
Решить проблему валентности углерода (равную в молекуле метана 4) можно, если допустить переход атома углерода в возбужденное состояние. Это изображается на доске следующим образом.
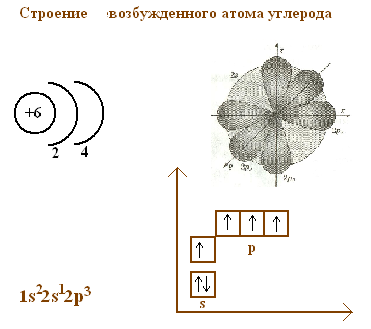
Обсудив с учениками строение атома углерода в возбужденном состоянии учащиеся САМИ делают вывод, что возбужденное состояние атома углерода не приводит к структуре тетраэдра. Учитель объясняет, что проблема снимается, если ввести понятие гибридизации. Строение атома углерода теперь можно изобразить следующим образом.
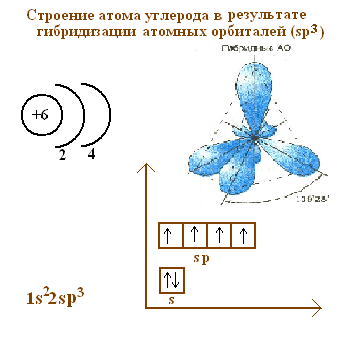
Общий рисунок на доске будет выглядеть следующим образом.
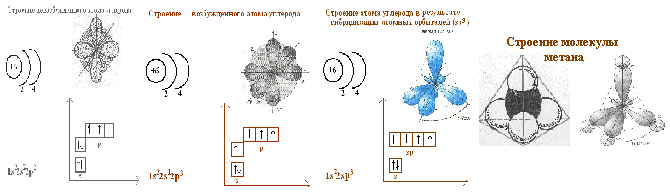
В заключение учитель делает обобщение и выводы.
ВОПРОСЫ И ЗАДАНИЯ
- Место органической химии в курсе химии.
- Значение органической химии.
- Построение и содержание раздела органической химии.
- Требования к знаниям и умениям выпускников в области органической химии.
- Особенности методики обучения органической химии.
- Выберите из словаря одно понятие и один термин и подготовьте краткое его объяснение.
- Рассмотрите схему генетических связей органических веществ и приведите пример 3-х звеньевой цепочки.
