Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера
| Вид материала | Закон |
- Тема №1 «Общая химия», 73.57kb.
- Материалы для подготовки к экзамену по химии, 462.84kb.
- Билеты для переводной аттестации по химии, 8 класс Билет, 100.43kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Урок повторение и обобщение по темам, 121.04kb.
- Урок тема: Металлы главных подгрупп, 62.33kb.
- Задачи урока: Обучающая: Создать условия для исследования учащимися физических и химических, 64.17kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Контрольная работа по темам: «Общие свойства металлов», 69.86kb.
- Задачи: Обучающая: Познакомить учащихся со свойствами щелочных металлов, Щелочно-земельных, 51.5kb.
26. Задача. Какую массу оксида углерода (IV) необходимо взять для получения 2 моль карбоната кальция?

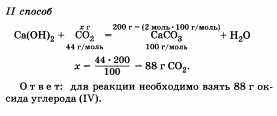
27. Углерод, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома, аллотропные видоизменения углерода. Оксиды углерода.
В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы.
Рассказ о строении атома углерода следует начать с изображения распределения электронов по электронным слоям:
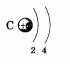
По желанию учащийся может дополнить свой ответ информацией, приведя состав, графическую схему и электронную формулу атома углерода:
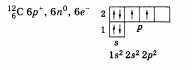
Углерод (С) — неметалл. Возможные степени окисления: -4; 0; +2; +4. Формулы высшего оксида и гидроксида: СО2 и Н2СО3. Оба соединения проявляют кислотные свойства.
При освещении вопроса о нахождении углерода в природе и характеристике физических свойств углерода следует остановиться на явлении адсорбции (поглощение одного вещества поверхностью другого). Вещество, на поверхности которого происходит поглощение, называется адсорбентом. Вследствие большой пористости древесный уголь является хорошим адсорбентом, т. е. способен поглощать своей поверхностью большие порции веществ (например, газов). Это свойство угля используется в медицине (активированный уголь), на этом основано использование угля в противогазах.
Среди аллотропных модификаций следует рассмотреть алмаз и графит . Следует отметить, что различие физических свойств алмаза и графита обусловлено строением их кристаллических решеток. Необходимо показать, что графит и алмаз превращаются друг в друга, при этом целесообразно воспользоваться схемой:

О других видоизменениях углерода (карбин, фулле-рен) ученик может рассказать по желанию.
Рассказ о химических свойствах углерода можно начать с анализа строения атома. Наличие четырех электронов на внешнем электронном слое (валентных электронов) предполагает возможность как принятия, так и отдачи этих электронов. Из этого следует, что углерод по химическим свойствам может быть: а) окислителем (например, в реакциях с металлами и водородом):

Эта реакция играет важную роль в металлургии (получение чистых металлов).
Далее следует перейти к сравнительной характеристике двух оксидов, образуемых углеродом: оксид углерода (II) и оксид углерода (IV). Для удобства ответ можно представить в виде таблицы.
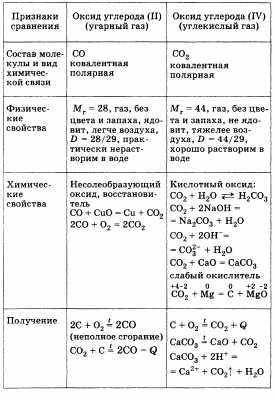
Оба оксида имеют важное значение: СО — в металлургии, получение метилового спирта; СО2 — в процессе фотосинтеза, получение мочевины (удобрения). Оба являются составной частью круговорота углерода в природе.
28. Задача. Какая масса хлорида железа (III) образуется при взаимодействии хлорида железа (II) с 4 моль хлора?

29. Кальций, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома. Физические и химические свойства; взаимодействие с кислородом, водой, кислотами.
В периодической таблице химических элементов Д. И. Менделеева кальций Са расположен в 4-м периоде II группы главной подгруппы.
Распределение электронов по электронным слоям в атоме кальция выглядит следующим образом:
По желанию учащийся может привести состав, графическую схему и электронную формулу кальция:
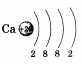
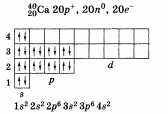
Кальций Са — металл. Основная степень окисления 4-2. Формулы высшего оксида и гидроксида СаО и Са(ОН)2. Оба соединения проявляют основные
свойства.
По физическим свойствам: кальций — металл серебристо-белого цвета, относительно легкий (плотность р = 1,54), температура плавления 854 °С, окисляется на воздухе.
Переходя к характеристикам химических свойств кальция, следует отметить, что его высокая активность объясняется легкостью отдачи двух электронов, расположенных на внешнем электронном слое.
Таким образом, в химических реакциях кальций — восстановитель. Это можно подтвердить уравнениями реакций кальция как с простыми, так и со сложными веществами:
1) с неметаллами
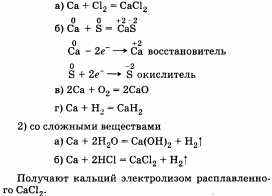
Получают кальций электролизом расплавленного СаС12.
Касаясь вопроса о применении, важно отметить широкое использование соединений кальция в строительстве: карбонат кальция СаС03 (известняк), оксид кальция СаО (негашеная известь), гидроксид кальция Са(ОН)2 (гашеная известь), сульфат кальция CaSO4 • 2Н2О (гипс, алебастр).
