Урок повторение и обобщение по темам
| Вид материала | Урок |
- Урок «Решение задач оптимизации с помощью табличного процессора Excel», 59.97kb.
- Урок «Решение задач оптимизации с помощью табличного процессора Excel», 65.29kb.
- Урок исследование одного слова. Тема : повторение изученного по темам «Лексикология»,, 102.51kb.
- Урок по русскому языку в 5 классе на тему: «Повторение и обобщение изученного по разделу, 46.96kb.
- Урок-проект «Обобщение и систематицация знаний по темам «Создание презентаций в среде, 151.37kb.
- Урок по обществоведению в 6 классе на тему: «Познай самого себя», 43.46kb.
- Тема: «Установление феодального строя» (повторительно -обобщающий урок с использованием, 76.97kb.
- Урок русского языка в 6 классе Тема: Повторение изученного об имени существительном, 102.7kb.
- Урок русского языка Тема Обобщение изученного по темам «Причастие» и«Деепричастие», 53.56kb.
- Тема урока: обобщение по темам «Одежда», «Семья», 153.35kb.
УРОК 8. Повторение и обобщение по темам: «Металлы главных подгрупп I–III групп периодической системы химических элементов Д.И.Менделеева», «Железо – представитель элементов побочных подгрупп периодической системы химических элементов Д.И.Менделеева».
Образовательные задачи: организовать деятельность учащихся по актуализации знаний и умений по темам «Металлы главных подгрупп I–III групп периодической системы химических элементов Д.И.Менделеева», «Железо – представитель элементов побочных подгрупп периодической системы химических элементов Д.И.Менделеева». Обратить внимание учащихся на те вопросы, которые ими были недостаточно поняты, для эффективной домашней подготовки к зачету.
Воспитательные задачи: обеспечить условия для формирования положительного отношения к ценности Познание: содействовать воспитанию способности осознавать ответственность, потребности и умения осуществлять самооценку своих знаний и намечать свои действия по их корректировке.
Развивающие задачи: создать условия для развития у учащихся умения разворачивать информацию; проводить анализ и сравнение; осуществлять перенос знаний в новую ситуацию. Содействовать развитию монологической речи учащихся.
Форма урока: интенсивная подготовка к зачету по следующим вопросам:
1)особенности строения атомов металлов, их роль в окислительно-восстановительных процессах;
2)общие свойства металлов, качественные реакции на катионы металлов;
3)свойства оксидов и гидроксидов, образуемых металлами главных и
побочных подгрупп (на примере железа);
4)причинно-следственные связи между строением атомов металлов и их свойствами, а также свойствами образуемых ими оксидов и гидроксидов.
На уроке сочетаются фронтальная, парная и индивидуальная формы работы учащихся. Перечисленные вопросы сначала обсуждаются устно фронтально, а затем следует небольшая индивидуальная работа с самопроверкой и взаимопроверкой в парах.
На столах учащихся находятся: карточки многоразового использования, листы с заданиями, чистые индивидуальные листы для выполнения заданий (на них выполняются все письменные задания).
Учащиеся нацеливаются на то, чтобы в процессе повторения и обобщения знаний и умений провести самооценку уровня готовности по теме, определить для себя затруднения по материалу темы для того, чтобы эффективно провести домашнюю подготовку к зачету.
Весь теоретический материал повторяется по схеме-конспекту, записанному на доске.
I. Характеристика элемента Ме
1

 . В 2. Me … ) от 1 е до 3 е
. В 2. Me … ) от 1 е до 3 е
Fr At
Ме+
вос-ль –
искл.Ме IV –– VII гр. гл. подгр.
Ra(Me)> Ra(НеMe)
3. Ме
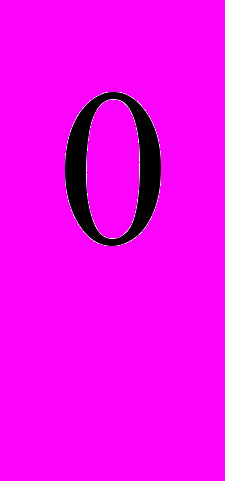 –– n e →Ме
–– n e →Ме (ок-ние)
(ок-ние)↓
вос-ль

 0, +1, +2, +3 низшая
0, +1, +2, +3 низшая4. Ст. ок. Ме ––
 +4, +5, +6, +4, +8 высшая
+4, +5, +6, +4, +8 высшая5. Изменение восстановительных св-в атомов Ме в ПС
в периоде Причина (период):
у

 меньшается > заряд ядра
меньшается > заряд ядра> N e на внешнем уровне
< R a
в гл. подгруппе Причина (группа):
увеличивается > R a
ІІ. Характеристика простого вещества Ме
метал.→ метал. → тв. сост., пластич.,
связь → кристал. электропровод.,
решетка теплопров.,
метал. Блеск
Изменения в ПС:
↑ в периоде
Твердость, t пл., t кип, ↓ в группе
Причина: ↑ N e на внешнем слое (период) и ↓ R a
↑ R a (в группе)
ІІІ. Хим.свойства Ме
 Неме
Неме? → ? основный оксид
? → ? амфотерный оксид

 О
О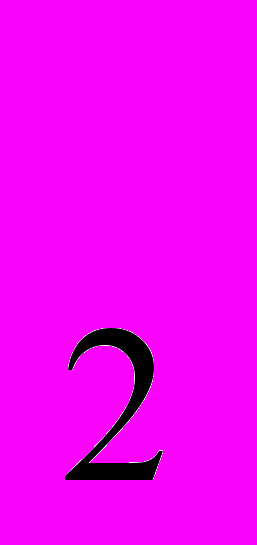
 Н
Н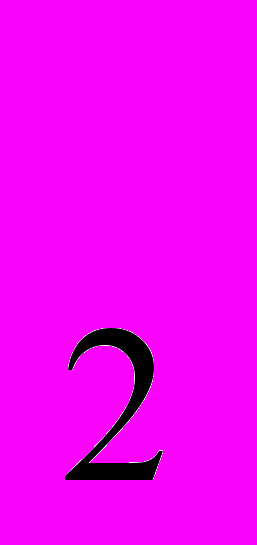 О ? → R(OH)
О ? → R(OH)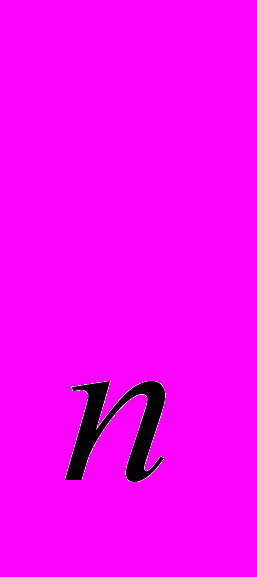 + H
+ H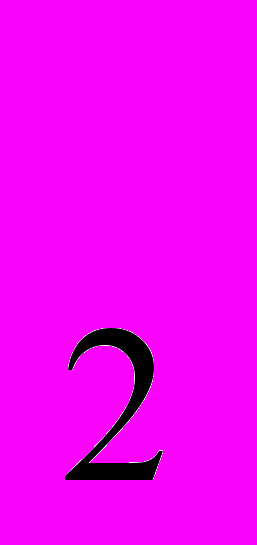 ↑
↑ ? t RO + H
? t RO + H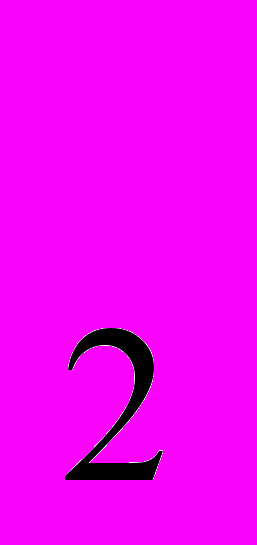 ↑
↑
Fe + HCl → FeCl
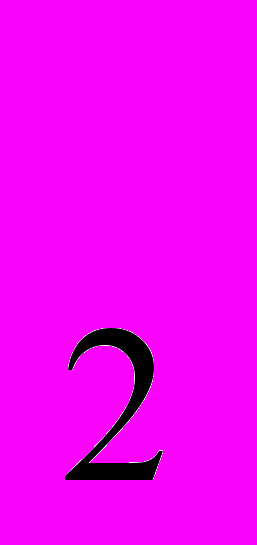 + ?
+ ?кислота
 соль
соль Zn + CuCl
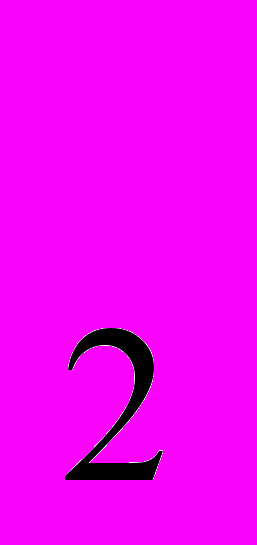 → ? + ?
→ ? + ?Cu + FeCl
 → Fe + ?
→ Fe + ?I
Ме
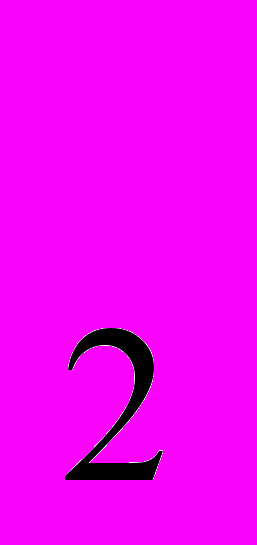 О
ОМеО
основные оксиды
V.
Ст. ок. +1, +2 МеОН


 Ме(ОН)
Ме(ОН)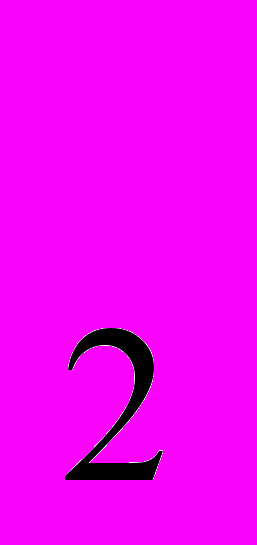
основания
ст. ок. +3


 Ме Ме
Ме Ме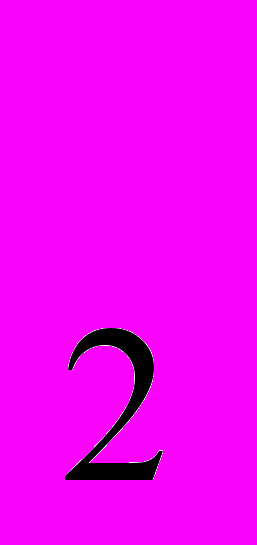 О
О Ме(ОН)
Ме(ОН)
амфотер. оксид амфотер. гидроксид
 ст. ок. +4 и > МеО
ст. ок. +4 и > МеО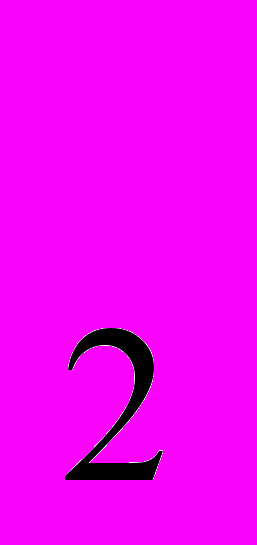 , Ме
, Ме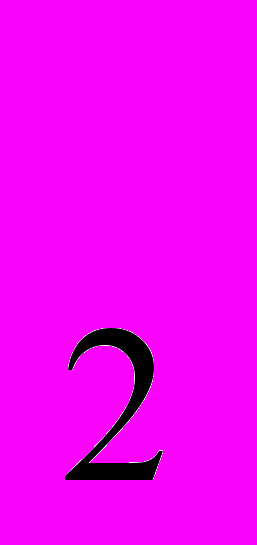 О
О и т. д. Н
и т. д. Н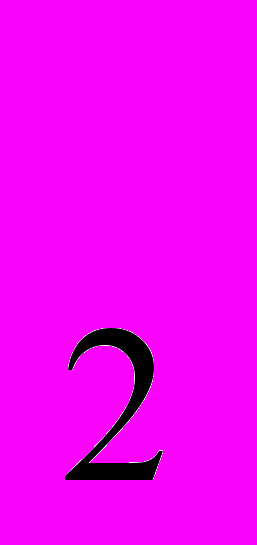 МеО
МеО , НМеО
, НМеО и т.д
и т.дI Особенности строения атомов металлов,
их роль в окислительно- восстановительных процессах
Один из учащихся освещает данный вопрос по схеме. Затем проводится фронтальная индивидуальная работа по карточкам многоразового использования: учащиеся устно выполняют задания учителя.
| № | I в | II в | I в | II в | № |
| 1. | F | Sr | 2е,8е,18е,6е | 2е,8е,1е | 1. |
| 2. | As | Ne | 2е,8е,18е,8е,1е | 2е,8е,6е | 2. |
| 3. | Rb | Cl | 2е,5е | 2е,8е,18,2е | 3. |
| 4. | Te | P | 2е,8е,3е | 2е,8е | 4. |
| 5. | Kr | Na | 2е,7е | 2е,8е,5е | 5. |
| 6. | Mg | Zn | 2е,8е,18е,5е | 2е,8е,18е,18е,7е | 6. |
| 7. | Li | S | 2е,8е,2е | 2е,8е,8е,1е | 7. |
| 8. | Se | N | 2е,8е,18е,18е,6е | 2е,8е,7е | 8. |
| 9. | Al | Mg | 2е,8е,18е,8е | 2е,8е,2е | 9. |
| 10 | Ca | I | 2е,1е | 2е,6е | 10 |
| 11. | N | K | 2е,8е,18е,7е | 2е,5е | 11. |
| 12. | Br | O | 2е,8е,8е,2е | 2е,8е,18е,8е,2е | 12. |
1.Найдите в первом столбце элементы главной подгруппы I группы.
2.Найдите во втором столбце соответствующие им электронные формулы.
3.У какого из этих металлов ярче выражены восстановительные свойства?
4. Найдите в первом столбце элементы главной подгруппы II группы.
5.Найдите во втором столбце соответствующие им электронные формулы.
6.У какого из этих металлов ярче выражены восстановительные свойства?
II Общие свойства металлов
Вначале вопрос освещается одним из учащихся по схеме, затем каждый учащийся индивидуально выполняет задание с последующей самопроверкой.
Задание: какие группы веществ будет реагировать с каждым из предложенных металлов. Для проверки правильности выполнения задания сложите цифры из клеток, соответствующих ответу «да». Если сумма равна: I вариант – порядковому номеру цинка, II вариант – порядковому номеру скандия, задание выполнено правильно.
I вариант
| Группы веществ | Na | Al | Fe |
| H2O, H2, Cl2 | 1 | 2 | 3 |
| H2O, NaOH, S | 4 | 5 | 6 |
| H2O, HCl, O2 | 7 | 8 | 9 |
II вариант
| Группы веществ | K | Ca | Al |
| O2, KOH, SO2 | 1 | 2 | 3 |
| LiOH, Cl2, H2O | 4 | 5 | 6 |
| H2SO4, S, H2 | 7 | 8 | 9 |
III Свойства оксидов и гидроксидов, образуемых металлами
главных и побочных подгрупп (на примере железа)
Вопрос повторяется по схеме , затем учащиеся выполняют задание на осуществление превращений. Учащимся предлагаются на выбор задания двух уровней.
Записать уравнения реакций следующих превращений:
I вариант
| 1) Cl2 + Fe → | 3)CaCO3 + HNO3 → |
| 2) FeCl3 + KOH → | 4) Li + H2O → |
II уровень
Al → AlCl3→ Al(OH) 3→ Na[Al(OH) 4]
↓
Al2O3
II вариант
| 1) Ca + H2SO4→ | 3) Al2O3 + KOH → |
| 2) Mg(OH) 2 + HCl → | 4) Cu SO4 + Zn → |
II уровень Ca → CaO → Ca(NO3)2 → CaCO3→ Ca(HCO3)2
Разберите первую реакцию как окислительно-восстановительный процесс. Для второй реакции уравнение запишите в молекулярном и ионном виде.
Учащиеся, закончившие работу раньше, выполняют задание под звездочкой.
I вариант *Составьте схему электролиза раствора хлорида калия.
II вариант * Составьте схему электролиза расплава гидроксида лития
Ответы на все задания записаны на обратной стороне листа с заданиями противоположного варианта, т.е. ответы задания I варианта записаны на обратной стороне листа с заданиями II варианта и наоборот.
После выполнения задания организуется взаимооценка правильности его выполнения. Проверяющий сверяет ответ с образцом, ставит за правильный ответ «+», за ошибочный – «-».
IV Качественные реакции на катионы металлов
У учащихся на столах находятся двухсторонние карточки. На лицевой стороне карточки написано задание, на обратной – ответы задания противоположного варианта.
I вариант
| Лицевая сторона Задание Определить каждую из трех солей по катиону: CaCl2, FeSO4, AlCl3 | Обратная сторона
|
II вариант
| Лицевая сторона Задание Определить каждую из трех солей по катиону: Al2(SO4)3, NaNO3, FeCl3 | Обратная сторона
|
Отвечающий ученик объясняет ход выполнения задания, проверяющий сверяет ответ с образцом на обратной стороны своей карточки, ставит за правильный ответ «+», за ошибочный – «-». Затем ученики меняются ролями.
После этой работы проводится диктант на три варианта.
Учитель читает утверждение, учащиеся записывают его номер и ставят «+», если утверждение верно для их металла и образованных им соединений, и знак «-»,если утверждение не верно. Диктант проводится в быстром темпе и сразу фронтально проверяется (учащиеся проводят самопроверку).
Диктант
(I вариант – Na, II вариант – Al, III вариант - Fe)
1.Имеет переменную степень окисления
2. Является d-элементом
3.Гидроксид взаимодействует с кислотами
4.Бурно реагирует с водой при обычных условиях
5.В окислительно-восстановительных процессах является восстановителем
6.Степень окисления +1
7.Оксид обладает сильными амфотерными свойствами.
8.Гидроксид взаимодействует со щелочами
9.В окислительно-восстановительных процессах является окислителем
10.Образует пероксид
11.Является p-элементом
12.Соли окрашивают пламя в желтый цвет.
13.Гидроксид нерастворим в воде
14.Получают электролизом расплавов солей.
15.Вытесняет цинк из растворов его солей.
По окончании работы листы индивидуальной работы сдаются учителю и оцениваются.
После завершения работы предлагаю ученикам определить, какие задания в ходе повторения показались им более сложными и почему, на какие вопросы при подготовке к контрольной работе им следует обратить внимание.
Домашнее задание. Повторить материал глав VI, VII, VIII по плану
1)особенности строения атомов металлов, их роль в окислительно-
восстановительных процессах;
2)общие свойства металлов, качественные реакции на катионы
металлов (таблица 3 на стр. 13);
3)свойства оксидов и гидроксидов, образуемых металлами главных побочных подгрупп (на примере железа);
4) зависимость свойств металлов и образуемых ими оксидов и гидроксидов от строения атомов металлов.
Решить задачу: 3 с.133; *2,3 с.138.
