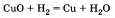Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера
| Вид материала | Закон |
- Тема №1 «Общая химия», 73.57kb.
- Материалы для подготовки к экзамену по химии, 462.84kb.
- Билеты для переводной аттестации по химии, 8 класс Билет, 100.43kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Урок повторение и обобщение по темам, 121.04kb.
- Урок тема: Металлы главных подгрупп, 62.33kb.
- Задачи урока: Обучающая: Создать условия для исследования учащимися физических и химических, 64.17kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Контрольная работа по темам: «Общие свойства металлов», 69.86kb.
- Задачи: Обучающая: Познакомить учащихся со свойствами щелочных металлов, Щелочно-земельных, 51.5kb.
18. Задача. Какой объем кислорода (н. у.) образуется при разложении бертолетовой соли (КСlO3) массой 24,5 г? Известно, что кроме кислорода образуется хлорид калия.


19. Основания, их классификация. Химические свойства щелочей: взаимодействие с оксидами неметаллов и кислотами.
Основаниями называют сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп.
По отношению к воде основания можно разделить на растворимые: NaOH; Ba(OH)2 и нерастворимые: Cu(OH)2; Fe(OH)2. Растворимые основания называются щелочами.
С точки зрения электролитической диссоциации основанием называется соединение, образующее в водном растворе из отрицательных ионов только гидроксид-ионы ОН .

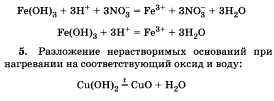
20. Понятие аллотропии. Аллотропные видоизменения кислорода.
Ответ следует начать с определения понятия аллотропии как способности химических элементов существовать в виде нескольких простых веществ (аллотропных видоизменений).
Аллотропия (от греч. allos — другой и tropos — образ, способ) связана либо с разным числом атомов в молекуле, либо со строением.
Аллотропные видоизменения есть у большинства химических элементов. Например, сера бывает ромбическая, моноклинная, пластическая; углерод существует в виде графита, алмаза, карбина, фуллере-на. Известно серое и белое олово; фосфор красный, белый и черный.
Кислород может существовать в виде двух аллотропных видоизменений: кислород О2 и озон О3.
При сравнении физических свойств кислорода и озона целесообразно вспомнить, что это газообразные вещества, различающиеся по плотности (озон в 1,5 раза тяжелее кислорода), температурам плавления и кипения. Озон лучше растворяется в воде.
Кислород в нормальных условиях — газ, без цвета и запаха, озон — газ голубого цвета с характерным резким, но приятным запахом.
Есть отличия и в химических свойствах.
Озон химически активнее кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами. Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании:
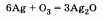
Но в то же время и озон и кислород реагируют с активными металлами, например с калием К.
Получение озона происходит по следующему уравнению:
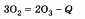
Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон — неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека.
Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона.
21. Соли угольной кислоты: карбонаты натрия, калия, кальция, их практическое значение. Распознавание карбонатов.
Карбонаты — соли угольной кислоты. Наиболее распространены в природе карбонаты кальция

да NaHCO3), кондитерском производстве (хлебопечение — разрыхлитель (NH4)2CO3), оптика (кальцит),
сельском хозяйстве (известняк, доломитовая мука для известкования кислых почв), строительстве (известняк), в быту (кальцинированная и питьевая сода) и так далее.
22. Задача. Какое количество вещества алюминия (моль) образуется при восстановлении 20,4 г оксида алюминия водородом?

23. Оксиды, их классификация и химические свойства (отношение к воде, кислотам, щелочам).
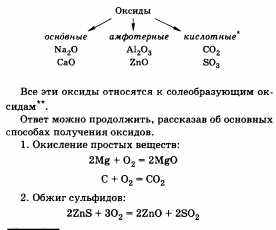
Следует обратить внимание на то, что к кислотным оксидам, помимо оксидов неметаллов, могут относиться также и оксиды металлов с валентностью больше трех (например, оксид хрома (VI)).
Примеры несолеобразующих оксидов учащийся приводит по желанию: СО, NO.
Разложение солей, кислот и нерастворимых оснований:

Аналогично основным оксидам рассматривают химические свойства кислотных оксидов и составляют соответствующие уравнения реакций, обратив внимание на взаимодействие кислотных оксидов с основными:
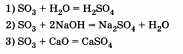
Свойства амфотерных оксидов можно (по желанию) рассмотреть на примере оксида алюминия:
1) реагирует с кислотами (как основные оксиды):
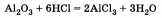
2) реагирует с основаниями (как кислотные оксиды):
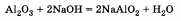
По желанию учащийся может рассказать о взаимодействии основных и амфотерных оксидов с водородом (Н2) (на примере оксида меди II):