Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера
| Вид материала | Закон |
- Тема №1 «Общая химия», 73.57kb.
- Материалы для подготовки к экзамену по химии, 462.84kb.
- Билеты для переводной аттестации по химии, 8 класс Билет, 100.43kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Урок повторение и обобщение по темам, 121.04kb.
- Урок тема: Металлы главных подгрупп, 62.33kb.
- Задачи урока: Обучающая: Создать условия для исследования учащимися физических и химических, 64.17kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Контрольная работа по темам: «Общие свойства металлов», 69.86kb.
- Задачи: Обучающая: Познакомить учащихся со свойствами щелочных металлов, Щелочно-земельных, 51.5kb.
12. Окислительно-восстановительные реакции. Окислитель и восстановитель.
Ответ можно начать с утверждения о том, что по изменению степени окисления химических элементов различают реакции окислительно-восстановительные и реакции, идущие без изменения степеней окисления (например, ионного обмена).
Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными реакциями.
Рассмотрим с точки зрения этого признака пример:
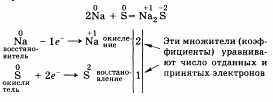
Частица (атом, ион), которая в ходе окислительно-восстановительного процесса отдает электроны, называется восстановителем. Процесс отдачи электронов — окисление. Восстановитель свою степень окисления повышает. В приведенном примере это натрий Na.
Частица, принимающая электроны, — окислитель, он восстанавливается и понижает степень окисления. В нашем случае это сера S.
Важно обратить внимание, что число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем.
В составе сложных веществ элементы могут иметь разные степени окисления. От этого зависит, окислителем или восстановителем является это вещество. Так, например, азотная кислота является окислителем. В состав азотной кислоты HNO3 входит азот, имеющий степень окисления +5, который в процессе окислительно-восстановительной реакции может только понижать свою степень окисления, принимая электроны.
Сероводород H2S — восстановитель за счет атома серы со степенью окисления -2.

13. Задача. Какая масса оксида углерода (IV) образуется при взаимодействии карбоната кальция с раствором соляной кислоты с массовой долей 8,3% и массой 100 г?

14. Реакции ионного обмена. Условия их протекания до конца. Отличие реакций ионного обмена от окислительно-восстановительных.
Ответ можно начать с положения о том, что поскольку электролиты в растворах образуют ионы, то реакции в них происходят не между молекулами, а между ионами.
Если смешать растворы двух диссоциирующих веществ, то положительно заряженные ионы (катионы) взаимодействуют с ионами, заряженными отрицательно (анионы).
Это положение следует подтвердить примерами.
1. Одно из образующихся веществ является малодиссоциирующим. Это может быть:
а) осадок
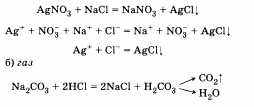
В результате реакции образуется угольная кислота, которая разлагается на газ оксид углерода (IV) и воду.

Все участвующие в реакции вещества находятся в виде ионов. Связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима.
Приведенные примеры свидетельствуют о том, что необходимыми условиями протекания реакций ионного обмена до конца являются: 1) образование осадка; 2) выделение газа; 3) образование малодиссоциирующих молекул воды.
Естественно, что в ходе ответа можно приводить другие примеры реакций ионного обмена, но при этом важно помнить об использовании таблицы «Растворимость кислот, оснований и солей в воде», из которой видно, какое вещество растворимо, а какое — нет.
Отличительной особенностью реакции ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц
15. Кислоты. Химические свойства кислот. Взаимодействие с металлами, основными оксидами, основаниями, солями (на примере серной или хлороводородной кислот).
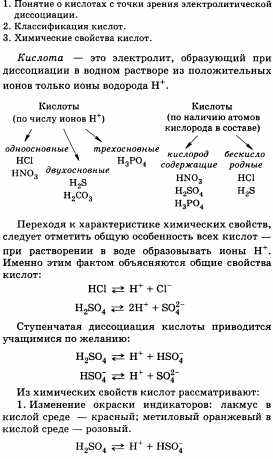

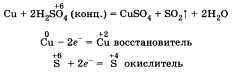
16. Задача. Вычислите массовую долю кислорода в карбонате кальция СаСО3.

17. Амфотерные гидроксиды (на примере гидроксида цинка или алюминия). Взаимодействие их с кислотами, щелочами, разложение при нагревании.
В начале ответа можно разъяснить, что такое ам-фотерность. Амфотерностъ (от греч. amphoteros — и тот и другой, оба) — способность некоторых химических элементов и их соединений (например, оксидов, гидроксидов) в зависимости от условий проявлять либо основные, либо кислотные свойства.
Известно, что свойства химических элементов одного периода периодической системы Д. И. Менделеева в связи с увеличением атомного номера изменяются: в начале периода расположены химические элементы металлы, а в конце — неметаллы.
В пределах каждого периода элементы со свойствами металлов сменяются элементами, которые проявляют свойства как металлов, так и неметаллов. Соединения этих элементов называются амфотерными, например Zn — цинк, Be — бериллий, А1 — алюминий и др. Простое вещество цинк — металл. Он образует оксид цинка ZnO и гидроксид цинка Zn(OH)2 — белое нерастворимое в воде вещество.
Как известно, характерным свойством кислот и оснований является их взаимодействие друг с другом.
Гидроксид цинка, как основание, взаимодействует с кислотой, образуя растворимую в воде соль:
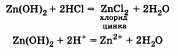
Но оказывается, что гидроксид цинка вступает во взаимодействие и со щелочью. При этом происходит следующая реакция:
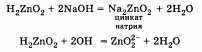
Гидроксид цинка в этой реакции проявляет свойства кислоты. Таким образом, гидроксид цинка имеет двойственные свойства, он амфотерен.
Разложение амфотерных гидроксидов при нагревании происходит так же, как и всех нерастворимых оснований:
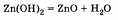
В заключение необходимо отметить, что наличие амфотерных соединений свидетельствует об отсутствии резких границ в классификации веществ (металлы — неметаллы, основания — кислоты).
