Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера
| Вид материала | Закон |
- Тема №1 «Общая химия», 73.57kb.
- Материалы для подготовки к экзамену по химии, 462.84kb.
- Билеты для переводной аттестации по химии, 8 класс Билет, 100.43kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Урок повторение и обобщение по темам, 121.04kb.
- Урок тема: Металлы главных подгрупп, 62.33kb.
- Задачи урока: Обучающая: Создать условия для исследования учащимися физических и химических, 64.17kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Контрольная работа по темам: «Общие свойства металлов», 69.86kb.
- Задачи: Обучающая: Познакомить учащихся со свойствами щелочных металлов, Щелочно-земельных, 51.5kb.
8. Простые и сложные неорганические вещества, их состав и классификация.
Ответом на этот вопрос может служить схема, в основе которой лежит классификация веществ по количественному и качественному составу.
Используя схему, необходимо кратко охарактеризовать вещества простые и сложные, состав веществ различных классов, привести примеры.

Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
Кислоты — это электролиты, при диссоциации которых из положительных ионов образуются только ионы водорода (Н+).
Основания — это электролиты, при диссоциации которых из отрицательных ионов образуются только гидроксид-ионы (ОН-).
Соли — это электролиты, при диссоциации которых образуются катионы металлов и анионы кислотного остатка.
Далее следует привести уравнения реакций, характеризующие основные свойства каждого класса соединений.
Для оксидов таким свойством является взаимодействие с водой:
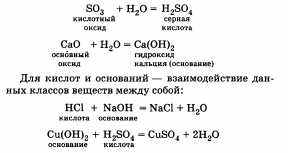
Характерным свойством солей является взаимодействие друг с другом:
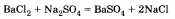
В заключение важно показать, что причинами многообразия веществ являются их: а) качественный состав; б) количественный состав.
В настоящий момент известно более 50 тыс. неорганических и несколько миллионов органических соединений, в то время как открыто лишь 114 химических элементов. Это объясняется тем, что атомы могут соединяться в разной последовательности и в разном количественном соотношении. Так, например, азот может образовывать пять оксидов: N2O; NO; N2O3; NO2, N2O5. А сера входит в состав 11 кислот.
Другая причина многообразия заключается в том, что некоторые химические элементы могут образовывать несколько простых веществ. Такое явление получило название аллотропия, а простые вещества — аллотропные видоизменения. Например, видоизменения кислорода, углерода и фосфора соответственно: кислород О2 и озон О3; графит, алмаз,
карбин, фуллерен; белый, красный, черный.
Различие в свойствах объясняется разным порядком связи атомов в молекулах и их расположением в пространстве, т. е. химическим строением.
9. Задача. Какой объем оксида углерода (IV) выделится при н. у. в результате взаимодействия соляной кислоты массой 7,3 г и карбоната натрия?


10. Взаимосвязь между классами неорганических веществ.
При ответе важно показать единство мира неорганических веществ. Для этого можно использовать схемы, отражающие связи между классами неорганических веществ, а затем записать уравнения химических реакций, подтверждающих эти связи.
Схемы могут быть, например, такими:
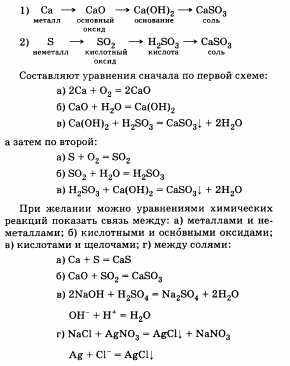
При составлении уравнений химических реакций необходимо давать названия веществам и указывать, к каким классам неорганических соединений они относятся
11. Классификация химических реакций.
тов реакции; б) выделение или поглощение теплоты; в) изменение степени окисления химических элементов; г) наличие или отсутствие катализатора; д) обратимость реакций.
а) По числу и составу исходных веществ и продуктов реакции химические реакции можно разделить на следующие типы: разложение; соединение; обмен; замещение
Разложение — это реакция, в результате которой из одного вещества получается несколько.
Разложению могут быть подвергнуты некоторые соли, кислоты, оксиды и основания (прежде всего нерастворимые):
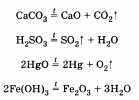
Соединение — это реакция, в результате которой из нескольких веществ получается одно. Например, сера соединяется с железом; многие кислотные и основные оксиды соединяются с водой или друг с другом:
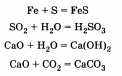
Обмен — это реакция между сложными веществами, в результате которой они обмениваются своими составными частями. Обмен наиболее характерен для ионных реакций. Например, реакция нейтрализации НСl + NaOH = NaCl + H2O; реакции между со-
лями СаСl2 + Na2CO3 = CaCO3 + 2NaCl и т. д.
Замещение — в неорганической химии к такому типу относят реакцию, в которую вступает сложное вещество и простое. В результате этой реакции образуется новое простое и сложное вещества. Например, железо замещает медь из ее хлорида Fe + CuCl2 = = Сu + FeCl2; натрий замещает водород из воды 2Na + 2Н20 = H2 + 2NaOH.
б) В зависимости от теплового эффекта реакции подразделяются на экзотермические и эндотермические.
Экзотермическими называют реакции, протекающие с выделением энергии:
2Mg + 02 = 2MgO + Q
Реакции, сопровождающиеся поглощением энергии, называют эндотермическими:
СаСО3 = СаО + СО2 - Q
Выделение или поглощение энергии может быть обозначено в уравнении реакции соответственно знаком +Q или -Q.
Реакции разложения обычно протекают с поглощением энергии, а присоединения — с выделением энергии.
в) Окислительно-восстановительными называют реакции, в результате которых некоторые элементы, входящие в состав исходных веществ и продуктов, меняют свои степени окисления. Например, окисление меди кислородом:
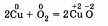
Замещение иона брома атомами хлора тоже является окислительно-восстановительной реакцией:
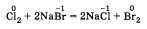
Есть реакции, идущие и без изменения степени окисления. Например, реакции ионного обмена:
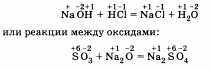
г) Каталитические и некаталитические реакции. Реакции, идущие с участием катализаторов, называются каталитическими. Не все реакции нуждаются в катализаторах, но многие без катализаторов практически идти не могут. Пример такой реакции — разложение пероксида водорода (протекает быстрее в присутствии оксида марганца (IV)):

д) Необратимые и обратимые реакции. Необратимые реакции протекают до полного превращения исходных веществ в продукты:
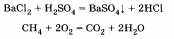
Признаками необратимости реакций в растворах является образование малодиссоциирующего вещества (осадка, газа или воды).
Обратимые реакции протекают как в сторону получения продуктов реакции, так и в сторону получения исходных веществ:
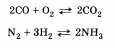
Важно отметить, что по разным признакам одна и та же реакция может быть отнесена одновременно к нескольким типам, например
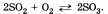 Эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым.
Эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым.