Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера
| Вид материала | Закон |
- Тема №1 «Общая химия», 73.57kb.
- Материалы для подготовки к экзамену по химии, 462.84kb.
- Билеты для переводной аттестации по химии, 8 класс Билет, 100.43kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Урок повторение и обобщение по темам, 121.04kb.
- Урок тема: Металлы главных подгрупп, 62.33kb.
- Задачи урока: Обучающая: Создать условия для исследования учащимися физических и химических, 64.17kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Контрольная работа по темам: «Общие свойства металлов», 69.86kb.
- Задачи: Обучающая: Познакомить учащихся со свойствами щелочных металлов, Щелочно-земельных, 51.5kb.
33. Вода, ее состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция, серы (IV)). Основные загрязнители природной воды, очистка природных и сточных вод.
Вода — самое распространенное в природе соединение. Молекула ее состоит из двух атомов водорода и одного атома кислорода (Н2О).
Молекула воды имеет угловую форму и образована по типу ковалентной полярной химической связи:
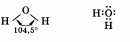
В ходе рассказа о физических свойствах воды можно подчеркнуть, что это единственное соединение, которое в природных условиях существует в трех агрегатных состояниях (твердом, жидком и газообразном).
Рассказ о химических свойствах воды целесообразно сопровождать записями уравнений реакций.
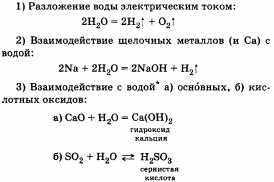
Далее следует рассказать о значении воды в природе и жизнедеятельности человека. Вода составляет 2/3 от массы человеческого организма.
Рассказ будет выглядеть более полным, если в нем удастся раскрыть важность использования воды как универсального растворителя в природе, быту, промышленности, сельском хозяйстве. Основные источники природной воды — лед, дождь, снег,
вода рек и озер. Из 10в18cт т. воды на Земле лишь 3% приходится на пресную воду, из которых 80% недоступно для использования. По теоретическим расчетам максимальное количество пресной воды, до-
Способность реагировать и с основными, и с кислотными оксидами говорит об амфотерных свойствах воды (об этом учащийся говорит по желанию). доступной для использования, составляет 40 000 км3 в год. Отсюда следует важность экономного и разумного использования запасов пресной воды, необходимость очистки загрязненных природных и сточных вод. К основным загрязнителям воды относятся: промышленные и бытовые стоки, твердые отходы, отходы сельского хозяйства (удобрения), естественные примеси, радиоактивные и тепловые загрязнители.
Очистка воды производится в промышленных масштабах на очистных сооружениях. В общем случае очистка воды включает три стадии: 1) первичная очистка проводится с целью удаления механических примесей; 2) вторичная очистка, при которой происходит разложение содержащихся органических веществ под действием микроорганизмов или хлора; 3) третичная очистка включает биологическую, химическую и физическую обработку вод. Эта стадия позволяет довести сточные и природные воды до такого уровня чистоты, что она отвечает стандартам на питьевую воду. Особое внимание в последнее время уделяется чистоте питьевой воды.
34. Аммиак, состав его молекулы, физические и химические свойства (отношение к воде, кислороду, кислотам), применение.
Ответ можно начать с того, что для неметаллов характерно существование газообразных соединений с водородом. У азота таким соединением является аммиак NH3, который состоит из атома азота и трех атомов водорода.
В молекуле аммиака три химических связи, образованных по ковалентному полярному механизму:
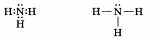
Далее можно перейти к описанию .физических свойств аммиака.
Аммиак (NH3) — газ, без цвета, с резким запахом, легче воздуха (Мг = 17), хорошо растворим в
в t°. «кип = -33,4 C°
Рассматривая химические свойства аммиака, следует остановиться на следующих группах реакций, протекающих:
1. Без изменения степени окисления.
а) Взаимодействие с водой:
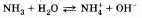
В результате растворения аммиака в воде образуются гидроксид-ионы ОН и ионы аммония NH. Раствор аммиака в воде называют аммиачной водой или гидроксидом аммония.
Следует отметить также, что раствор аммиака в воде имеет щелочную реакцию среды, что говорит об основном характере гидроксида аммония.
б) Взаимодействие с кислотами:
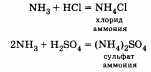
2. С изменением степеней окисления. Взаимодействие с кислородом (при этом продук ты реакции зависят от условий ее проведения):
а) Горение в кислороде:
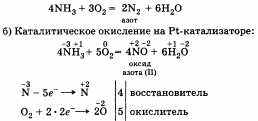
И в том и в другом случае аммиак за счет атома азота проявляет свойства восстановителя.
При описании получения и применения аммиака важно подчеркнуть, что основной способ связывания азота воздуха — это соединение его с водородом — синтез аммиака:
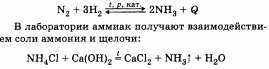
Используя аммиак, получают различные соединения, например азотные удобрения, азотную кислоту, нашатырный спирт.
35. Воздух, его состав. Основные загрязнители атмосферы и способы их устранения.
Воздух — смесь газов. Основные компоненты его — азот (78,16% по объему), кислород (20,9%) и инертные газы (0,94%). Переменные составные части воздуха — углекислый газ и водяной пар. Пыль и различные газы, например SO2, H2S, оксиды азота и др., — примеси, наличие которых в воздухе зависит от местных условий, времени года, близости промышленных предприятий и др.
Основное назначение воздуха — это обеспечение дыхания живых организмов; кроме того, воздух используется для получения азота и кислорода, благородных газов (из сжиженного воздуха), при его наличии происходит горение топлива и многие другие природные процессы.
Воздух — среда обитания всего живого на Земле, поэтому охрана воздуха — важнейшая задача человека. Первым шагом на пути к этому должно стать увеличение количества зеленых насаждений. Ведь именно растения являются основными поставщиками кислорода в атмосферу. Происходит это в процессе фотосинтеза :

Далее важно остановиться на источниках загрязнения атмосферы: химические производства, продукты сжигания топлива, выхлопные газы автомобилей, продукты сжигания бытовых отходов (полиэтиленовые пакеты, пластик, поливинилхлоридные материалы и т. д.). Основные загрязнители воздуха: пыль, оксиды азота (II), (IV), оксиды серы (IV), (VI), сероводород, оксид углерода (II). Следует отметить, что большая загазованность крупных городов отрицательно сказывается на экологической обстановке, что в свою очередь влияет на самочувствие людей, флору и фауну.
В настоящее время основные экологические проблемы атмосферы: а) образование озоновых дыр;б) парниковый эффект (выбросы СО2); в) увеличение
выбросов ионов тяжелых металлов (РЬ2+, Hg2+, Cd2+ и др.); г) выпадение кислотных дождей.
На сегодняшний день экологические бедствия приняли широкие масштабы, особенно в местах скопления крупных промышленных производств (Центр России, Урал).
Можно выделить несколько способов очистки атмосферы: установка очистных устройств на предприятиях (фильтры, улавливатели газов, дегазаторы и т. д.), создание малоотходных экологически чистых производств, а также разработка новых экологически чистых материалов.
36. Задача. Вычислите, какой объем ацетилена С2Н2 (при н. у.) образуется в результате взаимодействия с водой 100 г технического карбида кальция (СаС2), содержащего 4% примеси. Уравнение реакции процесса: СаС2 + 2Н2О = Са(ОН)2 + С2Н2.

37. Круговорот химических элементов в природе (на примере одного из элементов: углерода или кислорода). Роль живых существ в круговороте химических элементов.
Освещая вопрос о круговороте химических элементов, важно отметить, что в природе постоянно протекают различные химические реакции. Часть этих реакций проходит без участия живых существ, а часть — при их непосредственном участии, т. е. в живой природе. В результате химических процессов атомы перемещаются, движутся. Вследствие этого происходит обмен веществ и энергии между всеми оболочками Земли: литосферой, атмосферой, гидросферой, биосферой. Круговорот химических элементов является причиной постоянства протекания химических реакций. Можно сказать, что благодаря круговороту химических элементов возможна жизнь на Земле.
Круговорот веществ — это повторяющиеся процессы превращения и перемещения веществ в природе, имеющие более или менее циклический характер. Особо важную роль для жизни на Земле играют круговороты углерода и кислорода.
Далее можно рассмотреть, например, круговорот кислорода. Простое вещество кислород содержится в атмосфере, а как химический элемент он входит в состав многих природных соединений. Основная масса кислорода содержится в земной коре, где он связан с кремнием, алюминием, железом, образуя горные породы и минералы: оксиды (SiO2, A12O3,
Fe2O3); карбонаты (СаСО3, MgCO3, FeCO3); сульфаты (CaSO4, квасцы) и др.
Минералы и горные породы в процессе многовекового выветривания могут оказаться на поверхности, где получат запас энергии, исходящей от Солнца. Энергия расходуется на перестройку кристаллов горных пород, содержащих кислород, и останется там как внутренняя энергия образовавшихся кристаллических соединений. Эти породы с течением времени будут изменять свою структуру, разрушаться, растворяться, перекристаллизовываться, вступать в химические реакции и т. д., поглощая и освобождая энергию. Таким образом, кислород в земной коре играет большую роль в обмене энергии между слоями литосферы.
В природе происходит много реакций, в ходе которых кислород расходуется (дыхание, горение, медленное окисление и др.), и лишь одна реакция, в результате которой выделяется кислород. Это фотосинтез — процесс, который происходит на свету в листьях растений:

Большая часть кислорода (3/4) выделяется растениями суши, а 1/4 образуется в процессе жизнедеятельности растений Мирового океана.
Молекулярный кислород есть и в гидросфере. В природных водах всегда растворен очень большой объем кислорода.
Уравнение реакции фотосинтеза записывать не обязательно.
Круговорот кислорода связывает атмосферу с гидросферой и литосферой.
Кратко основные звенья круговорота кислорода можно обозначить так: фотосинтез (выделение О2) — окисление элементов на поверхности Земли — поступление соединений в глубинные зоны земной коры - частичное восстановление соединений в недрах Земли с образованием СО2 и Н2О - вынос СО2 и Н2О в атмосферу и гидросферу — фотосинтез.
Нетрудно заметить, что во многих процессах принимают участие углеродсодержащие соединения. Из них наиболее известными являются нефть, каменный уголь, торф, природный газ, а также карбонаты. С ними в природе также происходят химические процессы:
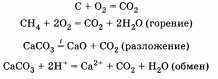
Из приведенных уравнений видно, что превращения углерода и кислорода тесно связаны между собой, что свидетельствует о единстве круговоротов различных химических элементов в природе.
Роль живых существ, в частности человека, в круговороте химических элементов все увеличивается. Например, вследствие деятельности человека увеличивается выделение многих веществ в атмосферу, гидросферу и в почву. Выделение автомобилями, ТЭЦ, заводами и фабриками в атмосферу оксида углерода (IV) и активная вырубка лесов создает опасность увеличения содержания этого оксида в атмосфере, что может привести к парниковому эффекту, изменению климата на планете.
При ответе на этот вопрос важно использовать схемы круговоротов различных элементов, имеющиеся в химическом кабинете.
38. Экологические проблемы, связанные с производством серной кислоты, и способы их решения.
В начале рассказа важно подчеркнуть, что в сернокислотном производстве перерабатывают и получают такие вещества, как сероводород H2S, оксид серы (IV) SO2, оксид серы (VI) SO3, серную кислоту H2SO4. Эти вещества, присутствуя в воздухе, вредно
отражаются на здоровье людей, губительно действуют на растения, разрушают постройки и т. п. Именно поэтому уделяется серьезное внимание проблеме охраны окружающей среды от загрязнения.
Далее в ответе можно выделить целый ряд экологических проблем, связанных с производством серной кислоты. Первая связана с обжигом серного колчедана FeS2 и других сульфидных руд. При обжиге, протекающем в «кипящем слое», получающийся оксид металла, например Fe2O3, выделяется в атмосферу*:
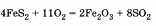
Это можно объяснить тем, что для аппаратов обжига в «кипящем слое» требуется порошок руды, подвергшийся сильному измельчению. В результате обжига образуется оксид железа или другого металла с очень маленькими частицами. С улавливанием этих частиц фильтры могут не справиться. Частицы оксида могут попасть в атмосферу при выгрузке из печи. Попадание в атмосферу измельченных оксидов железа или других металлов называют металлизацией атмосферы.
При производстве серной кислоты в атмосферу попадает много оксида серы (IV):
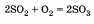
Это связано с тем, что производственные установки не всегда герметичны, а также с тем, что иногда автоматические системы управления не справляются с работой, что приводит к аварийным выбросам.
Для производства серной кислоты нередко используется сера, получаемая из сероводорода (это вещество является отходом ряда производств). Производится сера с помощью неполного окисления сероводорода Эта технологическая схема настолько несовершенна, что около 20% серы идет на образование оксида серы (IV), который выделяется в атмосферу.
В ходе производства возможны выбросы в атмосферу оксида серы (VI) и серной кислоты:
SO3 + Н2О = H2SO4
Эти выбросы считаются аварийными, но они возможны и, к сожалению, случаются нередко.
Один из способов разрешения экологических проблем — использование технологических схем, сводящих к минимуму загрязнение атмосферы:
1) непрерывность процесса;
2) циркуляционные процессы (непрореагировавшие вещества возвращаются в сферу реакции);
3) принцип противотока (увеличивается площадь поверхности реагирующих веществ и скорость реакции);
4) комплексное использование сырья, безотходная технология;
5) выбор оптимального сырья и режима его переработки.
Так, например, в мире около 80% серной кислоты производится из серы, а не из пирита FeS2. Это позволяет избежать металлизации атмосферы.
Еще один важный путь — это совершенствование технологического оборудования, в частности различных фильтров и поглотителей. Большое значение имеет профилактический ремонт оборудования, а также установка современных автоматических систем управления производством.
39. Получение металлов из оксидов с помощью восстановителей: водорода, алюминия, оксида углерода (II). Роль металлов и сплавов в современной технике.
В начале ответа целесообразно объяснить, почему металлы часто получают из оксидов. Это связано с тем, что многие металлы распространены в природе в виде оксидов, а также из-за того, что металлы в оксидах проявляют свойства окислителей.
Далее при иллюстрации способов восстановления металлов обращают внимание на составление уравнений химических реакций (по желанию можно указывать переход электронов у окислителя и восстановителя):
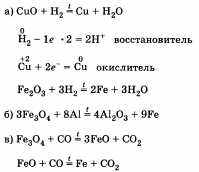
Необходимо отметить также, что восстановление водородом используется в основном в лабораториях, реже в промышленности. Это объясняется важностью водорода как сырья для производства аммиака и его относительной дороговизной. Оксид углерода (II) более доступен как один из продуктов при производстве стали. Восстановление алюминием — дорогостоящий процесс, однако с его помощью получают многие цветные металлы высокой степени чистоты. Восстановление металлов из оксидов с помощью алюминия называют алюминотермией.
Касаясь вопроса о роли металлов и сплавов, отмечают, что металлы, благодаря своим свойствам (твердость, механическая прочность, тепло- и электрическая проводимость, пластичность, магнитные свойства и др.), находят широкое применение во всех областях промышленности и в быту. Железо, хоть и является основным металлом современной техники, сдает некоторые свои позиции алюминию и титану. Ядерная энергетика широко использует уран, торий и цирконий. В электротехнике незаменимы медь, вольфрам, молибден. Редкоземельные металлы (№ 58—71) используют в различных отраслях техники: в радиоэлектронике, приборостроении, атомной технике, машиностроении, в стекольной промышленности (оксиды La, Ce, Nd, Pr), в химической промышленности (производство пигментов, лаков, красок; использование в качестве катализаторов и др.), фото- и киноматериалы содержат серебро.
Однако более широкое применение находят сплавы (системы, состоящие из двух и более металлов, а также металлов и неметаллов).
Свойства сплавов отличаются от свойств каждого из металлов, из которых они получены. Например, чистый алюминий — мягкий, ковкий металл. Сплавы алюминия с медью, магнием и марганцем отличаются прочностью и твердостью. Они называются дуралюминами и идут на изготовление корпусов самолетов, речных и морских судов.
Для паяния применяют сплав олова и свинца. Температура плавления этого сплава (припоя) ниже, чем температура плавления олова и свинца, отдельно взятых.
Сплав меди и никеля — мельхиор, блестящий и довольно прочный. По сравнению с медью и никелем обладает высокой химической стойкостью, широко используется для изготовления ювелирных украшений, столовых приборов.
Свойство сплавов можно регулировать, изменяя их состав. Они позволяют увеличить число материалов, обладающих более ценными свойствами, чем чистые металлы.
Сплавы известны человеку с глубокой древности. Уже тогда было замечено, что при сплавлении разных металлов получают соединения, отличающиеся свойствами от исходных веществ. Так, медь и олово образуют бронзу (90% Си, 10% Sn), твердость которой значительно выше, чем твердость просто меди и олова.
В технике используют более 5000 сплавов, но самое большое значение имеют сплавы на основе железа и алюминия. Железо и его сплавы (чугун, сталь, ферросплавы) называют черными металлами, остальные же металлы и их сплавы — цветными.
40. Задача. Определите количество вещества осадка гидроксида меди (II), образующегося при взаимодействии хлорида меди (II) и 10 г раствора гидроксида натрия, с массовой долей 8%.

