Урок тема: Металлы главных подгрупп
| Вид материала | Урок |
СодержаниеВоспитательные задачи Развивающие задачи Ход урока Отчеты групп |
- Урок повторение и обобщение по темам, 121.04kb.
- Контрольная работа по темам: «Общие свойства металлов», 69.86kb.
- Пояснительная записка к преподаванию элективного курса «Металлы главных и побочных, 103.12kb.
- Задачи: Обучающая: Познакомить учащихся со свойствами щелочных металлов, Щелочно-земельных, 51.5kb.
- Задачи урока: Обучающая: Создать условия для исследования учащимися физических и химических, 64.17kb.
- Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых, 461.43kb.
- Тема №1 «Общая химия», 73.57kb.
- Элективный курс по химии для 11 класса профильного уровня. Тема: «Химия металлов побочных, 91.51kb.
- Урок химии в 9 классе Тема: История в металлах, металлы в истории, 101.92kb.
- Лекции Лаборатории, 94.16kb.
УРОК 1. Тема: Металлы главных подгрупп I и II групп
Периодической системы химических элементов Д.И.Менделеева
Образовательные задачи: создать условия для совершенствования умения давать общую характеристику элементов подгруппы на основании их положения в Периодической системе химических элементов Д.И.Менделеева и строения их атомов; обеспечить применение учащимися знаний об общих физических и химических свойствах металлов, умений записывать уравнения реакций, иллюстрирующих эти свойства на примере металлов главных подгрупп I и II групп.
Воспитательные задачи: обеспечить формирование положительного отношения к ценности Творчество: воспитывать самостоятельность, активность, инициативность через организацию самостоятельной поисковой деятельности уч-ся на уроке. Продолжить работу по формированию мировоззрения уч-ся, раскрывая сущность причинно-следственной связи – строение-свойства.
Развивающие задачи: создать условия для отработки умения структурировать информацию, содействовать развитию основных приемов мышления: конкретизации и обобщения, анализа, сравнения, установления причинно-следственных связей, умения делать выводы.
ХОД УРОКА
Так как учащиеся уже изучили общую характеристику металлов, им дается задание для самостоятельной работы.
Задание: составить план характеристики изучаемых металлов.
Задание выполняется в группах по 4 человека.
Проверка: одна группа представляет свой план, остальные группы добавляют, корректируют.
После обсуждения принимается следующий план.
План
- Характеристика элементов группы по положению в периодической системе химических элементов и по строению атома:
а) положение в периодической системе химических элементов;
б) особенности строения атомов;
в) изменение восстановительных свойств в группе.
2. Важнейшие формы соединений элементов данной подгруппы.
3. Физические свойства металлов.
4. Химические свойства металлов.
5. Нахождение в природе. Получение.
6. Применение.
По данному плану организуется самостоятельная работа учащихся в группах.
Задание: подготовить отчет по пунктам плана:
1 группа – вопросы 1, 3 (главная подгруппа I группы);
2 группа - вопросы 1, 3 (главная подгруппа II группы);
3группа - вопрос 4 (главная подгруппа I группы);
4 группа – вопрос 4 (главная подгруппа II группы);
5группа - вопросы 2, 5, 6 (главная подгруппа I группы);
6 группа – вопросы 2, 5, 6 (главная подгруппа II группы).
Группы, работающие по вопросу 4, должны представить отчет в виде схемы. Все группы при отчете должны кратко и четко сформулировать основные выводы.
Учащиеся работают самостоятельно в группах. Используют учебник (§ 47).
Учитель направляет и корректирует работу групп, чтобы выводы были четкими и краткими.
Отчеты групп
1 группа
1. Щелочные металлы находятся в I группе главной подгруппе и образуют простые вещества – щелочные металлы.
2. Атомы щелочных металлов в наружном электронном слое имеют по одному электрону.
3. Для завершения наружного электронного слоя атомы щелочных металлов отдают один ê и проявляют восстановительные свойства.
4. Все щелочные металлы в соединениях проявляют степень окисления +1.
5. Атомы щелочных металлов отличаются друг от друга зарядом ядер; общим числом ê, расположенных вокруг ядра, размером радиусов, химической активностью.
6. Восстановительная способность атомов щелочных металлов в группе сверху вниз возрастает, так как увеличивается атомный радиус и способность к отдаче наружного ê возрастает.
7. Перечисляют основные физические свойства щелочных металлов.
2 группа
1. Щелочно-земельные металлы находятся во II группе главной подгруппе и образуют простые вещества – щелочно-земельные металлы.
2. Атомы щелочно-земельных металлов в наружном электронном слое имеют по два электрона.
3. Для завершения наружного электронного слоя атомы щелочно-земельных металлов отдают два ê и проявляют восстановительные свойства.
4. Все щелочно-земельные металлы в соединениях проявляют степень окисления +2.
5. Атомы щелочно-земельных металлов отличаются друг от друга зарядом ядер; общим числом ê, расположенных вокруг ядра, размером радиусов, химической активностью.
6. Восстановительная способность атомов щелочно-земельных металлов в группе сверху вниз возрастает, так как увеличивается атомный радиус и способность к отдаче наружных ê возрастает.
7. Перечисляют основные физические свойства щелочно-земельных металлов.
3, 4 группы
П
 редставляют отчет в виде схемы: + кислород
редставляют отчет в виде схемы: + кислород Оксиды, пероксиды;
Оксиды, пероксиды;Щ


 ел.(щ-з.) Химические Отношение + хлор
ел.(щ-з.) Химические Отношение + хлорметаллы свойства, к простым в-вам Хлориды;
присущие Ме + сера
 Сульфиды;
Сульфиды; + водород
+ водородОтношение Гидриды;
 к сложным + вода
к сложным + вода
 веществам Щелочь водород;
веществам Щелочь водород;
Особые хим.
свойства
Качеств. р-ция характерное окрашивание пламени
+ кислота
 Соль + водород.
Соль + водород.Учащиеся 3 группы демонстрируют лабораторный опыт, иллюстрирующий качественную реакцию на ионы натрия и калия, 4 группы – на ионы кальция.
5 группа
| Соединения | |||
| Оксид, его характер | Гидроксид, его характер | Соли | |
| Средние | Кислые | ||
| R 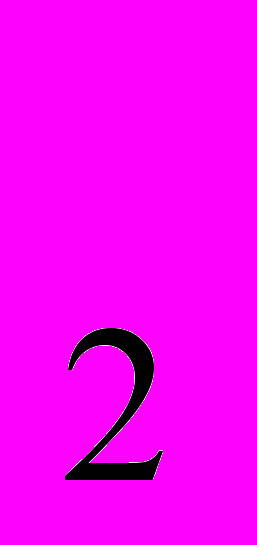 O, характер основный. O, характер основный. | ROH (щелочи) характер основный. | RCl, R 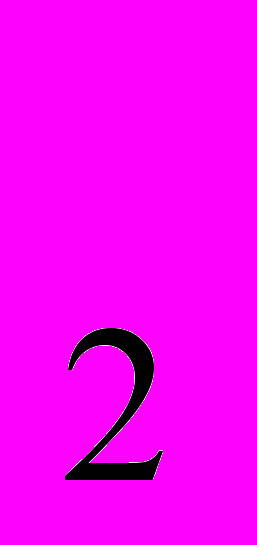 SO SO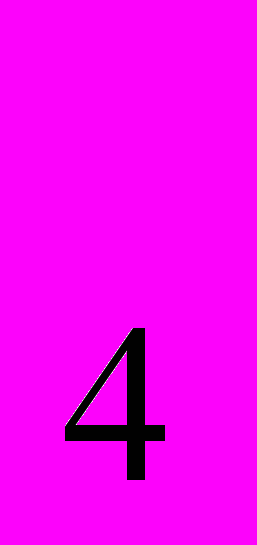 , R , R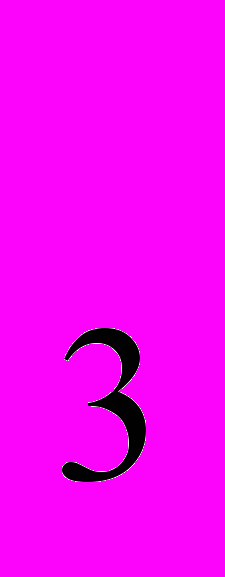 PO PO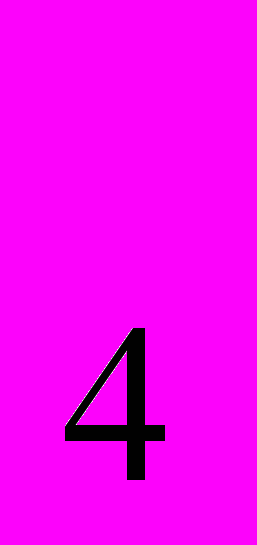 | RHSO4, RH2PO4, R2HPO4 |
2) Перечисляют основные природные соединения щелочных металлов (демонстрируют коллекцию). Подчеркивают, что благодаря высокой активности, щелочные металлы в свободном виде в природе не встречаются.
3) Указывают электролиз расплавов солей и щелочей, как основной способ получения щелочных металлов.
6 группа
| Соединения | |||
| Оксид, его характер | Гидроксид, его характер | Соли | |
| Средние | Кислые | ||
| RO, характер основный. | R(OH)2 характер основный. | RCl2, RSO 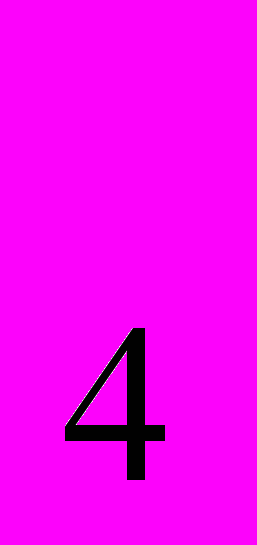 , R , R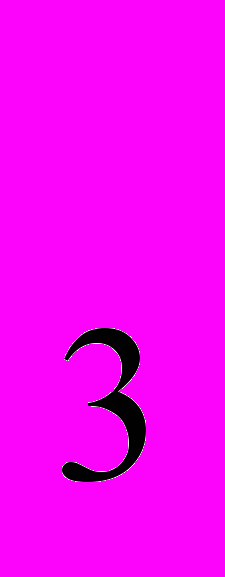 (PO (PO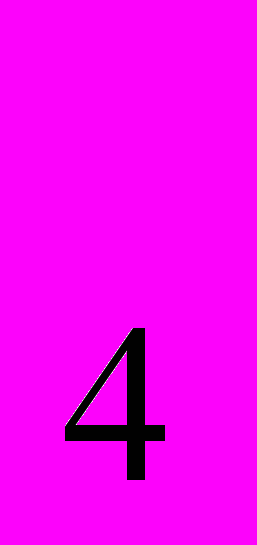 )2 )2 | RCl2, R(HSO 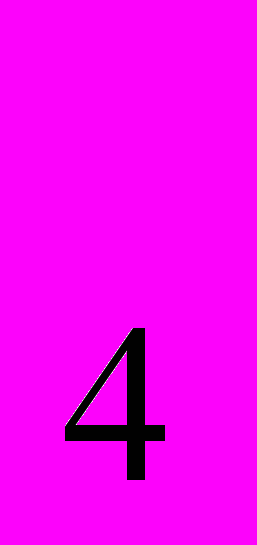 )2, )2, R ( H2PO4)2, R HPO4 |
2) Перечисляют основные природные соединения щелочно-земельных металлов (демонстрируют коллекцию). Подчеркивают, что благодаря высокой активности, щелочно-земельные металлы в свободном виде в природе не встречаются.
3) Указывают электролиз расплавов солей, как основной способ получения кальция.
Для проверки усвоения материала, обсуждаем вопрос, выполняем упражнение.
- Почему все щелочные и щелочно-земельные металлы являются сильными восстановителями?
- В каких группах все три вещества могут реагировать:
-
I вариант – с натрием
а) Cl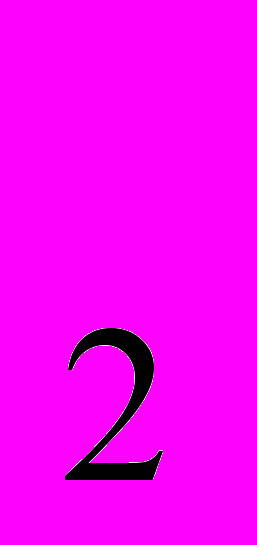 , KCl, H
, KCl, H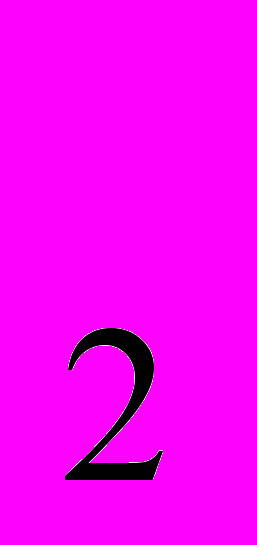 SO
SO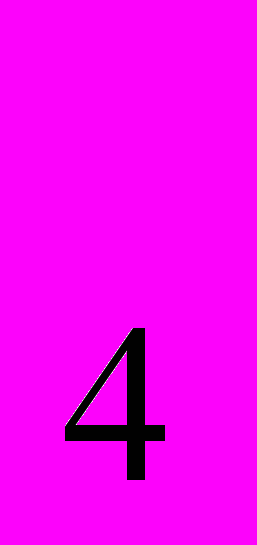
б) S, H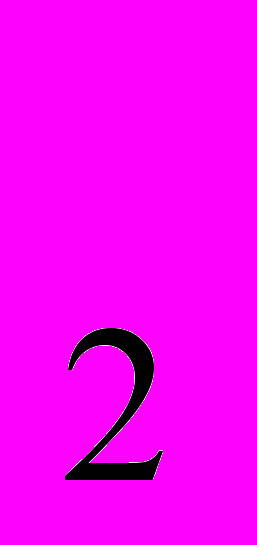 O, HCl
O, HCl
в) H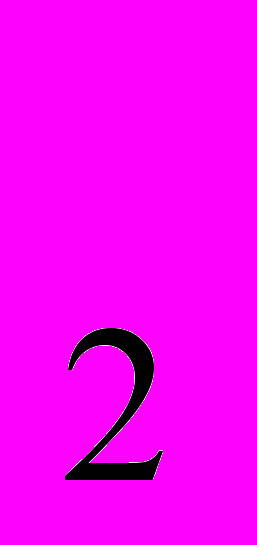 SO
SO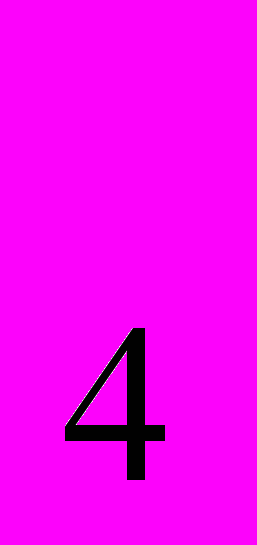 , H
, H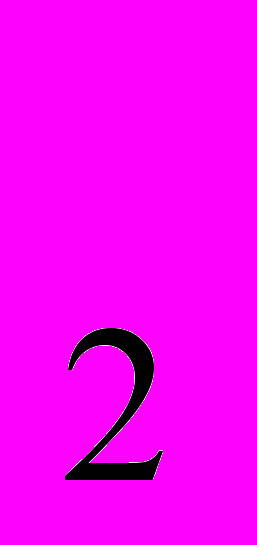 , O
, O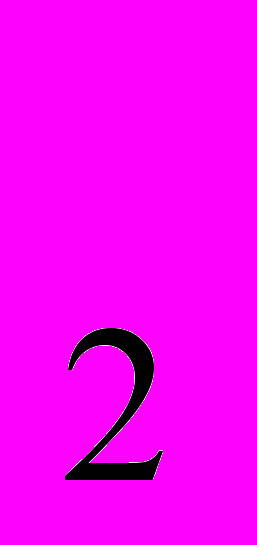
II вариант – с кальцием
а) H3PO4, N2, H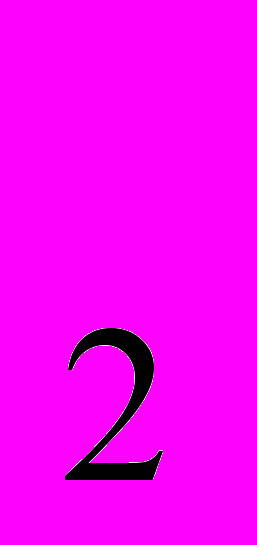 O
O
б) O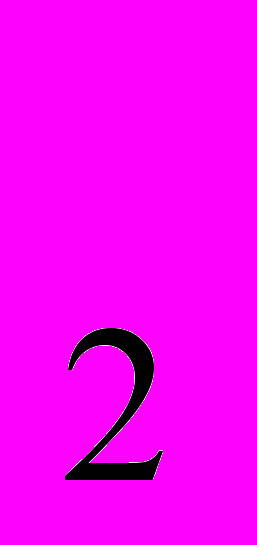 , H
, H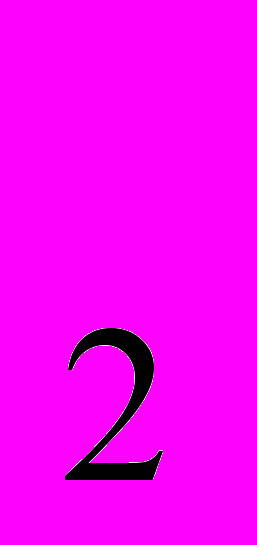 O, H
O, H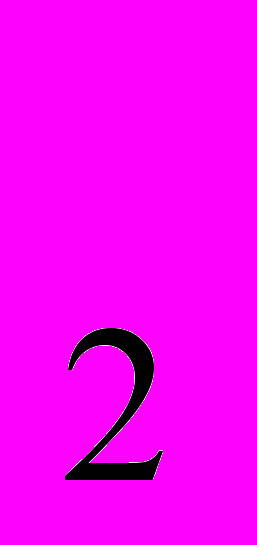
в) SO2, Cl2, HCl
Домашнее задание § 47.
I уровень Записать уравнения химических реакций по схеме, показать переход электронов.
Задача 4 с. 120.
II уровень * упражнение 12 с. 126,
задача 1 с. 126.
Учащиеся сами выбирают домашнее задание соответствующего уровня.
