Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера
| Вид материала | Закон |
- Тема №1 «Общая химия», 73.57kb.
- Материалы для подготовки к экзамену по химии, 462.84kb.
- Билеты для переводной аттестации по химии, 8 класс Билет, 100.43kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Урок повторение и обобщение по темам, 121.04kb.
- Урок тема: Металлы главных подгрупп, 62.33kb.
- Задачи урока: Обучающая: Создать условия для исследования учащимися физических и химических, 64.17kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Контрольная работа по темам: «Общие свойства металлов», 69.86kb.
- Задачи: Обучающая: Познакомить учащихся со свойствами щелочных металлов, Щелочно-земельных, 51.5kb.
30. Железо, его положение в периодической системе химических элементов Д. И. Менделеева, взаимодействие с серой, хлороводородной кислотой, растворами солей.
В периодической таблице гимических элементов Д. И. Менделеева железо Fe расположено в 4-м периоде VIII группы побочной подгруппы.
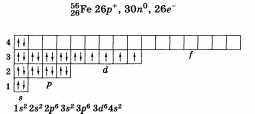
Распределение электронов по электронным слоям в атоме железа выглядит так:
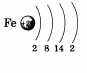
По желанию учащийся может привести состав, графическую схему и электронную формулу железа:

Физические свойства железа известны из повседневной жизни: металл, темно-серого цвета, пластичный, электро- и теплопроводный, тяжелый, притягивается магнитом.
Далее целесообразно отметить, что железо — после алюминия — самый распространенный в природе металл (общее содержание в земной коре — 4,65% по массе). Известно большое число минералов, в состав которых входит железо: магнетит (магнитный железняк) — Fe3O4, гематит (красный железняк) — Fe2O3, железный шпат (сидерит) — FeCO3, железный колчедан — FeS2 и др.
Железо проявляет химические свойства, характерные для всех металлов. Оно взаимодействует:
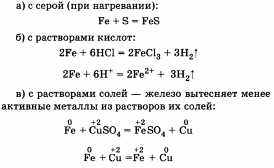
Получают железо восстановлением (водородом, оксидом углерода (II), алюминием) его из оксидов, а также при прохождении электрического тока через растворы солей. Можно привести примеры таких реакций:
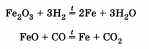
При ответе следует обратить внимание, что основное применение находят сплавы железа с углеродом — чугун и сталь. Друг от друга они отличаются различным содержанием углерода: в чугуне его более 2%, а в стали 0,5—1,5%. Кроме того, для придания особых свойств могут вводиться и другие элементы (Si, Mn, Cr, Ni).
31. Водород, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома и молекулы, физические и химические свойства, получение, применение.
Характеризуя водород по положению в периодической системе химических элементов Д. И. Менделеева, следует обратить внимание на особенности строения атома водорода — самого простейшего из химических элементов (состоит из ядра, представляющего собой один протон, и одного электрона). Такое строение обусловливает разнообразие свойств водорода, его двойственное положение в системе Д. И. Менделеева — в I и VII группах (об этом можно рассказать по желанию)*.
Наиболее распространенная степень окисления водорода +1. Водороду свойственна валентность, равная единице.
Молекула водорода двухатомная, связь ковалентная неполярная. Схема образования молекулы водорода:
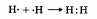
Водород — газ без цвета и запаха, плохо растворим в воде, в 14,5 раз легче воздуха.
л Так же как и у щелочных металлов (Li, Na, К и др.), у Н на внешнем электронном слое один электрон, с другой стороны, так же как и элементам VII группы, водороду не хватает одного электрона до его завершения.
Водород — самый распространенный элемент во Вселенной. На Земле водород содержится в воде, природном газе, нефти.
Получение водорода следует выразить уравнениями химических реакций. Например, в лаборатории водород получают при взаимодействии металлов с растворами кислот, например соляной:
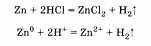
В промышленности водород получают из водяного пара при взаимодействии его с коксом, который в основном состоит из углерода, из природного газа метана СН4 и др.
При характеристике химических свойств водорода необходимо записать уравнения соответствующих реакций.
Водород может быть как восстановителем, так и окислителем:
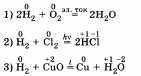
В этих реакциях водород проявляет свойства восстановителя, его атомы повышают степень окисления до 4-1.
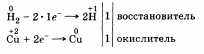
По желанию учащийся может рассказать об окислительных свойствах водорода, которые он проявляет, например, при взаимодействии с металлами:
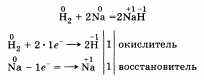
Говоря о применении водорода, стоит рассказать о его использовании в синтезе НСl и NH3, а также резке, сварке и получении металлов, в переработке нефти и жиров.
32. Задача. Какой объем кислорода и воздуха (н. у.) потребуется для сжигания 448 л метана СН4?


