Учебный план 2 иностранный язык 3 отечественная история 17
| Вид материала | Руководство |
- Учебный план общие дисциплины 1 Иностранный язык, 56.41kb.
- Учебный план общие дисциплины 1 Иностранный язык, 95.61kb.
- Программа аттестационных испытаний Филологический факультет Бакалавриат по направлению, 653.74kb.
- Учебно-методический комплекс дпп. Ф. 03 Старославянский язык Специальность 050301 Русский, 623.41kb.
- Методические рекомендации учителям-предметникам на 2009/2010 учебный год часть, 1491.73kb.
- Рабочий учебный план озо и фт и ппо специальность «Профессиональное обучение (экономика, 1909.51kb.
- Учебная программа для специальности (050303) "Иностранный язык " с дополнительной специальностью, 133.93kb.
- Учебно-методический комплекс по дисциплине «Латинский язык и античная культура» для, 152.82kb.
- Программа аттестационных испытаний Исторический факультет Бакалавриат по направлению, 892.46kb.
- Странному языку способствует не только более прочному и свободному практическому владению, 206.03kb.
Вопросы к экзамену
- Теория химического строения органических соединений Бутлерова А.М.: основные положения, значение для органической химии.
- Теория электронных смещений: мезомерный и индуктивный эффекты.
- Понятие гибридизации. Три валентных состояния атома углерода. Примеры соединений с различными типами гибридизации.
- Классификация органических реакций.
- Гомологический ряд предельных углеводородов. Номенклатура, изомерия, способы получения алканов.
- Химические свойства алканов (механизм Sr).
- Этилен: электронное строение молекулы, способы получения, применение.
- Алкены: общая формула, номенклатура, изомерия, химические свойства (механизм Ае). Правило Марковникова.
- Алкины: общая формула, номенклатура, изомерия, способы получения.
- Электронное строение молекулы ацетилена. Химические свойства ряда ацетиленовых углеводородов. Реакция Кучерова.
- Диеновые Углеводороды: общая формула, номенклатура, изомерия, химические свойства.
- Электронное строение молекулы бутадиена. Способы получения бутадиена, применение. Виды каучуков.
- Ароматические углеводороды. Правило ароматичности Хюккеля. Изомерия, номенклатура. Способы получения бензола и его гомологов.
- Правило ориентации. Ориентанты 1 и 2 рода.
- Химические свойства углеводородов ряда бензола.
- Сравнительная характеристика алкенов и алкинов.
- Этанол: электронное строение молекулы, способы получения, химические свойства.
- Одноатомные спирты: общая формула, номенклатура, изомерия, химические свойства.
- Важнейшие представители многоатомных спиртов: их способы получения, химические свойства.
- Строение карбонильной группы. Изомерия и номенклатура карбонильных соединений. Способы получения.
- Химические свойства альдегидов и кетонов.
- Монокарбоновые кислоты: важнейшие представители, изомерия, номенклатура, способы получения.
- Дикарбоновые насыщенные кислоты: важнейшие представители, изомерия, номенклатура, способы получения, химические свойства.
- Электронное строение карбоксильной группы. Химические свойства карбоновых кислот.
- Оксикислоты: общая формула, важнейшие представители, номенклатура, способы получения, особые свойства.
- Оксокислоты: общая формула, важнейшие представители, номенклатура, способы получения, химические свойства.
- Аминокислоты: изомерия, номенклатура, способы получения, химические свойства. Полипептиды.
- Моносахариды: классификация, важнейшие представители. Изомерия: оптическая, таутомерия. Способы получения.
- Химические свойства моносахаридов, их биологическое значение.
- Восстанавливающие дисахариды: важнейшие представители, типы связей, мутаротация, химические свойства.
- Невосстанавливающие дисахариды: важнейшие представители, типы связей, химические свойства.
- Полисахариды: общая формула, важнейшие представители, типы связей, химические свойства, применение.
- Фенолы: классификация, способы получения, химические свойства в сравнении со спиртами.
- Гетероциклические соединения: важнейшие представители, электронное строение, химические свойства.
Контрольная работа
1. Теоретические основы органической химии
1. В каких случаях ковалентная связь становится полярной? Какие из следующих соединений имеют полярные ковалентные связи: СН4, СН3 – ОН, СН3 – СН3, СН3Сl, СН3 – СN, CH3 – Na, CO2? Что такое электроотрицательность атомов?
2. Укажите, какие разновидности ковалентной связи имеются в следующих соединениях: СН3 –СН3, С2Н5 – Сl, NH4Cl, CH3 - NO2, CH3 – OH, HNO3, NO.
3. Приведите формулы, выражающие электронную конфигурацию атома углерода: 1) в возбужденном состоянии, 2) в основном состоянии, 3) карбокатиона (С+ ), 4) карбаниона (С-). Объясните, почему углерод не образует химические связи по донорно-акцепторному механизму.
4. Приведите графическую схему sp3-, sp2-, sp-гибридных орбиталей атома углерода с учетом их пространственного строения. Какие простые вещества соответствуют каждому валентному состоянию атома углерода?
5. Пользуясь представлениями о граничных поверхностях атомных орбиталей, нарисуйте схемы молекул метана, этана, пропана, изобутана.
6. Нарисуйте схемы молекул этилена и пропилена с обозначением направления осей - связей и значений валентных углов. Какие виды - связей имеются в молекуле пропилена? Дайте определение -связи.
7. Какие частицы могут образовываться при гомолитическом и гетеролитическом типах распада ковалентной связи в молекуле этана, пропана? Приведите все возможные варианты, назовите все частицы.
8. Укажите, в каких из приведенных ниже соединений заместители проявляют +I- и в каких –I-эффект: 1) СН3- СН2 – СНСl – СООН, 2) СН3 – СНСl – СН2 – СООН, 3) (СН3)2 – СН- СООН,
4) СН3 – СООН, 5) О2NСН2 – СООН, 6) НСООН, 7) СN – СН2 – СООН.
9. Укажите названия важнейших нефтепродуктов и перечислите области их применения.
10. Составьте уравнения реакций, которые могут происходить с углеводородом додеканом С12Н26 при крекинге нефти.
11. Каковы физические свойства и состав нефти? Какие материалы синтезируют на основе продуктов переработки нефти?
12.Чем отличается крекинг-процесс от фракционной перегонки нефти? Составьте уравнения реакций, которые могут происходить с нормальным гептаном при каталитическом крекинге нефти.
13. Составьте уравнения реакций получения из природного газа сажи, водорода, этилена, ацетилена.
14. Перечислите виды изомерии. Назовите вид изомерии для следующих пар изомерных соединений: а) первичный бутиловый и вторичный бутиловый спирты; б) диметилэтилметан и тетраметилметан; в) , Д – глюкоза и , Д - глюкоза. Приведите структурные формулы перечисленных соединений.
15. Перечислите виды структурной изомерии. Назовите вид изомерии для каждой из следующих пар изомерных соединений: а) бутаналь и 2-метилпропаналь, б) 1-бромпентан и 2-бромпентан, в) карбонильная и циклическая формы глюкозы. Приведите структурные формулы перечисленных соединений.
16. Напишите структурные формулы всех возможных изомеров ароматических углеводородов с общей формулой С9Н12. Назовите их.
17. Напишите графические формулы всех изомерных алкенов с формулой С6Н12. Назовите их. Укажите, для каких соединений возможна геометрическая изомерия.
18. Сколько пространственных изомеров соответствует 2,3-дихлорбутандиовой кислоте? Напишите проекционные формулы этих кислот. Какие из них отвечают оптические активным изомерам?
19. Укажите число возможных оптически деятельных изомеров для каждого из следующих соединений и составьте проекционные формулы этих изомеров: а) 2-бромпропанол-1, б) 1,2,3,- триоксибутан, в) 2-метилбутанол-3. Какие из этих изомеров будут оптическими антиподами и какие – диастереомерами?
20. Напишите графические формулы ациклических углеводородов, изомерных бензолу. Назовите их.
2. Углеводороды
1. Какое соединение получится, если на 1,2-дибромпентан подействовать цинком при нагревании, полученное соединение обработать бромоводородом, а затем металлическим натрием? Назовите полученное вещество по систематической номенклатуре. Какими свойствами оно обладает?
2. Напишите уравнения реакций взаимодействия метилацетилена с: а) водородом в присутствии катализатора, б) бромом, в) бромоводородом, г) металлическим натрием, д) гидроксидом диаминсеребра. Назовите полученные соединения. Объясните механизм третьей реакции.
3. Напишите уравнения реакций сульфирования: а) толуола, б) нитротолуола, в) сульфобензола. Объясните правила ориентации. Приведите механизм первой реакции.
4. Рассмотрите механизм фотохимического хлорирования изобутана. Объясните относительную реакционную способность первичной, вторичной и третичной С –Н –связи в реакции галоидирования.
5. Как пойдет реакция присоединения бромоводорода к 1-бутену и 3,3,3 – трихлорпропену по электрофильному механизму и в присутствии пероксидов? В каких случаях справедливо правило Марковникова?
6. Приведите схемы синтеза из ацетилена следующих соединений, используя любые органические и неорганические реагенты: этилена, этана, хлорэтана, этаналя, пропина, гексина-3.
7. Исходным сырьем для получения хлоропренового каучука является ацетилен:
ацетилен винилацетилен хлоропрен полимер хлоропрена
Напишите уравнения реакций хлоропренового каучука. Чем отличается каучук от резины?
8. Образование каких мононитросоединений можно ожидать при нитровании: а) м-крезола, б) п-дихлорбензола? Объясните правила ориентации и механизм первой реакции.
9. Взяв в качестве исходного вещества бутен-2, последовательно подействуйте на него концентрированной серной кислотой, водой (при нагревании), оксидом алюминия (при нагревании), бромоводородом, водным раствором гидроксида натрия. Покажите распределение электронной плотности в соединениях, имеющих -связь.
10. Образец индивидуального газообразного вещества может быть этаном, этиленом, ацетиленом. Каким образом качественно можно установить природу этого газа? Охарактеризуйте углерод-углеродные связи в этом ряду.
11. Этилбензол является одним из исходных продуктов для получения стирола, широко используемого для получения синтетического каучука и пластических масс. Напишите схемы реакций синтеза этилбензола из ацетилена, этанола и неорганических веществ. Напишите уравнение реакции полимеризации стирола в полистирол.
12. Напишите уравнения реакций нитрования по Коновалову следующих углеводородов: 1) пропана, 2) изобутана, 3) 3-метилпентана. Рассмотрите механизм реакции.
13. Получите 3-метилпентен-2 из соответствующего дигалогенпроизводного и приведите уравнения реакций взаимодействия его с а) бромоводородом, б) озоном, в) разбавленным раствором перманганата калия на холоде, г) концентрированным раствором перманганата калия в кислой среде. Приведите механизм первой реакции.
14. Если подействовать водой в условиях реакции Кучерова на следующие углеводороды: а) метилацетилен, б) этилацетилен, в) изопропилацетилен, - то образуются соответствующие кетоны. Объясните механизм реакции. В чем заключается правило Эльтекова?
15. Как, используя реакцию Вюрца-Фиттига, можно получить изобутилбензол, исходя: а) из хлорбензола, б) из бензилхлорида? Напишите уравнения реакций. Какие побочные продукты при этом образуются?
16. Какие три способа можно использовать для получения гексана? Напишите соответствующие уравнения реакций.
17. Какие спирты можно получить из следующих этиленовых углеводородов в результате гидратации их в присутствии серной кислоты: а) пропилена, б) бутена-1, в) 2-метилбутена-1, г) 2-метилбутена-2. Составьте схемы превращений. Рассмотрите механизм реакции 2.
18. Волокно нитрон больше всех других синтетических волокон приближается по свойствам к натуральной шерсти. Материал для него получают полимеризацией акрилонитрила, который синтезируют из ацетилена и синильной кислоты. Охарактеризуйте виды связей в молекуле этого соединения. Напишите уравнение реакции получения акрилонитрила и схему его полимеризации.
19. Напишите уравнения реакций, отраженные схемой:

20. Какие вещества образуются при действии на бензол: 1) бромной воды, 2) хлора (на солнечном свету), 3) хлороводорода, 4) брома (в присутствии FeBr3)? Во всех ли случаях пойдет реакция? Напишите уравнения реакций, назовите полученные вещества и рассмотрите механизмы 2 и 4 реакций.
3. Галогенпроизводные углеводородов
1. Напишите уравнения реакций получения моноиодпроизводных, исходя из следующих непредельных углеводородов: бутена-2, 2-метилпентена-3, пропилена. Поясните механизм реакции присоединения галогеноводорода к непредельным соединениям с точки зрения электронной теории с учетом статического и динамического факторов.
2. Напишите уравнения взаимодействия иодэтана со следующими веществами: цианидом калия, аммиаком, ацетатом натрия, натрием, гидросульфидом натрия, магнием (в присутствии эфира), нитритом серебра.
3. Как, имея изобутилиодид и необходимые неорганические реагенты, получить: а) изобутан, б) 2,5-диметилгексан?
4. Определите строение вещества состава С4Н9I, если известно, что при действии на него спиртового раствора щелочи получается углеводород, имеющий эмпирическую формулу С4Н8. Этот углеводород при озонировании и последующем разложении озонида водой образует только одно вещество. Напишите соответствующие уравнения реакций.
5. Напишите уравнения реакций трет-бутилбромида со следующими реагентами: а) гидроксидом натрия (водный раствор), б) гидроксидом серебра, в) метиламином, г) нитритом серебра. Рассмотрите механизм 1 реакции.
6. С помощью каких реагентов и в каких условиях можно осуществить превращения:
бензол толуол п-бромтолуол п-толилмагнийбромид п-толуиловая кислота терефталевая (п-фенилендикарбоновая кислота)?
7. Предложите схему синтеза п-нитроанизола (п-нитрометоксибензола) из хлорбензола. Каковы механизмы реакций и в каких условиях они проходят?
8. Напишите уравнения реакций между: 1) бромбензолом и цианидом калия, 2) бромбензолом и гидроксидом натрия, 3) о-хлортолуолом и амидом натрия (в аммиаке), 4) иодбензолом и ацетатом натрия, 5) п-иодтолуолом и фенолятом натрия, 6) п-хлорэтилбензолом и аммиаком. В каких условиях и по какому механизму идут эти реакции?
9. Составьте уравнения реакций, протекающих при нагревании 2,4-динитрохлорбензола: 1) с водным раствором карбоната натрия, 2) с метанолом, 3) с метиламином. Назовите продукты реакций и рассмотрите их механизм (SN2аром.).
10. Напишите уравнения реакций бензилхорида со следующими веществами: 1) гидроксидом натрия (водным раствором), 2) аммиаком, 3) цианидом калия. 4) нитритом серебра, 5) этилатом натрия. Рассмотрите механизм (SN1) этих реакций. Объясните, почему хлор в бензилхлориде обладает высокой подвижностью.
11. Предложите схемы получения следующих галогенпроизводных: 1) иодистого изобутила, 2) метилэтилбромметана, 3) 1-хлор-3-метилбутана.
12. Из соответствующего непредельного углеводорода получите 2-бром-2-метилбутан. Напишите для него уравнения реакций с аммиаком, нитритом серебра и ацетатом натрия.
13. Рассмотрите механизмы реакций взаимодействия 1,3-дихлор-3-метилбутана со спиртовым раствором и водным раствором щелочи.
14. Из каких иодистых алкилов при действии спиртового раствора щелочи могут быть получены триметилэтилен и пентен-1. Приведите схемы реакций.
15. Для хлористого изобутила напишите уравнение реакции со спиртовым раствором щелочи. На полученное соединение подействуйте бромом.
16. С помощью каких реактивов и в каких условиях можно осуществить следующие превращения:
С6Н6 С6Н5 - Br С6Н5 - MgBr С6Н5 - COOH
17. Из бензола получите следующие соединения: 1) п-хлортолуол, 2) м-бромбензойную кислоту, 3) 4-этилбромбензол.
18. Из соответствующего этиленового углеводорода получите 2-иод-2- метилпентан и напишите уравнения реакций его с иодистым водородом, с магнием в среде абсолютного эфира.
19. Составьте схемы реакций получения из соответствующих спиртов: 1) изопропилбромида, 2) хлорэтана, 3) 1,2,4-трихлорбутана, 4) 1-хлорпропана.
20. Составьте структурные формулы и назовите монобромпроизводные, которые могут получиться при действии брома на углеводороды: 1) изобутан, 2) пропан, 3) неопентан. Укажите условия реакций.
4. Спирты, простые эфиры
1. Составьте схемы реакций дегидратации спиртов: изогексилового, этилизопропилкарбинола, 4-метилпентанола-2 - при нагревании с серной кислотой (реакция идет через образование и последующий распад сложного эфира).
2. Приведите схемы получения: 1) динитрата этиленгликоля, 2) тринитрата глицерина. Какое практическое значение имеет тринитрат глицерина?
3. Приведите схемы реакций образования из спиртов в присутствии серной кислоты следующих простых эфиров: 1) диэтилового, 2) метилэтилового, 3) дипропилового. Рассмотрите механизм реакции 2.
4. На смесь метилового, этилового и пропилового спиртов подействовали металлическим натрием, а затем, удалив остатки натрия, к смеси при нагревании прибавили иодпропан. Какие вещества были получены в результате этих реакций?
5. Предложите способ получения винилбутилового эфира и дайте схему реакции его полимеризации.
6. Напишите схемы синтеза пропанола –2 из: а) олефина, б) алкилгалогенида, в) по реакции Гриньяра. Какой метод используется в промышленности и почему?
7. Укажите, какие соединения образуются при взаимодействии: а) 2-метилпропанола-2 с иодоводородом, б) 2-пропанола с серной кислотой, в) этанола с магнием, г) иодметана с пропанолятом натрия.
8. Составьте уравнения взаимодействия втор-бутилового спирта: 1) с металлическим натрием, 2) с хлоридом фосфора (V), 3) с уксусной кислотой в присутствии серной кислоты, 4) с хромовой смесью.
9. Установите строение молекулы спирта состава С5Н12О, который при дегидратации образует углеводород С5Н10 (этот углеводород при озонировании и последующем разложении озонида водой дает муравьиный и масляный альдегиды). Приведите схемы реакций.
10. Спирты при пропускании их паров над оксидом алюминия (при 375С) подвергаются дегидратации, образуя олефины. Напишите уравнения реакции дегидратации следующих спиртов: изоамилового, 3-метилбутанола-2.
11. Бутлеров А.М. получил триметилкарбинол по следующей схеме:
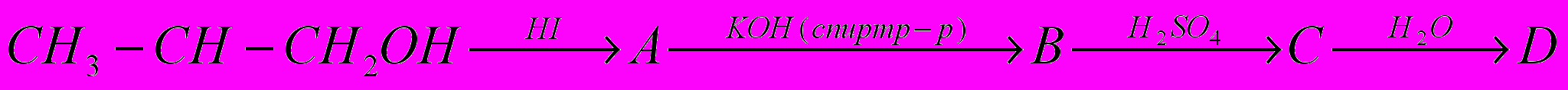
|
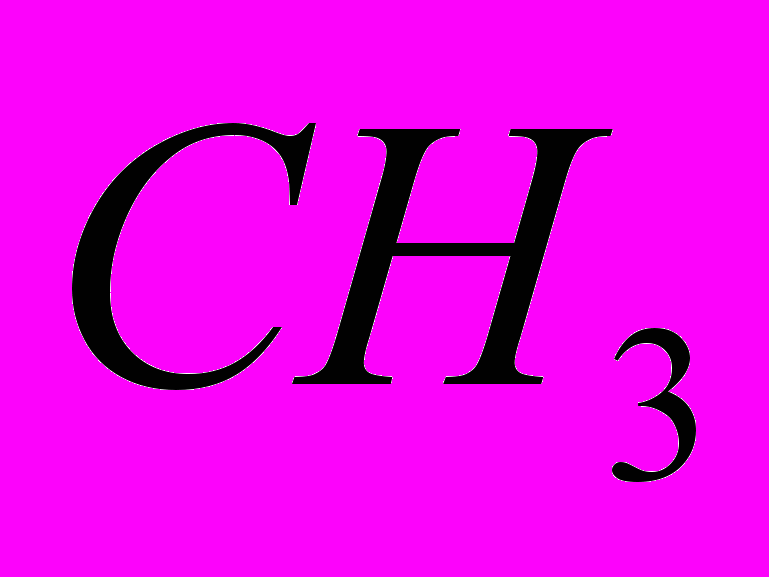
Напишите уравнения реакций.
12. Какие спирты получаются при гидратации в кислой среде: 1) изобутилена, 2) 2-метилпентена-1, 3) пропилена, 4) 2-метилбутена-2? Приведите схемы реакций и на одном из примеров рассмотрите механизм реакции.
13. Составьте структурные формулы третичных гептиловых спиртов (семь изомеров) и назовите их по карбинольной номенклатуре и IUPAC.
14. Изоамиловый спирт дегидратировали, полученное соединение обработали бромистым водородом и продукт реакции гидролизовали водной щелочью. Напишите уравнения реакций и назовите конечные продукты.
15. Из каких непредельных соединений, используя реакцию Вагнера, можно получить следующие соединения: а) пропандиол-1,2, б) 2-метилбутандиол-2,3, в) пинакон (2,3-диметилбутандиол-2,3).
16. Для каждого из следующих спиртов напишите 3-4 реакции: а) метанол, б) втор-бутиловый спирт, в) этиленгликоль. Как эти вещества можно различить?
17. На бутиловый спирт подействуйте пятихлористым фосфором, затем на полученное соединение – этилатом натрия. Напишите схемы реакций полученного соединения с HI (при нагревании), металлическим натрием и HCl.
18. Напишите структурные формулы изомерных простых эфиров состава С4Н10О и С5Н12О, назовите их.
19. Напишите уравнения реакций окисления следующих спиртов: изобутилового, трет-бутилового, бутанола-2. Какие спирты окисляются легче?
20. Какое соединение получается при полной дегидратации глицерина? Составьте схемы этих превращений.
5. Фенолы
1. Какое влияние оказывают друг на друга гидроксильная группа и бензольное ядро в молекуле фенола? Приведите соответствующие уравнения реакций.
2. Какие соединения образуются при действии на фенол и п-крезол: а) металлического натрия, а затем этилбромида, б) уксусного ангидрида, в) диметилсульфата в присутствии гидроксида натрия, г) азотной кислоты (1 моль), д) брома (1 моль), е) водного раствора гидроксида натрия, ж) цинковой пыли.
3. Дайте сравнительную характеристику бензилового спирта и фенола. Приведите уравнения соответствующих реакций.
4. Напишите уравнения реакций, лежащих в основе промышленных методов получения фенола: 1) из хлорбензола, 2) из бензолсульфокислоты, 3) из изопропилбензола (кумольный метод Сергеева). Рассмотрите механизм 3 реакции. Какое преимущество перед другими имеет кумольный метод? Из какой фракции каменноугольной смолы получают фенол?
5. Составьте уравнения реакций между следующими веществами: 1) фенолятом натрия и изопропилхлоридом, 2) п-крезолятом натрия и 2-бромбутаном, 3) о-крезолятом натрия и разбавленной серной кислотой. Назовите продукты реакций.
6. Как будут реагировать фенол и бензиловый спирт со следующими веществами: 1) водным раствором гидроксида натрия , 2) металлическим натрием, 3) бромоводородом, 4) уксусной кислотой (в присутствии серной кислоты), 5) ацетилхлоридом, 6) хлоридом железа (III)? Напишите уравнения реакций.
7. Какие из приведенных ниже соединений дают окраску с хлоридом железа (III), реагируют с бромоводородом и с раствором гидроксида натрия: 1) фенол, 2) бензиловый спирт, 3) м-крезол, 4) - фенилэтиловый спирт, 5) - фенилэтиловый спирт, 6) п-метоксифенол? Приведите уравнения реакций.
8. Какие соединения образуются при действии: 1) бромной воды на м-крезол, 2) разбавленной азотной кислоты на о-крезол (при комнатной температуре), 3) серной кислоты на фенол (при 20 и100С)? По какому механизму идут эти реакции?
9. Напишите уравнение конденсации фенола с формальдегидом. Рассмотрите механизм реакции. Чем обусловлены электрофильные свойства формальдегида? Чем отличаются по строению и свойствам новолачные смолы от резольных? Как получают резит?
10. Какие вещества образуются, если на п-крезол подействовать: 1) водным раствором гидроксида натрия, а затем иодметаном, 2) ацетилхлоридом, 3) разбавленной азотной кислотой, 4) уксусным ангидридом, 5) бромной водой, 6) цинковой пылью? Напишите уравнения реакций.
11. Предложите схемы следующих синтезов (укажите условия реакций и назовите промежуточные соединения):
- бензол п- нитрофенол
- бензол о-аминофенол
12. Укажите, какие соединения образуются при нитровании, сульфировании и галогенировании (провести монозамещение) следующих веществ: а) п-хлорфенол, б) м-крезол, в) о-бромфенол.
13. Как отличить друг от друга глицерин, фенол и гексиловый спирт? Приведите соответствующие уравнения реакций.
14. Установите строение и назовите вещество состава С7Н8О, если оно: 1) растворяется в щелочах, 2) дает окрашивание с хлоридом железа (III), 3) метилируется диметилсульфатом в щелочной среде. При окислении продукта метилирования получается п-метоксибензойная кислота.
15. Покажите, как из бензола получить анизол (метоксибензол). Напишите реакцию взаимодействия анизола с бромом.
16. Как из бензола и необходимых неорганических веществ получить м- и п-оксибензолсульфокислоты?
17. Определите строение вещества состава С7Н8О, которое не дает цветной реакции с хлорным железом, при взаимодействии с PCl5 – переходит в соединение С7Н7Cl, окисляется КМnО4 в вещество состава С7Н6О2, растворимое в водном растворе щелочи.
18. Составьте уравнения реакций щелочного гидролиза: 1) п-нитрохлорбензола, 2) хлорбензола, 3) о-нитрохлорбензола, 4) 2,4,6-тринитрохлорбензола, 5) м-нитрохлорбензола. Назовите продукты реакций.
19. Напишите схемы образования п-бромфенола, используя в качестве исходных продуктов: а) бензол, б) бензолсульфокислоту. Какие соединения образуются при взаимодействии щелочного раствора п-бромфенола с пропилиодидом, диметилсульфатом.
20. Расположите соединения в каждом из приведенных ниже рядов в порядке увеличения кислотности: а) п- нитрофенол, м-нитрофенол, бензиловый спирт, фенол, 3-фенилпропанол-1, б) фенол, вода, м-бромфенол, м-крезол, м-нитрофенол. Ответ поясните.
6. Альдегиды и кетоны
1. Напишите уравнения реакций взаимодействия 2-метилбутаналя с: а) хлоридом фосфора (V), б) аммиаком, в) гидроксиламином, г) гидразином, д) циановодородом. Назовите продукты.
2. Приведите схемы получения карбонильных соединений по реакции Кучерова (с указанием промежуточного продукта) из следующих веществ: 1) ацетилена, 2) этилацетилена, 3) диметилацетилена, 4) метилацетилена.
3. Из соответствующих дигалогенпроизводных получите следующие карбонильные соединения: а) пропаналь, б) диметилпропаналь, в) 2- метилбутанон-3.
4. Из этилацетилена получите бутанон и напишите для него реакции с пятихлористым фосфором, синильной кислотой, гидросульфитом натрия и гидроксиламином. Приведите механизм последней реакции.
5. Из соответствующего ацетиленового углеводорода получите 3-метилпетанон-2 и напишите для него реакцию бромирования и схему окисления.
6. Приведите схему альдольной и следующей за ней кротоновой конденсации уксусного альдегида с ацетоном.
7. Получите из толуола п-нитробензальдегид и напишите для него реакции с синильной кислотой, с гидросульфитом натрия.
8. Для о-толуилового альдегида приведите реакцию серебряного зеркала и реакции образования фенилгидразона и оксима.
9. Составьте схему взаимодействия пропионового альдегида с веществами: 1) фенилгидразином, 2) синильной кислотой, 3) атомарным водородом, 4) магнийбромэтилом, 5) гидросульфитом натрия. Объясните механизм (Аn) реакций присоединения магнийорганического соединения, гидросульфита натрия, синильной кислоты.
10. Составьте схемы реакций окисления карбонильных соединений: 1) метилэтилкетона, 2) диэтилкетона, 3) метилизопропилкетона, 4) масляного альдегида, 5) валерианового альдегида, 6) уксусного альдегида.
11. Определите строение вещества состава С5Н10О, если с аммиачным раствором оксида серебра оно дает реакцию на альдегидную группу, а при взаимодействии его с гидразином получается соединение состава С5Н12N2, которое при нагревании со щелочью в присутствии платины выделяет азот и образует углеводород С5Н12 нормального строения.
12. Составьте схемы реакций, происходящих при пропускании над нагретым катализатором (ТhO2, MnO2) паров следующих кислот: 1) масляной, 2) смеси уксусной и муравьиной, 3) смеси уксусной и масляной.
13. Приведите схему получения душистого вещества «жасмин-альдегида» кротоновой конденсацией гептаналя и бензойного альдегида.
14. Какие вещества получатся при действии на ацетофенон: 1) циановодородом, 2) магнийбромэтилом с последующей гидратацией, 3) цинком и соляной кислотой. Назовите продукты реакций.
15. Напишите уравнения реакций получения м-бромбензальдегида и фенилуксусного альдегида: 1) окислением соответствующих спиртов, 2) гидролизом геминальных галогенпроизводных.
16. Приведите уравнения реакций ацилирования бензола: 1) ацетилхлоридом, 2) уксусным ангидридом. По какому механизму идут эти реакции? Назовите продукты реакций.
17. Какие вещества образуются при взаимодействии с гидроксиламином: 1) бензойного альдегида, 2) ацетофенона, 3) бензофенона? Приведите уравнения реакций.
18. Напишите уравнения следующих реакций: 1) нитрования п-бромбензальдегида, 2) хлорирования бензальдегида (в присутствии железа). Рассмотрите механизмы этих реакций.
19. Расположите следующие соединения в ряд по увеличению их склонности к реакциям нуклеофильного присоединения: 1) изомасляный альдегид, 2) этилпропилуксусный альдегид, 3) ацетон, 4) уксусный альдегид, 5) метилэтилкетон.
20. Какими реакциями можно отличить бутаналь от бутанола, ацетон от пропаналя?
7. Карбоновые кислоты и их производные
1. Составьте уравнения реакций, протекающих между следующими веществами: 1) уксусной кислотой и карбонатом магния, 2) муравьиной кислотой и этанолом, 3) пропанолом и уксусным ангидридом. Рассмотрите механизм 2 реакции.
2. Расположите в ряд по возрастанию констант диссоциации следующие кислоты: монохлоруксусная кислота, уксусная кислота, трихлоруксусная кислота. Объясните влияние галогена на кислотные свойства этих соединений, применяя электронную теорию.
3. Укажите, какие соединения образуются при взаимодействии уксусной кислоты с: 1) металлическим натрием, 2) гидроксидом кальция, 3) бромоводородом, 4) хлоридом фосфора (V), 5) этанолом в присутствии серной кислоты. Во всех ли случаях пойдет реакция?
4. Как можно получить пропионовую кислоту, имея в качестве исходного вещества этилен? Напишите уравнения реакций образования хлорангидрида, ангидрида и кальциевой соли пропионовой кислоты.
5. Напишите уравнения взаимодействия - оксимасляной кислоты с: 1) гидроксидом натрия, 2) хлороводородом, 3) хлоридом фосфора (V), 4) этанолом в присутствии хлороводородной кислоты.
6. Напишите уравнения реакций янтарной кислоты с: 1) гидроксидом кальция, 2) карбонатом натрия, 3) аммиаком при последующем нагревании, 4) этанолом, 5) азотной кислотой. Во всех ли случаях будут происходить реакции?
7. Предложите наиболее рациональную последовательность в реакциях замещения для превращения толуола в: 1) 3-нитро-4-бромбензойную кислоту, 2) п-аминобензойную.
8. Приняв за исходное вещество бутен-2, напишите уравнения реакций получения метилэтилуксусной кислоты следующими способами: 1) действием оксида углерода (II) и воды в присутствии тетракарбонила никеля (синтез Реппе), 2) через нитрил, 3) с применением реактива Гриньяра.
9. Рассмотрите электролиз натриевой соли пропионовой кислоты. Назовите продукт реакции.
10. Приведите схемы реакций гидролиза, алкоголиза (изобутиловым спиртом), аммонолиз этилацетата.
11. Приведите схемы реакций получения по способу Вильямсона следующих эфиров: 1) изоамилацетата, 2) метилпропионата, 3) метилвалерата, 4) бутилацетата.
12. Рассмотрите схемы взаимодействия ацетилхлорида и пропионилхлорида с водой, этиловым спиртом, аммиаком, ацетатом натрия.
13. Напишите схемы реакций получения следующих ангидридов: 1) уксусного, 2) пропионового, 3) изомасляного (в присутствии оксида фосфора (V).
14. Составьте схемы реакций уксусного ангидрида со следующими веществами: водой, метиловым спиртом, аммиаком, метиламином.
15. Какие вещества образуются при взаимодействии акриловой кислоты с: 1) раствором перманганата калия в щелочной среде, 2) хромовой смесью при нагревании, 3) бромной водой, 4) гидроксидом натрия? Приведите схемы реакций.
16. Напишите уравнения реакций образования производных винилуксусной кислоты: 1) калиевой соли, 2) хлорангидрида, 3) ангидрида, 4) этилового эфира, 5) амида.
17. Главные триглицериды хлопкового масла – пальмитодилинолеин, трилинолеин, пальмитоолеолинолеин. Составьте структурные формулы этих веществ.
18. Рассмотрите схемы гидролиза следующих триглицеридов: 1) олеодипальмитина, 2) пальмитодистеарина, 3) пальмитоолеостеарина. Какие вещества называют мылами?
19. Составьте уравнение реакции образования малеинового ангидрида. Объясните, почему фумаровая кислота не имеет соответствующего ей ангидрида.
20. Среди соединений, которые приведены ниже, укажите вещества, существующие в виде оптических изомеров. Определите число изомеров.
1) 2-окси-3-метилбутановая кислота, 2) метилмалоновая кислота, 3) хлоряблочная кислота, 4) , -диоксимасляная кислота. Какой углерод называют асимметрическим?
8. Углеводы
1. Поясните кольчато-цепную таутомерию моносахаридов на примере Д-рибозы. Напишите перспективные (по Хеуорсу) формулы , Д-рибофуранозы и , Д-дезоксирибопиранозы.
2. Для какого дисахарида (трегалозы или целлобиозы) характерно явление мутаротации в водных растворах? Объясните, почему. Приведите схему процесса.
3. Какие виды изомерии характерны для моносахаридов? Приведите формулы всех оптических изомеров альдопентоз. Отметьте формулы оптических антиподов и диастереомеров.
4. Напишите уравнения реакций получения моносахаридов циангидриновым синтезом, исходя из: 1) Д-рибозы,2) Д-глюкозы.
5. Напишите уравнения реакций Д-галактозы со следующими веществами: 1) бромной водой, 2) азотной кислотой, 3) синильной кислотой, 4) избытком фенилгидразина, 5) водородом (в присутствии никеля), 6) гидразином.
6. Каким образом, используя качественные реакции, можно различить Д-глюкозу и Д-сорбит? Приведите уравнения реакций.
7. Напишите уравнения реакций Д-глюкозы со следующими реагентами: 1) СН3ОН в присутствии сухого хлороводорода, 2) избытком диметилсульфата, 3) уксусным ангидридром, 4) гидроксиламином. Назовите продукты реакций.
8. При помощи каких реагентов можно осуществить следующие превращения:
, Д-глюкоза тетраметил - , Д-метилгюкозид тетраметил – Д-глюкоза оксим тетраметил-Д-глюкозы.
Напишите уравнения реакций.
9. Напишите уравнения реакций Д-маннозы со следующими реагентами: 1) метиловым спиртом в присутствии сухого хлороводорода, а затем с избытком диметилсульфата, 2) водородом, 3) пропионовым ангидридом.
10. Обнаруживает ли мальтоза мутаротацию? Может ли она существовать в виде двух аномеров ( и )? Составьте проекционные и перспективные формулы таутомерных форм мальтозы.
11. На мальтозу подействовали аммиачным раствором гидроксида серебра. Полученный продукт подвергли гидролизу. Напишите уравнения реакций. Пойдут ли такие реакции с сахарозой? Ответ поясните.
12. Что такое мутаротация? Объясните это явление на примерах Д-галактозы и Д-фруктозы.
13. Напишите уравнения реакций согласно схеме, пользуясь перспективными формулами:
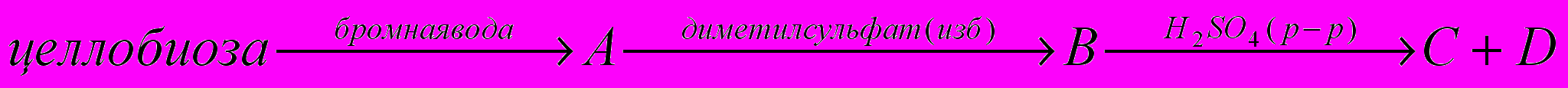
14. Сахарозу последовательно обработали: водным раствором серной кислоты при нагревании, затем избытком фенилгидразина. Составьте уравнения реакций.
15. Приведите перспективные формулы (по Хеуорсу) фрагментов молекул амилозы и амилопектина. Укажите типы связей между остатками Д-глюкозы. Отметьте отличия в строении и свойствах амилозы и амилопектина.
16. Приведите перспективную формулу фрагмента молекулы целлюлозы. Укажите типы связей между остатками глюкозы. В каких веществах растворяется целлюлоза? Что такое амилоид?
17. Составьте схемы получения моно-, ди- и тринитратов целлюлозы, используя перспективные формулы Хеуорса. Что такое коллоксилин и пироксилин? Какое применение находят нитраты целлюлозы?
18. Как получают и где используют ацетаты целлюлозы? Составьте схемы реакций.
19. В бурых водорослях встречается полисахарид ламинарин, выполняющий роль энергетического резерва клеток. Основная цепь этого биополимера построена из остатков ,Д- глюкопиранозы, соединенных -1,3- гликозидными связями. Приведите перспективную формулу фрагмента молекулы ламинарина.
20. Фруктаны типа флеана, как и инулин, содержатся в злаковых растениях. Флеан построен из остатков ,Д-фруктофуранозы, соединенных -2,6- связями. Напишите перспективную формулу фрагмента молекулы флеана.
9. Амины и аминоспирты
1. Составьте уравнения взаимодействия с соляной и серной кислотами следующих аминов: 1) пропиламина, 2) дипропиламина, 3) триметиламина.
2. Какие из изомерных аминов общей формулы С3Н9N могут ацилироваться уксусным ангидридом? Дайте примеры уравнений реакций.
3. Как будут реагировать с азотистой кислотой следующие амины: метиламин, диметиламин, триэтиламин, анилин? Напишите уравнения реакций и назовите полученные соединения.
4. Приведите уравнения реакций взаимодействия: 1) анилина с уксусной кислотой, 2) м-толуидина с ацетилхлоридом, 3) хлорида анилина с гидроксидом натрия, 4) диметиланилина с азотистой кислотой, 5) анилина с метилиодидом.
5. Из пропилового спирта получите метилпропиламин и напишите для него реакцию с азотистой кислотой.
6. Получите любым способом 2-аминопентан и напишите для него реакции с соляной кислотой, азотистой кислотой и уксусным ангидридом.
7. Получите из алкена 3-метил-2-аминобутан и приведите уравнения реакций, характеризующие его химические свойства.
8. Осуществите схему превращений:
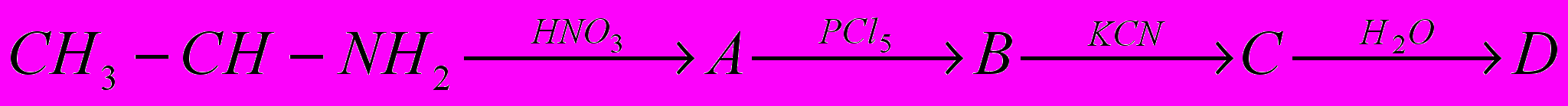
|
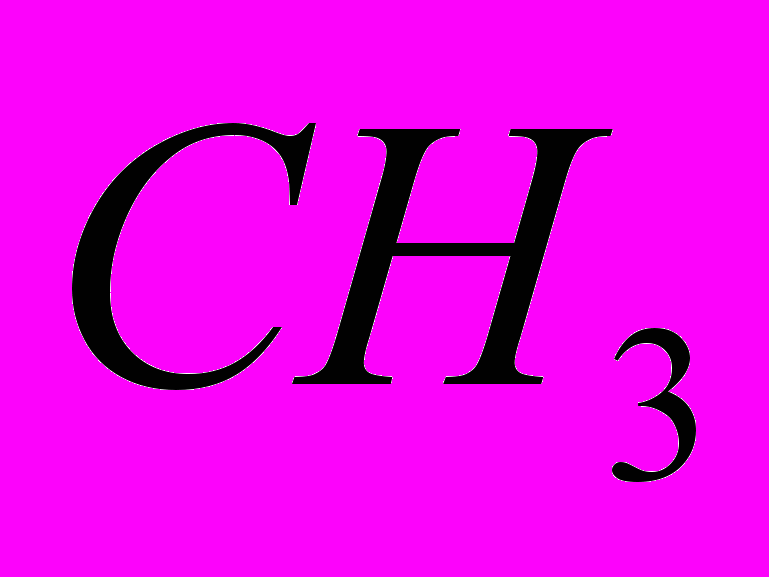
9. На 2,2-диметилпентанон-3 подействуйте гидроксиламином, полученное соединение восстановите. Для продукта восстановления напишите уравнения реакций с иодистым бутилом, соляной и азотистой кислотами.
10. Используйте ацетон для получения изопропиламина. Напишите для изопропиламина уравнения реакций с азотистой кислотой и хлорангидридом уксусной кислоты.
11. Из масляного альдегида получите оксим, восстановите его, из образовавшегося соединения получите сернокислую соль и напишите ее реакцию с хлорангидридом бутановой кислоты. Назовите конечный продукт.
12. Из бензола получите сульфаниловую кислоту и приведите уравнения реакций, характеризующие ее химические свойства по аминогруппе.
13. Из анилина получите п-нитроанилин и диэтиланилин и сравните их основные свойства.
14. Расположите следующие соединения в порядке ослабления их основных свойств: п-метиланилин, п-нитроанилин, анилин, дифениланилин. Дайте объяснения.
15. На анилин последовательно подействуйте ацетихлоридом, азотной кислотой (2 моль), водой. Назовите конечный продукт.
16. Напишите уравнение реакции получения этаноламина из окиси этилена. Какие химические свойства характерны для этаноламина? Приведите уравнения реакций.
17. Смесь первичного, вторичного и третичного аминов, полученная из бромистого пропила и аммиака, была обработана уксусным ангидридом. Напишите уравнения реакций и назовите получившиеся вещества.
18. Установите строение вещества состава С5Н13N, которое с соляной кислотой образует соль, взаимодействует с азотистой кислотой, выделяя азот и образуя соединение С5Н12О. Последнее соединение при окислении дает кетон, а в более жестких условиях образует уксусную и пропионовую кислоты.
19. Приведите схемы реакций получения из карбонильных соединений: 1) изопропиламин, 2) 2-аминобутан, 3) 1-амино-2-метилбутан.
20. Получите из амидов соответствующих кислот с помощью перегруппировки Гофмана следующие амины: 1) изопропиламин, 2) изобутиламин, 3) трет-бутиламин.
10. Аминокислоты, белки
1. -аминокислоты могут быть получены: из альдегидов через оксинитрилы, из - галогензамещенных кислот, восстановлением соответствующих -кетокислот в присутствии аммиака. Напишите уравнения реакций получения этими способами следующих аминокислот: 1) аланина, 2) валина (-аминовалериановой кислоты).
2. Изобразите в виде внутренних солей формулы аминокислот: 1) аминоуксусной (глицина), 2) -аминопропионовой (аланина), 3) аминоянтарной (аспарагиновой), 4) -аминоглутаровой (глутаминовой). Разберите механизм образования внутренней соли.
3. Внутренняя соль аминокислоты реагирует с основанием как кислота, с кислотой – как основание. Напишите уравнения взаимодействия аланина: 1) с гидроксидом натрия, 2) с гидроксидом аммония, 3) с соляной кислотой.
4. Рассмотрите схемы взаимодействия аланина со следующими веществами: 1) соляной кислотой, 2) аммиаком, 3) гидроксидом калия, 4) хлоридом ацетила.
5. Напишите уравнения реакций -аминомасляной кислоты со следующими веществами: 1) иодметаном, 2) азотистой кислотой, 3) уксусным ангидридом, 4) гидроксидом меди (II).
6. Как взаимодействуют изомерные аминокислоты состава С3Н7NО2 с азотистой кислотой. Приведите уравнения реакций. Назовите продукты.
7. Приведите формулы дипептидов: 1) аланил-глицина, 2) лейцил-аланина, 3) аланил-лейцина, 4) лейцил-валина.
8. Изобразите структурные формулы и назовите дипептиды, которые могут быть получены из следующих аминокислот: 1) глицина и лейцина, 2) аланина и валина, 3) аланина и аланина.
9. Рассмотрите схемы получения следующих дипептидов: 1) глицил-глицина, 2) аланил-глицина, 3) глицил-лейцина.
10. Разберите схемы реакций, происходящих при нагревании -аминомасляной, -аминовалериановой, -аминокапроновой кислот.
11. Предложите схему синтеза 2-аминобутановой кислоты из бутилового спирта. Для аминокислоты напишите реакции с НСl и NаОН.
12. Что такое денатурация белков? В чем ее сущность и какие факторы ее вызывают?
13. Составьте схемы реакций образования трипептидов из: 1) аминоуксусной кислоты, 2) 3-аминопропионовой кислоты.
14. Действием аммиака на галогензамещенные кислоты получите следующие аминокислоты: 1) аланин, 2) изолейцин, 3) 2,3-диаминобутановую, 4) 2-аминопентановую.
15. Напишите уравнения реакций между следующими веществами:
- -аминопропионовая кислота и пропиловый спирт;
- -аминомасляная кислота и хлорангидрид уксусной кислоты;
- лейцин и азотистая кислота;
- валин и изопропилбромид.
16. Напишите структурные формулы промежуточных и конечных продуктов в следующей схеме:

|
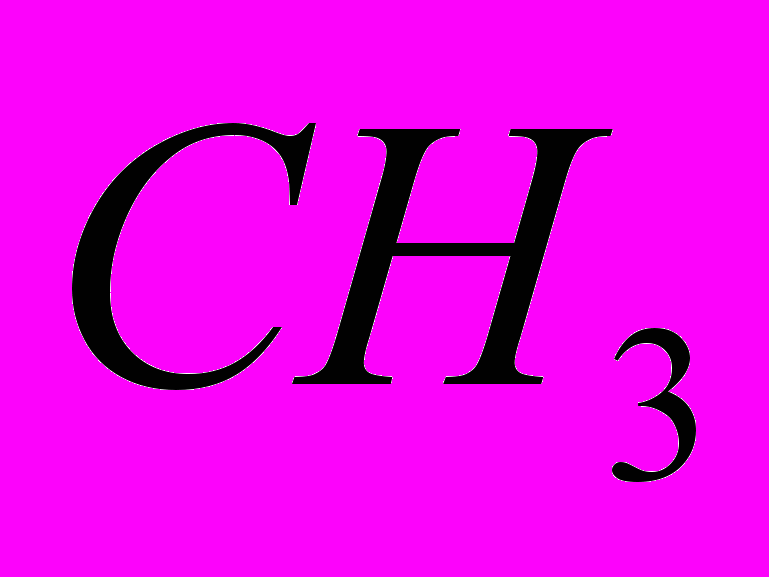
17. Из карбонильных соединений через оксинитрилы получите следующие аминокислоты: 2-амино-2-метилбутановую; 2-амино-3,3-диметилбутановую.
18. Приведите возможные схемы превращения ацетилена в 3-аминопропановую кислоту. Напишите для нее реакции с едким натром, соляной кислотой и пятихлористым фосфором.
19. Используя втор-бутиловый спирт, получите 2-амино-2-метилбутановую кислоту. Напишите уравнение реакции этой кислоты с РСl5, СН3I и (СН3СО)2О.
20. Приведите уравнения реакций взаимодействия -аминомасляной кислоты с: 1) гидроксидом натрия, 2) соляной кислотой, 3) этиловым спиртом, 4) азотистой кислотой.
11. Гетероциклические соединения
1. Какие вещества образуются в условиях реакции Юрьева, если взаимодействуют: 1) -метилтиофен и аммиак, 2) 2,5-диметилпиррол и сероводород, 3) -метилфуран и этиламин, 4) -метилпиррол и вода. Напишите уравнения реакций.
2. Как влияют электронодонорные (ЭД) и электроноакцепторные (ЭА) заместители на реакционную способность пятичленных гетероциклов в реакциях с электрофильными реагентами? Сравните реакционную способность фурана, 2-метилфурана и фурфурола.
3. Какой из гетероциклов наиболее легко вступает в реакции с электрофильными реагентами: 1) пиррол, 2) -метилпиррол, 3) 2-нитропиррол, 4) пиррол-2-карбоновая кислота? Приведите объяснения.
4. Напишите уравнения реакций фурана со следующими веществами: 1) пиридинсульфотриоксидом, 2) ацетилнитратом, 3) уксусным ангидридом. По какому механизму идут эти реакции? Почему фуран нельзя сульфировать серной кислотой и ацилировать ацетилхлоридом?
5. Напишите уравнения реакций для тиофена: 1) сульфирования серной кислотой, 2) нитрования ацетилнитратом, 3) хлорирования сульфурилхлоридом, 4) бромирования бромом. По какому механизму идут эти реакции?
6. В какие преимущественно положения вступает электрофильный заместитель при взаимодействии: 1) 3-метилфурана и ацетилнитрата, 2) 3-нитротиофена и ацетилхлорида, 3) 3-трет-бутилтиофена и ацетилхлорида? Напишите уравнения реакций (учтите ориентирующее влияние заместителей в ядре и пространственные факторы).
7. Напишите уравнения реакций: 1) нитрования пиридина, 2) сульфирования пиридина. Укажите условия реакций. Почему реакции электрофильного замещения в молекуле пиридина идут лишь в жестких условиях?
8. Объясните, почему -аминопиридин нитруется и сульфируется значительно легче, чем пиридин. В какое положение преимущественно вступают нитро- и сульфогруппы?
9. Составьте структурные формулы следующих биологически активных соединений: 1) витамина РР (-пиридинкарбоновой кислоты и ее амида), 2) пиридоксола (2-метил-3-окси-4,5-диметоксипиридина), 3) пиридоксаля (отличается от пиридоксола присутствием группы СНО в положении 4), 4) пиридоксамина (отличается от пиридоксола наличием группы СН2NН2 в положении 4).
10. Напишите графические формулы пиримидиновых оснований: урацила, тимина, цитозина, 5-метилцитозина. Укажите их таутомерные формы. В состав каких природных соединений входят пиримидиновые основания?
11. Напишите графические формулы пурина и пуриновых оснований (аденина, гуанина, 2-метиладенина). Какие гетероциклы входят в состав пурина? В состав каких природных соединений входят пуриновые основания?
12. Из тиофена реакцией алкилирования получите -изопропилтиофен, -этилтиофен.
13. В каком валентном состоянии находятся гетероатомы и атомы углерода в молекулах пиррола, фурана и тиофена? Нарисуйте схемы - и -связей в этих гетероциклах. Почему они проявляют ароматические свойства?
14. Напишите уравнения реакций между следующими веществами: 1) 1-метил-3-нитропирролом и уксусным ангидридом, 2) фуран-3-альдегидом и ацетилнитратом, 3) тиофен-3-карбоновой кислотой и бромом.
15. Составьте уравнения следующих реакций Sе2-типа: 1) нитрования 2,3-диметилфурана смесью азотной кислоты и уксусного ангидрида, 2) бромирования тиофена, 3) сульфирования пиррола пиридинсульфотриоксидом.
16. Какое сульфирующее средство (дымящую серную кислоту, 85%-ную серную кислоту, пиридинсульфотриоксид) следует применять для моносульфирования: 1) бензола, 2) пиррола, 3) фурана, 4) тиофена? Приведите уравнения реакций.
17. Предложите схемы синтезов из пиридина: 1) 3-оксипиридина, 2) 3-аминопиридина.
18. Разберите схемы частичного и полного гидрирования фурана, пиррола и тиофена. Назовите продукты реакций.
19. Напишите уравнения реакций взаимодействия -метилтиофена с: 1) бромом, 2) азотной кислотой, 3) серной кислотой, 4) перманганатом калия. Какие свойства проявляет -метилтиофен в этих реакциях?
20. У каких соединений легче протекают реакции электрофильного замещения – у бензола, анилина, пиридина или -аминопиридина – и почему? Приведите уравнения соответствующих реакций.
12. Вывод молекулярных формул (расчетные задачи)
1. Определите молекулярную формулу соединения, если при сжигании 0,18 г его образовалось 0,2475 г оксида углерода (IV) и 0,2023 г воды. Плотность паров по водороду равна 16 г/см3.
2. По данным элементарного анализа углеводород содержит 92,31 % углерода и 7,69 % водорода. Плотность паров этого вещества по водороду равна 39 г/см3. Найдите молекулярную формулу.
3. Найдите молекулярную формулу вещества, если при сжигании 13,8 г его получили 26,4 г оксида углерода (IV) и 16,2 г воды. Плотность паров его по водороду равна 23 г/см3.
4. В состав ароматического углеводорода входит 93,75 % углерода и 6,25 % водорода. Молярная масса углеводорода равна 128 г/моль. Выведите молекулярную формулу и напишите структурную формулу, имея в виду, что в состав молекулы входят два бензольных ядра.
5. Установите молекулярную формулу вещества, если известно, что оно содержит 30,7 % углерода, 3,82 % водорода, 45,23 % хлора и кислород. Плотность его паров по водороду равна 39,25 г/см3.
6. По данным элементарного анализа углеводород содержит 90 % углерода и 10 % водорода. Плотность паров этого соединения по водороду равна 20 г/см3. Найдите его молекулярную формулу.
7. Элементарным анализом установлено, что газ имеет следующий состав: углерода – 52,2 %, водорода – 13 % и кислорода – остальное. Объем этого газа 1 л, а масса 2,05 г (условия нормальные). Определите молекулярную и структурную формулы данного соединения, зная, что оно не взаимодействует с металлическим натрием.
8. Найдите молекулярную формулу вещества, имеющего состав: углерода – 82,8 %, водорода – 17,2 %, если известно, что 1 л этого соединения имеет массу 2,59 г (условия нормальные).
9. При сжигании некоторого количества газообразного углеводорода получили 3,3 г оксида углерода (IV) и 2,02 г воды. Плотность паров его по воздуху равна 1,035 г/см3. Составьте структурную формулу. К какому гомологическому ряду относится данное вещество?
10. При сжигании 0,2625 г вещества образовалось 0,392 г оксида углерода (IV) и 0,4725 г воды. Плотность паров данного соединения по водороду равна 15 г/см3. Определите молекулярную формулу исследуемого вещества.
11. Выведите молекулярную формулу газообразного вещества, имеющего состав: углерода – 82,8 %, водорода – 17,2 %, если известно, что масса 1 л этого газа составляет 2, 59 г (условия нормальные).
12. При сжигании 5,00 мг вещества выделилось 16,92 мг оксида углерода (IV) и 3,46 мг воды. Молярная масса исследуемого соединения 78 г/моль. Определите его молекулярную формулу.
13. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху 1,93. Найдите молекулярную формулу алкена.
14. Найдите молекулярную формулу алкена, массовая доля углерода в котором составляет 85,7 %. Относительная плотность этого алкена по азоту равна 2.
15. Найдите молекулярную формулу алкадиена, если при сжигании 2 г его образовалось 2,12 г воды и 6,48 г оксида углерода (IV). Относительная плотность паров этого вещества по водороду равна 34.
16. Алкин массой 13 г (при н.у.) занимает объем 11,2 л. Массовая доля водорода в нем составляет 7,7 %. Найдите его молекулярную формулу.
17. Определите молекулярную формулу амина, массовые доли углерода, азота и водорода в котором составляют 38,7, 45,15, и 16,15 % соответственно. Относительная плотность его паров по водороду равна 15,5.
18. При сжигании вещества массой 2,5 г, содержащего 23 % азота, образовалась вода массой 3,42 г и оксид углерода (IV) массой 5,57 г. Вывести молекулярную формулу вещества.
19. При сгорании вещества массой 2,3 г образуется оксид углерода (IV) массой 4,4 г, вода массой 2,7 г. Плотность паров этого вещества по воздуху 1,59. Вывести молекулярную формулу вещества.
20. Определить молекулярную формулу вещества по следующим данным: сожгли газ массой 0,29 г и получили оксид углерода (IV) объемом 0,448 л и воду массой 0,45 г. Относительная плотность горючего газа по воздуху 2.
Номер варианта и задания для индивидуальной контрольной работы
-
№ варианта
Номера заданий по темам
1
2
3
4
5
6
7
8
9
10
11
12
00
1
2
3
4
5
6
7
8
9
10
11
12
01
2
3
4
5
6
7
8
9
10
11
12
13
02
3
4
5
6
7
8
9
10
11
12
13
14
03
4
5
6
7
8
9
10
11
12
13
14
15
04
5
6
7
8
9
10
11
12
13
14
15
16
05
6
7
8
9
10
11
12
13
14
15
16
17
06
7
8
9
10
11
12
13
14
15
16
17
18
07
8
9
10
11
12
13
14
15
16
17
18
19
08
9
10
11
12
13
14
15
16
17
18
19
20
09
10
11
12
13
14
15
16
17
18
19
20
1
10
11
12
13
14
15
16
17
18
19
20
1
2
11
12
13
14
15
16
17
18
19
20
1
2
3
12
13
14
15
16
17
18
19
20
1
2
3
4
13
14
15
16
17
18
19
20
1
2
3
4
5
14
15
16
17
18
19
20
1
2
3
4
5
6
15
16
17
18
19
20
1
2
3
4
5
6
7
16
17
18
19
20
1
2
3
4
5
6
7
8
17
18
19
20
1
2
3
4
5
6
7
8
9
18
19
20
1
2
3
4
5
6
7
8
9
10
19
20
1
2
3
4
5
6
7
8
9
10
11
20
1
2
4
6
8
10
12
14
16
18
20
12
Литература
1. Альбицкая В.М., Серкова В.И. Задачи и упражнения по органической химии. – М.: Высшая школа, 1973.
2. Васильева Н.В., Буховец С.В., Журавлева Л.Е. и др. Задачи и упражнения по органической химии. – М.: Просвещение, 1982.
3. Кост А.Н., Сагитуллин Р.С., Терентьев А.П. Упражнения и задачи по органической химии. – М.: Высшая школа, 1974.
4. Киреева З.В. Контрольные работы по органической химии. – М.: Просвещение, 1985.
5. Романовская В.К. Химия. Решение задач. – С.-Пб.: Специальная литература, 1998.
6. Радецкий А.М., Горшкова В.П., Кругликова Л.Н. Дидактический материал по химии для 10-11 классов. – М.: Просвещение, 1996.
