Учебный план 2 иностранный язык 3 отечественная история 17
| Вид материала | Руководство |
- Учебный план общие дисциплины 1 Иностранный язык, 56.41kb.
- Учебный план общие дисциплины 1 Иностранный язык, 95.61kb.
- Программа аттестационных испытаний Филологический факультет Бакалавриат по направлению, 653.74kb.
- Учебно-методический комплекс дпп. Ф. 03 Старославянский язык Специальность 050301 Русский, 623.41kb.
- Методические рекомендации учителям-предметникам на 2009/2010 учебный год часть, 1491.73kb.
- Рабочий учебный план озо и фт и ппо специальность «Профессиональное обучение (экономика, 1909.51kb.
- Учебная программа для специальности (050303) "Иностранный язык " с дополнительной специальностью, 133.93kb.
- Учебно-методический комплекс по дисциплине «Латинский язык и античная культура» для, 152.82kb.
- Программа аттестационных испытаний Исторический факультет Бакалавриат по направлению, 892.46kb.
- Странному языку способствует не только более прочному и свободному практическому владению, 206.03kb.
ХИМИЯ
Щербакова В.А., Лосева Н.И.
Общая и неорганическая химия
Дисциплина ориентирует на учебно-воспитательную, социально-педагогическую, культурно-просветительскую, научно-методическую профессиональную деятельность. Ее изучение способствует решению следующих типовых задач профессиональной деятельности:
- осуществление процесса обучения химии в соответствии с образовательной программой
- планирование и проведение учебных занятий по химии с учетом специфики тем и разделов программы и в соответствии с учебным планом
- использование современных научно обоснованных приемов, методов и средств обучения химии, в том числе технических средств обучения, информационных и компьютерных технологий
- применение современных средств оценивания результатов обучения
- воспитание учащихся, формирование у них духовных, нравственных ценностей и патриотических убеждений
- реализация личностно-ориентированного подхода к образованию и развитию обучающихся с целью создания мотивации к обучению
- проведение профориентационной работы
- формирование общей культуры учащихся
- выполнение научно-методической работы, участие в работе научно-методических объединений
- обеспечение охраны жизни и здоровья учащихся во время образовательного процесса
- организация самостоятельной работы и внеурочной деятельности учащихся.
Требования к уровню освоения содержания дисциплины.
Программа определяет объем знаний будущего педагога, необходимый для преподавания химии в классах с различной направленностью (гуманитарный, химико-технологический, химико-биологический и др.), в альтернативных школах. В программу включены экологические, региональные и валеологические аспекты. Данная программа предусматривает более глубокое рассмотрение теоретических основ курса, усиление политехнической направленности химических элементов, имеющих важное теоретическое, практическое и прикладное значение.
В связи с новой парадигмой образования возникла необходимость ввести в курс химии вопросы региональной, экологии, гуманизации и валеологии, расширить сведения о применении химических соединений с учетом местных условий, усилить гуманитарную направленность программы.
После изучения данной дисциплины студент должен знать:
- понятия химических элементов, простого и сложного вещества, признаки и условия протекания химических реакций, законы постоянства состава веществ и сохранение массы веществ и энергии при химических реакциях;
- виды химической связи; уметь изображать графические формулы молекулярных соединений, определять степени окисления атомов химических элементов в предложенных формулах;
- распространение в природе, способы получения и практическое применение изученных неметаллов и металлов; важнейшие сплавы металлов и их применение.
Уметь:
- разъяснять смысл химических формул и уравнений;
- применять знания о строение атома, а также понятия относительной атомной и молекулярной массы, степени окисления при характеристике указанных в программе соединений неметаллов и металлов; составлять уравнения реакций, применять понятие окисления и восстановления при характеристике свойств изученных неметаллов и металлов; характеризовать свойства металлов - простых веществ на основе вытеснительного ряда металлов;
- определять по составу принадлежность веществ к изученным классам неорганических соединений (основным и кислотным оксидам, основаниям, кислотам, солям) и с помощью качественных реакций определять состав некоторых из них;
- составлять генетические ряды, образованные металлами и неметаллами, и выявлять генетические связи между веществами одного ряда и разных рядов;
- определять типы заданных химических реакций (соединения, разложения, замещения, обмена, ионного обмена, окисления-восстановления);
- аргументировать свои ответы при определении принадлежности веществ к классам неорганических соединений к определенным типам реакций;
- уметь различать понятия: химический элемент и простое вещество, кислородосодержащее и бескислородные кислоты, нормальные и кислые соли, экзо- и эндотермические реакции; объяснять условия протекания реакции ионного обмена до конца; расставлять коэффициенты с помощью электронного баланса;
- составлять уравнения реакций, подтверждающих химические свойства неорганических соединений; давать названия веществам;
- периодический закон химических элементов, структуру и основные закономерности периодической системы Д.И. Менделеева, значение периодического закона для развития науки, техники и представлений о природе;
- давать характеристику химических элементов первых трех периодов по положению в периодической системе и строению их атомов, определять состав атомных ядер, указывать заполнение электронами оболочек атомов, составлять формулы высших оксидов и гидроксидов химических элементов и соответствующих оснований, кислот, водородных соединений неметаллов;
- раскрывать тенденции изменения состава и свойств простых веществ, высших оксидов и гидроксидов, образованных химическими элементами одной главной подгруппы периодической системы Д.И. Менделеева или одного периода;
- выполнять обозначение в программе химические эксперименты;
- применять знания относительной атомной массы, вычислять относительную молекулярную массу веществ (по их формулам);
- производить расчеты по уравнениям химических реакций, обозначенные в программе.
Примерный перечень вопросов к зачету
- Основные классы неорганических соединений: а) кислоты, б) гидроксиды, в) оксиды, г) соли
- Определение. Классификация. Получение. Химические свойства.
- Основные законы химии.
- Периодический закон и периодическая система химических элементов.
- Гидролиз солей.
- Электролиз растворов и расплавов.
- Электролитическая диссоциация.
- Комплексные соединения.
- Окислительно-восстановительные реакции.
- Общая характеристика s-элементов.
- Общая характеристика р-элементов.
- Общая характеристика d-элементов.
Примерный перечень вопросов к экзамену
- Понятие «химическая реакция»: классификация химических реакций.
- Углерод. Характеристика углерода по положению в периодической системе. Физические, химические свойства. Водородные и кислородные соединения углерода их свойства.
- Оксиды (кислотные, основные, амфотерные). Их химические свойства.
- Натрий. Характеристика натрия по положению в периодической системе. Физические и химические свойства натрия. Соединения натрия и их свойства. Применение.
- Открытие периодического закона. Первые попытки классификации химических элементов. Значение периодического закона.
- Кальций. Положение кальция в периодической системе. Физические и химические свойства. Соединения кальция: оксид, гидроксид, соль. Применение.
- Основные характеристики химической связи: длина, энергия, направленность, валентный угол.
- Алюминий. Характеристика алюминия по положению в периодической системе. Физические и химические свойства алюминия. Соединения алюминия их свойства, применение.
- Ковалентная связь.
- Азот, положение азота в периодической системе, свойства, соединения азота: оксиды, кислоты.
- Ионная связь.
- Водородная и металлическая связь.
- Сера. Положение в периодической системе. Химические свойства. Сероводород. Оксиды серы. Серная кислота.
- Основные законы химии.
- Общая характеристика 7 группы главной подгруппы. Физические и химические свойства галогенов как простых веществ.
- Изменение свойств химических элементов в малых и больших периодах.
- Общая характеристика фосфора, по положению в периодической системе. Химические свойства. Фосфин, оксиды, фосфорная кислота.
- Изменение свойств химических элементов в главных и побочных подгруппах.
- Магний. Положение магния в периодической системе. Химические свойства магния и его соединений.
- Гидроксиды. Классификация. Химические свойства. Получение и применение.
- Общая характеристика химических элементов 5 группы, главной подгруппы.
- Кислоты. Классификация. Химические свойства. Получение и применение.
- Кислород. Положение кислорода в периодической системе. Химические свойства. Получение и применение.
- Соли. Классификация солей. Химические свойства. Практическая значимость.
- Цинк. Положение цинка в периодической системе. Физические и химические свойства. Соединение цинка.
- Строение ядер атомов, заполнение электронных оболочек химических элементов. Изотопы. Изобары.
- Общая характеристика химических элементов I группы, побочной подгруппы. Медь. Химические свойства. Свойства соединений меди.
- Комплексные соединения. Строение, номенклатура, классификация, изомерия.
- Водород. Положение водорода в периодической системе. Химические свойства.
- Окислительно-восстановительные реакции. Метод электронного баланса.
- Калий. Положение калия в периодической системе. Химические свойства калия и его соединений.
- Гидролиз солей.
- Железо. Положение в периодической системе. Химические свойства железа и его соединений. Физические свойства.
- Электролиз растворов и расплавов солей.
- Скорость химической реакции.
- Металлы. Положение металлов в периодической системе, их химические свойства.
- Химическое равновесие. Катализ.
- Кремний. Положение кремния в периодической системе. Химические свойства, соединения кремния.
Контрольная работа
Общие методические указания.
Для студентов-заочников биолого-химических факультетов педагогических вузов. Общая и неорганическая химия - основная дисциплина, фундамент, на котором базируется усвоение всех других химических дисциплин.
Цели и задачи:
- Способствовать развитию у студентов химического мышления.
- Дать студенту современное научное представление о материи и формах ее движения, о веществе как одном из видов движущейся материи, о механизме превращения химических соединений.
- Показать роль химических процессов в развитие Вселенной и воздействие на природу человека, который с помощью химических превращений получает вещества с заранее заданными свойствами.
- Добиться прочного усвоения студентами основных законов и теорий химии и овладения техникой химических расчетов. Вырабатывать навыки и умение самостоятельного выполнения лабораторных опытов и обобщения наблюдаемых фактов.
- Показать значение химии в промышленности и сельском хозяйстве.
Работа студента под курсом общей и неорганической химии слагается из следующих элементов: самостоятельное изучение материала по учебникам и учебным пособиям, выполнение контрольных заданий, лабораторного практикума, индивидуальные консультации, посещение лекций, сдача зачета по лабораторному практикуму и экзамена по всему курсу.
Самостоятельные занятия с книгой.
Приступая к изучению данного курса, прежде всего ознакомьтесь с его содержанием по программе, объемом каждой темы и последовательностью содержащихся в ней вопросов. Изучать курс рекомендуется по отдельным темам.
При первом чтение не следует особенно задерживаться на математических выводах, составлении уравнений реакций; старайтесь получить общее представление об излагаемых вопросах; отмечайте трудные или неясные места. Затем переходите к дальнейшему изучению материала.
Чтобы лучше запомнить и усвоить изучаемый материал, надо иметь рабочую тетрадь и заносить формулировки законов и основных понятий химии, значения новых незнакомых терминов и названий и уравнения реакций, математические зависимости и их выводы.
Краткий конспект полезен и при повторении материала в период подготовки к экзамену.
Контрольные задания.
В процессе изучения курса общей и неорганической химии студенты биолого-химического факультета педагогического института должны выполнить одну контрольную работу, которая включает теоретические вопросы и задачи.
Выполнение контрольной работы не должно быть самоцелью, оно является формой методической помощи студентам при изучении курса.
Решения задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы. При решении задач нужно приводить все математические преобразования. Контрольная работа должна быть аккуратно оформлена. Для замечаний рецензента надо оставлять поля. В работах номера и условия задач следует переписывать в том порядке, в каком они указаны в задании.
В конце работы следует привести список используемой литературы с указанием года издания. Работа должна быть датирована и подписана студентом. Каждый студент выполняет вариант контрольных заданий указанных преподавателем. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не засчитывается.
Консультации.
В случае каких –либо затруднений, возникающих при изучении курса, следует обращаться за консультацией к преподавателю, рецензирующему контрольные работы. Консультации можно получить по вопросам организации самостоятельной работы и по другим организационно – методическим вопросам.
Лекции.
В период экзаменационных сессий для студентов читаются лекции.
Зачет.
По выполнению лабораторного практикума и семинарских занятий, студент сдает зачет. Во время сдачи зачета необходимо изложить ход лабораторной работы, объяснить результаты выполненных опытов и выводы из них, уметь составлять уравнения реакций и решать соответствующие задачи.
Экзамен.
К сдаче экзамена допускаются студенты. Которые выполнили контрольные задания и получили зачет по семинарско - лабораторному практикуму.
Раздел I. Основные законы химии.
В задачах 1 –3 определить химический эквивалент подчеркнутых соединений, участвующих в реакциях ионного обмена..
1. KHSO4 + KOH = K2SO4 = H2O
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 = 2H2O
2. 2KOH +H2SO4 = K2SO4 + H2O
Cu(OH)2 + HCl = CuOHCl + H2O
3. H3PO4 + NaOH = NaH2PO4 +H2O
H3PO4 + 2NaOH = NaHPO4 + 2H2O
4. Вычислите малярную массу эквивалента серы, если известно, что при сгорании серы массой 5 грамм получится оксид серы (IV) SО2 массой 10 г.
5.Найдите эквиваленты металлов в соединениях AqNО3, K2SO4, FeCl3, NaHCO3.
- Для сгорания металла массой 4 г требуется кислорода объемом 2,24 л при нормальных условиях. Определите молекулярную массу эквивалента этого металла.
- Выведите истинную формулу вещества, состоящего из атомов водорода, углерода, кислорода с массовым соотношением 1:6:4 и с плотностью по водороду, равной 22.
- Какой объем воздуха (при н.у.) нужен для сжигания серы массой 4 г до SО2.
- При нормальных условиях масса 1 л оксида углерода (IV) равна 1,98 г. Определить массу оксида углерода (IV), занимающего при Оо С и давлении 4,52 х 104 Па объем 3 л.
- Сколько литров СО2 образуется при взаимодействии углерода массой 4 г с кислородом объемом 11,2 л (н.у.)? Избыток какого вещества и в каком количестве останется после реакции?
- Назовите элемент, который образует с водородом газообразное соединение с массовой долей водорода 2,47%.
- При окислении щелочно – земельного металла массой 2,25 г образуется оксид массой 6,25 г. Назовите этот металл.
- При сгорании трехвалентного металла массой 11,2 г образовался оксид массой 16 г. Какой был взят металл?
- Определите молярную массу газа, если 5 г его при нормальных условиях занимают объем 4 л.
- Вычислите объем, занимаемый при нормальных условиях: а) 11 г СО2; б) 4 г СН4; в) 71 г Cl2; г) 8 г О2.
- Масса азота объемом 1 л при нормальных условиях равна 1,25 г. Определите относительную молекулярную массу азота.
- Определите объем сернистого газа SО2 массой 16 г при нормальных условиях.
- Вычислите молярную массу эквивалента металла (II) и его молярную массу, если известно, что при взаимодействии этого металла массой 8 г с кислотой выделяется водород объемом 4,48 л (н.у).
- Выведите истинную формулу вещества с массовой долей углерода 80% и водорода 20%. При нормальных условиях 1 л этого газа имеет массу 1,34 г.
- Масса 8 л некоторого газа (н.у.) составляет 5,72 г. Определите относительную молекулярную массу этого газа.
Раздел II. Строение атома. Радиоактивность. Изотопы.
- Кем и когда были открыты электроны, протоны, нейтроны, какова их масса и заряд? Из каких частиц состоит атомное ядро?
- Какова сущность теории строения атома Резерфорда и ее недостатки.
- В чем сущность теории атома Бора- Зоммерфельда и ее недостатки?
Укажите для атомов
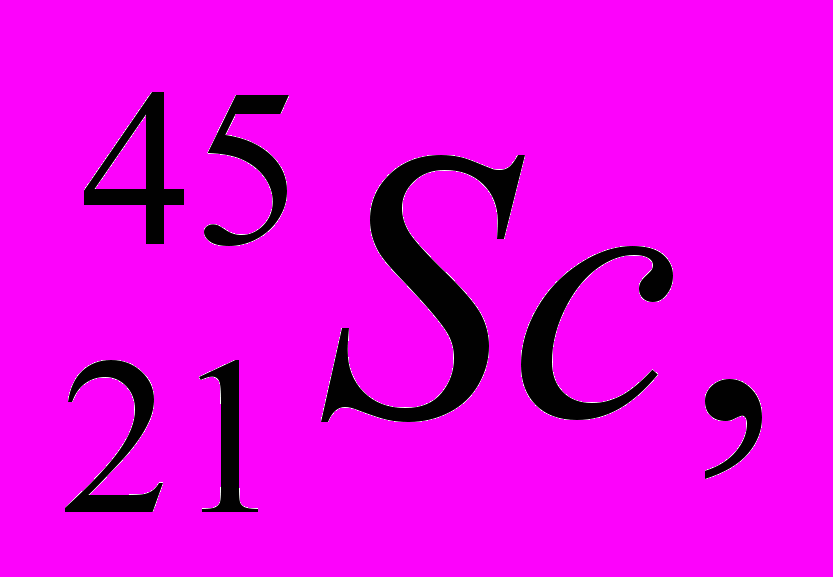

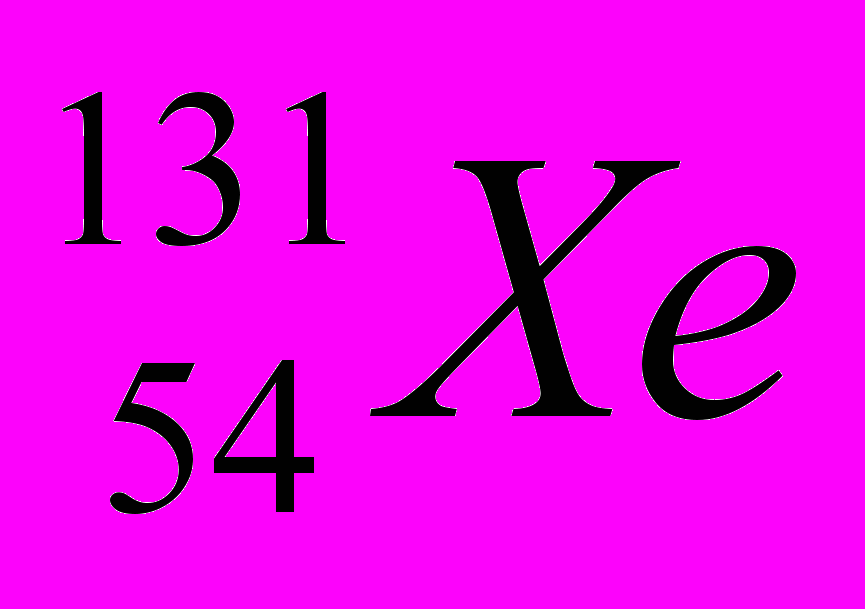

а) число протонов и нейтронов в ядре,
б) общее число электронов в атоме.
- На основание строения атома докажите, у какого элемента II группы, у магния или стронция, сильнее проявляются металлические свойства?
- Напишите электронные формулы для ионов: Fe 2+, Fe 3+, Cl-, S2-, Cu 2+.
- Сколько свободных d – орбиталей имеет атом ванадия? Напишите для него электронную и электронно – графическую формулы.
- В задачах 8-10 определите : атому какого элемента отвечает каждая из электронных формул?
а) 1S22S22P3; б) 1S22S22P63S23P63d104S1.
9. а) 1S22S22P63S23P4; б) 1S22S22P63S23P63d44S2.
10. а) 1S22S22P63S23P5; б) 1S22S22P63S23P63d104S24Р5.
В задачах 11-13 напишите электронные формулы атомов элементов, находящихся в нормальном и возбужденном состоянии, соответствующем их высшей степени окисления.
11. Фосфора и алюминия;
12. Хлора и марганца;
13. Кремния и серы.
14. Составьте электронную формулу атома элемента с порядковым номером 39. На основании электронной формулы определите период и группу периодической системы, в которых находится этот элемент.
15. Написать квантовые числа, характеризующие электроны четвертого энергетического уровня.
16. По какому принципу делят элементы на s-, p-, d-, f- свойства?
17. Определить место в периодической системе элементов, атомы которых имеют электронные структуры, выражаемые электронными формулами:
а) 1S22S22P3; б) 1S22S22P63S23P63d34S2; б) 1S22S22P63S23P63d104S1.
18. Рассчитайте максимальное число электронов на 4-ом и5-ом энергетических уровнях атома.
19. Определите число протонов и нейтронов в изотопе алюминия 27Al и изотопе 15N.
20. Сформулируйте принцип Паули и правило Хунда, используемые при написании электронных конфигураций.
Раздел III. Периодический закон и периодическая система химических
элементов Д.И. Менделеева.
- Элемент, высший солеобразующий оксид которого соответствуют формуле RO2, образует с водородом газообразное соединение, содержание12,5 % водорода. Определите этот элемент.
- Элемент, высший солеобразующий оксид которого отвечает формуле R2O5 образует с водородом газообразное соединение, содержащее 3,85 % водорода . Назовите этот элемент.
- Найдите в периодической системе Д.И. Менделеева элемент, который с кальцием образует соединением CaX2. В водородом соединении элемента 5% водорода.
- Какими свойствами должен обладать элемент, порядковый номер которого в периодической системе элементов Д.И. Менделеева равен 25?
- При взаимодействии 10 г двухвалентного металла с водой выделилось 0,25 моля водорода. Определите металл.
- Какими химическими свойствами должен обладать элемент с порядковым номером 35? С какими элементами в периодической системе он должен быть наиболее сходен? Дайте обоснованный ответ.
- У какого из элементов I группы, у калия или цезия, сильнее выражены металлические свойства? Почему? Какой из них образует более сильный гидроксид? Как можно получить этот гидроксид.
- При взаимодействии двухвалентного металла массой 4 г с водой выделился водород объемом 0,224 л , измеренный при нормальных условиях. Назовите этот металл.
- Как изменяются металлические свойства элементов в группах и периодах ?
- Назовите элемент, высший солеобразующий оксид которого отвечает формуле ХО3, образует с водородом газообразное соединение, массовая доля водорода в котором 1,54%.
- Определите, к какой группе и подгруппе относится элемент, образующий газообразное соединение с водородом, если высший оксид его имеет относительную молекулярную массу 108 и массовая доля кислорода 74%.
- Опишите в общем виде характер изменения энергия ионизации атомов при движении по периодам и по группам периодической системы.
- С какими веществами, приведенными ниже, будет реагировать при обычных условиях гидроксид элемента № 30 в водной среде: серная кислота, кислород, гидроксид калия, железо, оксид алюминия.
- В каких группах периодической системы находится элементы, образующие газообразные соединения с водородом? Какие из них обладают кислотными свойствами? Ответ подтвердите уравнениями реакций.
- Определите относительную атомную массу элемента II группы, в карбиде которого массовая доля углерода 37,5 %. Дайте полученному элементу характеристику по положению в периодической системе и опишите его химические свойства.
- Определите относительную атомную массу элемента V группы, в водородном соединении которого массовая доля водорода 8,82%. Назовите элемент и опишите его химические свойства.
- Определите металл и опишите его свойства, если при растворении 7,8 г его в воде выделяется водород объемом 2,24 л при нормальных условиях.
- Какой из гидроксидов будет проявлять основные, какой амфотерные свойства? Почему?
а) Fe(OH)2 и Fe(OH)3;
б) CuOH и Cu(OH)2;
в) Mn(OH)2 и Mn(OH)4.
- Какое основание более сильное и почему?
А) Ca(OH)2 или Zn(OH)2;
Б) Sr(OH)2 или Cd(OH)2;
В) Zn(OH)2 или Sr(OH)2.
- Какими свойствами должен обладать элемент, порядковый номер которого в периодической системе элементов Д.И. Менделеева равен 25. Приведите уравнения реакций.
