Учебный план 2 иностранный язык 3 отечественная история 17
| Вид материала | Руководство |
- Учебный план общие дисциплины 1 Иностранный язык, 56.41kb.
- Учебный план общие дисциплины 1 Иностранный язык, 95.61kb.
- Программа аттестационных испытаний Филологический факультет Бакалавриат по направлению, 653.74kb.
- Учебно-методический комплекс дпп. Ф. 03 Старославянский язык Специальность 050301 Русский, 623.41kb.
- Методические рекомендации учителям-предметникам на 2009/2010 учебный год часть, 1491.73kb.
- Рабочий учебный план озо и фт и ппо специальность «Профессиональное обучение (экономика, 1909.51kb.
- Учебная программа для специальности (050303) "Иностранный язык " с дополнительной специальностью, 133.93kb.
- Учебно-методический комплекс по дисциплине «Латинский язык и античная культура» для, 152.82kb.
- Программа аттестационных испытаний Исторический факультет Бакалавриат по направлению, 892.46kb.
- Странному языку способствует не только более прочному и свободному практическому владению, 206.03kb.
Окислительно- восстановительные реакции.
- Расположите соединения: 1) ВСl3, 2)CCl4, ZiCl, ВeCl2 по возрастанию полярности связи. Дайте объяснение.
- Перечислите основные типы химической связи, приведите по два примера каждого вида связи. Изобразите электронные схемы молекул
Cl2, HBr, N2.
- Даны формулы химических соединений: S, CaSO4, Na2S, SO2, K2SO4. Определить степень окисления серы.
- Даны формулы соединений: CrCl2, K2CrO4, Cr, CrO3, Cr(OH)3.
Определить степень окисления хрома.
- Определить степень окисления азота в следующих формулах веществ: N2O4, NaNO2, N2O5, NH3, HNO3.
- Определить вид химической связи: 1) хлор; 2) бромид кальция; 3) сероводород; 4) хлорид кальция; 5)оксид углерода (IV).
- В заданиях 7-10 закончить уравнение ОВР, расставить коэффициенты указать тип окислительно- восстановительной реакции, указать окислитель и восстановитель.
Cu + HNO3 (p) →
Na2SO3 + KMnO4 + H2SO4 →
KClO3 →
As2O3 + HClO3 + H2O →
- Fe + HNO3 (p) →
KI + KMnO4 + H2SO4 →
H2O →
FeS +O2 +H2SO4 →
- Mg + HNO3 раз →
Na2SO3 + KMnO4 + KOH →
NH4NO3 →
H2S +Br2 →
- Сu + H2SO4к →
NaI + MnO2 + H2SO4 →
NaNO3 →
As2S3 + HNO3 +H2O →
- KMnO4 + FeSO4 +H2SO4 →
NH4NO3 →
HNO3 +P + H2O →
AgNO3 + I2 + H2O →
- PbO + C →
NO2 + KMnO4 +H2O →
SnCl2 +K2CrO7 + H2SO4 →
KClO3 →
- KMnO4 + KNO2 +H2SO4 →
FeBr2 +Cl2 →
FeSO3 + K2Cr2O7 +H2SO4 →
Cu2S + O2 →
- FeSO3 +KMnO4 + H2SO4 →
Cu2 S +HNO3 →
FeS2 +O2 →
NH3 + Br2 →
- Na2S + HNO3 →
NH3 + Br2 →
MnO2 + HBr →
Fe + H NO3р-р →
- PbO2 +HCl →
HCl + CrO3 →
Co + H NO3р-р →
FeS + H NO3конц →
- HCl + KMnO4 →
Al + HNO3 →
Pb + H NO3 р-р→
H2SO4 + Cu →
18. Hg + H2SO4 →
HCl + MnO2 →
PH3 + O2 →
S + H2SO4 →
19. H3PO3 + KMnO4 + H2SO4 →
KNO3 →
Ca(OH)2 + Cl →
H2+N2 →
20. KMnO4 →
KOH + Cl →
Mg + CO2 →
C + HNO3 →
Раздел V. Электролитическая диссоциация. Растворы электролитов.
Ионные реакции обмена.
В задачах с 1-10 составьте молекулярные, ионные и сокращенно – ионные уравнения реакций, протекающих между следующими:
1.а) хлоридом железа (III) и фосфатом натрия
б) гидроксидом цинка и раствором гидроксида калия.
в) гидрокарбонатом кальция и гидроксидом кальция.
2.а) хлоридом меди (II) и фосфатом калия
б) гидроксидом сурьмы (III) и гидроксидом натрия
в) гидрофосфатом натрия и гидроксидом калия
3.а) сульфатом железа (II) и соляной кислотой
б) хлоридом алюминия и гидроксидом калия
в) сульфатом натрия и хлоридом бария.
4. а)фосфатом меди (II) и серной кислотой
б) оксидом хрома (III) и гидроксидом калия
в) гидрокарбонатом магния и соляной кислотой.
5.а) нитратом свинца (III) и хроматом калия
б) гидроксидом алюминия и гидроксидом натрия
в) хлоридом калия и нитратом серебра.
6. а) гидрокарбонатом кальция и бромидом водорода.
б) сульфидом натрия и хлоридом цинка.
в) сульфат алюминия и нитратом бария.
7.а) хлоридом железа (III) и гидроксидом калия
б) карбонатом натрия и гидроксидом кальция
в) силикатом натрия и соляной кислотой.
8.а) сульфатом меди (II) и гидроксидом натрия
б) хлоридом меди (II) и карбонатом калия
в) оксидом меди (II) и азотной кислотой (конц.)
9.а) гидроксидом алюминия и азотной кислотой
б) сульфатом железа (III) и гидроксидом натрия
в) гидроксидом бария и фосфорной кислотой.
10.а) сульфатом цинка и сульфидом аммония
б) оксидом олова (II) и соляной кислотой
в) силикатом натрия и серной кислотой
В задачах 11-20 укажите какие соли подвергаются гидролизу. Составьте молекулярные, ионные уравнения гидролиза.
11. иодид калия, сульфат натрия, сульфат цинка.
12. хлорид натрия, сульфат меди, хлорид хрома (III)
13. нитрат никеля (II), сульфид калия, хлорид железа (II)
14. ацетат натрия, нитрат меди (II), сульфид меди (II)
15. сульфид хрома (III), хлорид кальция, нитрат алюминия.
16. карбонат аммония, сульфид алюминия, хлорид цинка.
17. карбонат алюминия, сульфит калия, сульфат алюминия.
18. карбонат калия, хлорид железа (II), сульфид железа (II).
19. нитрат калия, сульфат алюминия, карбонат натрия.
20 хлорид цинка, нитрат меди, сульфат железа (III)
Раздел VI. Комплексные соединения
В заданиях 1- 10 дайте название комплексного соединения, определите степень окисления и координационное число комплексообразователя.
1. K[AuBr4]
2. [Cd(NH3)4]OH2
3. Na3[Ag(SO3)2]
4. K[Pt(NH3)Cl5]
5. H[CO(CN)4(H2O)2]
6. Cu2[Fe(CN)6]
7. K3[CO(NO2)6]
8. Ba[Cu(SCN)(CN)3]
9. [Cr(NH3)4(H2O)2] Br3
10. [Ag(NH3)2]Cl
11. Из каких солей можно получить K3 [Fe(CN)6], написать уравнение реакции.
12. Написать в молекулярной и ионной форме уравнение реакции между
Cu(NO3)2 и K4 [Fe(CN)6], протекающей с образованием осадка
Cu3 [Fe(CN)6]
В заданиях 13-20 назовите комплексное соединение, укажите координационное число, степень окисления комплексообразователя, напишите уравнение диссоциации.
13. [Ag(NH3)6]Cl
14. K[Ag(CN)2]
15. K3[Fe(CN)6]
16. K4[Fe(CN)6]
17. [Cu(NH3)4]SO4
18. [Co(NH3)4]Cl4
19. [Co(NH3)4]SO4
20. [Zn(CN)4]SO4
Раздел VII. Цепочка превращений.
В заданиях 1 приведите уравнение реакций для указанных цепочек превращения
1. карбонат кальция → гидрокарбонат кальция → карбонат кальция → оксид кальция → гидроксид кальция → алюминат кальция.
2.
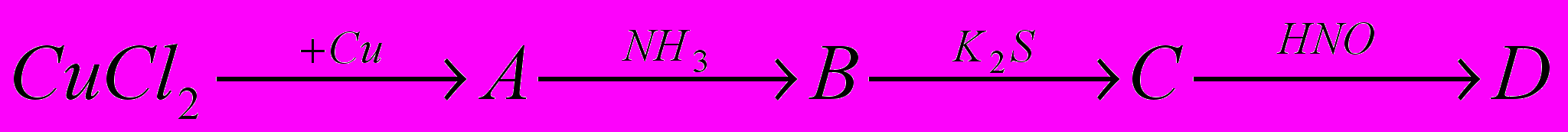
3.
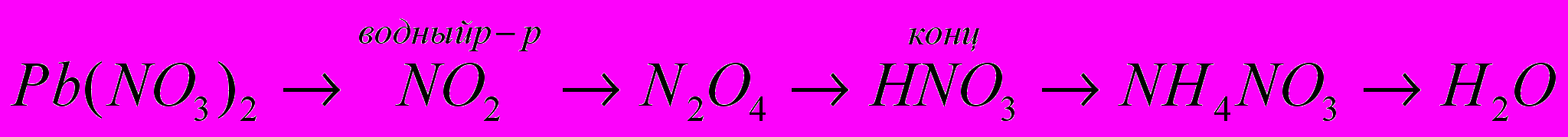
4.

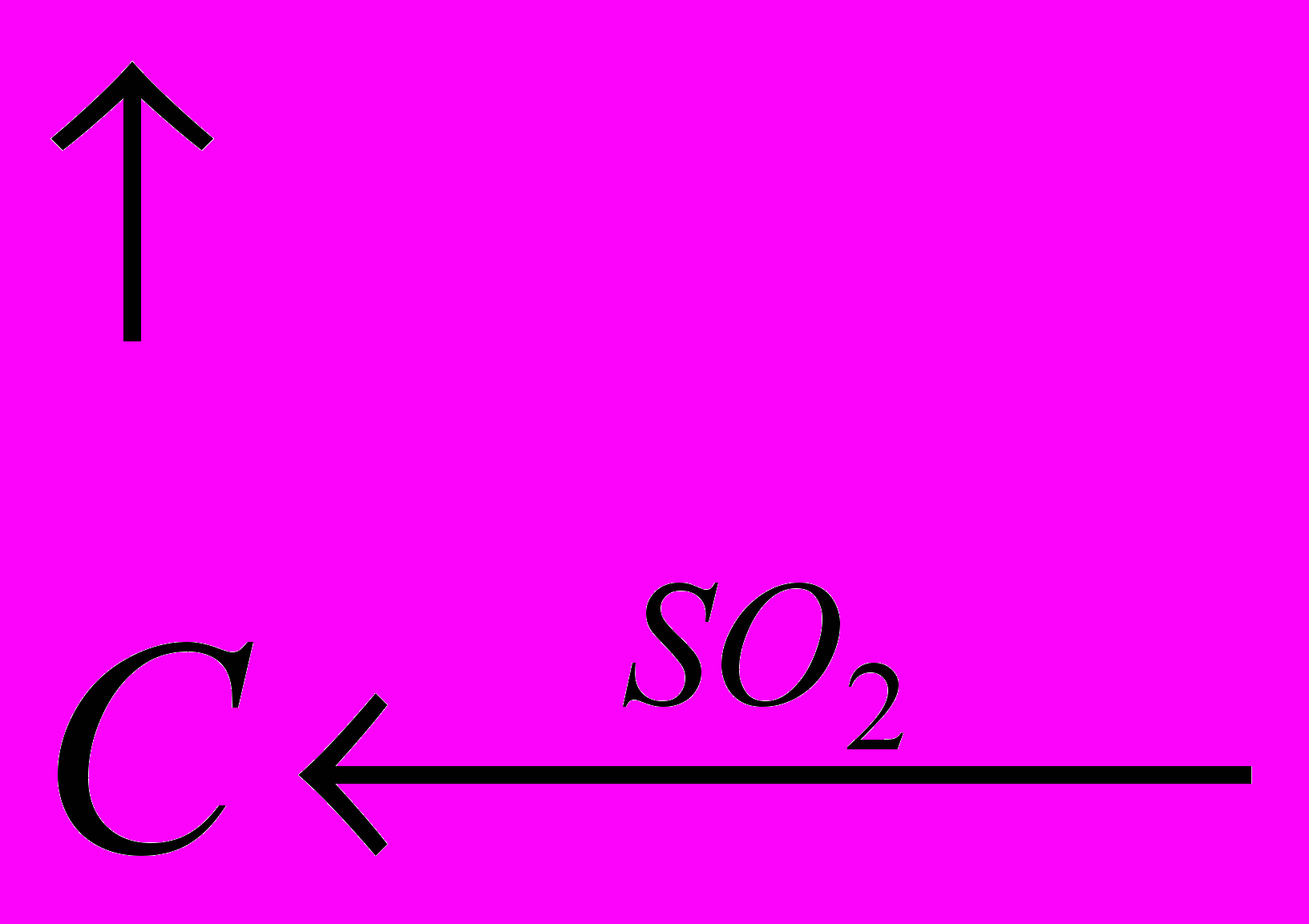
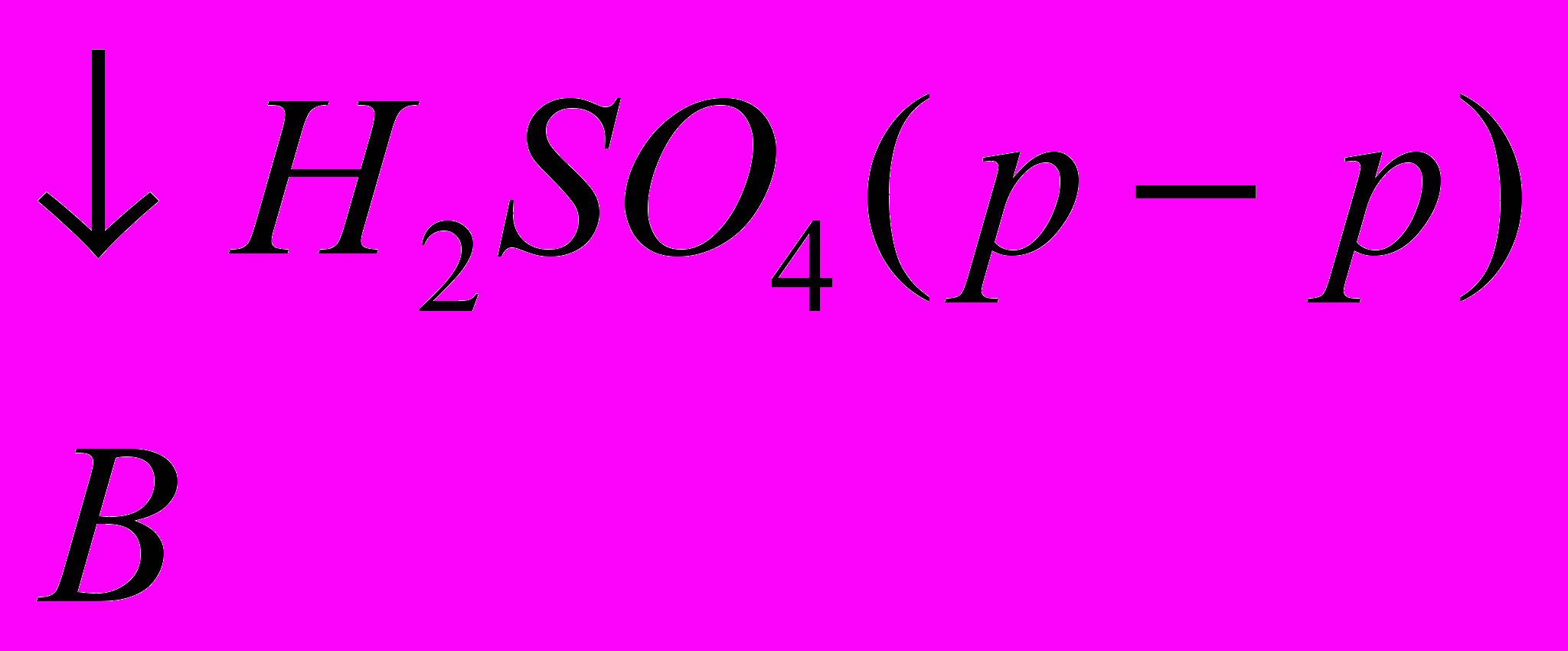
H2SO4
5.
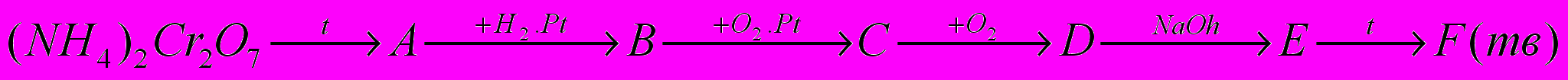
6.
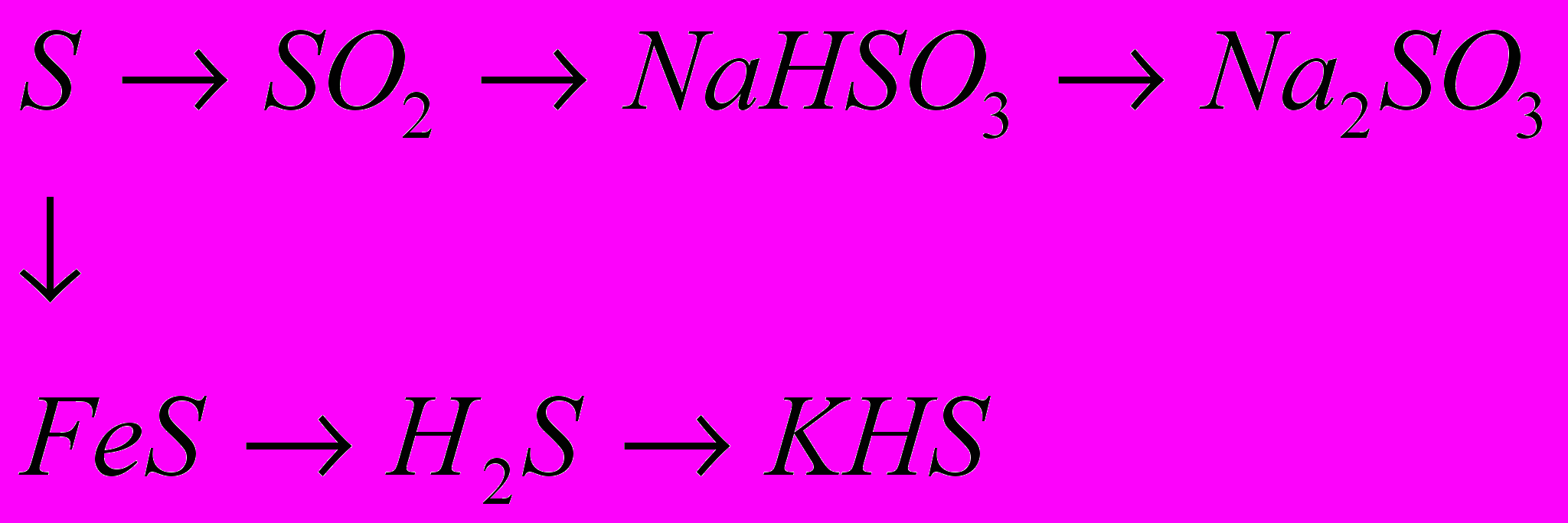
7.
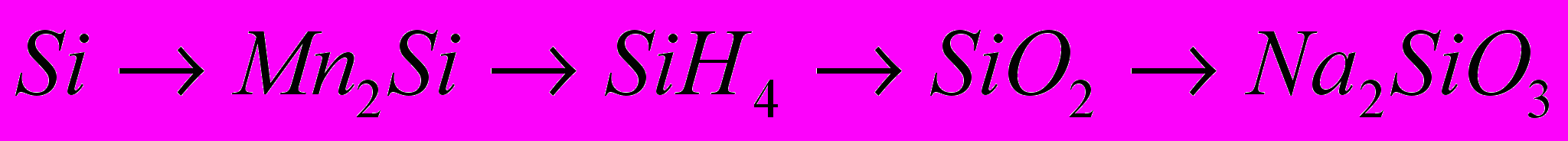

8.
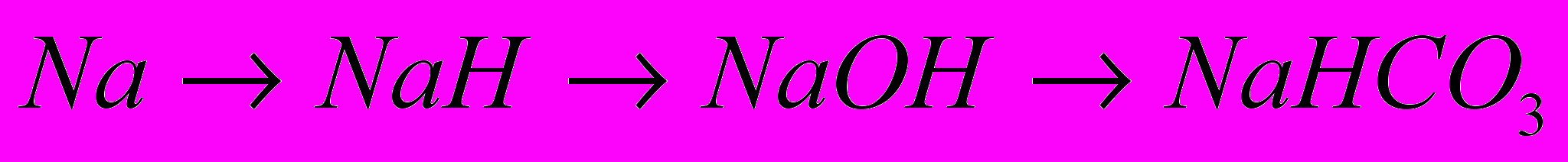
9.

10. Ca → CaH2 → Ca(OH)2 →Ca(HCO3)2 → CaCO3 → CaCl2→ Ca3(PO4)2
11. Al →Al2O3 →NaAlO2 → AlCl3 →Al(OH)3 → Na[Al(OH)4]
12. Cr2O3 → K2CrO4 → K2Cr2O7 → Cr2(SO4)3 → K3[Cr(OH)6]
13. Железо → нитрат железа (III) → оксид железа (III) → оксид железа (II) → железо → сульфат железа (II) → гидроксид железа (III)→ тетрагидрокса – феррат (III) натрия.
14. Al → AlCl3 → Al(OH)3 → NaAlO2 → AlCl3
15. S → SO2 → SO3 → H2SO4 → S
16. NO2 → HNO3 → NH4NO3 → Ba(NO3)2 → NO2
17. Mn → Mn(NO3)2 → MnO2 → K2MnO4→ KMnO4 → MnO2
18. SiO2 → Si → Mg2Si → Si H4 → Na2SiO3
19. ZnO → ZnCl2 → Zn(OH)2 → Zn(NO3)2 → Na2 [Zn(OH)4]
20. Fe → Fe(OH)2 → Fe(OH)3 → Fe2O3
Раздел VIII.Взаимодействие металлов с водой кислотами и щелочами.
1. Сплав меди и серебра массой 5 г растворили в избытке концентрированной азотной кислоты. К полученному раствору добавили 50 г раствора хлорида натрия, содержащего 10 масс % NaCl. При этом образовалось 1,44 г белого творожистого осадка. Определите процентный состав меди и серебра.
2. Объясните, почему при практическом осуществлении электролиза раствора хлорида натрия объем водорода, выделяющегося на катоде, больше объема хлора, выделяющегося на аноде? (н.у.)
3. Имеется смесь углекислого газа и кислорода. Как химическим путем выделить из этой смеси чистый кислород и чистый углекислый газ?
4. Сколько оксида хрома (III) и азота в литрах образуется при разложении дихромата аммония массой 27 г , содержащего массовую долю примесей 7,41 %?
5. Сколько граммов KMnO4 потребуется для окисления Na2SO3 массой 12,6 г в щелочной и кислой средах?
6. К 4 г соли, содержащей перманганат калия, прибавили концентрированную соляную кислоту. Определить процентное содержание перманганата калия в соли, если в результате реакции образовалось 1,12 г хлора (н.у)
7. При действии на сплав железа с медью избытка соляной кислоты выделилось 224 мл газа (н.у). Вычислите массу сплава, если известно, что железа в нем содержалось 20% по массе.
8. Определите массу раствора NaOH (10 – 40%) необходимую для нейтрализации раствора, в котором содержится 1 моль ортофосфорной кислоты, 3 моль уксусной, 2 моль соляной и 1 моль серной.
9. При растворении в соляной кислоте 1,82 смеси алюминия с неизвестным металлом, стоящим в ряду стандартных электродных потенциалов после водорода, выделилось 0,672 л водорода. Чтобы окислить эту смесь, потребовалось 0,56 л кислорода (н.у.) Какой металл был взят? Определите массовую долю металла в смеси.
10. Как распознать следующие вещества, имея воду и азотную кислоту: мел, гипс, сода, апатит? Ответ обоснуйте и подтвердите соответствующими уравнениями реакций?
11. При нагревании твердого вещества массой 2,45 г. выделился кислород объемом 672 мл (н.у). В оставшемся твердом веществе содержатся элементы: калий массовой долей 52,35 % и хлор массовой долей 47,65 %. Вывести химическую формулу исходного вещества.
12. В раствор поваренной соли массой 200 г и массовой долей 5% добавили 10 г соли. Вычислить массовую долю соли в образовавшемся растворе.
13. К 234 5 % - ного раствора хлорида натрия примеси 687 г 10 % - ного раствора нитрата серебра. Осадок отфильтровали. Какова масса осадка? Какие вещества содержатся в фильтрате?
14. При обработке смеси карбоната, и гидрокарбоната натрия массой 6,98 г соляной кислотой выделился газ объемом 1,568 л, измеренный при н.у. Вычислите массовые доли компонентов в смеси.
15. Исходя из минимального числа простых веществ и продуктов их взаимодействия получите медный купорос. Напишите соответствующие химические реакции, укажите условия их протекания и назовите классы образующихся соединений.
16. С помощью химических превращений разделите смесь серебра, карбоната кальция и оксида кремния (VI).
17. Какие химические реакции можно осуществить, имея алюминий, серную кислоту и щелочь?
18. Оксид кремния (IV) массой 24 г прокалили с магнием массой 28,8 г При обработке образовавшейся массы соляной кислотой выделился водород объемом 6,72 л (н.у) Определите массу полученного кремния.
19. Для восстановления Fe2O3 до металлического железа потребовалось 6,72 л СО. Образовавшийся в результате реакции газ поглотили раствором, содержащим 22,2 г Са(ОН)2. Определить состав и массу образовавшейся соли, а также исходную массу Fe2O3.
20. У какого из оксидов более выражены основные свойства: а) РbO или SnO; б) РbO или РbO2? Чем это объясняется?
Рекомендуемая литература
Основная
1. Ахметов Н.С. Общая неорганическая химия. – М.: Высшая школа, 2001.
2. Гаршин А.П. Неорганическая химия. СПб., 2000.
3. Гельфман М.И., Юстратов В.П. Химия. СПб., 2000.
4.Глинка Н.Л. Задачи и упражнения по общей химии. – М.: Интеграл – Пресс, 2002.
5. Глинка Н.Л. Общая химия. – М.: Интеграл – Пресс, 2002.
6. Дробашева Т.И. Общая химия. Ростов-на-Дону: Феникс, 2004.
7. Коровин Н.В. Общая химия. – М.: Высшая школа, 2002.
8. Пособие для самоподготовки по химии. / Под ред. В.Н. Чернышева. Ростов-на-Дону, 2003.
9. Пустовалова Л.М., Никанорова И.Е. Неорганическая химия. Ростов-на-Дону: Феникс, 2005.
10. Угай Я.А. Общая химия и неорганическая химия. – М: Высшая школа, 2002.
Дополнительная
1. Бабич М.Е. Практикум по неорганической химии. – М.: Просвещение, 1991.
6. Князев В.Д., Смарыгин С.Н. Неорганическая химия. – М.: Просвещение, 1990.
7. Кудрявцев А.А. Составление химических уравнений. – М.: Высш. школа, 1991. - 320 с.
9. Кукушкин Ю.Н. Соединения высшего порядка. Вопросы современной химии. – М.: Химия, 1991. - 112 с.
11. Медин и др. Неорганическая химия в вопросах. – М.: Высшая школа, 19991.- 256 с.
12. Мартыненко Л.И., Спицин В.И. Избранные главы неорганической химии. - М.: Изд-во МГУ, 1988. - 225 с.
13. Мовсумзаде Э.М. и др. Химия в вопросах и ответах с использованием ЭВМ. – М.: Высшая школа, 1991.- 191 с.
14. Некрасов Б.В. Основы общей химии. – М.: Химия, 1973. Т.1.II.
16. Химия актиноидов /Под ред. Дж. Каца, Г. Сиберта, П. Морсса. – М.: Мир, 1991.- 525 с.
Органическая химия
Данный раздел по органической химии включает изучение основных классов органических веществ, ознакомление с историей науки и основными положениями методологии, с закономерностями строения, свойств и превращений органических веществ. Включены также вопросы о механизмах органических реакций, физико-химических методах. Исследования в органической химии, значении катализа в превращениях органических веществ являются базовыми знаниями для изучения биологической химии. Также предполагается знакомство с важнейшими открытиями и тенденциями последних десятилетий.
Знания по органической химии крайне важны и по соображениям мировоззренческого характера. Они помогут учителям биологии средней школы в воспитательной работе и вооружат их правильными представлениями о многообразии и сложности материального мира, высшие формы развития которого построены из органических соединений.
Основу раздела программы «Органическая химия» составляют вопросы, имеющие наибольшее значение для понимания основных проблем органической химии и позволяющие студентам самостоятельно работать с учебными пособиями.
Программой предусматривается изложение лекционного курса, лабораторный практикум, самостоятельные работы, контрольные работы, собеседование со студентами по наиболее трудным вопросам курса. Часть материала, не представляющего собой трудности для усвоения (алкадиены, ненасыщенные карбоновые кислоты и др.) может быть вынесена на самостоятельное изучение. В программу включены вопросы эколого - валеологического (алканы, спирты, ароматические углеводороды и т.д.) и гуманитарного (история открытия соединений, исторические факты из жизни знаменитых химиков - органиков) характера. В некоторых, темах учтен региональный аспект (способы получения и применение алканов, диеновых углеводородов и т.д.).
В качестве итогового контроля знаний при изучении данного курса учебным планом предусмотрено проведение экзамена и зачета.
Цели и задачи дисциплины
Дисциплина ориентирует на учебно-воспитательную, социально-педагогическую, культурно-просветительскую, научно-методическую профессиональную деятельность. Ее изучение способствует решению следующих типовых задач профессиональной деятельности:
- осуществление процесса обучения естественным наукам в соответствии с образовательной программой
- использование современных научно обоснованных приемов, методов и средств обучения биологии и химии, в том числе технических средств обучения, информационных и компьютерных технологий
- применение современных средств оценивания результатов обучения
- воспитание учащихся, формирование у них духовных, нравственных ценностей и патриотических убеждений
- реализация личностно-ориентированного подхода к образованию и развитию обучающихся с целью создания мотивации к обучению
- проведение профориентационной работы
- формирование общей культуры учащихся
- выполнение научно-методической работы, участие в работе научно-методических объединений
- обеспечение охраны жизни и здоровья учащихся во время образовательного процесса
- организация самостоятельной работы и внеурочной деятельности учащихся
Требования к уровню освоения содержания дисциплины
В результате изучения курса студент должен:
Знать:
- основные положения теоретической органической химии, строение органических веществ, номенклатуру, физические и химические свойства, распространение в природе и применение;
- основные направления развития теоретической и практической органической химии;
- знать типовые механизмы химических реакций и уметь применять их;
- знать промышленные и лабораторные способы получения основных продуктов химии;
Уметь:
- определить класс и назвать органические соединения по применяемым номенклатурам;
- освоить основные принципы и методы современного органического эксперимента;
- по строению вещества определять его химические свойства;
- пользоваться химической литературой (справочной, научно – популярной, периодической и др.);
- соблюдать правила ТБ при работе с органическими соединениями, принимать меры первой помощи при отравлении или попадании на кожу органических веществ.
Владеть навыками:
- лабораторной работы;
- идентификации органических соединений.
Вопросы к зачету
1. Гомологический ряд предельных углеводородов. Номенклатура, изомерия, способы получения алканов.
2. Химические свойства алканов (механизм Sr).
3. Этилен: электронное строение молекулы, способы получения, применение.
4. Алкены: общая формула, номенклатура, изомерия, химические свойства, Правило Марковникова.
5. Алкины: общая формула, номенклатура, изомерия, способы получения.
6. Электронное строение молекулы ацетилена. Химические свойства ряда ацетиленовых углеводородов. Реакция Кучерова.
7. Диеновые углеводороды: общая формула, номенклатура, изомерия, химические свойства.
8. Электронное строение молекулы бутадиена. Способы получения бутадиена, применение. Виды каучуков.
9. Ароматические углеводороды. Правило ароматичности Хюккеля. Изомерия, номенклатура. Способы получения бензола и его гомологов. Химические свойства.
10. Правила ориентации в ароматическом ряду. Ориентанты 1 и 2 рода.
