«Загальні відомості про неметали та їх сполуки»
| Вид материала | Урок |
СодержаниеHcooh = h |
- Загальні висновки І рекомендації 8 Список використаної літератури 9 Додатки, 569.55kb.
- План загальні історичні відомості про розвиток малярства на склі, зокрема на Гуцульщині., 207.25kb.
- І. Загальні відомості про хвору дитину (praefatio), 518.46kb.
- Предмет: Органічна хімія Мета, 369.43kb.
- Муровомокуриловецький р-н, Вінницька обл, 2723.63kb.
- Про суспільно-політичну ситуацію у лютому 2012 року, 119.31kb.
- Програма вступного іспиту з фаху на напрям 100101"Енергетика та електротехнічні системи, 43.34kb.
- Лекція 1 хф (лекція) Тема Загальні властивості неметалів, 1201.72kb.
- Зміст навчальної програми з вищої математики для студентів 1 курсу фармацевтичного, 32.69kb.
- 1. Загальні відомості про суб'єкта господарювання*, 78.9kb.
Оксид вуглецю (II) CO
Будова молекули
Молекула оксиду вуглецю (II) має лінійну будову. Між атомами вуглецю і кисню утворюється потрійний зв'язок.

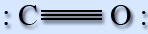
Два зв'язки отримано шляхом перекривання неспарених 2р-электронов вуглецю і кисню, а третина – по донорно-акцепторному механізму за рахунок вільної атомної орбіталі 2р вуглецю і електронної пари 2р кисню. Молекула СО є донором електронної пари.
Фізичні властивості
Оксид вуглецю (II) – чадний газ, газ без кольору і запаху, легше за повітря, дуже мало розчинимо у воді (2,32 мл в 100 г води при 20 °C), розчинимо в спирті і бензолі. Ткип = -192 °C; Тпл = -205 °C. Отруйний. Необоротно взаємодіє з гемоглобіном крові.
Хімічні властивості
У хімічному відношенні – інертна речовина. Відноситься до несолетворних оксидів, не реагує з водою, проте при нагріванні з розплавленими лугами утворює солі мурашиної кислоти:
CO + NaOH = HCOONa,
що дозволяє формально розглядати його як ангідрид мурашиної кислоти.
Взаємодія з киснем
При нагріванні в кисні згорає красивим синім полум'ям:
2СО + О2 = 2СО2.
Взаємодія з воднем
Реагує з воднем:
СО + Н2 = С + Н2О.
Взаємодія з іншими неметалами
При опромінюванні і у присутності каталізатора взаємодіє з галогенами:
СО + Cl2 = COCl2 (фосген).
і сіркою при 350° C:
СО + S = COS (карбонілсульфід).
Відновні властивості
СО– енергійний відновник. Відновлює багато металів з їх оксидів:
C+2O + CuO = Сu + C+4O2.
- Взаємодія з перехідними металами
З перехідними металами утворює карбоніли:
Ni + 4CO = Ni(CO)4;
Fe + 5CO = Fe(CO)5.
Отримання
У промисловості
Утворюється в газогенераторах при пропусканні повітря через розжарене вугілля:
C + O2 = CO2,
CO2 + C = 2CO.
У лабораторії
Виходить при термічному розкладанні мурашиної або щавлевої кислоти у присутності концентрованої сірчаної кислоти:
HCOOH = H2O + CO,
H2C2O4 = CO + CO2 + H2
Оксид вуглецю (IV) CO2
Будова молекули
Молекула СО2 лінійна, довжина подвійного зв'язку С=О рівна 0,116 нм.

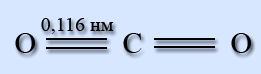
В рамках теорії гібридизації атомних орбіталей дві -зв’язки утворені sp-гібрідними орбіталями атома вуглецю і 2р-орбиталями атома кисню. Р-орбіталі вуглецю, що не беруть участь у гібридизації, утворюють з аналогічними орбіталями кисню p-зв’язки. Молекула неполярна.
Фізичні властивості
Оксид вуглецю (IV) – вуглекислий газ, газ без кольору і запаху, важче за повітря, розчинимо у воді, при сильному охолоджуванні кристалізується у вигляді білої снігоподібної маси – «сухого льоду». При атмосферному тиску він не плавиться, а випаровується, температура сублімації -78 °С. Вуглекислий газ утворюється при гнитті і горінні органічних речовин. Міститься в повітрі і мінеральних джерелах, виділяється при диханні тварин і рослин. Мало розчинимо у воді (1 об'єм вуглекислого газу в одному об'ємі води при 15 °С).Оксид кремнію (IV)
Хімічні властивості
Хімічно оксид вуглецю (IV) інертний.
Окислювальні властивості
З сильними відновниками при високих температурах проявляє окислювальні властивості. Вугіллям відновлюється до чадного газу:
С + СО2 = 2СО.
Магній, засвічений на повітрі, продовжує горіти і в атмосфері вуглекислого газу:
2Mg + CO2 = 2MgO + C.
Властивості кислотного оксиду
Типовий кислотний оксид. Реагує з основними оксидами і підставами, утворюючи солі вугільної кислоти:
Na2O + CO2 = Na2CO3,
2NaOH + CO2 = Na2CO3 + H2O,
NaOH + CO2 = NaHCO3.
Якісна реакція
Якісною реакцією для виявлення вуглекислого газу є помутніння вапняної води:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
На початку реакції утворюється білий осад, який зникає при тривалому пропусканні CO2 через вапняну воду, оскільки нерозчинний карбонат кальцію переходить в розчинний гідрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2.
Оксиди кремнію
Кремній утворює два оксиди: монооксид SіO і діоксид SiO2.
Монооксид кремнію – нестійке з'єднання, на повітрі поволі окислюється до SiO2. Це тугоплавкий темно-коричневий порошок, володіє хорошими діелектричними характеристиками і механічною міцністю.
Твердий монооксид кремнію не розчиняється в кислотах, окрім плавикової, легко розчиняється в лугах з виділенням водню, є хорошим відновником.
Кристалічні модифікації SiO2

Діоксид кремнію широко поширений в природі. Кристалічний оксид кремнію – це кварц, гірський кришталь, халцедон, яшма, основа кварцового піску. Дуже тверда, міцна, тугоплавка речовина. При звичайному тиску і температурі існують три кристалічні модифікації SiO2: кварц, тридиміт і кристобаліт. Для кожної модифікації відомі низькотемпературні α- і високотемпературні β-форми
Взаємне розташування тетраедрів в різних модифікаціях абсолютно різне, але між собою α- и β- форми відрізняються трохи, тому між ними перетворення протікають при низьких температурах, а взаємні переходи між різними модифікаціями вимагають розриву зв'язків Si – O – Si, тому вони протікають при високих температурах і досить поволі.
