«Загальні відомості про неметали та їх сполуки»
| Вид материала | Урок |
- Загальні висновки І рекомендації 8 Список використаної літератури 9 Додатки, 569.55kb.
- План загальні історичні відомості про розвиток малярства на склі, зокрема на Гуцульщині., 207.25kb.
- І. Загальні відомості про хвору дитину (praefatio), 518.46kb.
- Предмет: Органічна хімія Мета, 369.43kb.
- Муровомокуриловецький р-н, Вінницька обл, 2723.63kb.
- Про суспільно-політичну ситуацію у лютому 2012 року, 119.31kb.
- Програма вступного іспиту з фаху на напрям 100101"Енергетика та електротехнічні системи, 43.34kb.
- Лекція 1 хф (лекція) Тема Загальні властивості неметалів, 1201.72kb.
- Зміст навчальної програми з вищої математики для студентів 1 курсу фармацевтичного, 32.69kb.
- 1. Загальні відомості про суб'єкта господарювання*, 78.9kb.
Карбіди
З'єднання вуглецю з металами називаються карбіди. Їх склад не підкоряється простим правилам валентності, а хімічний зв'язок змінюється від іонної і ковалентної до чисто металевою.
За типом хімічного зв'язку карбіди діляться на ковалентні, іонні, або солетворні, і металеві.
Іонні карбіди містять іони С4-, наприклад: карбід алюмінію Al3C4, карбід бериліяBe2C, формально вони є продуктами заміщення водню в метані на метал і називаються метанидами. При їх гідролізі утворюється метан.
Деякі карбіди містять іони С22-, наприклад, карбід кальцію CaC2, вони формально є похідними ацетилену і називаються ацетиленідом. До них відносяться карбіди лужних і лужньо-земельних металів, при їх гідролізі утворюється ацетилен.
У структурі карбідів літію Li4C3 і магнію Mg2C3 міститься лінійний іон С34-. При їх гідролізі утворюється суміш метилацетилену і аллена.
До металевих відносяться карбіди d-элементів з делокалізованим металевим зв'язком. Вони хімічно інертні, проявляють металеві властивості, володіють високою твердістю, жароміцністю, високими температурами плавлення.
Ковалентні карбіди – з'єднання вуглецю з неметалами.
Хімічні властивості кремнію
Взаємодія з галогенами
За звичайних умов кремній досить інертний, що пояснюється міцністю його кристалічної решітки, безпосередньо взаємодіє тільки з фтором, при цьому проявляє відновні властивості:
Si + 2F2 = SiF4.
З хлором реагує при нагріванні до 400–600 °С:
Si + 2Cl2 = SiCl4.
Взаємодія з киснем
Подрібнений кремній при нагріванні до 400–600 °С реагує з киснем:
Si + O2 = SiO2.
Взаємодія з іншими неметалами
При дуже високій температурі близько 2000 °С реагує з вуглецем:
Si + C = SiC
і бором:
Si + 3B = B3Si.
При 1000 °С реагує з азотом:
3Si + 2N2 = Si3N4.
З воднем не взаємодіє.
Взаємодія з галогеноводнями
З фтороводнем реагує за звичайних умов:
Si + 4HF = SiF4 + 2H2,
з хлороводнем – при 300 °С, з бромоводнем – при 500 °С.
Взаємодія з металами
Окислювальні властивості для кремнію менш характерні, але вони виявляються в реакціях з металами, при цьому утворює силіциди:
2Ca + Si = Ca2Si.
Взаємодія з кислотами
Кремній стійкий до дії кислот, в кислому середовищі він покривається нерозчинною плівкою оксиду і пасивується. Кремній взаємодіє тільки з сумішшю плавикової і азотної кислот:
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O.
Взаємодія з лугами
Розчиняється в лугах, утворюючи силікат і водень:
Si + 2NaOH + H2O = Na2SiO3 + H2.
Силани
Водневі з'єднання кремнію – силани SinH2n+2 – відносяться до групи кремнійводневих з'єднань, відомі силани з n = 14. Всі вони дуже отруйні речовини з неприємним запахом. Перші два – SiH4 і Si2H6– гази, Si3H8 і Si4H10 – рідини, останні – тверді речовини.
Найбільш вивчено просте з'єднання SiH4 – силан. Молекула силана має будову тетраедра, довжина зв'язку Si – H рівна 0,109 нм.

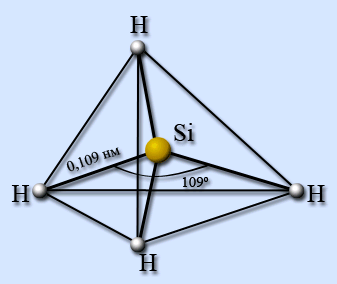
Багато силани на повітрі запалали і згорають з великим виділенням тепла:
SiH4 + 2O2 = SiO2 + 2H2O.
Силани – кислотні гідриди, активно взаємодіють з лугами:
SiH4 + 2NaOH + H2O = Na2SiO3 + 4H2.
У нейтральному і кислому середовищі силани стійкі.
Силан є сильним відновником:
SiH4 + 2AgCl = SiH3Cl + HCl + 2Ag.
При нагріванні він розкладається:
SiH4 = Si + 2H2.
Утворюються при дії на силіцид магнію соляною кислотою:
Mg2Si + 4HCl = 2MgCl2 + SiH4.
Силани хімічно менш стійкі, чим вуглеводні.
Силіциди
При заміщенні водню на метал в силані утворюються силіциди. Їх склад не підкоряється простим правилам валентності, а хімічний зв'язок змінюється від практично іонною до металевої.
Силіциди лужних і лужньо-земельних металів характеризуються переважно іонним типом зв'язку, вони хімічно активні. Багато хто з них складається з катіонів металу і тетраедрів Si44-. Вони легко розкладаються водою з виділенням водню:
Na2Si + 3H2O = Na2SiO3 + 3H2
або розбавленими кислотами з виділенням силана:
Ca2Si + 2H2SO4 = 2CaSO4 + SiH4.
Багато силіцидів перехідних металів володіють металевою провідністю.
У силіциди неметалів найчастіше реалізується ковалентний зв'язок. Серед таких силіцидів найбільше значення має карбід кремнію – карборунд SIC, що має структуру алмазу, він характеризується високою твердістю і температурою плавлення, а також високою хімічною стійкістю.
Виходять силіциди сплавом простих речовин або відновленням суміші оксидів коксом в електропечах:
2Mg + Si = Mg2Si,
2MgO + SiO2 + 4C = Mg2Si + 4CO.
Урок №28
Самостійна робота
За матеріалами « Теоретичні відомості» скласти таблицю:
Взаємодія | Карбону | Силіцію |
з галогенами | ||
з киснем | ||
з неметалами | ||
| з металами | ||
| з водою | ||
| оксидами металів | ||
| з галогеноводнями | ||
| з кислотами | ||
| з лугами |
