«Загальні відомості про неметали та їх сполуки»
| Вид материала | Урок |
- Загальні висновки І рекомендації 8 Список використаної літератури 9 Додатки, 569.55kb.
- План загальні історичні відомості про розвиток малярства на склі, зокрема на Гуцульщині., 207.25kb.
- І. Загальні відомості про хвору дитину (praefatio), 518.46kb.
- Предмет: Органічна хімія Мета, 369.43kb.
- Муровомокуриловецький р-н, Вінницька обл, 2723.63kb.
- Про суспільно-політичну ситуацію у лютому 2012 року, 119.31kb.
- Програма вступного іспиту з фаху на напрям 100101"Енергетика та електротехнічні системи, 43.34kb.
- Лекція 1 хф (лекція) Тема Загальні властивості неметалів, 1201.72kb.
- Зміст навчальної програми з вищої математики для студентів 1 курсу фармацевтичного, 32.69kb.
- 1. Загальні відомості про суб'єкта господарювання*, 78.9kb.
Повідомлення 1 команди:
Історія силіцію – дуже цікава. У епоху палеоліту, тобто 800-1000 тисячоліть тому, силіцій допоміг людині в боротьбі за життя. Цей твердий камінь, від якого легко відбити шматок з гострими краями, послужив матеріалом для першої зброї (наконечником копій і стріл) і перших знарядь праці (сокир, ножів і так далі). Пізніше, коли на зміну каменю пришли мідь, бронза, залізо, кремінь знайшов використання у вигляді кресала. При ударі твердого кремнію об залізо від нього відриваються дрібні осколки, нагріті до високої температури, унаслідок швидкого переходу механічної енергії удару в теплову. А розжарене залізо легко спалахує на повітрі і запалює трут. До винаходу сірників такий спосіб добування вогню був широко поширений. За цим же принципом влаштована старовинна зброя - кременевий пістолет, тільки в нім замість труту запалав порох.
Повідомлення 2 команди:
У неорганічній природі силіцій, мабуть, грає таку ж важливу роль, як карбон в живій. По поширеності в земній корі силіцій – другий (після кисню) элемент.12% маси земної кори складає кремнезем і більш75% - складніші кисневі з'єднання силіцію (глини, сланці, польові шпати, слюда і так далі) Потрапляючи в тканині рослин і відкладаючись в них, з'єднання силіцію підвищують їх жорсткість, і здатність рости вгору. Не випадково особливо багато кремнію в рослинах “ високого зростання” - в бамбуку хвощах; зола одного з хвощів містить до 20% SіO2. Багато силіцію і в стеблах жорсткої осоки (пригадайте, як неприємно – точно вістрям бритви – порізатися осокою)
Повідомлення 3 команди.
Карбон – один з небагатьох елементів, ім'я першовідкривача якого невідоме. Алмаз, графіт, не кажучи вже про вугілля, знайомі людству з якнайдавніших часів.
Атом карбону має два стійкі ізотопи: 12С і 13С. Дуже важливий радіоактивний ізотоп карбону 14С, що випускає α - частинки і період напіврозпаду, що має 5570 років.
Відкриття цього ізотопу мало надзвичайно важливі наслідки для археології, геології, палеонтології і історії! За допомогою цього ізотопу учені змогли досить точно визначати вік карбонвмістних порід, стоянок стародавньої людини, його починання, останків тварин і рослин, давно зниклих з лиця землі. Визначаючи радіоактивність неживої органічної речовини, і порівнюючи її з радіоактивністю такої ж кількості органічної речовини живої рослини, можна розрахувати час, протягом якого відбувався розпад 14С. Іншими словами – дізнатися вік знахідки.
Недаремно говорять, що всі науки зв'язані між собою і залежать одна від одної.
Урок №35
Тема: Загальні відомості про неметали та їх сполуки
Тема уроку:Тематична контрольна робота з теми «Карбон і силіцій»
Мета: оцінити рівеньнавчальних досягнень учнів з теми «Карбон і силіцій»
Тип уроку: . Урок контролю, оцінки і корекції знань
Обладнання і матеріали: Періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, електрохімічних ряд нгапруг металів, завдання до тематитчної контрольної роботи
Структура уроку:
1.Організаційний етап.
2.Підготовка до основного етапу занять (мотивація).
3.Контрольна робота
4.Підведення підсумків уроку
Хід уроку
1.Організаційний етап
- Перевірка облікового складу учнів
- Перевірка готовності групи до уроку
-Проведення інструкції до виконання контрольної роботи
2.Підготовка до основного етапу занять (мотивація).
Щоб перевірити ваші знання з вивченої теми ми сьогодні проведемо тематичну контрольну роботу з теми «Карбон і силіцій» в формі тестів ,, які містять різні типи завдань.
3.Контрольна робота (завдання в ІІІ варіантах)
4. Підведення підсумків уроку.
ДОДАТКОВИЙ МАТЕРІАЛ ДО УРОКУ
Критерії оцінювання навчальних досягнень учнів з теми «Карбон і Силіцій»
| Рівень | Оцінка | Критерії |
| Низький | 1—3 | Учень повинен знати: хімічні знаки Карбону й Силіцію, розміщення цих елементів у періодичній системі, їх валентність, і ступінь окисника; знати формули їхніх оксидів і кислот; знати назви алотропних модифікацій Карбону, коротку характеристику їхніх фізичних властивостей; знаходження цих елементів і їхніх сполук у природі; застосування вуглецю, Силіцію і деяких сполук (найбільш розповсюджених) їхніх.сполук (найбільш розповсюджених) ■ . - |
| Середній | 4—6 | Учень повинен вміти: зобразити схему будови атомів Карбону і Силіцію, характеризувати їх відповідно до положення в періодичній системі Менделєєва; характеризувати хімічні й фізичні властивості алотропних модифікацій Карбону, порівнювати їх; за допомогою хімічних реакцій описувати хімічні властивості Карбону, Силіцію, їхніх оксидів-; характеризувати хімічні й фізичні властивості карбонатної і силікатної кислот та їхніх солей; мати уявлення про будівельні матеріали: скло, цемент, бетон. |
| Достатній | 7—9 | Учень повинен уміти складати хімічні рівняння реакцій відповідно до ланцюга хімічних перетворень, що включають кислі солі; практично одержувати карбон (IV) оксид, карбонатну кислоту, силікатну кислоту, знати якісні реакції на СО-і С02, розв'язувати експериментальні задачі на розпізнавання речовин; розв'язувати типові розрахункові задачі на домішки, надлишок, вихід продукту. |
| Високий | 10—12 | Учень повинен вільно володіти вивченим матеріалом у межах програми, мати додаткові знання про властивості карбону, силіцію та їхніх сполук; розв'язувати творчі практичні й теоретичні завдання, використовуючи знання про властивості цих елементів, їхніх сполук та інших вивчених елементів; розв'язувати складні комбіновані розрахункові задачі. |
«Загальні відомості про неметали та їх сполуки.»
Тематична контрольна робота
з теми: «Карбон і Силіцій».
І варіант
| І рівень | ||
| 1 | В якому вигляді елемент Силіцій зустрічається в природі? | 1б |
| 2 | Наявністю яких іонів зумовлена загальна твердість води? | 1б |
| 3 | Назвіть речовину формула якої Na2CO3 А) гідроксид натрію Б) карбонат натрію В) карбонатна кислота | 1б |
| | ІI рівень | |
| 4 | Напишіть електронну конфігурацію атому карбону. Які ступені окислення він здатний проявити? | 1б |
| 5 | Напишіть рівняння реакцій: А) калій силікат + хлоридна кислота Б) барій хлорид + натрій карбонат В) натрій фосфат + аргентум нітрат | 1б |
| 6 | Який об’єм оксиду карбону (ІІ) утворюється в результаті окислення вуглецю кількістю речовини2,5 моль? | 1б |
| | ІІІ рівень | |
| 7 | Допишіть рівняння реакцій: А) Na2SiO3+HCl→ Б) CO2+KOH→ В) CaCO3+2H2SO4→ Назвіть продукти реакції. Рівняння однієї з реакцій обміну напишіть в іонному вигляді. | 1б |
| 8 | Як змінюється твердість води при кип’ятінні і чому? | 1б |
| 9 | Оксид силіцію (IV)відновили вуглецем, при цьому утворилося 11,2л чадного газу. Обчислити масу оксиду силіцію (IV), що вступив в реакцію, якщо масова частка виходу продукту реакції становить 80%. | 1б |
| | ІV рівень | |
| 10 | Написати рівняння реакції за допомогою яких можна здійснити такі перетворення: BaCl2→BaCO3→Ba(HCO3)2→CO2→K2CO3 Рівняння однієї з реакцій написати в іонному вигляді. | 1б |
| 11 | Як розпізнати розчини натрій карбонату і натрій сульфату | 1б |
| 12 | Оксид карбону(ІV), який утворився при взаємодії ортофосфатної кислоти з магній карбонатом масою 16,8 г пропустили крізь 200г розчину з масовою часткою натрій гідроксиду 20%. Яка сіль і якої маси утворилася | 1б |
Розділ І «Загальні відомості про неметали та їх сполуки.»
Тематична контрольна робота
по теми: «Карбон і Силіцій».
ІI варіант
| І рівень | ||
| 1 | Яка сировина необхідна для отримання скла? | 1б |
| 2 | Чи можна позбутися постійної твердості води? Якщо можна, то як. | 1б |
| 3 | Вкажіть формулу солі силікатної кислоти А) Na2SiO3 Б) CaCO3 В) Na2SO4 | 1б |
| | ІI рівень | |
| 4 | Напишіть електронну конфігурацію атому карбону. Які ступені окислення він здатний проявити? | 1б |
| 5 | Напишіть рівняння реакцій: А) карбонатна кислота+ калій гідроксид Б) аргентум нітрат + калій карбонат В) барій хлорид+ натрій карбонат | 1б |
| 6 | Який об’єм діоксиду карбону утворюється в результаті прожарювання 300кг вапняку масова частка домішок в якому складає 12% | 1б |
| | ІІІ рівень | |
| 7 | Допишіть рівняння реакцій: А) SiO2+NaOH→ Б) Ca(HCO3) → В) Ba2++ CO2→BaCO3 Назвіть продукти реакції. Рівняння однієї з реакцій обміну напишіть в іонному вигляді. | 1б |
| 8 | Чи можливо пом’якшити воду додаванням до неї соди? Відповідь підтвердити рівнянням реакції. | 1б |
| 9 | Яка маса натрій силікату утвориться, якщо для його добування взято 24г оксиду силіцію(ІV) і 28г натрій гідроксиду? | 1б |
| | ІV рівень | |
| 10 | Написати рівняння реакції за допомогою яких можна здійснити такі перетворення: Si→SiO2→Na2SiO3→H2SiO3→SiO2 Рівняння однієї з реакцій написати в іонному вигляді. | 1б |
| 11 | Як розпізнати розчини амоній хлориду та натрій нітрату? | 1б |
| 12 | Оксид карбону(ІV), який утворився при взаємодії 100г розчину з масовою часткою нітратної кислоти 0,2 пропустили крізь 200г розчину з масовою часткою натрію гідроксиду 0,1. Яка сіль утворилася. | 1б |
Розділ І «Загальні відомості про неметали та їх сполуки.»
Тематична контрольна робота
по теми: «Карбон і Силіцій».
ІІІ варіант
| І рівень | ||
| 1 | Які алотропні форми карбону зустрічаються в природі? | 1б |
| 2 | Як позбутися тимчасової твердості води? | 1б |
| 3 | Вкажіть формулу карбонатної кислоти А) NaCl Б) CaCO3 В) Na2SO4 | 1б |
| | ІI рівень | |
| 4 | Напишіть електронну конфігурацію атому сіліцію. Які ступені окислення він здатний проявити? | 1б |
| 5 | Напишіть рівняння реакцій: А) кремнезем + калій гідроксид Б) аргентум нітрат + калій карбонат В) хлорид на кислота + натрій карбонат | 1б |
| 6 | Який об’єм діоксиду карбону утворюється в результаті прожарювання 450кг вапняку масова частка домішок в якому складає 15% | 1б |
| | ІІІ рівень | |
| 7 | Допишіть рівняння реакцій: А) SiO2+NaOH→ Б) Ca(HCO3) → В) Ba2++ CO2→BaCO3 Назвіть продукти реакції. Рівняння однієї з реакцій обміну напишіть в іонному вигляді. | 1б |
| 8 | Чи можливо пом’якшити воду додаванням до неї соди? Відповідь підтвердити рівнянням реакції. | 1б |
| 9 | Яка маса натрій силікату утвориться, якщо для його добування взято 12гоксиду силіцію(ІV) і 14г натрій гідроксиду? | 1б |
| | ІV рівень | |
| 10 | Написати рівняння реакції за допомогою яких можна здійснити такі перетворення: Si→SiO2→Na2SiO3→H2SiO3→SiO2 Рівняння однієї з реакцій написати в іонному вигляді. | 1б |
| 11 | Як розпізнати розчини амоній хлориду та натрій нітрату? | 1б |
| 12 | Оксид карбону(ІV), який утворився при взаємодії 100г розчину з масовою часткою нітратної кислоти 0,2 пропустили крізь 200г розчину з масовою часткою натрію гідроксиду 0,1. Яка сіль утворилася. | 1б |
Карбон, Силіцій і елементи IV-A підгрупи
У подруппу карбону входять елементи: карбон, силіцій, германій, станум, плюмбум
| ЗНАХОДЖЕННЯ В ПРИРОДІ |
| Вміст в земній корі:карбон - 0,087%, силіцій - 25,8%, германій - 0,00056%, станум - 0,0035%, плюмбум - 0,0018% |
Фізічні властивості елементів підгрупи карбону.
| Елемент | Карбон С | Силіцій Si | Германій Ge | Станум Sn | Плюмбум Pb |
| Властівість | |||||
| Порядковій номер елементу | 6 | 14 | 32 | 50 | 82 |
| Відносна атомна маса | 12,011 | 28,086 | 72,61 | 118,711 | 207,2 |
| Температура плавління, С0 | 3850 | 1423 | 959 | 232 | 327 |
| Щільність г/см3 | 3,51 2,22 | 2,33 | 5,35 | 7,28 | 11,34 |
| Ступені окислення | +4, +2, -4 | +4, +2, -4 | +4, +2 | +4, +2 | +1, +3 |
| АЛЛОТРОПНІ МОДІФІКАЦІЇ КАРБОНУ. | ||||||||
|
Отрімання карбону і силіцію
| карбон | силіцій |
| Отрімують нагріванням без доступу повітря з деревини і каменного вугілля, а також при крекінгу метану: CH4=C+2H2 | SiO2+C=Si+2CO SiH4=Si+2H2 2Mg+SiO2=2MgO+Si |
Хімічні властивості карбону
і силіцію
| карбон | силіцій |
| відновник 1.C+O2=CO2-нижче 500 0С 2.С+H2O=CO+H2-вище 1200 0С 3.CuO+C=Cu+CO-при нагріванні 4.4HNO3+3C=3CO2+4NO+2H2O окислювач Ca+2C=CaC2 карбід кальцію 2H2+C=CH4 | відновник 1.Si+2F2=SiF4 2.Si+O2=SiO2 3.Si+Cl2=SiCl4 4.Si+2NaOH+H2O=Na2SiO3+2H2-нагрів. 5.Si+C=SiC 6.2N2+3Si=Si3N4 (> 1000 0C) окислювач 2Ca+Si=Ca2Si силіцид кальцію |
З'єднання вуглецю і кремнію.
| карбон | силіцій |
| 1.Вуглеводні(CH4, C2H2, C6H6 і ін.) 2.Карбіди а)металевого характеру Fe3C би)ионные карбіди Al4C3, CaC2 і ін. 3)оксиди карбону(II)і (III) 4)солі вугільною кислоти-карбонати | 1.Оксид силіцію 2.Солі силікатної кислоти-силікати 3.Цементи: звичайний( CaO, SiO2) CaO · SiO2+CO2+H2O=CaCO3 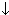 +H2SiO3 +H2SiO3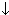 портланд-цемент (суміш CaSiO5, Ca 2SiO4, Ca 3(AlO 3) 2) Ca3SiO5+H2O=Ca2SiO4+Ca(OH)2 Ca2SiO4+4H2O=Ca2SiO4 · 4H2O Ca3(AlO3)2+6H2O=Ca3(AlO3)2 4.Скло |
Методичні рекомендації
Враховуючи, що здібності - це сукупність природного і набутого, їх можна розвивати в процесі навчання. Проблема хімічних здібностей вперше було помічена ще М. Ломоносовим в роботі "Слово про користь хімії".
"Хімік потрібен не такий, який розуміє свою науку з книжкою, а такий, який особистим мистецтвом в ній старанно вправами практикує".
Хімічні здібності включають в себе особливості органів чуття і моторики (добра організація, почуття часу, простору, швидкість реакції, здібність до автоматизму роботи руками) та здібності психічних процесів (Аналітико-синтетичні якості, розвиток асоціативного мислення, здібність до абстракції, оперування символами, образне мислення, ситуативність, кмітливість, рипучість, терпіння, акуратність, методичність в роботі, великий об’єм уваги).
Методична розробка «Карбон і силіцій» допоможе учням в засвоєнні та закріпленні нового матеріалу. Тому при плануванні уроків і підборки матеріалу до них використовуються різні засоби надання інформації:
- Лекційний матеріал, який складає дуже маленьку частку, але є необхідною складовою для вивчення матеріалу. (базові знання).
Так, як велике значення приділяється розвитку креативного мислення, а відповідно і використання різних засобів навчання, багато часу при вивченні цієї теми приділяється самостійній роботі (до кожного уроку розроблені самостійні роботи різних напрямків: робота з інформаційними картками, опорним конспектом, пошук інформацї в додаткових джерелах (книги, журнали,, інтернет))
- Складання опорного конспекту Ці конспекти рекомендуються в основному на уроках вивчення нового матеріалу. Учням пропонується стислий зміст уроку, таблиці, сигнальні картки, схеми, які активізують розумову діяльність учнів на уроці, викликають зацікавленість, спрощують сприйняття нової теми. Уроки за темами: «Карбон і Силіцій, їх місце в періодичній системі, будова атомів. Алотропні модифікації Карбону.», «Хімічні властивості вуглецю і силіцію», «Оксиди карбону (II) і карбону (ІУ), Оксид силіцію (IV). їхні властивості, застосування. Поняття про парниковий ефект», «Кругообіг Карбону в природі», «Силікатна кислота і силікати .Будівельні матеріали».
- Виконання практичної роботи «Добування оксиду карбону (IV). Взаємоперетворення карбонатів і гідрогенкарбонатів» і лабораторних дослідів «Карбон і Силіцій, їх місце в періодичній системі, будова атомів. Алотропні модифікації Карбону.», «Карбонатна кислота і карбонати. Якісна реакція на карбонат-іони. Перетворення карбонатів. Поняття про кислі солі. Поняття про твердість води», «Силікатна кислота і силікати .Будівельні матеріали».
- Використовується метод проектів на урокі за темою «Карбонатна кислота і карбонати. Якісна реакція на карбонат-іони. Перетворення карбонатів. Поняття про кислі солі. Поняття про твердість води»
Робота над проектом поділяється на кілька етапів:
• підготовка — визначення теми (головним чином, через вибір проектного завдання);
- планування — визначення джерел інформації, способів обробки й аналізу інформації, способів подання результатів, процедури і критеріїв оцінювання, розподіл завдань між членами групи (в разі групового проекту);
- дослідження — збір інформації;
- результат — аналіз інформації і формулювання висновків;
- подання результатів або звіт;
- оцінка результатів процесу.
- Використаний тип уроку семінар «Кругообіг Карбону в природі», який дає можливість для розвитку вміння аналізувати і робити висновки.
- В ракурсі сучасних технологій розроблений урок з використанням мультімедійної презентації «Поширення Карбону і Силіцію в природі, їхнє значення в живій і не живій природі», який надає можливість яскраво і інформаційно підвести підсумки вивченої теми .
- Практично на всіх уроках учням пропонується робота з додатковими джерелами інформації.( книги, журнали, інтернет.
- Для перевірки знань використовуються самостійні роботи у вигляді карток, тестових завдань. Для підсумкової перевірки знань з теми розроблена «Тематична контрольна робота » в формі тестів з використанням закритої і відкритої форм завдань. Валідність тесту підтверджена для спеціальності: «Штукатур, лицювальник – плиточник, маляр».
Характеристика теми
Тема «Карбон і силіцій» розглядається в І розділі «Неорганічна хімія», містить 9 уроків. Тема є заключною при вивченні розділу «Неорганічна хімія» і важливою, так, як весь розділ, який буде вивчатися надалі, це розділ про елемент Карбон – «Органічна хімія»
