Лекція 1 хф (лекція) Тема Загальні властивості неметалів
| Вид материала | Лекція |
- З м І с т стор. Вступ. Лекція, 1088.23kb.
- Курс лекцій для студентів денної І заочної форми навчання спеціальності 050301 „Товарознавство, 1137.66kb.
- Єльнікової Тетяни Олександрівни з курсу "Моделювання та прогнозування стану довкілля", 33.26kb.
- Вступна лекція Голема. Про людину трояко Вісімнадцята лекція, 11204.11kb.
- Лекція Основи молекулярно-кінетичної теорії І ідеальний газ, 101.02kb.
- Лекція 4. Тема: вивчення твору світової літератури, 130.47kb.
- Лекція на тему „Основи теорії держави І права" > Лекція на тему, 3538.68kb.
- Лекція №12 Тема: Організація обліку доходів І фінансових результатів діяльності, 198.65kb.
- Лекція тема 2, 153.96kb.
- Лекція №7 тема: зведена І консолідована фінансова звітність, 147.05kb.
ЛЕКЦІЯ 1
ХФ (лекція)
Тема Загальні властивості неметалів
Загальна характеристика елементів-неметалів
У періодичній системі Д. І. Менделєєва елементи-неметали містяться у її правій верхній частині. Межа проходить по умовній лінії, яка з'єднала б елементи Бор і Астат.
Елементи-неметали належать до р-елементів, за виключенням Гідрогену і Гелію, які є s-елементами (s1 і s2).
Усі неметалічні р-елементи мають загальні властивості, бо структура зовнішнього електронного шару їхніх атомів подібна: ns2np1-5. У елементів благородних газів, на відміну від типових неметалів, р-підрівень завершений (має шість електронів) ns2np8. Це зумовлює вкрай низьку їхню реакційну здатність, і тому благородні гази не відносять до типових неметалів.
Такі особливості в будові атомів неметалів, а саме наявність неспарених електронів визначає здатність елементів приєднувати електрони до завершення енергетичного рівня. Тому в елементів-неметалів переважають окиснювальні властивості і в сполуках з гідрогеном та металами вони мають негативні ступені окиснення. Залежність між будовою зовнішнього електронного рівня й ступенем окиснення елементів-неметалів відображено у таблиці 1.

У властивостях неметалів, незважаючи на подібність у будові валентних рівнів, більше різного, ніж спільного. Зазначимо, що всі елементи-неметали, які починають підгрупи, тобто елементи 2-го періоду, різко відрізняються від інших елементів підгрупи і групи. Це пояснюється тим, що атоми цих елементів мають найменший радіус і найбільше значення електронегативності.
Елементи будь-якої групи неметалів утворюють хімічні зв'язки як за рахунок s- та p-електронів, так і за рахунок d-електронів. Тому вони можуть мати ступені окиснення, більші за кількості неспарених електронів.
Для прикладу зіставимо електронні конфігурації атомів Нітрогену 1s22s22p3 й Фосфору 1s22s22p63s23p3.
Із малюнка видно, що атоми Нітрогену і Фосфору у нормальному (незбудженому) стані мають по три неспарених електрони й тому можуть утворювати по три ковалентних зв'язки. Крім того, за рахунок відповідно 2s- та 3s-орбіталей інколи утворюється четвертий зв'язок за донорно-акцептор-ним механізмом. Тому Нітрогену і Фосфору відповідають сполуки: аміак NH3 та іон амонію NH4+, фосфін РН3 й іон фосфонію РН4+. Крім того, атом Фосфору у збудженому стані має п'ять неспарених електронів, що відповідає валентності п'ять. Ось чому атоми Фосфору в молекулі ортофосфорної кислоти (в іоні РO43-) мають валентність 5 і ступінь окиснення + 5. В той же час атом Нітрогену в молекулі азотної кислоти (в іоні NO3- ) має валентність 4, а ступінь окиснення + 5.
Різниця у будові зовнішніх електронних шарів неметалічних елементів відбивається на їхніх властивостях, а саме на здатності приєднувати електрони. У підгрупах вона поступово зменшується відповідно до зменшення електронегативності, але зростає здатність елементів віддавати електрони, набуваючи при цьому позитивні ступені окиснення (табл. 1). Значення позитивного ступеня окиснення елементів змінне, що великою мірою залежить від атомів-партнерів, з якими реагуватиме неметал.
Е
 лектронегативність елементів визначає тип хімічного зв'язку. Ті елементи-неметали, які розміщені ближче до центру періодичної системи, утворюють тільки ковалентні сполуки, наприклад: ВС13, SiH4, NO2. Більш електронегативні неметалічні елементи, розміщені справа в періодичній системі, утворюють як ковалентні сполуки: ОF2, Н2О, SО2, так і іонні сполуки: LіF, NаСІ. Характерними для неметалів є ковалентні сполуки.
лектронегативність елементів визначає тип хімічного зв'язку. Ті елементи-неметали, які розміщені ближче до центру періодичної системи, утворюють тільки ковалентні сполуки, наприклад: ВС13, SiH4, NO2. Більш електронегативні неметалічні елементи, розміщені справа в періодичній системі, утворюють як ковалентні сполуки: ОF2, Н2О, SО2, так і іонні сполуки: LіF, NаСІ. Характерними для неметалів є ковалентні сполуки.Нарешті відзначимо, що атоми неметалів входять до складу комплексних сполук, наприклад: [Сu(NН3)4]SО4, Nа2[Сu(ОН)4].
Із наведеного вище можна зробити висновки:
- Неметалічні елементи у періодичній системі містяться головних підгрупах IV—VII груп, лише Бор — у III групі. Вони займають верхню праву частину періодичної системи елементів Д. І. Менделєєва (від умовної лінії «Бор — Астат»).
- Елементи-неметали відносять до р-елементів, крім Гі,рогену і Гелію. На р-орбіталях міститься від 1 до 5 електронів. Структури зовнішніх електронних рівнів подібні, тому властивості їх аналогічні.
3. Загальні властивості неметалів:
-переважають окиснювальні властивості;
-характерний ковалентний зв'язок, а отже, й ковалентні сполуки.
4. Неметалічні властивості елементів закономірно змінюються в періодах та головних підгрупах періодичної системи.
5. Кожний перший елемент підгруп неметалів значно від рівняється від інших елементів своїми властивостями. Це взагалі особлива властивість елементів 2-го періоду. Вона пояснюється малими радіусами атомів і відповідно великими значеннями електронегативності.
6. Неметалічні елементи за властивостями більше різняться між собою, ніж подібні.
Неметали як прості речовини
Неметалічні елементи утворюють прості речовини, які відрізняються своїм складом.
Будова неметалів. Прості речовини неметали існують у вигляді двохатомних або багатоатомних молекул. Атоми елементів 2-го періоду, а також Гідроген, утворюють між собою хімічні зв'язки лише за рахунок неспарених s-електронів (Гідроген) і p-електронів й тому вони двохатомні, наприклад: водень Н2, кисень О2, азот N2 та молекули галогенів — На12. Виняток становлять бор і вуглець як тверді речовини. Елементи-неметали 3-го періоду утворюють додаткові зв'язки за рахунок вакантних d-орбіталей, тому їхні прості речовини багатоатомні за звичайних умов, наприклад: білий фосфор Р4, сірка S8. Карбон утворює багато зв'язків тому, що в його атомі кількість валентних електронів та орбіталей однакова. Зв'язок між атомами в молекулах — ковалентний неполярний.
Більшість неметалів мають молекулярну структуру (молекулярні кристалічні ґратки), а бор, вуглець (алмаз), силіцій, арсен, селен, телур — атомну структуру (атомні кристалічні ґратки). Деякі неметали мають різні структури, бо існують у вигляді алотропних модифікацій.
Будова речовин впливає на їхні властивості, і насамперед на фізичні.
Фізичні властивості неметалів. Залежність фізичних властивостей неметалів від їхньої будови відображає схема 2.
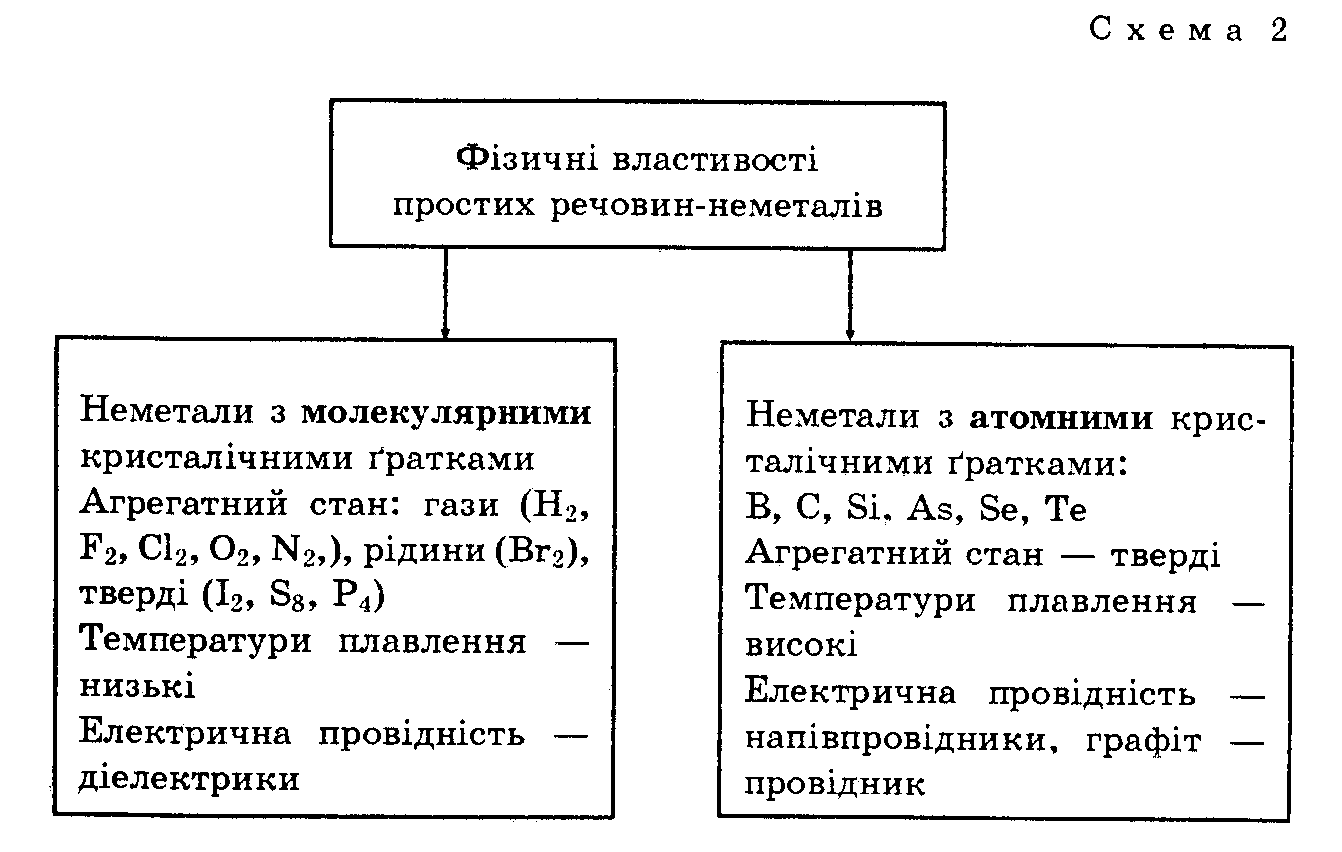
Треба пам'ятати, що одна й та ж речовина може залежно від умов проявляти властивості неметалів або металів. Так, фосфор — неметал за звичайних умов, а під тиском вище 4103 МПа набуває металічних властивостей.
У той же час алотропні модифікації неметалів мають різну будову, що впливає на їхні властивості. Конкретні приклади наведені в таблиці 2.
Зверніть увагу, що лише графіт є електричним провідником. Нині вважають, що електрична провідність — це один із головних критеріїв поділу речовин атомної будови на метали та неметали.
Отже, фізичні властивості неметалів залежать від їхньої будови.
Хімічні властивості неметалів
Хімічні властивості простих речовин-неметалів зумовлені особливостями атомів елементів, що їх утворюють. Так, якщо елементи-неметали — окисники, то й прості речовини-неметали у багатьох реакціях виявляють окиснювальні властивості.
Неметалічні властивості речовин залежать значною мірою від енергії зв'язку між атомами у молекулі. Розглянемо значення енергій зв'язку (кДж/моль) у таких молекулах: хлору Сl2 — 243, кисню О2 — 494, азоту N2 — 945. Чим більше спільних електронних хмар, тим міцніше атоми зв'язані між собою (енергія зв'язку більша). Звідси найбільш активна речовина — хлор, а найменш активна — азот.
Більшість неметалів свою хімічну активність виявляють лише за певних умов.
! Перед тим як розглядати хімічні властивості неметалів, зауважимо, що в природі існує така об'єктивна закономірність: між собою реагують речовини, протилежні за складом і за властивостями.
Виходячи з цього, неважко усвідомити, що неметали реагують з металами, окисники з відновниками (між собою можуть реагувати і два неметали), неметали — прості речовини із складними, неметали як неорганічні речовини з органічними. У всіх перелічених реакціях неметали будуть або окисниками, або відновниками залежно від хімічної природи другого реагенту. У таблиці 3 наведені приклади, які ілюструють окиснювальні і відновні властивості неметалів.
З таблиці видно, що для неметалів характерні реакції сполучення й заміщення. Всі вони окисно-відновні, більшість із них — екзотермічні. Реакції між газоподібними неметалами — обернені. Більшість продуктів реакцій сполучення — ковалентні сполуки з більшою чи меншою часткою іонного зв'язку.
Деякі неметали відрізняються від усіх інших. Так, фтор — це єдиний з неметалів, який виявляє лише окиснювальні властивості. Неметали: бор, вуглець, силіцій та фосфор — відновлюють такі сильні окисники, як азотну і концентровану сірчану кислоти. У реакціях із кислотами кожний із неметалів окиснюється повністю, ступінь окиснення металу стає максимально позитивним.
У деяких неметалів залежно від умов відбувається одночасно збільшення і зменшення ступеня окиснення одного й того ж елемента. Наприклад, у реакції розчинення хлору у воді або розчині гідроксиду натрію атоми Хлору як віддають електрони (відновники), так і приєднують електрони (окисники):
C12 + H2O HC1 + HC1O
о
Cl - le Cl (процес окиснення, Cl — відновник)
Cl + 1e Cl (процес відновлення, Cl — окисник)
Такі реакції належать до реакцій самоокиснення — самовідновлення, або диспропорціювання.
Отже, залежно від умов неметали у хімічних реакціях можуть бути як окисниками - в більшості випадків,- так i відновниками.
Поширеність, добування і кругообіг неметалів у природі
Поширеність неметалів у природі підлягає певним принципам. Найбільш активні неметали — галогени — зустрічаються у природі виключно у вигляді сполук, головним чином із лужними металами (карналіт КС1МgСl26Н2О). Оксиген і Сульфур також активні мінералоутворювачі, у більшості випадків із перехідними металами (вапняки СаСО3, пірит FeS2 та ін.). Оксиген, крім того, утворює численні силікати й алюмосилікати (каолін А12О32SiО22Н2О), а Сульфур — сульфати (гіпс СаSО42Н2О).
Кисень і сірка зустрічаються в природі й у вільному стані завдяки процесам фотосинтезу й вулканічній діяльності.
Основною формою Нітрогену в природі є атмосферний азот за рахунок виключно великої міцності молекули N2. Він утворюється головним чином завдяки розкладу азотовмісних органічних сполук та спалювання палива в промисловості. Головними природними сполуками Фосфору є фосфати (фосфорит Са3(РО4)2 й апатит Са5Х(РО4)3, де X — F-, С1-). Ці cполуки нерозчинні у воді й утворюють великі родовища.
Природний карбон зустрічається у двох формах - органічного та інерального походження. До першої відносять родовища кам'яного вугілля, нафти, природного газу, друга становить головним чином карбонатні породи і вуглекислий газ СО2.
Силіцій — основний елемент, який утворює літосферу,— представлений численними силікатами і алюмосилікатами.
Отже, форма існування неметалів у природі визначається хімічною активністю елемента. Більшість елементів-неметалів у природі знаходиться у зв'язаному стані. Розповсюдження сполук неметалів залежить також від їх розчинення у воді.
Більшість простих речовин із їхніх природних сполук добувають внаслідок окисно-відновних процесів, крім тих випадків, коли прості речовини зустрічаються в природі у самородному стані. Так, азот і кисень виділяють із зрідженого повітря фізичними методами — фракційною перегонкою.
Найбільш активні неметали-галогени можна виділити із природних сполук лише окисненням завдяки електролізу (електрохімічні методи). Порівняно малоактивні неметали, які поширені у природі в окисненому стані (бор, кремній, фосфор тощо), виділяють у вільному стані дією відновників. Малоактивні неметали (Вr2 та І2) можна витиснути із розчинів бромідів та йодидів більш енергійним окисником — хлором — або термічним розкладом йодидів, інколи бромідів (хімічні методи).
Таким чином, поширення неметалів у природі, а також добування їх із сполук визначаються хімічною активністю елементів-неметалів, що є наслідком будови їхніх атомів і молекул. Знання хімії неметалів важливе для розуміння природних геохімічних циклів хімічних елементів Нітрогену, Фосфору, Карбону, Оксигену й усвідомлення причин їх порушення внаслідок діяльності людини. Необхідно пам'ятати, що коли природні цикли стають необерненими, то виникає загроза всьому живому на Землі, бо перелічені елементи є органогенними.
Гідрогеновмісні сполуки неметалів
Неметали утворюють водневі сполуки згідно з місцем елементів у періодичній системі та відповідно до їх електронегативності. У цих сполуках елементи-неметали мають негативний ступінь окиснення, що видно з таблиці 4. У молекулах гідрогеновмісних сполук зв'язок Н-Е – ковалентний полярний. Полярність зв'язку залежить від електронегативності елемента й закономірно змінюється в періодах і групах, як видно з таблиці 14. Кристалічні ґратки цих сполук молекулярні. Тому всі вони за звичайних умов-гази з низькими температурами плавлення, крім води. Молекули водневих сполук мають різну термічну стійкість. У групах вона зменшується, бо збільшується довжина зв'язку (розміри атомів збільшуються) й відповідно зменшується енергія (міцність) зв'язку. Ось чому, наприклад, молекули води розкладаються на водень і кисень під дією електричного струму, а молекули гідроген селеніду й гідроген телуриду розпадаються на відповідні елементи вже при несильному нагріванні без доступу повітря.

Вам відомо, що водневі сполуки розчиняються у воді, але по різному.
У чому ж причина різної розчинності водневих сполук? Звернемося до електронної будови молекул водневих сполук другого періоду:
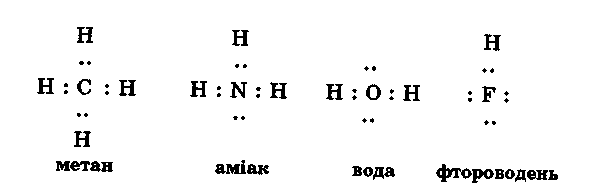
З формул видно, що лише в молекулі метану всі ковалентні зв'язки насичені. В молекулах інших речовин є вільні електронні пари, які зумовлюють полярність молекул і сприяють донорно-акцепторній взаємодії з протоном води. Саме тому метан практично не розчинний, а аміак і Гідроген фторид добре розчинні у воді.
! Пам'ятайте про таку особливість: полярні речовини добре розчиняються у полярних розчинниках, а неполярні речовини — відповідно у неполярних розчинниках. Так, бензол С6Н6 практично не розчиняється у воді, але добре розчиняється в ацетоні як неполярному органічному розчинникові.
Запам'ятайте: подібне розчиняється у подібному!
З дослідів за допомогою індикатору метилового оранжевого ви також дізналися, що аміак і хлороводень не лише розчинялися у воді, а й взаємодіяли з нею за таким механізмом:
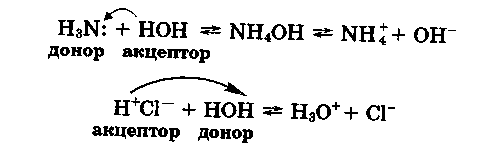
Як видно з наведених рівнянь реакцій, взаємодія води з аміаком та хлороводнем відбувалася за донорно-акцепторним механізмом і сприяла утворенню іонів гідроксилу ОН- й іонів гідроксонію Н3О+ (водню). Наявність цих іонів й зумовила зміну забарвлення індикатору метилового оранжевого: він став рожевим у розчині хлороводню (кисле середовище) і жовтим — у розчині аміаку (лужне середовище).
Вода в цих реакціях виявляє різні властивості: по відношенню до аміаку — кислотні, а до хлороводню — основні. Отже, вода залежно від умов проявляє амфотерні властивості.
Таким чином, більшість водневих сполук неметалів мають кислотні властивості, їхні водні розчини — кислоти. Водні розчини відповідних сполук V групи становлять виняток, вони — луги.
Оскільки є як кислотні, так і основні водневі сполуки, то вони можуть реагувати між собою.
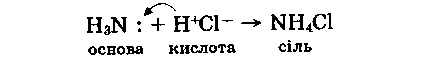
Усі розглянуті вище реакції мають практичне значення. Так, на розчиненні водневих сполук неметалів у воді засновано добування безкисневих кислот: галогеноводневих, сірководневої тощо, а також лугів — гідроксиду амонію (нашатирного спирту). Реакції між водневими сполуками з різними хімічними властивостями використовують для добування солей амонію, сульфідів тощо.
Водневі сполуки неметалів — сильні відновники завдяки негативному ступеню окиснення неметалічного елемента. Розглянемо деякі приклади:
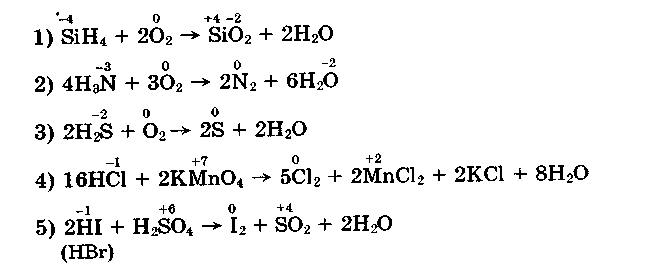
Завдяки відновним властивостям сірководню й аміаку вони не накопичуються в природі у вільному стані (сірководень та аміак — токсичні сполуки). На відновних властивостях водневих сполук засноване їх використання в лабораторіях для добування деяких простих речовин, наприклад хлору (рівняння 4).
Таким чином, властивості водневих сполук неметалів залежать як від електронної будови молекул, так і від ступеня окиснення елемента неметалу.
Оксигеновмісні сполуки неметалів
І
Неметали утворюють два класи кисневмісних сполук оксиди і гідроксиди.
Оксиди неметалів. В оксидах, як відомо, Оксиген має ступінь окиснення - 2. Лише в сполуці ОF2 він дорівнює + 2. Оксиген може мати ступінь окиснення — 1, наприклад у молекулі пероксиду гідрогену Н2О2 (Н-О-О-Н). Сполуки, в яких Оксиген має ступінь окиснення — 1, називаються пероксидами. Майже всі неметали утворюють кілька оксидів, бо елементи мають змінну валентність. Наприклад: оксиди карбону(II й IV) СО та СО2, оксиди нітрогену (І—V) N2О, NO, N2О3, NО2, N2О5, оксиди сульфуру (IV й VI) SО2 та SО3 тощо. Отже, за складом молекул оксиди неметалів поділяються на нормальні (СО2, NО2, SО2, Сl2О7) та пероксиди (Н2O2).
Зв'язок Е-О у молекулах оксидів - ковалентний, але залежно від природи елемента ступінь його полярності буде різним.
Оксиди неметалів - це кислотні оксиди, кислотний характер яких збільшується із збільшенням ступеня окиснення, про що свідчить також зростання теплового ефекту реакцій розчинення оксидів у воді. Наприклад:

На цих реакціях засновано добування кисневмісних кислот. Розчинення оксидів у воді залежить від полярності їхніх молекул. Так, СО2, молекула якого неполярна, погано розчиняється у воді, утворюючи слабку вугільну кислоту:
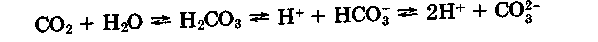
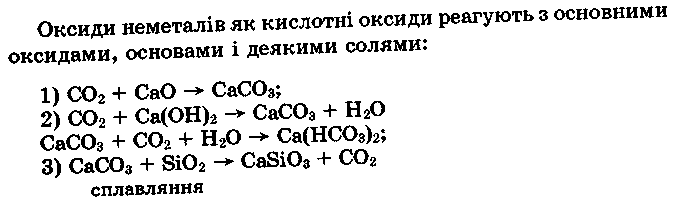
Більшість кислотних оксидів є солетворними.
Окисно-відновні властивості оксидів неметалів залежать від ступеня окиснення елемента і природи компонента в реакції. Так, NО на повітрі окиснюється і є відновником:
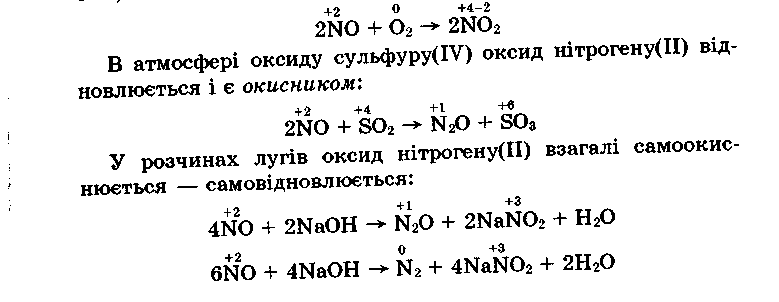
На відміну від нітроген(ІІ) оксиду нітроген(ІV) оксид є сильним окисником: в ньому горять фосфор, сірка, вуглець і деякі органічні сполуки. Але нітроген (IV) оксид може бути й відновником:
2NO2 + H2O HNO3 + HNO2
Порівняно з нітрогеном (ІІ) оксидом NO для нітороген (IV) оксиду NO2 більш характерною є окиснювальна функція. Нарешті, оксид N2O5 — дуже сильний окисник (і лише окисник!). Органічні речовини в його середовищі загоряються.
Таким чином, для оксидів із низьким позитивним ступенем окиснення характерні відновні властивості; з високим, що відповідає номеру групи,— окиснювальні, а з проміжним — окиснювальні й відновні.
Оксигеновмісні кислоти. Ви неодноразово помічали, що один і той же елемент може утворювати кілька кислот, наприклад:
сульфітна H2SO3 і сульфатна H2SO4, нітритна HNO2 і нітратна HNO3. У цьому випадку головна причина полягає у ступені окиснення відповідного елемента. Крім того, різноманітність кислот залежить і від кількості молекул води, що може зв'язатися з молекулою відповідного оксиду. Так, у метакислотах на один моль оксиду припадає не більше одного моля води, а в ортокислотах — більше одного моля води:
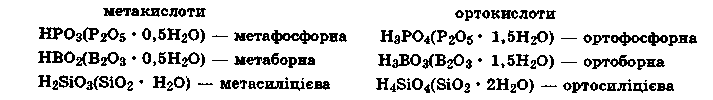

Хімічні властивості кислот зумовлені їхньою здатністю дисоціювати у водних розчинах з утворенням іонів гідроксонію Н3О+. Сила оксигеновмісних кислот різна і характеризується ступенем дисоціації (табл. 15).
Сила оксигеновмісних кислот у групах р-елементів із збільшенням протонного числа елемента послаблюється, а у періодах посилюється від IV до VII групи.
Згідно з теорією електролітичної дисоціації, всі загальні характерні властивості кислот (кислий смак, зміна забарвлення індикатору, взаємодія з основами, основними оксидами, солями) зумовлені іонами гідроксонію.
Особливі властивості оксигеновмісних кислот стосуються їхньої окиснювальної здатності. В цих сполуках елемент перебуває у вищому ступені окиснення, тому такі кислоти є сильними окисниками відносно як металів різної активності, так і неметалів та органічних речовин. Сказане повною мірою стосується нітратної кислоти будь-якої концентрації й концентрованої сульфатної кислоти. Розглянемо деякі приклади:
- Взаємодія концентрованих нітратної і сульфатної кислот із металами різної активності:
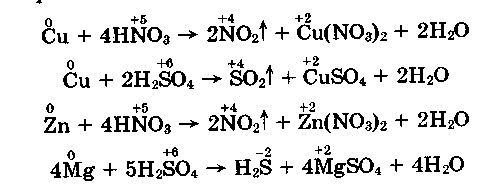
- Взаємодія розведених сірчаної й азотної кислот із металами різної активності:
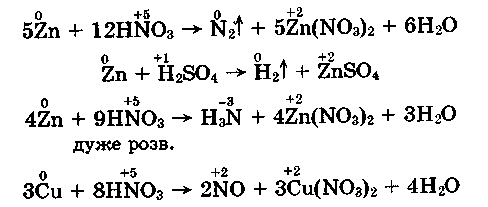
З наведених рівнянь реакцій виходить, що неметал у молекулі кислоти (Нітроген або Сульфур) знижує свій ступінь окиснення, тобто є окисником. Виняток становить дія розчину ссульфатної кислоти на активні метали.
Характер взаємодії цих кислот із неметалами відображений у таблиці 15. Вам відомо, що концентрована сульфатна кислота обвуглює органічні речовини — цукор, папір, деревину тощо, відбираючи від них елементи води. При цьому утворюються гідрати сульфатної кислоти. Обвуглювання цукру відбувається за таким рівнянням:
С12Н22О11 + nH2SO4 12C + H2SO412H2O
Вугілля, що утворилося, частково вступає у взаємодію з кислотою:
C + 2H2SO4 CO2 + 2SO2 + 2H2O
Кислоти з меншим ступенем окиснення неметалу можуть бути відновниками (нітритна кислота HNO2 — сильний відновник) і окисником залежно від властивостей речовини-партнера. Зіставимо нітритну й сульфітну кислоти:
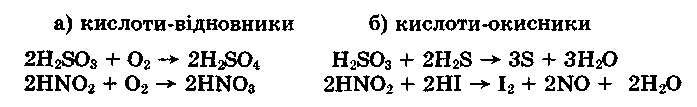
Отже, оксигеновмісні сполуки у вищих ступенях окиснення неметалу — окисники, а у нижчих — відновники й окисники залежно від умов реакції.
Таким чином, оксигеновмісні кислоти неметалів мають як загальні характерні властивості, так і особливі.
