Лекція 1 хф (лекція) Тема Загальні властивості неметалів
| Вид материала | Лекція |
- З м І с т стор. Вступ. Лекція, 1088.23kb.
- Курс лекцій для студентів денної І заочної форми навчання спеціальності 050301 „Товарознавство, 1137.66kb.
- Єльнікової Тетяни Олександрівни з курсу "Моделювання та прогнозування стану довкілля", 33.26kb.
- Вступна лекція Голема. Про людину трояко Вісімнадцята лекція, 11204.11kb.
- Лекція Основи молекулярно-кінетичної теорії І ідеальний газ, 101.02kb.
- Лекція 4. Тема: вивчення твору світової літератури, 130.47kb.
- Лекція на тему „Основи теорії держави І права" > Лекція на тему, 3538.68kb.
- Лекція №12 Тема: Організація обліку доходів І фінансових результатів діяльності, 198.65kb.
- Лекція тема 2, 153.96kb.
- Лекція №7 тема: зведена І консолідована фінансова звітність, 147.05kb.
2. Властивості оксокислот хлора
2.1. Особливості будови і міцність зв’язку Cl-O в оксоаніонах
Таблиця №7. Назви оксикислот хлору
| Формула кислоти | Тривіальна назва | Сучасна назва | ||
| кислоти | кислотного залишку | кислоти | кислотного залишку | |
| HClO | хлорнуватиста | гіпохлорит | хлоратна (І), оксохлоратна | хлорат (І), оксохлорат |
| HClO2 | хлориста | Хлорит | хлоратна (ІІ), діоксохлоратна | хлорат (ІІ), діоксохлорат |
| HClO3 | хлорнувата | Хлорат | хлоратна (ІІІ), триоксохлоратна | хлорат (ІІІ), триоксохлорат |
| HClO4 | хлорна | Перхлорат | хлоратна (ІV), тетраоксохлоратна | хлорат (ІV), тетраоксохлорат |
У водних розчинах оксокислоти хлору дисоціюють, більшість із них відомі тільки в розчинах, тому, за винятком слабкої HClO, має сенс порівнювати будову (будову газоподібної HClO4 установлено електронографічно: атоми оксигену розташовані у вершинах викривленого тетраедра) і властивості оксоаніонів. В ряду HClO-HClO2--HClO3-HClO4 просторова будова аніонів змінюється (табл.8) від лінійної у випадку ClO- до тетраедричної в ClO4-.
Таблиця 8. Будова і властивості оксокислот хлору
| Формула кислоти | HclO | HClO2 | HClO3 | HClO4 | | ||||
| Довжина зв’язку Cl-O, 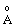 | 1.71 | 1.64 | 1.57 | 1.45 | | ||||
| Кути |  HOCl=113o HOCl=113o |  OСlO=110,5 OСlO=110,5 |  OClO=107o OClO=107o |  OClO=105.6o OClO=105.6o | | ||||
| Eзв. Cl-O, кДж/моль | 209.0 | 244.5 | 243.7 | 363 | | ||||
| рКa 25оС | 7.5 | 2.0 | -1.2 | -10 | | ||||
| Ео, B  | 1.63 | 1.63 | 1.47 | 1.34 | | ||||
| |  |  |  |  | |||||
Слід відзначити зменшення міжатомної відстані і зростання енергії зв’язку Cl-O в аніонах по мірі зростання в них числа атімов оксигену. З позиції метода МО ЛКАО це пов’язано з збільшенням числа електронів на зв’язуючих молекулярных орбиталях. З точки зору метода валентних зв’язківй (МВЗ), підвищення міцності зв’язку Cl-O в ряду HClO-
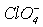 може бути пов’язано із зростанням зв’язування за рахунок вакантних
може бути пов’язано із зростанням зв’язування за рахунок вакантних 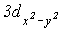 ,
,  -орбіталей хлора і електронів 2рх - і 2рy-орбіталей оксигену, які не приймають участі в утворенні
-орбіталей хлора і електронів 2рх - і 2рy-орбіталей оксигену, які не приймають участі в утворенні  -зв’язків.
-зв’язків.2.2. Кислотні властивості. Індукційний ефект
Із співставлення величин рКa, наведених в табл.7, видно, що легкість відщеплення протона в оксокислотах зменьшується в ряду HClO4>HClO3>HClO2>HClO. Правила, що характеризують силу оксокислот, сформульовані Л.Полінгом. Перше правило: величина першої константи дисоціації оксокислот (HO)nXOm визначається числом m кінцевих, негідроксильних атомів оксигену. Величину константи дисоціації pK1 = = -lgK1 для кислот (HO)nXOm можна оцінити за рівнянням рК1 = 8-5m. Це правило якісно пояснюють так званим індукційнмм ефектом. Індукційний ефект полягає в тому, що більш електронегативний кінцевий (негідроксильний) атом оксигену відтягує на себе електронну густину від атома хлора. Атом хлора із збільшеним позитивним зарядом, в свою чергу, відтягує електрони від атома оксигена гідроксильної групи. Таким чином, кінцевий атом оксигену знижує електронну густину на зв’язку Н-О, ослаблює ї и, тим самим, збільшує легкість відщеплення протона молекулами води.
По мірі переходу від HClO до HClO4 число кінцевих атомів оксигену і індукційний ефект збільшуються, а сила кислот, відповідно, зростає.
Друге правило Полінга стосується величин констант дисоціації багатоосновних кислот (HO)nXOm, де n>1: послідовність констант дисоціації К1, К2, К3, ј знаходяться у відношенні 1:10-5:10-10. Це правило є емпіричним, а зменшення величин констант дисоціації зумовлено зростанням заряду аніона.
2.3. Стабильность оксокислот хлора и их солей.
Більшість оксокислот галогенів існує тільки у водних розчинах. Хімічні властивості кислот і їх солей визначаються стабільністю, чи стійкістю, аніонів в кислих, нейтральних і лужних середовищах.
Оксигеновмісні кислоти хлора HClO, HClO2, HClO3 при рН=0 термодинамічно нестабільні і диспропорціонують за реакціям
3HClO = HClO3 + 2HCl (1),
3HClO2 = 2HClO3 + HCl (2),
4HClO3 = 3 HClO4 + HCl (3).
Оскільки Е3>Е2>Е1, то термодинамічна стабільність зменшується в ряду HClO - HClO2 - HClO3.
Можливий перебіг і таких реакцій
5HClO = 2Cl2 + HClO3 +2H2O (4)
7HClO3 = Cl2 + 5HClO4 + H2O (5).
Крім того, потенціал відновлення кисню
O2 + 4H+ + 4e = 2H2O (6)
(Е0=1,23 В) при рН = 0 и р(О2)=1 атм менший за потенціали реакцій (1)-(5), тому можливо, що, наприклад, HClO буде окиснювати воду з виділенням кисню а рівняння реакції (7) не важко отримати комбінуванням реакцій

HClO = HCl + 1/2O2 (7).
При рН=0 найбільш стійкими формами є HClO4 і Cl2, оскільки вони є кінцевими продуктами всіх реакцій диспропорціонування (1-5).
В лужному середовищі потенціали і енергії Гіббса напівреакцій, що включають іони гідрогену, зменшуються. Солі оксокислот тому стають стабільніше, ніж самі кислоти. Кінцевими продуктами розпаду будуть хлориди і перхлорати.
Розглянемо кінетичну стабільність оксокислот і їх солей, тобто швидкість реакцій (1-5, 7). Вона визначається трьома факторами:
- ростом енергії зв’язку Cl-O в ряду HClO–HClO2 –HClO3 – HClO4;
- збільшенням екранування атома хлору атомами оксигену, тобто зменшенням його доступності до взаємодії з іншими атомами (чи їх угрупуваннями);
- трудністю зародження газової фази в рідкому розчині.
Фактори 1 і 2 підвищують енергію активації і уповільнюють швидкість реакції (1-3) в ряду HClO>HClO2>HClO3, так oо на найповільнішою стає реакція (3). Кінетично нестійкими) будуть кислоть HClO і HClO2, а нацбільш інертною - хлорновата кислота HClO3. Одержати у розчині хлорну кислоту HClO4 шляхом диспропорціонування HClO3 неможливо через кінетичні причини. Фактор 3 приводить до того, що процеси (4,5,7) стають загальмованими, оскільки гетерогенні реакції, що супроводжуються виділенням хлору і кисню, перебігають значно повільніше, ніж гомогенні реакції диспропорціонування.
В цілому, всі оксокислоти хлору термодинамічно і кінетично нестабільні. Солі оксокислот хлору, навпаки, термодинамічно і кінетично більш стійкі. Це пов’язано з тим, що тверді солі побудовані із іонів, електростатична взаємодія яких підвищує енергію кристалічної ґратки і, відповідно, стабільність.
2.4. Окиснювальна здатність оксокислот хлора
Окиснювальна здатність оксокислот хлору пов’язана з можливістю пониження ступені окиснення в аніоні кислоти HXOn, n = 1,2,3,4.
1.Всі oксокислоти є сильними окисниками.
2.Їх окисна здатність відповідає такій послідовності: Cl2 <HClO
 HClO2 >HClO3 > HClO4.
HClO2 >HClO3 > HClO4.Наприклад, розчин солі NaClO окиснює
 до Br2 в кислому, нейтральному та лужному середовищах:
до Br2 в кислому, нейтральному та лужному середовищах:NaClO + 2KBr + H2O = NaCl +Br2 +2KOH (в лужному середовищу відбувається подальше окиснення Br2 до
 ).
).За допомогою NaClO3
 окиснює тільки в кислому середовищу:
окиснює тільки в кислому середовищу:NaClO3+ 6KBr +3H2SO4 = 3Br2 + NaCl + 3K2SO4 + 3Н2О.
3.Із зростанням рН = -lg[H+] окиснювальна здатність зменшується. Наприклад, для реакції
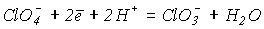

у відповідності до рівняння Нернста
 .
.величина потенціалу зменшується від Ео = 1.02 В при рН = 0 до Ео= +0.37 при рН=14. Таким чином, окиснювальна здатність солей нижче, ніж відповідних кислот.
