Лекція 1 хф (лекція) Тема Загальні властивості неметалів
| Вид материала | Лекція |
СодержаниеМетоди синтезу гідрогенгалогенідів. HF, наприклад, можна одержати нагріванням твердих біфторидів лужнихх металів: KHF Оксиди галогенів Таблиця 5. Оксиди галогенів Таблиця 6. Будова оксидів Х2О |
- З м І с т стор. Вступ. Лекція, 1088.23kb.
- Курс лекцій для студентів денної І заочної форми навчання спеціальності 050301 „Товарознавство, 1137.66kb.
- Єльнікової Тетяни Олександрівни з курсу "Моделювання та прогнозування стану довкілля", 33.26kb.
- Вступна лекція Голема. Про людину трояко Вісімнадцята лекція, 11204.11kb.
- Лекція Основи молекулярно-кінетичної теорії І ідеальний газ, 101.02kb.
- Лекція 4. Тема: вивчення твору світової літератури, 130.47kb.
- Лекція на тему „Основи теорії держави І права" > Лекція на тему, 3538.68kb.
- Лекція №12 Тема: Організація обліку доходів І фінансових результатів діяльності, 198.65kb.
- Лекція тема 2, 153.96kb.
- Лекція №7 тема: зведена І консолідована фінансова звітність, 147.05kb.
Методи синтезу гідрогенгалогенідів.
Відомі три основні методи синтезу галогеноводнів.
1. Прямий синтез із елементів. Фтор и хлор реагують з водороднем із вибухом, що свідчить про ланцюговий механізм реакції. Однак при певних співвідношеннях тисків водня (
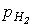 ) і хлора (
) і хлора (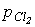 ) водень сгоряє в атмосфері хлора без вибуху. Згоряння хлора з воднем є основним промисловим способом отримання HCl. Бром і йод реагирують з воднем бьльш спокійно, однак вихід невеликий, оскільки рівновага Н2 + Х2 = 2НХ (Х = Br, I) зміщенв ліворуч.
) водень сгоряє в атмосфері хлора без вибуху. Згоряння хлора з воднем є основним промисловим способом отримання HCl. Бром і йод реагирують з воднем бьльш спокійно, однак вихід невеликий, оскільки рівновага Н2 + Х2 = 2НХ (Х = Br, I) зміщенв ліворуч.2. Витіснення із солей. Газоподібні НХ виділяються при дії нелетких сильних кислот на тверді іонні галогеніди металів : (на практиці використовують 70-85%-ний р-н сульфатної к-ты, оскільки реакція йде на поверхні кристалів солі). Якщо брати конц. к-ту, осаджується NaHSO4. При використанні розб. сульфатної к-ти значна частина HCl залишається в р-ні. HCl, що виділилася просушують над конц. сірчаною к-тою. Оксид фосфора для цього не використовують оскільки він взаємодіє с HCl:
P4O10 + 12HCl = 4POCl3 + 6H2O
CaF2 + H2SO4(конц) = CaSO4
 + 2HF
+ 2HF 
NaCl + H2SO4(конц) = NaHSO4 + HCl

При одержанні HBr і HI, що мають сильні відновні властивості, використовують нелеткі кислоти-неокисникм, наприклад, H3РO4:
KX + H3РO4(конц)
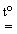 KH2РO4 + HX
KH2РO4 + HX , X = Cl, Br, I.
, X = Cl, Br, I.3. Гідроліз галогенідів неметалів. Більшість галогенідів неметалів відносіться до сполук з ковалентним зв’язкои і гідролізуються з виділення відповідного гідрогенгалогеніду, наприклад,
SiCl4 + 4H2O = SiO2. 2H2O + 4HCl

Для отримання галогеноводнів часто використовують реакції гідролизу галогенідів фосфора PX3 (X = Cl, Br, I):
PX3 +3H2O(хол) = H3PO3 + 3HX
 .
.При одержанні НХ (X = Br, I) немає необхідності попередньо синтезувати PХ3. Наприклад, для утворення HI механичну суміш I2 + Pкр обробляють водою:
2Pкр + 3I2 + 6H2O = 2H3PO3 + 6HI
 .
.Існіють і інші способи синтезу галогеноводнів. HF, наприклад, можна одержати нагріванням твердих біфторидів лужнихх металів:
KHF2
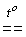 KF + HF
KF + HF .
.Галогеноводні утворюються також при галогенуванні органічних сполук, наприклад:
RH +Cl2 = RCl + HCl
 .
.Иодистоводневу кислоту можна отримати пропусканням H2S через суспензію I2:
H2S + I2 = 2HI + S

ЛЕКЦІЯ 4
Тема. Оксигеновмісні сполуки галогенів
-
Оксиди галогенів
Більшість оксидів галогенів нестійкі і одержані непрямим шляхом, оскільки галогені з киснем не реагують. Відомі такі оксиди галогенів (табл.5).
Таблиця 5. Оксиди галогенів
| Ступінь окиснення | +1 | +4 | +5 | +6 | +7 |
| F | F2O | - | - | - | - |
| Сl | Cl2O | ClO2 | - | Cl2O6 | Cl2O7 |
| Br | Br2O | BrO2 | - | BrO3 | Br2O7 |
| I | - | I2O4 | I2O5 | - | I2O7 |
Оксиди галогенів (I). Молекули оксидів Х2О (Х = F, Cl, Br) мають кутову будову:
Таблиця 6. Будова оксидів Х2О
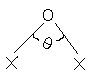 | X = F; |  = 103.20; = 103.20; | 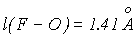 ; ; |
| X = Cl; |  =110.90 ; =110.90 ; |  |
F2O (іногді називають оксиген дифторидом) - безбарвний газ (т.пл. -2240С, т.кип. -1450С), який може бути одержаний при пропусканні фтора через 2%-ний водний розчин NaOH:
2F2 + 2NaOH = F2О + 2NaF +H2O.
При збільшенні концентрації NaOН вихід F2O зменшується через перебіг побічної реакції:
F2О + 2NaOH = O2 + 2NaF + H2O.
Хлор (I)оксид Cl2O - жовто-коричневий газ (т.пл. -1160С, т.кип. 40С).
Його отримують, пропускаючи струм хлора через трубку із свіжоосадженим і потім висушеним меркурій (ІІ) оксидом:
2HgO + 2Cl2
 Hg2OСl2 + Cl2O.
Hg2OСl2 + Cl2O.Утворений Cl2O конденсують при температурі -60оС. Сполука вкрай нестійка, при підвищеній температурі розкладається з вибухом.
Cl2O добре розчиняється у воді (при 0оС 1 об. H2O розчиняє 200 об. Cl2O), його водний розчин проявляє властивості слабкої кислоти:
H2O + Cl2O = 2HClO.
Бром (I) оксид Br2O нагадує за властивостями і методу синтезу Cl2O.
Діоксиди ClO2 і BrO2. Діоксид хлора ClO2 при стандартних умовах - жовтий газ (т.пл.-600С, т.кип. 100С). Це єдиний із оксидів галогенів, який використовується в промисловості, наприклад, як відбілююча речовина. В техніці його одержують пропусканням SO2 в підкислений розчин натрій хлорату:
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + 2ClO2 .
В лабораторних умовах ClO2 синтезують із хлорату KClO3 і вологої щавлевої кислоти в присутності концентрованої сульфатної кислоти:
2KClO3 + H2C2O4 +H2SO4 = K2SO4 +2ClO2 + 2CO2 +2H2O.
Одержаний ClO2 розбавлений CO2, що знижує ймовірність вибуху. Якщо ж використовувати концентровану H2SO4 і KClO3, то реакція стає вибухонебезпечною:
3KClO3 +3H2SO4,конц. = 3KHSO4 +2ClO2 + HClO4 +Н2О.
Працювати з ClO2 треба вкрай обережно: він вибухає від незначної механічної дії, введення в систему відновника (гумова пробка), при нагріванні до 100оС.
Молекули ClO2 и BrO2 мають кутову будову ОСlО = 117.60, l(Cl-O) = 1.47Å. В лужному середовищу ClO2 диспропорціонує
2ClO2 + 2NaOH = NaClO2 + NaClO3 + H2O.
BrO2 (т.пл. -400С) - нестійкий оксид и вище -400С розкладається:
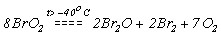 .
.I2O4 - жовта кристалічна речовина, побудована із йонів IO+ і IO-3 . При нагріванні вище 1000С розкладається на I2 і O2.
Хлор (VI) оксид Cl2O6- червона маслоподібна рідина (т.пл. 3.50С, т.кип. 2030С), вибухонебезпечна, легко розкладається на ClO2 і O2. В твердій фазі побудований із йонів
 і
і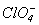 . Є змішаним ангідридом кислот HClO3 и HClO4.
. Є змішаним ангідридом кислот HClO3 и HClO4. Cl2O6 + H2O = HClO3 + HClO4.
Утворюється при окисненні ClO2 озоном:
 .
.Йод (V)оксид I2O5 - бела тверда речовина (т.пл. 3000С), єдиний термодинамічно стійкий із оксидів галогенів. Твердий оксид I2O5 складається із молекул O2IOIO2,, зв’язаних між собою слабкою міжмолекулярною взаємодією. Одержують I2O5 дегідратацією HIO3 при 200-2500С в струмені сухого повітря. I2O5 використовується як окисник в кількісному аналізі для визначення СО:
5СО + I2O5
 I2 + 5CO2.
I2 + 5CO2.Хлор (VII)оксид Cl2O7 - масляниста безбарвна рідина (т.пл.-930С, т.кип. 800С), легко вибухає. Молекула Cl2O7 побудована з двох тетраедрів ClO4, що мають спільну вершину. Cl2O7 - ангідрид хлорної кислоти HClO4. Його одержують дегідратацією концентрованої хлорної кислоти за допомогою P2O5 с наступною обережною перегонкою у вакуумі:
6HClO4 + P2O5
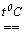 3Cl2O7 + 2H3PO4.
3Cl2O7 + 2H3PO4.