Лекція 1 хф (лекція) Тема Загальні властивості неметалів
| Вид материала | Лекція |
- З м І с т стор. Вступ. Лекція, 1088.23kb.
- Курс лекцій для студентів денної І заочної форми навчання спеціальності 050301 „Товарознавство, 1137.66kb.
- Єльнікової Тетяни Олександрівни з курсу "Моделювання та прогнозування стану довкілля", 33.26kb.
- Вступна лекція Голема. Про людину трояко Вісімнадцята лекція, 11204.11kb.
- Лекція Основи молекулярно-кінетичної теорії І ідеальний газ, 101.02kb.
- Лекція 4. Тема: вивчення твору світової літератури, 130.47kb.
- Лекція на тему „Основи теорії держави І права" > Лекція на тему, 3538.68kb.
- Лекція №12 Тема: Організація обліку доходів І фінансових результатів діяльності, 198.65kb.
- Лекція тема 2, 153.96kb.
- Лекція №7 тема: зведена І консолідована фінансова звітність, 147.05kb.
3.Властивості оксокислот галогенів
3.1. Оксокислоти HXO та їх солі
Гіпогалогенітні кислоти HXO відомі лише в розбавлених водних розчинах. Їх одержують взаємодією галогена з суспензією оксида ртуті:
2X2 + 2HgO + H2O = HgO. HgХ2
 +2HOX.
+2HOX.Слід відзначити особливість сполуки HOF. Вона утворюється при пропусканні фтора над кригою при -400С і конденсацією утвореного газу при температурі нижче 0оС.
F2,газ + H2Oлед
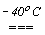 HOF + HF
HOF + HFHOF не утворює солей, а при її взаємодії з водою з’являється гідроген пероксид:
HOF + H2O = H2O2 + HF
Гіпогалогенітні кислоті є слабкими. При переході від хлору до йоду по мірі зростання радіуса і зменшення електронегативності атом галогену слабкіше зміщує електронну густину від атома оксигена и, тим самим, слабкіше поляризує зв’язок Н-О. В наслідок чого кислотні властивості в ряду HClO - HBrO - HIO послаблюються (див. величини рКa в табл.9).
Таблиця 9. Властивості кислот HXO та йонів ХО-
| Властивості | HOCl | HOBr | HOI |
| Eo,B (pH=0): HOХ+H++ 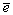 =1/2Х2+H2O =1/2Х2+H2O | 1.63 | 1.59 | 1.45 |
| Eo,B (pH=14):  | 0.94 | 0.76 | 0.49 |
| pKа процесу  | 7.25 | 8.7 | 11 |
| Константа рівноваги  | 1027 | 1015 | 1020 |
Розчини гіпогалогенітів мають сильно лужну реакцію, а пропускання через них СО2 приводить до утворення кислоти, наприклад,
NaClO + H2O + CO2 = NaHCO3 + HClO.
Окиснювальна здатність кислот HXO і іонів

 в том ж ряду термодинамічної точки зору зменшується. Це слідує із порівняння величин стандартних потенціалів Ео(табл.9).
в том ж ряду термодинамічної точки зору зменшується. Це слідує із порівняння величин стандартних потенціалів Ео(табл.9). Високу окиснювальну здатність гіпохлоритів илюструють наступні реакції:
NaСlO +2NaI + H2O = NaCl + I2 + 2NaOH
2NaClO + MnCl2 + 4NaOH = Na2MnO4 + 4NaCl + 2H2O.
Швидкість же реакції окиснення і диспропорціонування в ряду HClO-HBr-HIO
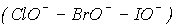 зростає. Це зумовлено зростанням радіуса галогену і його доступності до атаки реагенту.
зростає. Це зумовлено зростанням радіуса галогену і його доступності до атаки реагенту.Таким чином, термодинамічна і кінетична стабільність в ряду HClO-HBrO-HIO змінюються в протилежних напрямках. Дійсно, константа рівноваги диспропорціонування гіпохлорит-іона велика (табл.9), але швидкість розпаду мала. Тому гіпохлорити можна отримати дією хлора на холодный розчин лугу. В промисловості таким чином одержують білильне вапно (формула CaOCl2 відображає основний склад, в продуктах взаємодії присутні Ca(OCl)2, Ca(OH)2, CaCl2 які містять кристалізаційну воду.) :
Ca(OH)2 + Cl2 = CaCl(OСl) +H2O
Для іонів
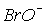 та
та 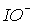 константи рівноваги диспропорціонування менше, за
константи рівноваги диспропорціонування менше, за 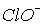 . Однак швидкості їх розпаду набагато більші. Наприклад, натрій гіпоброміт диспропорціонує при t > 0oC за реакцією:
. Однак швидкості їх розпаду набагато більші. Наприклад, натрій гіпоброміт диспропорціонує при t > 0oC за реакцією:3NaBrO. xH2O
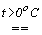 NaBrO3 + 2NaBr + 3xH2O.
NaBrO3 + 2NaBr + 3xH2O.3.2. Оксокислоти HXO2
Із оксокислот HXO2 відомі лише хлориста кислота HClO2. Вона не утворюється при диспропорціонуванні HClO. Водні розчини HClO2 отримують обробкою Вa(ClO2)2 сульфантою кислотою с наступним відфільтровуванням осаду BaSO4 :
Ba(ClO2)2 + H2SO4 = BaSO4
 + 2HClO2.
+ 2HClO2.HClO2 - кислота середньої сили: рКа = 2.0 (табл.8). Хлорити використовують для відбілювання. Їх одержують м’яким відновленням ClO2 в лужному середовищі:
2СlO2 + Ba(OH)2 + H2O2 = Ba(ClO2)2 + 2H2O + O2
2СlO2 + PbO + 2NaOH = PbO2 + 2NaClO2 + H2O.
Броміт барію вдалося синтезувати за реакцією:
Ba(BrO)2 + 2Br2 + 4KOH
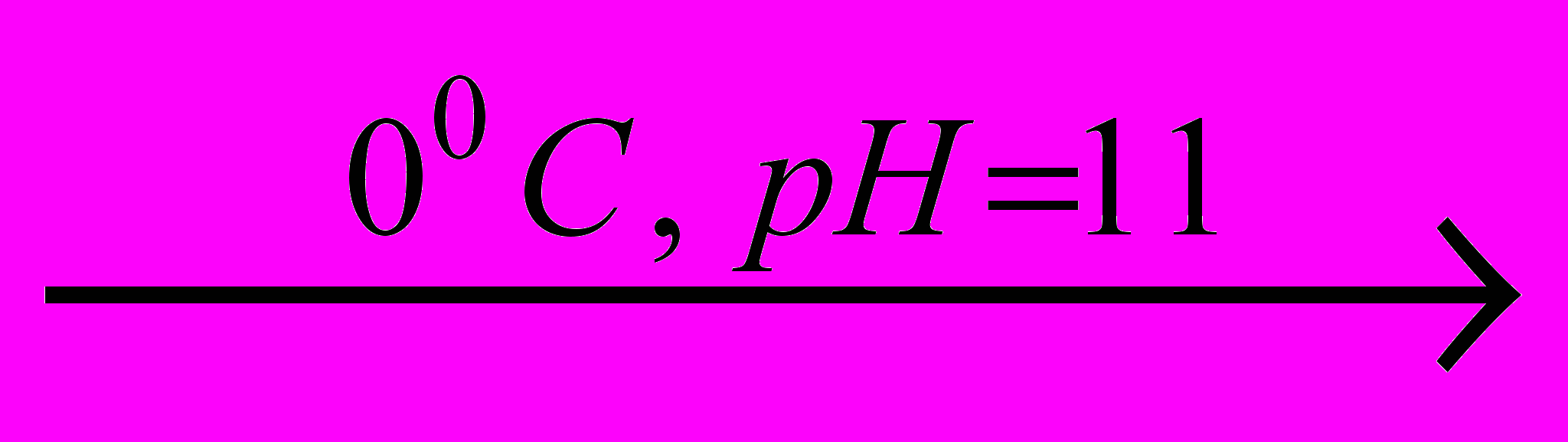 Ba(BrO2)2 +4KBr + 2Н2О.
Ba(BrO2)2 +4KBr + 2Н2О.3.3. Властивості кислот HXO3 та їх солей.
Оксокислоти HXO3 більш стійкі, ніж HX. Хлорновата HClO3 і бромновата HBrO3 кислоти отримані в розчинах з концентрацією нижче 30%, а тверда йодновата HIO3 виділена як індивідуальна речовина.
Розчини HClO3 і HBrO3 одержують дією розбавленої H2SO4 на розчини відповідних солей, наприклад,
Ba(ClO3)2 + H2SO4 = 2HClO3 + BaSO4
 .
.При концентрації розчинів вище 30% кислоти HBrO3 і HClO3 розкладаються з вибухом.
Тверду йодновату кислоту можна одержати окисненням йода концентрованою HNO3, хлорноватою кислотою чи гідроген пероксидом: I2 + 5Н2О2 = 2HIO3 + 4H2O.
При нагріванні відбувається її дегідратація:
2 HIO3
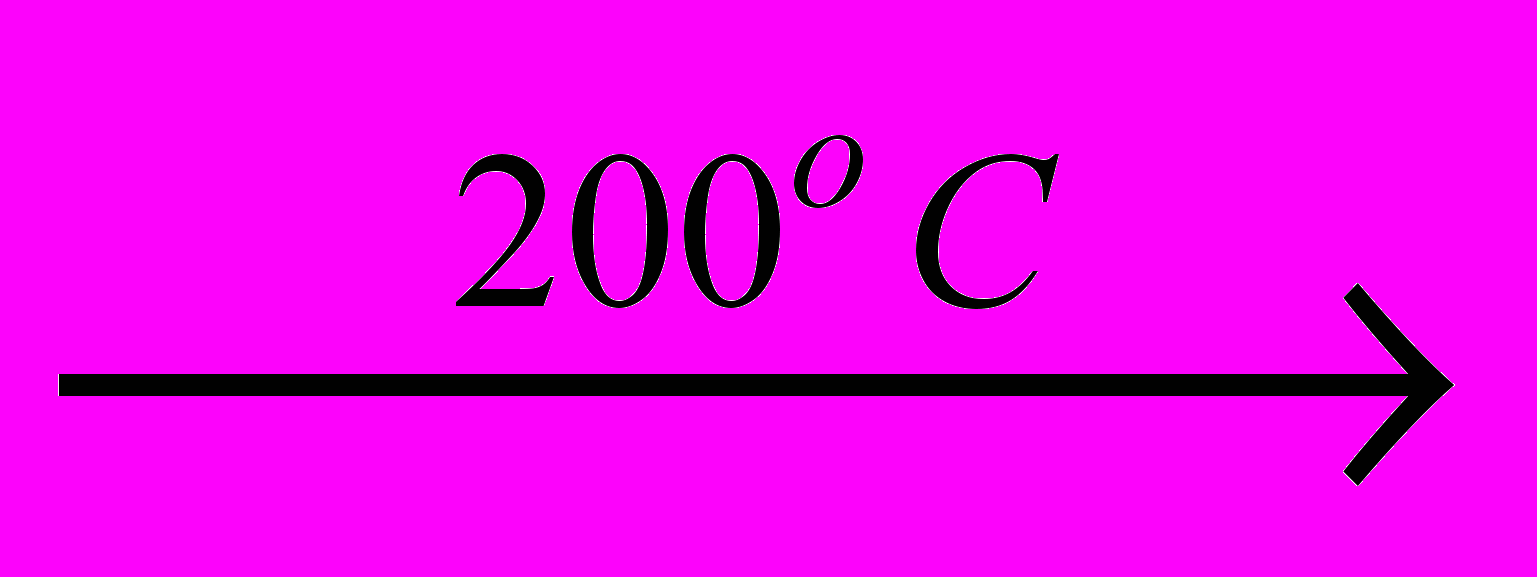 I2O5 + H2O.
I2O5 + H2O.Вдастивості кислот HXO3, а також міжатомні відстані (l) і валентні кути в пірамідальних іонах ХО3- представлені в табл.10.
Таблиця 10. Будова і властивості іонів ХО3-
| Свойства | ClO3- | BrO3- | IO3- |
| l X-O,Å | 1.48 | 1.65 | 1.81 |
| OXO | 1070 | 1040 | 1000 |
| Eo, B (pН=0):6H++ХО3-+5е=1/2X2 +3H2O | 1.47 | 1.52 | 1.20 |
| pН=14: ХО3-+3H2O+6e=X-+6OH- | 0.62 | 0.61 | 0.26 |
| pКа HХO3 = H++ ХО3- | -1.2 | 0.7 | 0.8 |
| Константи рівноваги 4XO3- = X- + 3XO4- | 1029 | 10-33 | 10-53 |
Водні розчини HXO3 є сильними кислотами. В ряду HClO3-HBrO3-HIO3 спостерігається деяке зменшення сили кислот (табл.10). Це можна пояснити тим, що з ростом розміру атома галогену міцність кратного зв’язку Х=О зменшується, що приводить до зменшення полярності зв’язку H-O і зменшенню легкості відриву від неї гідрогену молекулами води.
В кислому середовищі (рН
 0) з точки зору термодинаміки окиснювальна здатність зменшується ряду BrO3-ClO3->IO3-, що витікає із співставлення величин стандартних потенціалів Ео (табл.10). Дійсно, в кислому середовищі при взаємодії натрій бромату з хлором чи йодом виділяється вільний бром:
0) з точки зору термодинаміки окиснювальна здатність зменшується ряду BrO3-ClO3->IO3-, що витікає із співставлення величин стандартних потенціалів Ео (табл.10). Дійсно, в кислому середовищі при взаємодії натрій бромату з хлором чи йодом виділяється вільний бром: 2NaBrO3 + Cl2 = 2NaClO3 + Br2
2NaBrO3 + I2 = 2NaIO3 + Br2,
а взаємодія йоду с розчином натрій хлорату приводить до виділення хлору:
2NaСlO3 + I2 = 2NaIO3 + Cl2
Термодинамічна стабільність іонів ХО3- по відношенню до розпаду на пергалогенат ХО4- і галогенід Х- іони зростає від ClO3- до ІО3- (табл.10). Відомо також, що HClO3 існує лише в розчинах, а HIO3 виділена у вигляді безбарвних кристалів (т.пл.110оС). Відзначимо таку важливу обставину. Як зазначалось, с точки зору термодинаміки в ряду
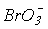

 >
>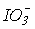 окиснювальна здатність зменшується, а стабільність до диспропорціонування зростає. Реальний же склад продуктів визначається кінетикою, тобто механізмом відповідних реакцій. Виходить так, що швидкість реакцій окиснення і диспропорціонування в тому ж ряду збільшується:
окиснювальна здатність зменшується, а стабільність до диспропорціонування зростає. Реальний же склад продуктів визначається кінетикою, тобто механізмом відповідних реакцій. Виходить так, що швидкість реакцій окиснення і диспропорціонування в тому ж ряду збільшується:  <
<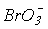 <<
<<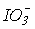 . Таким чином, термодинаміка і кінетика в даному випадку працюють в протилежних напрямках.
. Таким чином, термодинаміка і кінетика в даному випадку працюють в протилежних напрямках.Це зумовлено зростанням розміру атома галогену r(Cl)
Наприкінці відзначимо, що солі більш стійкі до нагрівання, ніж відповідні кислоти. Так деякі із йодатів зустрічаються в природі у вигляді мінералів, наприклад, лаутарит NaIO3. При нагріванні твердого КСIO3 до 500оС можливо диспропорціонування
4KClO3
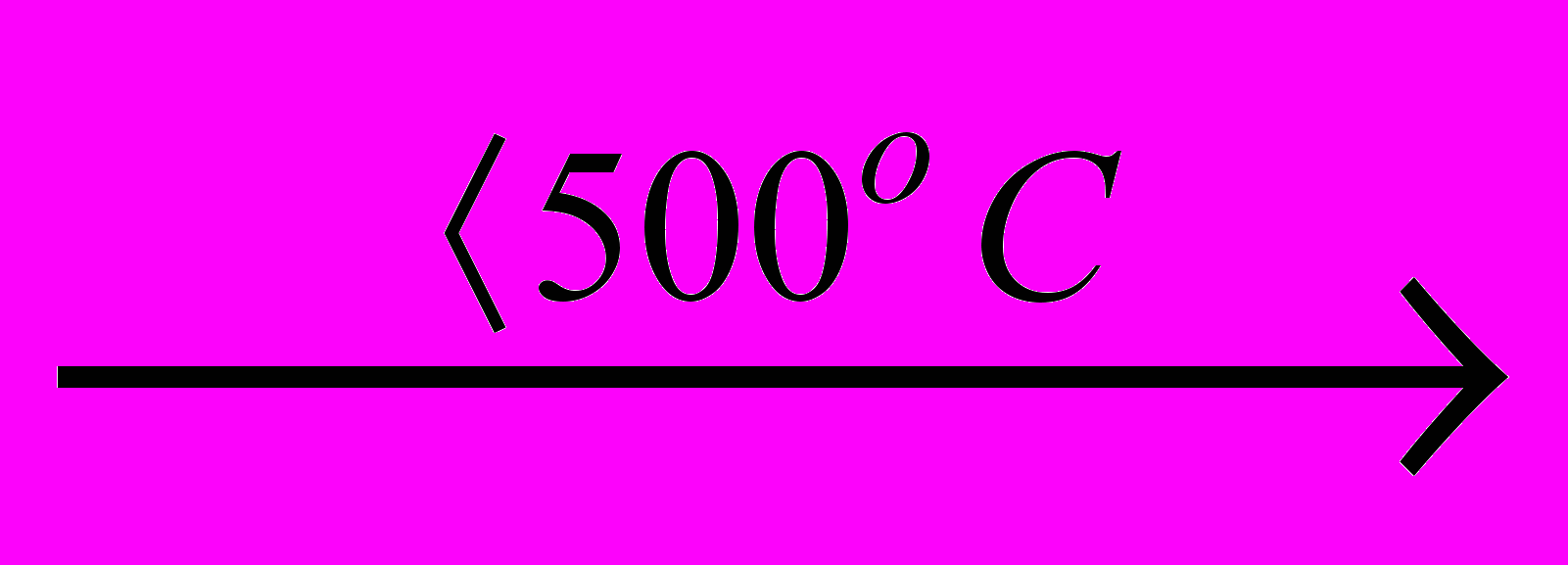 3KClO4 +KCl,
3KClO4 +KCl,(за наявності каталізаторів, наприклад, MnO2, вдається не тільки знизити температуру розкладу, а й змінити шлях процесу: 2KClO3
 2KCl +3О2
2KCl +3О2а при більш високої температурі розклад розлаву KClO4 : KClO4
 KCl +2O2 .
KCl +2O2 . Склад продуктів розкладу броматів і йодатів залежить від природи катіона, наприклад,
2KIO3
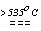 2KI + 3O2 (аналогічно и бромати лужних металів);
2KI + 3O2 (аналогічно и бромати лужних металів);2Cu(BrO3)2
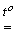 2CuO + 2Br2 + 5O2 (аналогічно йодат кальцію);
2CuO + 2Br2 + 5O2 (аналогічно йодат кальцію);5Ba(IO3)2
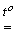 Ba5(IO6)2 +4I2 +9O2
Ba5(IO6)2 +4I2 +9O23.4. Оксокислоти HXO4
В табл.11 приведены данные о свойствах кислот HXO4, а также о межатомных расстояниях и валентных углах в тетраэдрических ионах
 .
.Таблиця 11. Властивості кислот HXO4
-
Властивості
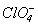
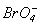
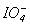
l X-O, Å
1.43
1.61
1.78
OXOo
~1000
1090
1070
pKа: HXO4=H+ + XO4-
-10
~ -9
-
H5IO6=H+ + H4IO6-
3.0
H4IO6-= H+ + H3IO62-
8.0
Eo, B; pН=0:
XO4- +8H+ + 7e =1/2X2 + 4H2O
1.39
1.59
Хоча метаиодна кислота HIO4 і деякі її солі невідомі, йод(VII) через збільшення радіусу в ряду Сl-Br-I и підвищення його координаційного числа утворює, головним чином, гідроксопохідні складу H5IO6, в яких атом йода октаедрично оточений атомами оксигену і п’ятьома гідроксильними групами.
Хлорна кислота (Тпл.= -102оС, Ткип.= 90оС) отримана в індивідуальному стані нагріванням твердої солі КClO4 з концентрованою H2SO4 с наступною відгонкою при зниженому тиску:
КClO4 ,тв.+ H2SO4,конц
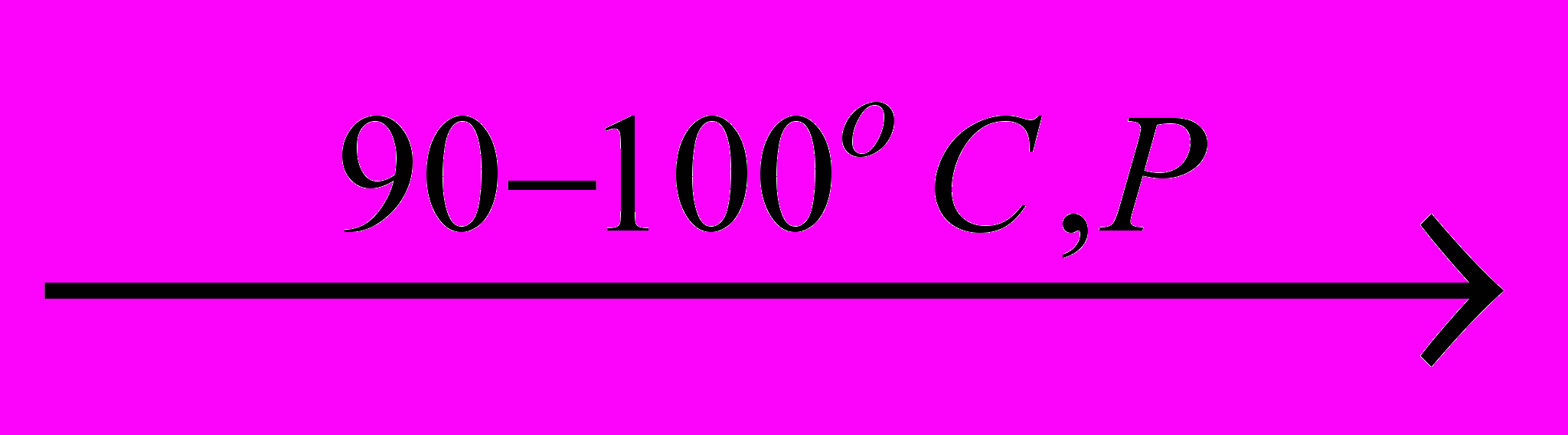 HClO4 + KHSO4
HClO4 + KHSO4HClO4 легко вибухає при контакті з органічними речовинами.
Бромна кислота HBrO4 відома лише в розчинах (не вище 6М), які отримують підкисненням перброматів NaBrO4, які, в свою чергу, вдалося синтезувати окисненням броматів фтором в розбавлених лужних розчинах (бромати можна окиснити до перброматів за допомогою XeF2 чи електролітично) :
NaBrO3 + F2 + 2NaOH = NaBrO4 + 2NaF +H2O .
Хлорная кислота - одна із сильних кислот. За силою до неї наближається бромна кислота.
Иодна кислота існує в декількох формах, головними із яких є ортойодна H5IO6 і метайодна HIO4 кислоти. Ортойодна кислота утворюється у вигляді безбарвних кристалів при обережному упарюванні розчину, утвореного за обмінною реакцією
Ba3(H2IO6)2 + 3H2SO4 = 3BaSO4
 + 2H5IO6.
+ 2H5IO6.(вихідний перйодат синтезують за схемою:
| NaIO3 + 4NaOH + Cl2  | Na3H2IO6  | + 2 NaCl + H2O |
| | (pH=7-8) | |
| 2Na3H2IO6 + 3Ba(NO3)2 = | Ba3(H2IO6)2  | + 6NaNO3. |
В кристалічному стані речовина має молекулярну структуру: у вузлах кристалічної решітки знаходяться октаедри (HO)5IO. Ортойодна кислота у водних розчинах проявляє властивості слабкої п’ятиосновної кислоти. Константи дисоціації H5IO6 за 4-ою і 5-ою ступенями настільки малі, що у водних лужних розчинах можливо відтитрувати тільки перші три протона, що відповідає утворенню солей типу KH4IO6, K2H3IO6 и K3H2IO6 (Сіль складу K4HIO6 отримати не вдається).
У ряді випадків із розчинів виділяється середня сіль, наприклад, Ag5IO6, стікість якої обумовлена високою енергією кристалічної решітки і полімерною структурою.
При обережному нагріванні ортойодної кислоти утворюється метайодна кислота
H5IO6
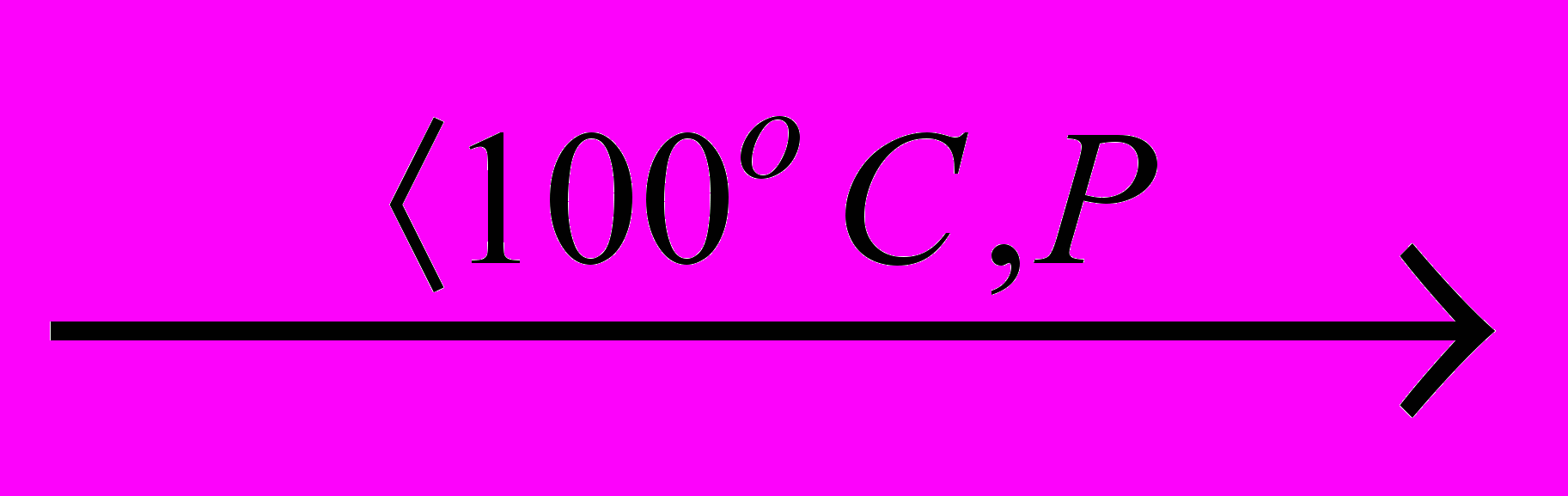 HIO4 + 2H2O.
HIO4 + 2H2O.Як і у випадку кислот HXO3, термодинамічна і кінетична стабільність кислот HXO4 і їх солей різніться. Термодинамічна стійкість йодної кислоти и перйодатів до розкладу вище, ніж хлорної кислоти і перхлоратів. Безбарвна концентрована HClO4 навіть при кімнатній температурі синтезу темніє через утворення оксидів хлору з больш низькими ступенями окиснення.
Метайодна кислота розкладається тільки при нагріванні 2HIO4
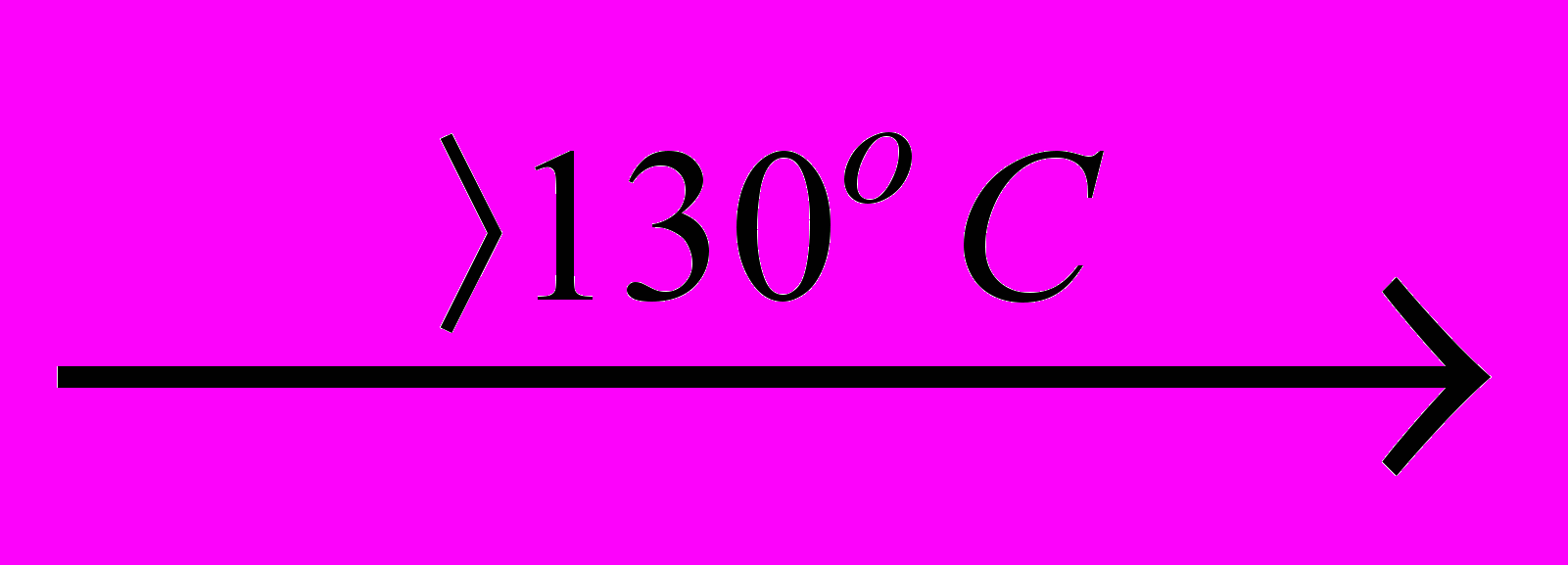 2HIO3 + O2 .
2HIO3 + O2 .В ряду ClO4-BrO4-IO4-(H5IO6) спостерігається аномалія у зміні термодинамічної стабільності і окисної здатності: бромна кислота та її солі менш стабільні, однак більш сильні окисники, ніж відповідні кислоти і солі хлору Cl(VII) і йода I(VII) (табл.11,). Аналогіні порушення в послідовності змін властивостей оксокислот спостерігаються і для інших елементів 4-го періоду – SeO42-, AsO43-, GeO44-. Такі аномалії іноді називають вторинною періодичністю, розуміючи, наприклад, що властивості сполук брому схожі на властивості аналогічних сполук фтору. Ці аномалії у властивостей перброматів пов’язані з зниженням міцності зв’язку Br-O порівняно із зв’язком Cl-O. В свою чергу, це викликано зрстанням енергій 4s- і 4p-орбіталей атома брому порівняно з енергіями 2s- і 2p-орбіталей оксигену, а, таким чином, із зменшенням взаємодії (перекриття) 4s-, 4p-орбяталей брому і 2s, 2p-орбіталей оксигена (енергії 2s-, 2p-, 3s-, 3p-, 4s- і 4p-атомних орбіталей складають 32.4, 15.9, 25.3, 13.7, 24.1 и 12.5 еВ відповідно). Підвищення стабільності і зменшення окислювальної здатності оксосполук при переході Br(VII)
 I(VII) зумовлено особливостями будови і збільшення міцності зв’язку I-O в октаедричних йонах IO6 порівняно із зв’язком Br-O в тетраедрах BrO4-. Атом йода порівняно з атомом брому має більший радіус, для нього характерно координаційне число 6. Зростання числа координованих атомів оксигену приводить до росту числа електронів на зв’язуючих молекулярных орбіталях і, відповідно, до підвищення міцності зв’язку.
I(VII) зумовлено особливостями будови і збільшення міцності зв’язку I-O в октаедричних йонах IO6 порівняно із зв’язком Br-O в тетраедрах BrO4-. Атом йода порівняно з атомом брому має більший радіус, для нього характерно координаційне число 6. Зростання числа координованих атомів оксигену приводить до росту числа електронів на зв’язуючих молекулярных орбіталях і, відповідно, до підвищення міцності зв’язку.Стійкість солей вище, ніж відповідних оксокислот HXO4. Кристали солей, наприклад, KClO4, побудовані із йонів K+ і ClО4-, електростатична взаємодія яких збільшує енергію кристалічної решітки и підвищує стабільність.
Розглянуті термодинамічні закономірності не співпадають с кінетичними: швидкість реакції окиснення за участю йонов BrO4- і особливо ClО4- повільна. Наприклад, взаємодія 70%-ої HClO4 з магнієм супроводжується виділенням водню:
Mg + 2 HClO4 = Mg(ClO4)2 + H2 ,
а 1М розчин HBrO4 не окиснює хлор із HCl. У випадку ж H5IO6 подібна реакція перебігає без кінетичних ускладнень:
H5IO6 + 2HCl = HIO3 + Cl2 + 3H2O .
Увеличение скорости реакции окисления в ряду ClO4-BrO4-IO4-(H5IO6), зумовлено ростом радіуса атома галогену, зростанням доступності його до атаки атомами відновника, а у випадку H5IO6 існуванням коротких (1.78Å) і довгих (1.89Å) зв’язків I-O.
На схемі 12 представлені тенденції у зміні кислотних властивостей, термодинамічної стабільності і окиснювальної здатності (рН = 0) оксокислот галогенів.
| HClO |  | HClO2 | 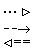 | HClO3 | 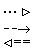 | HClO4 |
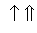 | | | | 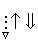 | | 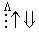 |
| [HBrO] | |  | | HBrO3 |  | HBrO4 |
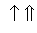 | | | | 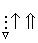 | | 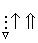 |
| [HIO] | | 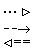 | | HIO3 | 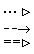 | HIO4 |
| | | | | | | (H5IO6) |
Схема.12. Зростання сили кислот (
 ), термодинамічної стабільності (
), термодинамічної стабільності (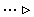 ) і окиснювальної здатності (
) і окиснювальної здатності ( ) оксокислот галогенів.
) оксокислот галогенів. 