Лекція 1 хф (лекція) Тема Загальні властивості неметалів
| Вид материала | Лекція |
СодержаниеГалогени 1. Загальна хактеристика галогенів. Таблиця 1.Деякі характеристики атомів галогенів |
- З м І с т стор. Вступ. Лекція, 1088.23kb.
- Курс лекцій для студентів денної І заочної форми навчання спеціальності 050301 „Товарознавство, 1137.66kb.
- Єльнікової Тетяни Олександрівни з курсу "Моделювання та прогнозування стану довкілля", 33.26kb.
- Вступна лекція Голема. Про людину трояко Вісімнадцята лекція, 11204.11kb.
- Лекція Основи молекулярно-кінетичної теорії І ідеальний газ, 101.02kb.
- Лекція 4. Тема: вивчення твору світової літератури, 130.47kb.
- Лекція на тему „Основи теорії держави І права" > Лекція на тему, 3538.68kb.
- Лекція №12 Тема: Організація обліку доходів І фінансових результатів діяльності, 198.65kb.
- Лекція тема 2, 153.96kb.
- Лекція №7 тема: зведена І консолідована фінансова звітність, 147.05kb.
Галогени
1. Загальна хактеристика галогенів.
До елементів VII головної підгрупи належать флуор (F), хлор (Cl), бром (Br), иод (I), астат (At). Назва цих елементів - галогени (греч. "ті, що народжують солі") - зумовлено тим, що більшість їх сполук з металами є типові солі (KCl, NaCl и т.д.).
Таблиця 1.Деякі характеристики атомів галогенів.
| Атом | Електронна конфігурація | Орбі таль ний атом ний радіус, ( 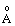 ) ) | Еср Спорідне-ність до електрону еВ (кДж/моль) | Eион Перша енергія іонізації еВ(кДж/моль) | ЕН Елек тро нега- тив- ність* | Стійкі ступені окиснення |
| 9F | [He]2s22p5 | 0.39 | 3.45(333) | 17.42(1682) | 4.1 | -1; 0 |
| 17Cl | [Ne]3s23p53d0 | 0.73 | 3.7 (348) | 12.97(1255) | 2.9 | -1;0;+1;+3;(+4); +5; (+6); +7. |
| 35Br | [Ar]3d104s24p54d0 | 0.85 | 3.4(325) | 11.81(1143) | 2.8 | -1; 0; +1; +3; (+4); +5; +7. |
| 53I | [Kr]4d105s25p55d0 | 1.04 | 3.1(295) | 10.47(1012) | 2.2 | -1; 0; +1;+3; +5; +7. |
В основному стані атоми галогенів мають електронну конфигурацію ns2np5. Порівняно з атомами інших галогенів у атомів флуору 2s2 и 2p5 електрони слабо екрановані від ядра, що приводить до високої питомої (на одиницю об’єму) електронної густини і, відповідно, меншому радіусу, великим значенням енергії іонизації і електронегативності. При переході від флуору до іоду розмір атомів і можливі координацийні числа збільшуються, енергії іонизації і електроонегативності (ЕН) зменшуються.
Властивості флуору, як і інших елементів другого періода (Li-F), відрізняються від властивостей більш важких елементів відповідних груп. Наприклад, спорідненість до електрону у фтора менше, ніж у хлора. Це пов’язано з високою електронною густиною і сильним міжелектронним відштовхуванням. При переході від хлора до йоду спорідненість до електрону зменшується із-за збільшення радіусу атома галогена. До особливостей фтора належть також висока електронегативність, що приводить до того, що для фтора із всих можливих ступенів окиснення -1, 0, +1, +3, +5, +7 характерні тільки дві перші. Слід також зазначити високі порівняно з іншими галогенами ентальпії утворення іонних і ковалентних фторидів. У випадку іонних фторидів цео зумовлено невеликим розміром іона
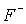 , сильною кулонівською взаємодією і, відповідно, высокою енергиєю кристалічної решітки. Висока ентальпія утворення ковалентних фторидів пов’язана з малим радіусом атома фтора (табл.1), с великим порівняно з іншими галогенами перекриттям атомних орбіталей и, отже, з більш міцним ковалентним зв’язком. Наприклад, в молекулах NF3 и NCl3 енергії зв’язку N-X станвоить 272 і 193 кДж/моль, відповідно.
, сильною кулонівською взаємодією і, відповідно, высокою енергиєю кристалічної решітки. Висока ентальпія утворення ковалентних фторидів пов’язана з малим радіусом атома фтора (табл.1), с великим порівняно з іншими галогенами перекриттям атомних орбіталей и, отже, з більш міцним ковалентним зв’язком. Наприклад, в молекулах NF3 и NCl3 енергії зв’язку N-X станвоить 272 і 193 кДж/моль, відповідно.Галогени проявляють позитивні ступені окиснення в сполуках з більш електронегативними елементами, наприклад, з фтором (ClF7, IF7) і киснем. Сполуки, в яких атом галогена виступав би як одновалентний катіон Х+, невідомі, оскільки енергетичні витрати на іонизацію (табл.1) не компенсуються енергією кристалічної гратки і сольватації. Однак для йода і брома ввідомі комплексні сполуки, наприклад,
 (з піридином), в яких атом галогена знаходиться в позитивному степені окиснення +1, +3.
(з піридином), в яких атом галогена знаходиться в позитивному степені окиснення +1, +3.Астат за своїми властивостями нагадує йод, наприклад, ідентифіковані сполуки HAt, CH3At, BiAt, Ba(AtO3)2. Однак сполуки у вщому ступеню окиснення At (VII) не одержані.
