Лекція 1 хф (лекція) Тема Загальні властивості неметалів
| Вид материала | Лекція |
- З м І с т стор. Вступ. Лекція, 1088.23kb.
- Курс лекцій для студентів денної І заочної форми навчання спеціальності 050301 „Товарознавство, 1137.66kb.
- Єльнікової Тетяни Олександрівни з курсу "Моделювання та прогнозування стану довкілля", 33.26kb.
- Вступна лекція Голема. Про людину трояко Вісімнадцята лекція, 11204.11kb.
- Лекція Основи молекулярно-кінетичної теорії І ідеальний газ, 101.02kb.
- Лекція 4. Тема: вивчення твору світової літератури, 130.47kb.
- Лекція на тему „Основи теорії держави І права" > Лекція на тему, 3538.68kb.
- Лекція №12 Тема: Організація обліку доходів І фінансових результатів діяльності, 198.65kb.
- Лекція тема 2, 153.96kb.
- Лекція №7 тема: зведена І консолідована фінансова звітність, 147.05kb.
Міцність зв’язку Х-Х і хімічні властивості простих речовин.
Кратність зв’язку в молекулах галогенів дорівнює одиниці. Їх хімічні властивості пов’язані з особливостями розриву цього зв’язку. Він може розірватися гомо- чи гетеролітично. В першому випадку електронна густина розподіляється порівну між частиками
Х : Х = Х . + Х . (1),
так, що утіворюються два атома Х . з неспаренимм електроном. У другому випадку електронна густина зміщається до одного із атомів
Х : Х
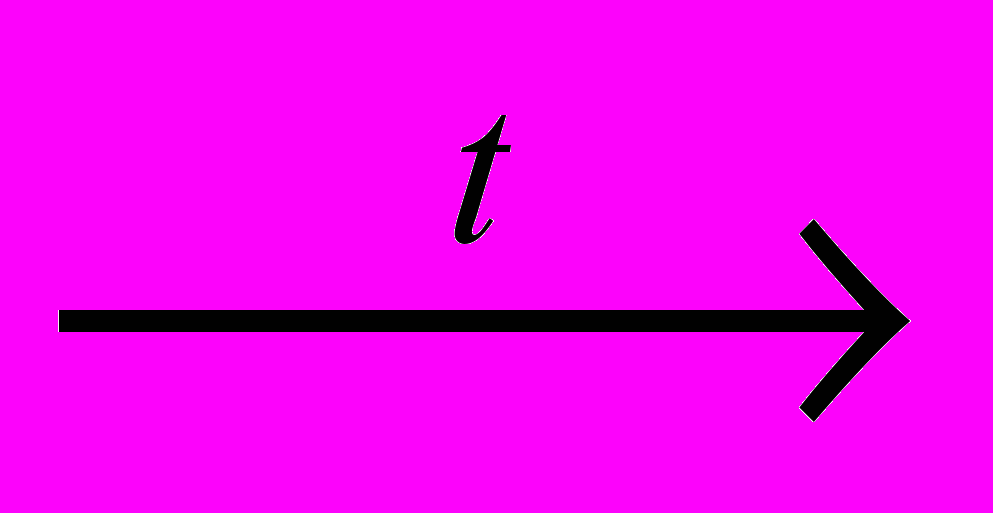 Х+ + Х- (2),
Х+ + Х- (2),так що утворюються позитивна
 і негативна
і негативна  частки.
частки.Енергія гомолітичного роспада (
 H гом), чи енергія зв’язку Х-Х змінюється немонотонно: збільшується від фтора до хлору, а від хлора до иоду зменшується (табл.2) .
H гом), чи енергія зв’язку Х-Х змінюється немонотонно: збільшується від фтора до хлору, а від хлора до иоду зменшується (табл.2) .Величини енергії гетеролітичного розпаду зменщуються в ряду фтор-хлор-бром-йод. Це пояснюється тим, що найбільший внесок в неї вносять енергії іонизації (Еион), які в групі галогенів зменшуються монотонно (табл.1).
Наибільш ймовірний гетеролітичний розпад для иоду, оскільки енергія, що витрачається в такому процесі наименьша і може бути зкомпенсована енергією кристалічної решітки чи енергією сольватації тощо.
Наприклад, виділено сполуку
 , в якій енергетичні витрати скомпенсовані утворенням сильного ковалентного зв’язку між катіонами I+ і основою Льюіса (донором електронної пари) - піридином C5H5N .
, в якій енергетичні витрати скомпенсовані утворенням сильного ковалентного зв’язку між катіонами I+ і основою Льюіса (донором електронної пари) - піридином C5H5N .
При взаємодії з неметалами і металами зв’язок в молекулах Х2 найчастіше розривається по гомолітичному механізму. Цьому сприяє нагрівання, освітлення, катализатори. Основні хімічні властивості простих речовин наведені в табл.3.
Таблиця 3.Хімічні властивості простих речовин.
| Неметали | Фтор | Хлор | Бром | Иод |
| He, Ne, Ar | Не взаємодіють. | |||
| Kr, Xe | ЕFn , n = 2,4,6. | Не взаємодіють. | ||
| Галогени | XF (X=Cl,Br,I); BrCl, ICl, BrCl, IBr ICl, IBr XF3 (X=Cl,Br,I); I2Cl6 I2Cl6 XF5(X=Cl,Br,I) XF7 (X=I) | |||
| О2 | F2O2 (в електр.розряді) | Не взаємодіють. | ||
| S | SF6, S2F10 | S2Cl2, SCl2,SCl4 | S2Br2 | Не реагує. |
| N2 | Не взаємодіють. | |||
| P | PХ3 и РХ5 | PI3, P2I4,PI5(?) | ||
| H2 | З вибухом в темряві | З вибухом на світлі. | Реагирує вище 2000С; Pt-катализатор | Рівновага H2+Г2=2НГ зміщена вліво |
| Метали | Загоряються | Реагують при нагріванні. | ||
За хімічними властивостями галогени - найактивніші неметали. Через низьку енергію дисоціації (табл.2) і високу енергію гідратації іона
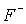 наибільш реакційноздатним із галогенів є флуор. Він взаємодіє безпосередньо зі всіма елементами Періодичної таблиці Д.И.Менделеева, крім He, Ne, Ar. В атмосфері фтора згоряють вода
наибільш реакційноздатним із галогенів є флуор. Він взаємодіє безпосередньо зі всіма елементами Періодичної таблиці Д.И.Менделеева, крім He, Ne, Ar. В атмосфері фтора згоряють вода2H2O + 2F2 = 4HF + O2
и скляна вата
SiO2 + 2F2 = SiF4 + O2 .
Якщо ж елемент може проявляти декілька ступенів окиснення, то, як правило, утворюються вищі можливі фториды (SF6 , VF5, XeF6 и т.д.).
Взаємодія фтора з деякими перехідними металами, наприклад, нікелем, проходить край повільно через утворення на їх поверхні тонкої захистної плівки відповідного фториду метала.
Взаємодія галогенів с водой - складний процес, що включає розчинення, утворення сольватів і диспропорціонування.
Розчинність (моль/л) хлора, брома і иода у воді незначна, причому із збільшенням температури для хлору вона зменшуєтся, брому - практично не змінюється, а иоду - збільшується.
Можна відзначити два типи взаємодії молекул води з молекулами галогенів. До першого належить процес утворення клатратів, наприклад, 8Cl246H2O при кристалізації розчинів за зниженої температури. Молекули галогена в клатратах займають вільні полості в каркасі із молекул H2O, зв’язаних між собою водневими зв’язками.
До другого типу можна віднести гетеролітичний розпад і окисно-відновне диспропорціонування
 (реакция 2,табл.3):
(реакция 2,табл.3):(Механізм реакції диспропорціонування включає поляризацію молекули хлора молекулою H2O, утворення промежної сполуки і наступну її дисоціацію з утворенням Cl-:


Таблиця 3. Константи рівноваги реакцій (250С)
| № | Рівновага | Хлор | Бром | Иод |
| 1 | X2(газ,ж.,тв.)=X2(р-р) | 0.06 | 0.21 | 0.0013 |
| 2 | X2(р-р)+H2O = HOX + H ++ 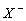 | 3.9. 10-4 | 7.2. 10-9 | 2. 10-13 |
| 3 |  | 1027 | 1015 | 1020 |
| 4 | 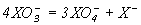 | 1029 | 10-33 | 10-53 |
Константи цієї рівноваги для Х = Cl, Br, I малі (табл.3), особливо для Х = Br, I , тому бром і иод при розчиненні у воді залишається в основному в молекулярній формі Br2 и I2.
Слад продуктів взаємодії галогенів з водою залежить від рН, можливсті виведення із сфери реакції кінцевих чи вихідних речовин, констант рівноваги і швидкостей реакції диспропорцінування гипогалогенітів.
Ріновагу (табл.3) можна змістити праворуч додаванням лужних реагентів, наприклад, Na2CO3:
Cl2 + Na2CO3 + H2O = NaHCO3 + NaCl + HClO ,
Cl2 + NaOH = NaCl + NClO + H2O
а також додаванням суспензій оксидов ртуті (II) чи бісмута Bi2O3 для переведення в осад хлорид-іонов:
Cl2 + 2HgO + H2O = HgO . HgСl2
 + 2HClO,
+ 2HClO,2 Cl2 + Bi2O3 + H2O = 2BiOCl
 + 2HClO.
+ 2HClO.Наведені реакції використовують для одержання HClO, HBrO, HIO.
Швидкість реакции взаємодії хлору з водою сильно залежить від температури. Так при дії хлора на охолоджений розчин лугу утворюються гіпохлорити, наприклад, жавелева вода:
2NaOH + Cl2
 NaClO + NaCl +H2O.
NaClO + NaCl +H2O.При взаємодії ж хлора з неохолодженим розчином лугу відбувається розігрів розчину і утворюються хлораты, наприклад, бертолєтова сіль KClO3:
6KOH + 3Cl2
 KClO3 +5KCl + 3H2O.
KClO3 +5KCl + 3H2O.Таким чином, сукупність термодинамічних і кінетичних факторів зумовлюють наступний склад продуктів взаємодії в системі Cl2+H2O: розчинений у воді хлор (його найбільше), HCl, HClO, HClO3. При насичені хлором холодної води (0-20оС) частина молекул Cl2 диспропорціонує:
Cl2 + H2O = HCl + HClO,
при цьому кислотність розчину поступово зростає.
Комбінуючи потенциали Ео реакции
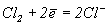 ;
; 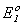 = 1.36 В;
= 1.36 В;O2 + 4H+ + 4
 = 2H2O;
= 2H2O; 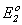 = 1.23 В,
= 1.23 В,можна оцінити і потенціал процесу:
Cl2 + H2O = 2HCl + О2;
 .
.Тому при зберіганні водного розчину хлора на холоду із нього повільно виділяється кисень, а концентрація HClO зменшується, причому сонячне світло прискорює розкладання. При насичені хлором гарячої води (>20оС) розчинність хлора істотно зменшується, а замість HClO у розчині накопичується хлорнувата кислота HClO3.
Бром і йод взаємодіють з водою аналогічно хлору. Однак збільшення розмірів атома галогена і аніона
 приводить до підвищення швидкості диспропорціонування. Тому, незважаючи на велике значення константи рівноваги реакции 3 (табл.3), її швидкість при переході від хлора до брому і йоду істотно увеличивается. В результаті іон
приводить до підвищення швидкості диспропорціонування. Тому, незважаючи на велике значення константи рівноваги реакции 3 (табл.3), її швидкість при переході від хлора до брому і йоду істотно увеличивается. В результаті іон 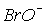 в розчинах можна виявити лише при температурах нижче 00С. Швидкість диспропорціонування іона
в розчинах можна виявити лише при температурах нижче 00С. Швидкість диспропорціонування іона 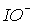 велика при будь-якій температурі, тому в розчинах він не існує. Крім того, поява HХ підвищує кислотність і зміщує рівновагу 2 (табл.3) ліворуч. Таким чином, бром і йод при розчиненні у воді залишаються у формі Br2 і I2.
велика при будь-якій температурі, тому в розчинах він не існує. Крім того, поява HХ підвищує кислотність і зміщує рівновагу 2 (табл.3) ліворуч. Таким чином, бром і йод при розчиненні у воді залишаються у формі Br2 і I2. Від фтора до йоду окисна здатність зменшуєтся, а відновна - збільшується. Як приклад розглянемо процеси, що перебігають при пропусканні хлора у водний розчин иодида калія KI. Спочатку хлор, как більш сильний окисник, витісняє иод із иодиду калія, що приводить до появи забарвлення:
2KI + Cl2 = I2 + 2KCl.
Далі надлишок хлора окиснює иод, і розчин при цьом знебарвлюється:
I2 + Cl2 +6H2O = 2HIO3 + 10HCl.
Другим прикладом відновних властивостей йода може бути утворення йодноватої кислоты HIO3:
3I2(тв.) + 10HNO3(конц) = 6HIO3 + 10NO2 + 2H2O.
Фізичні властивості гідрогенгалогенідів
Розглянемо фізичні властивості гідрогенгалогенідів, використовуючи табл.4. По мірі зростання розміру атомів галогенів міжатомна відстань Н-Х збільшується, енергія зв’язку Н-Х зменшується. Змешення енергії зв’язку Н-Х приводить до підвищення значень ентальпій утворення в ряду HF-HI, наприклад, HI в стандартних умовах утворюється из простих речовини вже з поглинанням тепла (табл.4).
Таблица 4. Властивості гідрогенгалогенідів
| | Межатомна відстань rе ( 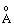 ) ) | Езв’язку кДж/моль |  fHo298 fHo298кДж/моль | Дипольний момент, D | рКа | Тпл,оС | Ткип,оС |
| HF | 0.92 | 565 | -271 | 1.91 | 3.2 | -83.4 | +19.7 |
| HCl | 1.28 | 431 | -92 | 1.03 | -7.0 | -114.3 | -85.1 |
| HBr | 1.41 | 364 | -36 | 0.79 | -9.5 | -86.9 | -66.8 |
| HI | 1.60 | 297 | +27 | 0.42 | -10 | -50.9 | -35.4 |
Молекули HХ полярні. Дипольні моменти зменшуються в ряду HF-HI.
В стандартних умовах гідрогенгалогеніди - гази. З ростом масси і размірів молекул посилюється міжмолекулярна взаємодія і, як наслідок, підвищуються температури плавлення (Тпл) і кипіння (Ткип). Однак для HF величини Тпл і Ткип, утворені екстраполяцією в ряду однотипних сполук HF-HCl-HBr-HI, будуть істотно нижче, ніж експериментальні (табл.4). Аномально високі температури плавлення і кипіння пояснюються посиленням міжмолекулярної взаємодії за рахунок уоврення водневих зв’язків між молекулами HF:

Твердий HF складаєтьяс із зигзагоподібних полимерних ланцюгів. В рідкому і газоподібному HF майже до 60оС присутні полімери від (HF)2 до (HF)6. Для HCl, HBr, HI утворення водневих зв’язків не характерно серез меншу електронегативність атому галогена.
Хімічні властивості гідрогенгалогенідів.
Розчинність у воді. Завдяки високій полярності газоподібні НХ добре розчинні у воду, наприклад, в 1 об’ємі води при 0оС розчиняється 507 объемів HCl чи 612 объемов HBr. При охолодженні із водних розчинів виділені кристалічні гідрати HF. H2O, HCl. 2H2O и т.д., які побудовані із відповідних галогенідів оксонія, наприклад,
 .
.Кислотні властивості. У водних розчинах НХ встановлюється протолітична рівновага
HX + HOH =
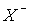 + H3O+ (X = F, Cl, Br, I), (1),
+ H3O+ (X = F, Cl, Br, I), (1),Таким чином ці розчини є кислотами.
В ряду HCl-HBr-HI ступінь протоліза, тобто сила кислот зростає (см.величины рКa в табл.4), що пов’язано з ростом розміру аніона
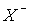 і зменшенням енергії гетеролітичного розпаду НХ(р-р)= Н+(р-р) +
і зменшенням енергії гетеролітичного розпаду НХ(р-р)= Н+(р-р) + 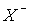 (р-р) ([1], с.291).
(р-р) ([1], с.291).Водні розчини HCl, HBr і HI поводять себе як сильні кислоти. В розбавлених водних розчинах HF є слабкою кислотою (рКа = 3.2), що пов’язано з високою енергією зв’язку H-F порівняно з енергеєю зв’язку H-О в молекулі води. Однак при підвищенні концентрації HF вище 1 М сила кислоти зростає. За рахунок утворення водневого зв’язку утворюються іони
 : HF +
: HF +  =
= ; К = 3.86 (25оС) и тому рівновага (1) зміщується праворуч.
; К = 3.86 (25оС) и тому рівновага (1) зміщується праворуч.Особливістю гідроген фториду і плавикової кислоти є здатність роз’єдати скло:
Na2O. CaO. 6SiO2 + 28HF(газ) = 2NaF + СaF2 + 6SiF4 + 14H2O
Na2O. CaO. 6SiO2 + 36HF(р-р) = Na2SiF6 + CaSiF6 + 4H2SiF6 + 14H2O,
тому при работі з ними використовують посуд, виготовлений із тефлону.
Відновні властивості гідрогенгалогенідів. Із зростанням розміру і зменшенням енергії іонізації атома галогена відновна зданість в ряду HF-HCl-HBr-HI зростає. Наприклад, плавикова HF і соляна HCl кислоты з концентрованою сірчаною кислотою не взаємодіють, а HBr і HI нею окиснюються:
2HBr + H2SO4(конц) = Br2 + SO2 + 2H2O
8HI + H2SO4(конц) = 4I2 + H2S + 4H2O.
