«Загальні відомості про неметали та їх сполуки»
| Вид материала | Урок |
- Загальні висновки І рекомендації 8 Список використаної літератури 9 Додатки, 569.55kb.
- План загальні історичні відомості про розвиток малярства на склі, зокрема на Гуцульщині., 207.25kb.
- І. Загальні відомості про хвору дитину (praefatio), 518.46kb.
- Предмет: Органічна хімія Мета, 369.43kb.
- Муровомокуриловецький р-н, Вінницька обл, 2723.63kb.
- Про суспільно-політичну ситуацію у лютому 2012 року, 119.31kb.
- Програма вступного іспиту з фаху на напрям 100101"Енергетика та електротехнічні системи, 43.34kb.
- Лекція 1 хф (лекція) Тема Загальні властивості неметалів, 1201.72kb.
- Зміст навчальної програми з вищої математики для студентів 1 курсу фармацевтичного, 32.69kb.
- 1. Загальні відомості про суб'єкта господарювання*, 78.9kb.
Тема уроку: Карбонатна кислота і карбонати. Якісна реакція на карбонат-іони. Перетворення карбонатів. Поняття про кислі солі. Поняття про твердість води
Мета: вивчити склад та властивості карбонатної кислоти, на основі знань про загальні властивості кислот і солей. з'ясувати умови взаємного перетворення карбонатів, розширити знання про кислі солі; ознайомити з поняттям «твердість води», розвивати навички самостійного пошуку знань, уміння робити висновки, уміння оцінювати, стимулювати творчі здібності учнів, формувати навички екологічно грамотної поведінки в побуті.
Тип уроку: засвоєння нових знань.
Форми роботи: робота з опорним конспектом, виконання лабораторної роботи, захист міні-проектів, рецензування відповідей.
Обладнання і матеріали: зразки карбонатів (крейда, сода, черепашки молюсків); штатив з пробірками, натрій карбонат, розчин хлоридної кислоти; програмне забезпечення «Віртуальна хімічна лабораторія».
План уроку
1.Організаційний етап
2.Актуалізація і корекція опорних знань
3.Повідомлення теми, мети, мотивація
4.Вивчення нового матеріалу
-Карбонатна кислота
-Карбонати і гідрогенкарбонати
-Твердість води
5. Узагальнення і систематизація знань
6. Підсумки і домашнє завдання
Хід уроку.
1.Організаційний етап
- Перевірка облікового складу учнів
- Перевірка готовності групи до уроку
- Запис дати, теми, плану уроку.
2. Актуалізація і корекція опорних знань
Бесіда
- Які ви знаєте оксиди Карбону?
- Який з них солетворний?
- Які властивості характерні для карбон.(ІV) оксиду?
- Яка речовина утворюється в результаті взаємодії С02 з водою?
- Які речовини утворюються в результаті взаємодії С02 з оксидами і лугами?
3. Мотивація навчальної діяльності
Відстрочена відгадка
«...Вона вийняла з вуха одну з тих величезних перлин і занурила її в рідину Запанувала тиша, вражені гості, завмерши, спостерігали, як незрівнянна перлина повільно розчиняється в рідині. Ось від неї не залишилось й сліду, і тоді Клеопатра підняла келих і випила напій весь до останньої краплини». Це уривок з книги Г. Р. Хаггарда «Клеопатра». Який напій випила Клеопатра? Що сталося з перлиною? Відповідь на це запитання і багато інших ми з'ясуємо в процесі уроку.
4. Вивчення нового матеріалу
1. Карбонатна кислота проявляє властивості слабких кислот. Будучи двоосновною, утворює два типи солей карбонати і гідрокарбонати.
Карбонат-іон має форму правильного плаского трикутника.

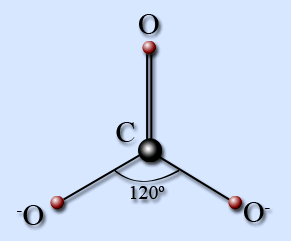
Три гібридні орбіталі атома вуглецю беруть участь в утворенні трьох зв'язків з атомами кисню, що залишилася р-орбіталь вуглецю перекривається з аналогічною орбіталлю кисню.
Н2С03 —добре розчинна у воді, нестійка, існує лише в розчині.
Дисоціює ступінчасто:
Н2С03 →Н+ + НС03-
НС03-→Н++С032-
Демонстрація пляшки мінеральної води. Чому під час відкривання пляшки спостерігаємо, як вуглекислий газ у вигляді бульбашок виходить з води?
2. Солі карбонатної кислоти
• Середні карбонати:
Na2С03, СаС03, МgС03
• Кислі гідрогенкарбонати
NaНС03, Са(НС03)2, Мg(НС03)2
Дослідимо розчинність їх у воді (таблиця розчинності).
Хімічні властивості:
- Розклад у процесі нагрівання:
t
МgС03 → Мg0 + С02
t
Мg(НС03)2→МgС03+СО2↑ + Н20
2. Взаємодія з кислотами:
МgС03 +2НС1 → МgС12 + Н20+С02↑
Мg(НС03)2+2НС1→МgС12 + 2Н20 + 2С02↑
3. Перетворення на гідрогенкарбонати:
МgСО3 + Н20+С02 →Мg(НС03)2
Яку якісну реакцію на карбонат-іон можна використати?
Лабораторна робота
«Якісна реакція на карбонат-іон»
Яке обладнання-і реактиви необхідні для проведення досліду?
Які правила техніки безпеки слід пам'ятати? (Загальні правила, правила поводження з кислотами)
Обговорення результатів і спостережень, формулювання висновків з допомогою програми «Віртуальна хімічна лабораторія».
Захист міні-проектів
Інструктаж щодо рецензування, оцінювання виступів, обробки результатів.
Учні оцінюють міні-проекти за такими критеріями:
- актуальність проблеми — 3 бали;
- практична значущість — 3 бали;
- творчий підхід — 3 бали;
- якість доповіді — 3 бали.
Сумарний бал виставляють у бланки оцінювання, після яких отримують середній бал за роботу над проектом.
Прикладний проект
Тема. Застосування карбонатів і гідрогенкарбонатів
Мета і завдання: дібрати зразки карбонатів і гідрогенкарбонатів, з'ясувати їх застосування.
Актуальність теми: карбонати і гідрогенкарбонати мають широке практичне застосування.
Демонстрація зразків: крейда, черепашки молюсків, яйце, сода.
СаС03 — мармур, крейда, вапняк — застосовують у будівництві.
Na2С03 — кальцинована сода — застосовується у виробництві скла, мила, барвників, мийних засобів.
NaНС03 — питна сода — застосовується в медицині (інгаляції, полоскання, для зниження кислотності в шлунку), побуті, харчовій промисловості.
К2С03 — поташ — використовується у виробництві мила, скла, у фотографії.
Запитання для обговорення
Яка реакція відбувається під час гасіння соди оцтом у процесі випікання кондитерських виробів? (Виділення вуглекислого газу)
Як очистити яйце, не розбиваючи шкаралупу? (Обробити розчином оцтової чи хлоридної: кислоти)
3. Твердість води
2. Інформаційний проект
Тема. Твердість води
Мета і завдання: з'ясувати, що називають твердістю води, способи її усунення.
Актуальність проблеми. Тверда вода непридатна для промислових і господарських потреб (у ній погано намилюється мило, утворює накип на стінках парових котлів, погано розварюються овочі).
Демонстрація таблиці
| Карбонатна(тимчасова) | Некарбонатна (постійна) |
| Зумовлена наявністю Са(НС03)2та Мg(НС03)2 Усувається: | Зумовлена наявністю СаС12, МgСІ2, СаS04, MgSO4 Усувається: |
| а) кип'ятінням | а) додаванням соди |
| Са(НС03)2= СаС03+С02 + Н20 | СаS04 + Na2С03 = СаС03 + Na2S04 |
| б) додаванням гашеного вапна | б) додаванням фосфатів |
| Са(НС03)2+Са(ОН)2 = 2СаСО3 +2Н20 | ЗСаS04 + 2Na3Р04 = Са3 (Р04)2 + 3Na2S04 |
Твердість — явище, зумовлене наявністю іонів Са2+ і Мg2+ у воді.
Запитання для обговорення
Отже, ми з'ясували, що накип у чайнику не що інше. як СаС03. Як же його позбавитись? (З допомогою кислоти, наприклад оцту)
3. Дослідний проект
Тема. Визначення твердості води
Мета і завдання: дослідити одиниці вимірювання твердості води; порівняти твердість води з різних джерел: водопровідна вода, вода з криниці, морська вода.
Шляхи реалізації
а) Теоретичний: твердість води вимірюється в міліеквівалентах (1 міліеквівалент = 20,04 мг/г іонів Са2+ або 12,16 мг/г іонів Мg2+) < 4 міліеквівалент/л — м'яка вода
4—8 міліеквівалент/л — середня твердість
8—12 міліеквівалент/л — тверда. вода
б) Практичний: відібрати зразки води. У кожному зразку розчинити шматочок господарського мила (дві-три сірникові голівки). В усіх випадках вийде мутний розчин. Потім у кожен зразок через трубочку продувають повітря. Найбільша піна — у водопровідній воді, у морській відсутня.
Запитання для обговорення
Як, на вашу думку, пояснити найбільшу твердість морської води?
4. Дослідний проект
Тема. Дослідження впливу засобів побутової хімії
Мета: дослідити дію «Саlgon» і «Сilit BANG», з'ясувати, які реакції відбуваються під час їх використання.
«Сilit BANG» видаляє вапняні відкладення, тому що до його складу входять дві кислоти, одна з яких ортофосфатна.
«Саlgon» містить у своєму складі соду Na2С03 і фосфати, що усувають твердість води.
Запитання для обговорення
Про які правила техніки безпеки слід пам'ятати, працюючи з «Сilit BANG»? (Поводження з кислотами)
Чому засіб не можна використовувати для поверхонь з мармуру?
5. Узагальнення і систематизація знань
Що сталося з перлиною Клеопатри? Який напій вона випила?
6.Домашнє завдання: підготувати доповіді по темі «Кругообіг карбону в природі»
Достатній рівень: завдання 131.
Високий рівень: завдання 137 (підручник Н. М. Буринської).
7.Підведення підсумків уроку.
1. Самооцінювання учнів
2. Оцінювання учителем роботи класу та окремих учнів
3. Аргументація виставлених оцінок
| | | |
| актуальність проблеми | 3 бали | |
| практична значущість | 3 бали | |
| творчий підхід | 3 бали | |
| якість доповіді | 3 бали | |
Харківської обласної державної адміністрації
Харківський обласний методичний центр професійно – технічної підготовки
Вище професійно – технічне училище будівництва
м. Харків
Самостійна робота з теми
«Карбон і Силіцій»
Тема уроку:«Карбонатна кислота і карбонати. Якісна реакція на карбонат-іони. Перетворення карбонатів. Поняття про кислі солі. Поняття про твердість води»
Назва самостійної роботи: «Матеріал для опорного конспекту»
Урок №30
Самостійна робота
Жорсткість води і способи її усунення.
Жорсткість води – сукупність властивостей води обумовлена, наявністю в ній переважно солей кальцію і магнію. Використання жорсткої води приводить до осадження твердого осаду (накипу) на стінках парових казанів, теплообмінників,затруднює вариво харчових продуктів, прання. Розрізняють тимчасову і постійну жорсткість води. Перша пов'язана з присутністю у воді гідрокарбонатів, друга – інших солей. Тимчасову жорсткість води усувають кип'яченням, постійну – зм'якшуванням води (додаванням гашеного вапна, соди, застосуванням катіонітів і ін.).
У питній воді жорсткість позначається на смаку, жорстка вода гіркувата на смак. Також жорсткість води впливає на організм людини. Жорстка вода згубна для сучасної побутової техніки, автономних і централізованих систем гарячого водопостачання і опалювання, новітніх зразків сантехніки.
Жорсткість води визначається вмістом у воді розчинених солей кальцію і магнію, які при нагріванні випадають в осад, утворюючи наліт, всім добре відомий як накип.
На побутовому ж рівні жорсткість води проявляє себе значною (на 30–50%) перевитратою миючих засобів при пранні білизни і вмиванні, а також погіршенням споживчих властивостей води. При кип'яченні достатньо жорсткої води на її поверхні утворюється плівка. При заварюванні кава в такій воді може випадати бурий осад. До того ж дієтологами встановлено, що в жорсткій воді гірше розварюється м'ясо. Зв'язано це з тим, що солі жорсткості, вступають в реакцію з тваринними білками, утворюючи нерозчинні з'єднання.
У природі вода, перш ніж потрапити в колодязь або водопровідну мережу, просочується крізь грунт і насищається в ній розчинними солями. Природні води містять сульфати і гідрокарбонати кальцію і магнію, тобто катіони Ca2+ і Mg2+, аніони SO42– і HCO3–. Вода, в якій вміст іонів Ca2+ і Mg2+ малий, називається м'якою; вода з підвищеним вмістом цих іонів – жорсткою. При кип'яченні жорсткої води гідрокарбонати розкладаються, утворюючи нерозчинні карбонати, наприклад:
Ca2+ + 2HCO3– = CaCO3↓ + H2O + CO2↑
Широко відомо, що в жорсткій воді мило погано милиться. Вивчимо це явище на досвіді, взявши за штучну жорстку воду, наприклад, розчин гіпсу. Наллємо в бюретку розбавлений розчин мила і підливатимемо його помалу, порція за порцією, до жорсткої води, сильно струшуючи після кожного приливу стакан з жорсткою водою. Перші порції мила витрачатимуться на утворення пластівчастого осаду, і піни при струшуванні виходити не буде. Тільки після того, як припиниться утворення осаду, з'явиться піна. Мила – це натрієві (іноді калієві) солі органічних кислот, і їх склад можна виразити формулою NaR або KR, де R – кислотний залишок. Аніони R утворюють з катіонами кальцію і магнію нерозчинні солі CaR2 і MgR2. На утворення цих нерозчинних солей і витрачається марно мило. Таким чином, за допомогою мильного розчину ми можемо оцінити загальну жорсткість води, загальний вміст в ній іонів кальцію і магнію.
Для побутових потреб потрібна вода з незначною жорсткістю, оскільки при кип'яченні жорсткої води утворюється накип. До того ж в жорсткій воді погано розварюються м'ясо, овочі, крупа.
При пранні тканин в такій воді нерозчинні з'єднання, що утворюються, осідають на поверхні ниток і поступово руйнують волокна.
При живленні парових казанів жорсткою водою утворюється накип. Накип затруднює нагрівання води, викликає збільшення витрати палива, прискорює зношування стінок казана. Для пониження жорсткості води використовують хімічні методи, що приводять до перекладу іонів кальцію і магнію до складу нерозчинних солей, зазвичай в карбонати.
Карбонатну жорсткість усувають додаванням вапняного молока:
Ca(HCO3)2+Ca(OH) 2 = 2CaCO3↓ + 2H2O
Некарбонатна жорсткість усувається додаванням соди:
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4
Види жорсткості.
| Види жорсткості | Причини | Методи усунення |
| Тимчасова | Присутність у воді гідрокарбонатів Ca(HCO3)2 | Кип'ятіння води: Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O |
| Постійна | Присутність у воді інших солей MgSO4; CaSO4; MgCl2; | Пом’якшення води. Содовий: CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4 Вапняковий(гашене вапно): Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O Натронний (ідкий натр): Ca(HCO3)2 + 2NaOH = CaCO3 + Na2CO3 + 2H2O |
| Загальна | Сумарна | Сумарні методи усунення |

3. Способи пом’якшення води.
Основні: термічний, реагентний, електродіаліз, зворотній осмос. Жорсткість води буває карбонатна і некарбонатна, ще її називають тимчасовою і постійною. Усунути тимчасову жорсткість простіше простого. Досить прокип'ятити воду, щоб гідрокарбонат кальцію розпався з виділенням вуглекислого газу і випаданням в осад карбонату кальцію. Цей процес ми щодня спостерігаємо в чайниках. У промисловості цей метод застосовують за наявності парових казанів або інших дешевих енергоносіїв.
Реагентні методи найбільш поширені на станціях водопідготовки і зводяться до перекладу солей кальцію в нерозчинні з'єднання, випаданні в осад. Залежно від складу води додають соду, гашене вапно або те, і інше. Вода звільняється від каламутних суспензій і попутно зм'якшується. Цей метод має і свої незручності, і недоліки: великий об'єм твердих відходів, необхідність точної дотації хімікатів і спеціально обладнані склади для їх зберігання.
Зворотний осмос і електродіаліз застосовуються при одночасному обстеженні води, тому найбільшого поширення набув метод іонообміну на синтетичних іонообмінних смолах. Під час роботи іони жорсткості, наявні в початковій воді, замінюються на іони натрію смоли. Під час регенерації іонообмінної смоли розчином куховарської солі здійснюється зворотний процес: іони натрію з куховарської солі замінюються на іони солей жорсткості, затримані смолою. Технічно це утілюється в пом'якшувачах, що є напірною ємкістю, заповненою іонообмінною смолою, з керівником програмованим клапаном і баком з сольовим регенеруючим розчином. Частота регенерацій розраховується залежно від жорсткості початкової води і ємкості пом'якшувача по солях жорсткості. Клапан, що управляє, програмується таким чином, що включає фільтр на регенерацію або по витраті води, або за часом.
Головна відмінність між побутовими пом'якшувачами в харчовому і не харчовому виробництві полягає в тому, що в першому необхідно використовувати іонообмінну смолу тільки харчового класу.
Сіль для регенерації побутових пом'якшувачів теж повинна відповідати харчовим стандартам. До того ж високий ступінь очищення солі від іонів кальцію і магнію забезпечує смолі вищу питому обмінну ємкість під час регенерації.
Прилади, що працюють на магнітному і електромагнітному способах зм'якшування води, не видаляють жорсткість, а тільки стабілізують її, запобігаючи кальцієвим відкладенням на трубах. Пристрої даного класу добре зарекомендували себе на поверхневій воді. Для підземної води з підвищеним вмістом вільної вуглекислоти застосування приладів даного класу малоефективне.
Основи пом’якшення води, класифікація методів.
1. Фізична (магнітна і радіочастотна) обробка води.
У основі технології обробки води покладений принцип зміни форми кристала карбонату кальцію під дією електромагнітних хвиль звукового діапазону.
2. Термічний спосіб.
Пов'язаний з нагрівом води, знижує тільки тимчасову (карбонатну) жорсткість.
3. Реагентне пом’якшення.
Проводиться за рахунок додавання у воду соди або гашеной винищити.
4. Зворотний осмос і електродіаліз.
Дорожчі способи зм'якшування води, які вимагають попереднього її очищення і пов'язані з видаленням з води всіх солей, зокрема необхідних людині мікроелементів.
5. Пом’якшення води таким, що катіонує.
Здатна при контакті з водою поглинати іони кальцію і магнію, віддаючи взамен іони натрію або водню, називаючись, відповідно, Na-катионитовой і Н-катіонітової. Na-катионитовые завантаження регенеруються розчином куховарської солі (NaCl) або сірчанокислого натрію (Na 2SO4).
Останнім часом у вітчизняній і зарубіжній практиці для боротьби з накипеобразованием успішно застосовують магнітну обробку води.
Хімічні методи пом’якшення води:
1. Вапняний – дія гашеного вапна (видаляється Жтим):
Ca(HCO3)2 + Ca(OH) 2 = 2CaCO3↓ + 2H2O.
2. Натронний – дія їдкого натру (видаляється ЖMg і Жтим):
Ca(HCO3)2 + 2NaOH = CaCO3 + Na2CO3 + 2H2O;
MgCl2 + 2NaOH = Mg(OH) 2↓ + 2NaCl.
3. Содовий – дія соди (карбоната натрія, видаляється Жзаг):
CaCl2 + Na2CO3 = 2NaCl + CaCO3↓.
Головне управління освіти і науки
Харківської обласної державної адміністрації
Харківський обласний методичний центр професійно – технічної підготовки
Вище професійно – технічне училище будівництва
м. Харків
Інформаційна картка з теми
«Карбон і Силіцій»
Тема уроку: «Карбонатна кислота і карбонати. Якісна реакція на карбонат-іони. Перетворення карбонатів. Поняття про кислі солі. Поняття про твердість води»
« Якісна реакція на карбонат-іони»
Урок № 30
Інформаційна картка до уроку №30
Якісна реакція на карбонат-іони
У дві пробірки всипте потроху (аби тільки вкрилось дно) карбонату магнію і карбонату натрію. В обидві пробірки додайте по 1 мл розбавленої хлоридної кислоти й одразу ж закрийте кожну пробірку пробкою з відведеною трубкою, кінець якої опустіть у пробірку з вапняною водою (розчин Са(ОН)2).
Що спостерігається? Складіть рівняння реакцій і запишіть їх у повній та скороченій іонних формах. Зробіть висновок, що є реактивом на карбонат-іони . СО32-
_____________________________________________________________________________________
Отже, для розпізнавання карбонатів (і гідрокарбонатів) використовують сильні кислоти. Під час їх дії відбувається характерне «закипання» внаслідок бурхливого виділення вуглекислого газу С02. Реакція виражається таким іонним рівнянням:
СО32- + 2Н+ = С02 + Н20
Харківської обласної державної адміністрації
Харківський обласний методичний центр професійно – технічної підготовки
Вище професійно – технічне училище будівництва
м. Харків
Самостійна робота з теми
«Карбон і Силіцій»
Тема уроку:«Карбонатна кислота і карбонати. Якісна реакція на карбонат-іони. Перетворення карбонатів. Поняття про кислі солі. Поняття про твердість води»
Назва самостійної роботи: «Перевірна самостійна робота»
Урок № 30
Урок №30
Самостійна робота
Завдання №1
- Карбонатна кислота добре розчиняється у воді. Напишіть рівняння ступінчастої дисоціації карбонатної кислоти.
- Карбонатна кислота нестійка, тому легко розкладається на карбон діоксид і воду. Це оборотній процес. Напишіть рівняння реакції.
- Воду під тиском насичують вуглекислим газом – утворюється газована вода. Коли пляшку відкривають, тиск зменшується і вуглекислий газ вигляді бульбашок виходить з води
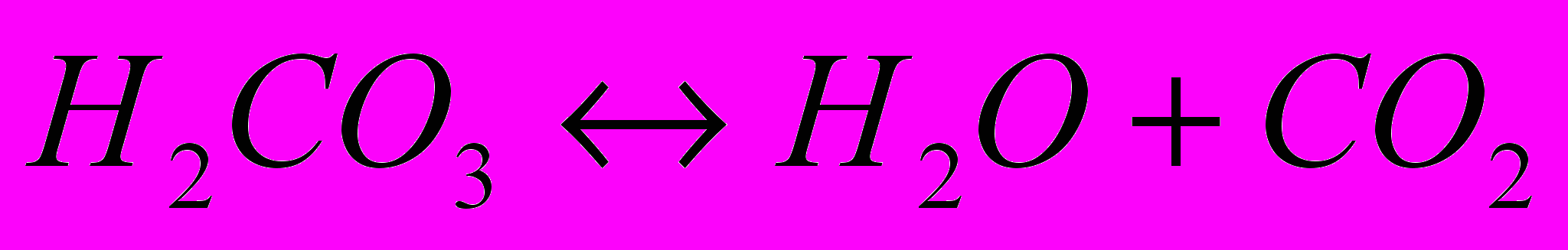
Поясніть процес з принципу Ле Шательє.
Завдання №2
- Напишіть рівняння реакцій, за яких утворюються натрій карбонат натрій гідрокарбонат.
- Як можна з гідрокарбонатів одержати карбонати? Напишіть рівняння реакцій перетворення гідрокарбонатів на карбонати в молекулярному і іонному вигляді.
- Як з карбонатів одержати гідрокарбонати? Напишіть рівняння реакції.
- Яку якісну реакцію ви можете запропонувати?
| Карбонатна(тимчасова) | Некарбонатна (постійна) |
| Зумовлена наявністю Са(НС03)2та Мg(НС03)2 Усувається: | Зумовлена наявністю СаС12, МgСІ2, СаS04, MgSO4 Усувається: |
| а) кип'ятінням | а) додаванням соди |
| Са(НС03)2= СаС03+С02 + Н20 | СаS04 + Na2С03 = СаС03 + Na2S04 |
| б) додаванням гашеного вапна | б) додаванням фосфатів |
| Са(НС03)2+Са(ОН)2 = 2СаСО3 +2Н20 | ЗСаS04 + 2Na3Р04 = Са3 (Р04)2 + 3Na2S04 |
урок № 31
