«Загальні відомості про неметали та їх сполуки»
| Вид материала | Урок |
СодержаниеЯкісна реакція Hcooh = h |
- Загальні висновки І рекомендації 8 Список використаної літератури 9 Додатки, 569.55kb.
- План загальні історичні відомості про розвиток малярства на склі, зокрема на Гуцульщині., 207.25kb.
- І. Загальні відомості про хвору дитину (praefatio), 518.46kb.
- Предмет: Органічна хімія Мета, 369.43kb.
- Муровомокуриловецький р-н, Вінницька обл, 2723.63kb.
- Про суспільно-політичну ситуацію у лютому 2012 року, 119.31kb.
- Програма вступного іспиту з фаху на напрям 100101"Енергетика та електротехнічні системи, 43.34kb.
- Лекція 1 хф (лекція) Тема Загальні властивості неметалів, 1201.72kb.
- Зміст навчальної програми з вищої математики для студентів 1 курсу фармацевтичного, 32.69kb.
- 1. Загальні відомості про суб'єкта господарювання*, 78.9kb.
4.Вивчення нового матеріалу (учні складають опорний конспект за схемою наданою в додатку.
«Порівняльна характеристика оксидів карбону і силіцію»
| СО | СО2 | SiO2 | |
Будова молекули | | | |
Фізичні властивості | | | |
Хімічні властивості | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
Отримання | | | |
| Якісна реакція | | | |
Оксид вуглецю (II) CO
Будова молекули
Молекула оксиду вуглецю (II) має лінійну будову. Між атомами вуглецю і кисню утворюється потрійний зв'язок.

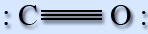
Два зв'язки отримано шляхом перекривання неспарених 2р-электронов вуглецю і кисню, а третина – по донорно-акцепторному механізму за рахунок вільної атомної орбіталі 2р вуглецю і електронної пари 2р кисню. Молекула СО є донором електронної пари.
Фізичні властивості
Оксид вуглецю (II) – чадний газ, газ без кольору і запаху, легше за повітря, дуже мало розчинимо у воді (2,32 мл в 100 г води при 20 °C), розчинимо в спирті і бензолі. Ткип = -192 °C; Тпл = -205 °C. Отруйний. Необоротно взаємодіє з гемоглобіном крові.
Хімічні властивості
У хімічному відношенні – інертна речовина. Відноситься до несолетворних оксидів, не реагує з водою, проте при нагріванні з розплавленими лугами утворює солі мурашиної кислоти:
CO + NaOH = HCOONa,
що дозволяє формально розглядати його як ангідрид мурашиної кислоти.
- Взаємодія з киснем
При нагріванні в кисні згорає красивим синім полум'ям:
2СО + О2 = 2СО2.
- Взаємодія з воднем
Реагує з воднем:
СО + Н2 = С + Н2О.
- Взаємодія з іншими неметалами
При опромінюванні і у присутності каталізатора взаємодіє з галогенами:
СО + Cl2 = COCl2 (фосген).
і сіркою при 350° C:
СО + S = COS (карбонілсульфід).
- Відновні властивості
СО– енергійний відновник. Відновлює багато металів з їх оксидів:
C+2O + CuO = Сu + C+4O2.
- Взаємодія з перехідними металами
З перехідними металами утворює карбоніли:
Ni + 4CO = Ni(CO)4;
Fe + 5CO = Fe(CO)5.
Отримання
У промисловості
Утворюється в газогенераторах при пропусканні повітря через розжарене вугілля:
C + O2 = CO2,
CO2 + C = 2CO.
У лабораторії
Виходить при термічному розкладанні мурашиної або щавлевої кислоти у присутності концентрованої сірчаної кислоти:
HCOOH = H2O + CO,
H2C2O4 = CO + CO2 + H2
Оксид вуглецю (IV) CO2
Будова молекули
Молекула СО2 лінійна, довжина подвійного зв'язку С=О рівна 0,116 нм.

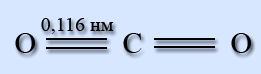
В рамках теорії гібридизації атомних орбіталей дві -зв’язки утворені sp-гібридними орбіталями атома вуглецю і 2р-орбиталями атома кисню. Р-орбіталі вуглецю, що не беруть участь в гібридизації, утворюють з аналогічними орбіталями кисню p-зв’язки. Молекула неполярна.
