«Загальні відомості про неметали та їх сполуки»
| Вид материала | Урок |
- Загальні висновки І рекомендації 8 Список використаної літератури 9 Додатки, 569.55kb.
- План загальні історичні відомості про розвиток малярства на склі, зокрема на Гуцульщині., 207.25kb.
- І. Загальні відомості про хвору дитину (praefatio), 518.46kb.
- Предмет: Органічна хімія Мета, 369.43kb.
- Муровомокуриловецький р-н, Вінницька обл, 2723.63kb.
- Про суспільно-політичну ситуацію у лютому 2012 року, 119.31kb.
- Програма вступного іспиту з фаху на напрям 100101"Енергетика та електротехнічні системи, 43.34kb.
- Лекція 1 хф (лекція) Тема Загальні властивості неметалів, 1201.72kb.
- Зміст навчальної програми з вищої математики для студентів 1 курсу фармацевтичного, 32.69kb.
- 1. Загальні відомості про суб'єкта господарювання*, 78.9kb.
Тема уроку: Силікатна кислота і силікати .Будівельні матеріали
Мета: ознайомити учнів з властивостями силікатної кислоти й силікатів.
Формувати знання учнів про провідні галузі силікатної промисловості.
Розвивати пізнавальний інтерес до учбової роботи і самостійності в ній.
Тип уроку:. комбінований
Обладнання і матеріали: Періодична система хімічних елементів Д.І.Менделєєва, будівельні матеріали: кирпичи, керамзит; предмети побуту: глиняна, фаянсова и фарфоровий посуд; скло - звичайне, калійне, кришталеве, скловолокно та інше., цемент. Плакат «Схема устройства цементной вращающейся печи»
Базові поняття і терміни: Силікати, алюмосилікати, силікатна промисловість, скло, порцеляна, цемент, колоїдний розчин, гель, золь.
Структура уроку:
1.Організаційний етап.
2.Повторення
3.Підготовка до основного етапу занять (мотивація).
4.Вивчення нового матеріалу
5.Закріплення знань .
6.Домашнє завдання.
7.Підведення підсумків уроку
Хід уроку
1.Організаційний етап
- Перевірка облікового складу учнів
- Перевірка готовності групи до уроку
- Запис дати, теми, плану уроку.
2.Повторення
1. 2 учня. Працюють по карткам (на місцях)
Картка № 1.
Здійснити перетворення
Si – SiO2 – Na2SiO3 – H2SiO3 - SiO2
Картка № 2
Складіть молекулярне і іонне рівняння реакції
Na2 SiO3 + Ca Cl2 =
Картка № 3
Розрахуйте масу негашеного вапна CaO, яку отримали при обжигі 300кг,вапна, якщо масова доля домішок в ньому дорівнює 0,08.
2. З класом хімічна розминка.
А) запишіть формули наступних речовин: сульфатна кислота, амоніак, аммонія хлорид, аммонія дигідроортофосфат, натрія гідросульфат, карбонова кислота, натрія гідросульфат, нітроген ( IV) оксид, кальцій карбід, алюмінію карбід, кремнезем, карборунд.
Б) закінчіть визначення:
- процес розпаду електроліту на іони при розчинені у воді або розплавленні називається ……
- реакції, які протікають з зміною ступеня окислення елементів називають…
- явище, коли один і той же елемент утворює декілька простих речовин називають…
- вкажіть дві алотропних модифікації оксигену, сульфуру, карбону…
- хімічні реакції, які протікають протилежних напрямках називають…
- речовини, які містять три важливих елемента N, P, K і здатні в ґрунтовому розчині дисоціювати на іони…
- поглинення газоподібних і розчинних речовин поверхньою твердої речовини називають…
3.Підготовка до основного етапу занять (мотивація).
В нашому житті ми постійно зустрічаємося з виробами з сполук силіція..
Які ви знаєте сполуки силіція?
Чи уявляєте ви своє життя без виробів з скла, кераміки?
Чи могли б ми жити без такого матеріалу як цемент, бетон?
Потрібні вам знання в житті про силікати і будівельні матеріали?
4.Вивчення нового матеріалу
І. Колоїдні розчини. Розповідь учителя.
Силікатна кислота практично нерозчинна у воді. Силікатні кислоти - сполуки силіція оксиду з водою, дуже слабкі нерозчинні кислоти. Співвідношення силіція оксиду і води різні. Загальна формула - - nSiO2·mH2O. В водних розчинах доведено існування ортосилікатної H4SiO4 , піросилікатної H6Si2O7, метасилікатної H2SiO3і дисилікатної H2Si2O5кислот.

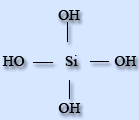
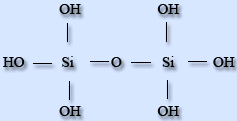
H4SiO4 H6Si2O7
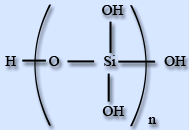
H2SiO3
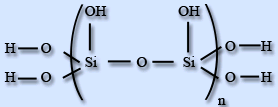
H2Si2O5
Залежно від умов, вона може бути одержана як у вигляді драглевидної маси, так і у вигляді колоїдного розчину — золю.
Колоїдні розчини — високодисперсні двофазні системи, що складаються з дисперсійного середовища і дисперсної фази, причому лінійні, розміри часток останньої лежать у межах від 1 до 100 нм. Колоїдні розчини за розмірами часток є проміжними між істинними розчинами та суспензіями й емульсіями. Колоїдні розчини з такими великими частками при однобічному висвітленні здаються мутними внаслідок розсіювання колоїдними частками світла (ефект Тиндаля). Кожна колоїдно-дисперсна, система може існувати в двох основних видах: золь — рідкий колоїдний розчин і гель — желатиноподібна Драглиста маса. Золі мають ряд специфічних властивостей, які докладно вивчає колоїдна хімія. Так, золі в залежності від розмірів часток можуть мати різне забарвлення, а в істинних розчинів воно однакове. Наприклад, золі золота можуть бути синіми, фіолетовими, вишневими, рубіново-червоними. Однією з найважливіших властивостей золів є те, що їхні частки мають електричні заряди одного знаку. Завдяки цьому вони не з'єднуються в більш великі частки і не осаджуються. Значення золів надзвичайно велике, тому що вони більш поширені, .ніж істинні розчини. Протоплазма живих клітин, кров, соки рослин — усе це складні золі.
ІІ Силікатна кислота і її солі- силікати
Силікатна кислота H2SiO3 – слабка малорозчинна двоосновна кислота
Учитель записує рівняння реакцій , що характеризують її властивості:
- ступінчаста дисоціація;
- розклад при нагріванні;
- взаємодія з основними оксидами;
- взаємодія з основами.
Силікатну кислоту, як і будь-який інший нерозчинний гідроксид,
можна одержати з її розчинних солей, наприклад із натрій силікату, діючи більш сильною кислотою. Н2Sі03 не можна одержати взаємодією силіцій (IV) оксиду і води. .
Демонстрація.
Одержання силікатної кислоти із натрій силікату. До розчину натрій силікату (силікатного клею) додати розчин хлоридної кислоти. Випадає драглистий осад силікатної кислоти. Якщо вихідні розчини мають низьку концентрацію, то Н2Sі03 може бути одержана у вигляді колоїдного розчину.
Учні записують рівняння реакції в молекулярній та іонній формах. Завдання.
Запишіть рівняння реакцій, що характеризують хімічні властивості силікатів.
Солі силікатної кислоти – силікати. Вони нерозчинні у воді, за виключенням силікатів натрію і калію, їх називають «рідким склом.». Силікати широко розповсюджені в природі Властивості силікатів різні в залежності від їх складу і будови, дуже часто мають яскравий колір, деякі з них використовують в ювелірній справі.(гранат, топаз, ізумруд).
ІІІ Будівельні матеріали
В природі силіцій зустрічається виключно в вигляді сполук з оксигеном, кремнезему і силікатів.
Природний кремнезем, силікати і глина - сировина для силікатної промисловості Головними продуктами її є: кераміка, скло і цемент. З виробництвом деяких познайомимося більш детальніше.
На дошці схема
Силікатна промисловість
Кераміка Скло Цемент
Учні нам приготували повідомлення. Але нам потрібно їх слухати дуже уважно, щоб заповнити таблиці, які ви маєте на столах. (або можна використати, як варіант самостійної роботи)
| | Силікатна промисловість | ||
| Кераміка | Скло | Цемент | |
| 1.Сировина 2.Види промисловості продукції | | | |
Кераміка.
1-й учень. Кераміка (від грецького слова «керамон» - глина). Основною сировиною для виробництва кераміки служить глина. Якщо домісити до глини трохи води, виходить пластичне тісто, здатне зберігати надану йому форму, яка зберігається після висихання і закріплюється при випаленні. Вироби з глини, що пройшли випалення, називаються керамічними. Кераміка представляє один з якнайдавніших штучних і зараз поширених матеріалів в будівництві, повсякденному побуті і мистецтві. З білої глини виготовляють фарфорові і фаянсові вироби, глиняний посуд. Сформовані з глиняного тісту вироби доводять випаленням до спікання, а не до плавлення. Керамічні вироби виходять пористі і влагостійкі. Тому зовні їх покривають глазур'ю – різними легкоплавкими складами, утворюючими на поверхні керамічного виробу тонкий, вологонепроникний склоподібний шар.
(йде показ керамічних виробів)
2-й учень. Керамічне виробництво довгий час розвивалося по двох напрямах – будівельна кераміка і кераміка для побуту. Пізніше з'явився третій напрям – технічна кераміка.
Розвиток сучасного керамічного виробництва привів до того, що з'явилися нові сфери застосування кераміки. На керамічній основі робляться деякі інструментальні матеріали. Було потрібно і виробництво так званої тонкої кераміки для авіації, приладобудування, електротехніки, радіотехніки.
3-й учень. Процес виготовлення кераміки зазвичай зводиться до наступних стадій: підготовка сировини, приготування керамічної маси, формування виробів, сушка, випалення.
Основна сировина – різноманітні глини. До складу побутової кераміки додають кварцовий пісок, польовий шпат, подрібнений фарфор або фаянс, фарбники.
Зміна складу і структури кераміки дозволила отримати численні керамічні матеріали. Однією з головних наукових сенсацій кінця XX століття стало відкриття високотемпературної надпровідності на зразках кераміки, складеної з оксидів міді, барії і рідкоземельних елементів.
Керамічні матеріали переживають сьогодні, як би друге народження. Від гончарного круга до якнайтоншої апаратури для дослідження мікроструктури і нових авіаційних приладів – такий шлях розвитку кераміки.
Вчитель. У природі зустрічається худа і жирна глина. Худа глина для ліплення не годиться. Оскільки в ній багато піску.
Отже, що ж є сировиною для виробництва кераміки?
Які види промислової продукції ви відзначили?
Скло.
4-й учень. Скло – теж силікат.
Відкрито скло дуже давно. Ще в IV тисячолітті до н.е. в деяких країнах Сходу уміли виплавляти скло. Ім'я його першовідкривача, природно, невідоме. Популярна легенда про випадковість цього відкриття: про моряків, що обклали грудками соди розведене на піску вогнище, і про знайдені на цьому місці блискучі камінчики – краплі, що утворилися з піску, що сплавилися, і соди.
Частка істини в легенді є.
Скло дійсно варять з декількох компонентів. Пісок і сода, як правило, основні складові силікатних стекол, але окрім них входять і інші речовини.
Склад звичайної шибки: Na2O CaO 6SiO2.. Скло отримують при сплаві в спеціальних печах суміші соди Na2CO3, вапняку CaCO3 і білого піску SiO2:
6SiO2 + Na2CO3 + CaCO3 = Na2O·CaO·6SiO2 + 2CO2.ссылка скрыта
Для отримання спеціального скла вводять різні добавки, так скло те, що містить іони Pb2+ – кришталь; Cr3+ – має зелене забарвлення, Fe3+ – коричневе темно-зелене скло, Co2+ – дає синій колір, Mn2+ – червоно-бузковий.
5-й учень. Прослідкуємо шлях розвитку скла
До того як розквітло скловиробництво у Венеції, до того, як з'явилися вази і кубки з кольоровими нитками, звитими спіраллю, мир вже знав дивовижні вітражі і мозаїки з кольорового скла, виті браслети і намиста Візантії і Київської Русі. Майстерні в скляній справі умільці в стародавньому Пскові і великому Новгороді. Були майстри, та не збереглося ремесло після татарського нашестя і смутного часу. Нелегко було тягнутися за іншими російській людині: він починав заново в ту пору, коли славу венеціанців починали оспорювати французькі склороби, чеські майстри, що створили богемський кришталь. Русь потребувала скла.
6-й учень. У 1668 році в селі Ізмайлово був побудований завод. Майстрів , але майстрів, яких відправили навчатися в Венецію довгий час далі за підсобну роботу не допускали, але вони вже дещо починали розуміти, а інше доповнювали кмітливістю. Рік від року все більшою гордістю ставав Ізмайловський завод. У 1705 році встановлений імператорський завод дзеркального скла. Петро I змусив російську людину по-справжньому узятися за склодувну трубку. Відважна біда – початок.
Мало досвіду було у нашого майстра, але прийшов йому на допомогу М. В. Ломоносов Він розкрив багато, що зберігалося в таємниці: навчив варити кольорове скло, а зроблені з кубиків смальти нові російські мозаїки, оспівав навіть у віршах :
« Неправо о вещах те думают, Шувалов,
Которые Стекло чтут ниже Минералов,
Приманчивым лучом блистающих в глазах:
Не меньше пользы в нем, не меньше в нем краса.»
7-й учень. Різне є скло. Є грубе, темно-зелене і віконне. А є тонке, свинцеве скло. В нього блиск і дзвін дуже чисті. Він грає веселкою, як алмаз. Виробів з скла, дуже важливо робити не тільки більше, але і краще і красивіше.
Поет О. Количев у вірші «Стакан» пише:
«Когда прозрачный, тонкий, музыкальный
Стакан с водой я подношу ко рту,
Я вижу девушку с завода Гусь – Хрустальный,
Создавшую вот эту красоту.
Она вложила в солнечные грани
Все мастерство нелегкое свое,
И отражаются в простом стакане
Ее улыбка и душа ее».
Вчитель. Яка сировина необхідна для виробництва скла?
8-й учень. Сировиною для виробництва звичайного скла потрібні чистий кварцовий пісок, сода і вапняк. Для отримання кольорового скла до сировини додають оксид відповідного металу. Якщо додати оксид кобальту виходить більш синє скло, оксид хрому – зелене скло, оксид міді – синьо-зелене, а якщо додати мілкороздріблене золото – рубінове.
Вчитель. Розплавлене скло при охолоджуванні твердне не відразу, а поступово загусає, утворюючи спочатку в'язку масу. Завдяки цій властивості скло піддається формуванню – в розігрітому стані йому можна надати будь-яку форму, приготувати скляні нитки (скловолокно)
(демонструє дослід)
Які види промислової продукції ви записали в своїх таблицях?
Цемент.
9-й учень. Цемент відноситься до найважливіших сучасних будівельних матеріалів. Основною сировиною для цементу є вапняк і глина. Цемент отримують в циліндрових похилих печах, що поволі обертаються. Суміш завантажують у верхній кінець печі, і, пересипаючись, вона рухається вниз назустріч потоку розжарених газів – продуктів згорання вдувного через форсунку палива. При цьому з вапняку виділяється вуглекислий газ, з глини – вода, а оксиди кальцію, що залишилися, алюмінію і кремнію утворюють між собою з'єднання – силікати і алюмінати кальцію, складові цементу. Його перемелюють в порошок і упаковують для ізоляції від води. При змішуванні цементу з водою виходить цементне тісто, що поступово твердіє.
10-й учень. Для економії цементу і підвищенні міцності виробів до цементу додають пісок або щебінь. Отримана волога суміш називається бетоном. Міцність бетонних споруд ще більш зростає, якщо в бетон вводиться каркас із залізних прутів. Таке поєднання бетону і заліза отримала назва залізобетону. Залізобетон широко застосовують в капітальному будівництві, при зведенні заводських корпусів, дамб і інших споруд.
(демонстрація поступового твердіння цементу при з'єднанні його з водою.)
Вчитель.
Отже, що ж є сировиною для виробництва цементу?
На яких властивостях цементу засновано його широке застосування в будівництві?
5. Закріплення знань
З виробництвом якої промисловості ми познайомилися?
Які головні будівельні матеріали ви виділите в силікатній промисловості?
- На яких властивостях глини засновано виробництво керамічних виробів?
- У якому стані склу можна надати форму?
- Які властивості цементу лежать в основі його застосування?
6. Домашнє завдання
. Запишіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Si →SiCl4 →Si →SiO2 →Si →K2SiO3.
Рішення:
Силіцій реагує з хлором при нагріванні до 400–600 °С, утворюючи силіцій тетрахлорид :
Si + 2Cl2 = SiCl4.
Силіцій утворюється при відновленні силіцій тетрахлориду воднем при 1200 °С:
SiCl4 + 2H2 = Si + 4HCl.
Подрібнений силіцій при нагріванні до 400–600 °С реагує з киснем:
Si + O2 = SiO2.
При відновленні кремній (IV) оксиду коксом в електричних пічках утворюється силіцій:
SiO2 + 2C = Si + 2CO.
Кремній розчиняється в лугах, утворюючи силікат і водень:
Si + 2KOH + H2O = K2SiO3 + 2H2.
7. Підведення підсумків уроку.
1. Самооцінювання учнів
2. Оцінювання учителем роботи класу та окремих учнів
3. Аргументація виставлених оцінок
Головне управління освіти і науки
Харківської обласної державної адміністрації
Харківський обласний методичний центр професійно – технічної підготовки
Вище професійно – технічне училище будівництва
м. Харків
Самостійна робота з теми
«Карбон і Силіцій»
Тема уроку:«Силікатна кислота і силікати .Будівельні матеріали»
Назва самостійної роботи: «Будівельні матеріали»
Урок № 33
Урок №33
Самостійна робота
«Будівельні матеріали»
Заповніть таблицю.
| | Силікатна промисловість | ||
| Кераміка | Скло | Цемент | |
| 1.Сировина 2.Види промисловості продукції | | | |
Кераміка.
Кераміка (від грецького слова «керамон» - глина). Основною сировиною для виробництва кераміки служить глина. Якщо домісити до глини трохи води, виходить пластичне тісто, здатне зберігати надану йому форму, яка зберігається після висихання і закріплюється при випаленні. Вироби з глини, що пройшли випалення, називаються керамічними. Кераміка представляє один з якнайдавніших штучних і зараз поширених матеріалів в будівництві, повсякденному побуті і мистецтві. З білої глини виготовляють фарфорові і фаянсові вироби, глиняний посуд. Сформовані з глиняного тісту вироби доводять випаленням до спікання, а не до плавлення. Керамічні вироби виходять пористі і влагостійкі. Тому зовні їх покривають глазур'ю – різними легкоплавкими складами, утворюючими на поверхні керамічного виробу тонкий, вологонепроникний склоподібний шар.

Керамічне виробництво довгий час розвивалося по двох напрямах – будівельна кераміка і кераміка для побуту. Пізніше з'явився третій напрям – технічна кераміка.

Розвиток сучасного керамічного виробництва привів до того, що з'явилися нові сфери застосування кераміки. На керамічній основі робляться деякі інструментальні матеріали. Було потрібно і виробництво так званої тонкої кераміки для авіації, приладобудування, електротехніки, радіотехніки.

Процес виготовлення кераміки зазвичай зводиться до наступних стадій: підготовка сировини, приготування керамічної маси, формування виробів, сушка, випалення.
Основна сировина – різноманітні глини. До складу побутової кераміки додають кварцовий пісок, польовий шпат, подрібнений фарфор або фаянс, фарбники.
Зміна складу і структури кераміки дозволила отримати численні керамічні матеріали. Однією з головних наукових сенсацій кінця XX століття стало відкриття високотемпературної надпровідності на зразках кераміки, складеної з оксидів міді, барії і рідкоземельних елементів.
Керамічні матеріали переживають сьогодні, як би друге народження. Від гончарного круга до якнайтоншої апаратури для дослідження мікроструктури і нових авіаційних приладів – такий шлях розвитку кераміки.
У природі зустрічається худа і жирна глина. Худа глина для ліплення не годиться. Оскільки в ній багато піску.
Отже, що ж є сировиною для виробництва кераміки?
Які види промислової продукції ви відзначили?
Скло.
Скло – теж силікат.
Відкрито скло дуже давно. Ще в IV тисячолітті до н.е. в деяких країнах Сходу уміли виплавляти скло. Ім'я його першовідкривача, природно, невідоме. Популярна легенда про випадковість цього відкриття: про моряків, що обклали грудками соди розведене на піску вогнище, і про знайдені на цьому місці блискучі камінчики – краплі, що утворилися з піску, що сплавилися, і соди.
Частка істини в легенді є.
Скло дійсно варять з декількох компонентів. Пісок і сода, як правило, основні складові силікатних стекол, але окрім них входять і інші речовини.
Склад звичайної шибки: Na2O CaO 6SiO2.. Скло отримують при сплаві в спеціальних печах суміші соди Na2CO3, вапняку CaCO3 і білого піску SiO2:
6SiO2 + Na2CO3 + CaCO3 = Na2O·CaO·6SiO2 + 2CO2.ссылка скрыта
Для отримання спеціального скла вводять різні добавки, так скло те, що містить іони Pb2+ – кришталь; Cr3+ – має зелене забарвлення, Fe3+ – коричневе темно-зелене скло, Co2+ – дає синій колір, Mn2+ – червоно-бузковий.

Венеціанське скло
Прослідкуємо шлях розвитку скла
До того як розквітло скловиробництво у Венеції, до того, як з'явилися вази і кубки з кольоровими нитками, звитими спіраллю, мир вже знав дивовижні вітражі і мозаїки з кольорового скла, виті браслети і намиста Візантії і Київської Русі. Майстерні в скляній справі умільці в стародавньому Пскові і великому Новгороді. Були майстри, та не збереглося ремесло після татарського нашестя і смутного часу. Нелегко було тягнутися за іншими російській людині: він починав заново в ту пору, коли славу венеціанців починали оспорювати французькі склороби, чеські майстри, що створили богемський кришталь. Русь потребувала скла.
У 1668 році в селі Ізмайлово був побудований завод. Майстрів , але майстрів, яких відправили навчатися в Венецію довгий час далі за підсобну роботу не допускали, але вони вже дещо починали розуміти, а інше доповнювали кмітливістю. Рік від року все більшою гордістю ставав Ізмайловський завод. У 1705 році встановлений імператорський завод дзеркального скла. Петро I змусив російську людину по-справжньому узятися за склодувну трубку. Відважна біда – початок.
Мало досвіду було у нашого майстра, але прийшов йому на допомогу М. В. Ломоносов Він розкрив багато, що зберігалося в таємниці: навчив варити кольорове скло, а зроблені з кубиків смальти нові російські мозаїки, оспівав навіть у віршах :
| « Неправо о вещах те думают, Шувалов, Которые Стекло чтут ниже Минералов, Приманчивым лучом блистающих в глазах: Не меньше пользы в нем, не меньше в нем краса.» |  |
Різне є скло. Є грубе, темно-зелене і віконне. А є тонке, свинцеве скло. В нього блиск і дзвін дуже чисті. Він грає веселкою, як алмаз. Виробів з скла, дуже важливо робити не тільки більше, але і краще і красивіше.
| Поет О. Количев у вірші «Стакан» пише: «Когда прозрачный, тонкий, музыкальный Стакан с водой я подношу ко рту, Я вижу девушку с завода Гусь – Хрустальный, Создавшую вот эту красоту. Она вложила в солнечные грани Все мастерство нелегкое свое, И отражаются в простом стакане Ее улыбка и душа ее». |  |
Яка сировина необхідна для виробництва скла?
Сировиною для виробництва звичайного скла потрібні чистий кварцовий пісок, сода і вапняк. Для отримання кольорового скла до сировини додають оксид відповідного металу. Якщо додати оксид кобальту виходить більш синє скло, оксид хрому – зелене скло, оксид міді – синьо-зелене, а якщо додати мелкороздріблене золото – рубінове.
Розплавлене скло при охолоджуванні твердне не відразу, а поступово загусає, утворюючи спочатку в'язку масу. Завдяки цій властивості скло піддається формуванню – в розігрітому стані йому можна надати будь-яку форму, приготувати скляні нитки (скловолокно)
Які види промислової продукції необхідні для виробництва скла?
Цемент.

Цемент відноситься до найважливіших сучасних будівельних матеріалів. Основною сировиною для цементу є вапняк і глина. Цемент отримують в циліндрових похилих печах, що поволі обертаються. Суміш завантажують у верхній кінець печі, і, пересипаючись, вона рухається вниз назустріч потоку розжарених газів – продуктів згорання вдувного через форсунку палива. При цьому з вапняку виділяється вуглекислий газ, з глини – вода, а оксиди кальцію, що залишилися, алюмінію і кремнію утворюють між собою з'єднання – силікати і алюмінати кальцію, складові цементу. Його перемелюють в порошок і упаковують для ізоляції від води. При змішуванні цементу з водою виходить цементне тісто, що поступово твердіє.
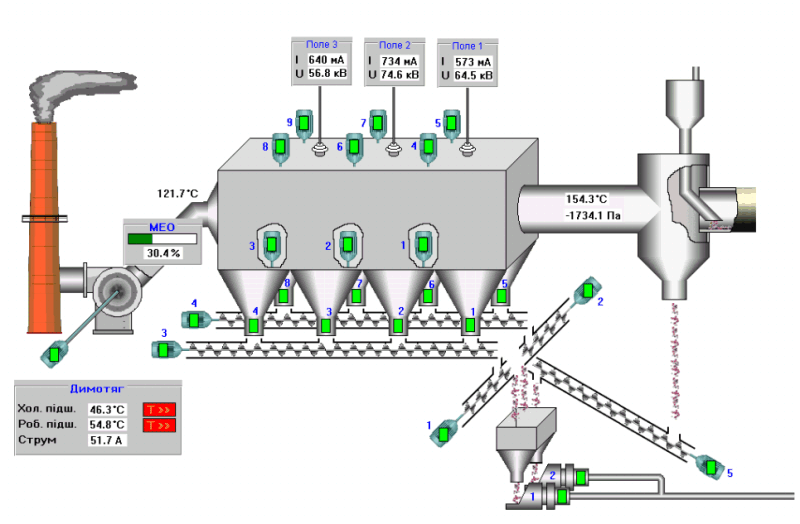
Для економії цементу і підвищенні міцності виробів до цементу додають пісок або щебінь. Отримана волога суміш називається бетоном. Міцність бетонних споруд ще більш зростає, якщо в бетон вводиться каркас із залізних прутів. Таке поєднання бетону і заліза отримала назва залізобетону. Залізобетон широко застосовують в капітальному будівництві, при зведенні заводських корпусів, дамб і інших споруд.

Отже, що ж є сировиною для виробництва цементу?
На яких властивостях цементу засновано його широке застосування в будівництві?
№ уроку 34
Тема: Загальні відомості про неметали та їх сполуки
Тема уроку Поширення Карбону і Силіцію в природі, їхнє значення в живій і не живій природі
Мета урока:
Навчальна:
- Узагальнити знання учнів по пройденій темі,
- Перевірити ступінь засвоєння матеріалу, вміти застосовувати знання на практиці. .
Розвиваюча:
- Розвивати інтерес до предмету, ерудицію, вміння формулювати свою думку, логічно мислити, порівнювати придбані знання
Виховна:
- Виховувати вміння працювати в колективі
- вчити бути делікатними по відношенню до товаришів при їх відповідях
- вчити бути організованими уважними при праці на уроку.
Наш урок присвячений двом хімічним елементам.
З мене складається все живе,
Я – графіт, антрацит і алмаз.
Я на вулиці в школі і вдома,
Я в деревах і в кожному з вас.
В питанні про виникнення життя необхідно насамперед звернутися і до даних про карбон.
Академік А.Є. Ферсман назвав його “основа життя, тому, що без карбону життя неможливе.”.
“Всі органічні речовини, з яких побудовані живі організми, відрізняються від неорганічних тим, що в їх основі лежить хімічний елемент карбон”.
Навряд чи знаєте вільним цей елемент, який тут
Ми обговорюємо, черговим, проте, пам'ятайте, він весь
Ховається від наших поглядів в склі, піску і кришталі.
І без сумнівів, ви знайдете його всюди на Землі.
Кремній – другий за поширеністю хімічний елемент в природі (після кисню), близько 30% всієї земної кори складається з кремнію.
Сьогодні на уроці ми проведемо незвичайний КВК – хімічний.
ссылка скрыта
Темою КВК, як ви вже здогадалися, будуть два елементи IV головної підгрупи ПС хімічних елементів Д.І.Менделєєва –карбон і силіцій .(1 слайд)
У КВК беруть участь 3 команди. вибираємо капітанів, вони отримують завдання в конвертах.
Всього 5 етапів, кожен етап оцінюється. На дошці таблиця для підрахунку балів.(2 слайд)
| № завдання | 1 | 2 | 3 | 4 | 5 |
| 1 команда | | | | | |
| 2 команда | | | | | |
| 3 команда | | | | | |
1 етап – Розминка (3 слайд)
(За правильну відповідь 1 бал), (після відповідей демонструється 4 слайд).
1. Які алотропні форми карбону вам відомі?
2.Як пояснити властивості алотропних форм?
3.Як довести, що алмаз і графіт утворені одним елементом?
4. З допомогою яких явищ, які ви можете спостерігати в житті, можна довести, що м’ясо, молоко, хліб містить карбон?
5. Де знаходять використання алмаз і графіт?
6. В чому спільність і відмінність вищих оксидів силіцію?
2 етап - Домашнє завдання (5 слайд)
(За правильну відповідь 5 балів)
(Кожна команда знайомить суперників з відповідями на завдання , які у них були в конвертах і з підготовленими заздалегідь доповідями)
Завдання ( 6 слайд)
- 1 команди: Складіть рівняння реакцій,, які відбуваються з утворенням оксиду карбону(IV) в побуті, в промисловості, в лабораторії.
- Завдання
- 2 команди: Свіча, яка горить(лучина), гасне в нітрогені і в оксиді карбону(IV) Чому? Як ці гази можна відрізнити один від одного?
- Завдання
- 3 команди: Чому в вогнегасниках використовують натрій гідрокарбонат , а не натрій карбонат?
3 етап Експериментальний( 7 слайд)
(За правильну відповідь 5 балів)).
| З  авдання 1 команди: Пустун заліз до шкільної лабораторії і відірвав всі етикетки з колб, а вам терміново знадобився розчин соди. Ваші дії. Де використовується сода? авдання 1 команди: Пустун заліз до шкільної лабораторії і відірвав всі етикетки з колб, а вам терміново знадобився розчин соди. Ваші дії. Де використовується сода? |
| З  авдання 2 команди: Пустун заліз до шкільної лабораторії і відірвав всі етикетки з колб, а вам терміново знадобився розчин кухарської солі. Ваші дії. Де використовується кухарська сіль? авдання 2 команди: Пустун заліз до шкільної лабораторії і відірвав всі етикетки з колб, а вам терміново знадобився розчин кухарської солі. Ваші дії. Де використовується кухарська сіль? |
| З  авдання 3 команди: Пустун заліз до шкільної лабораторії і відірвав всі етикетки з колб, а вам терміново знадобився розчин сульфатної кислоти. Ваші дії. Де використовується сульфатна кислота? авдання 3 команди: Пустун заліз до шкільної лабораторії і відірвав всі етикетки з колб, а вам терміново знадобився розчин сульфатної кислоти. Ваші дії. Де використовується сульфатна кислота? |
( 8 слайд – як підсумок завдання)
4 етап – Завдання - змагання.( 9 слайд)
(за швидку і правильну відповідь 5 балів).
Дописати можливі рівняння реакції, вирішити задачу
| 1 команда  | 2 команда  | 3 команда  |
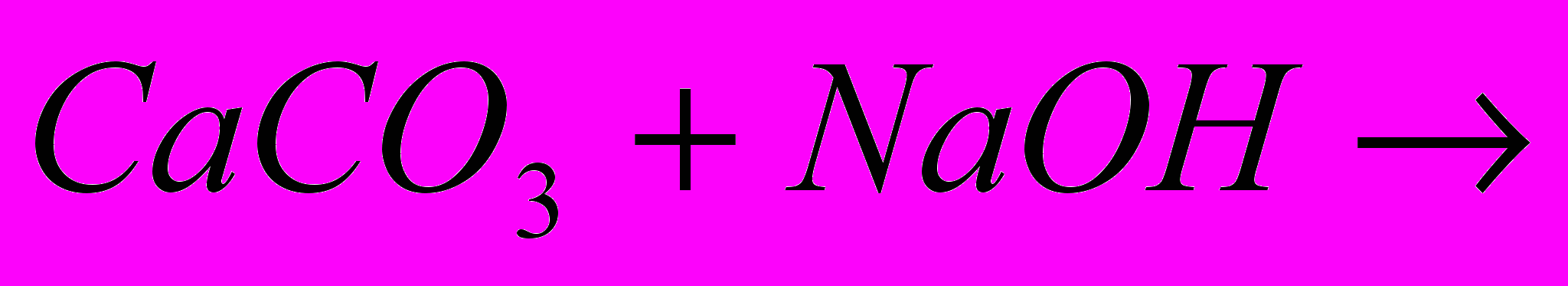 |  | 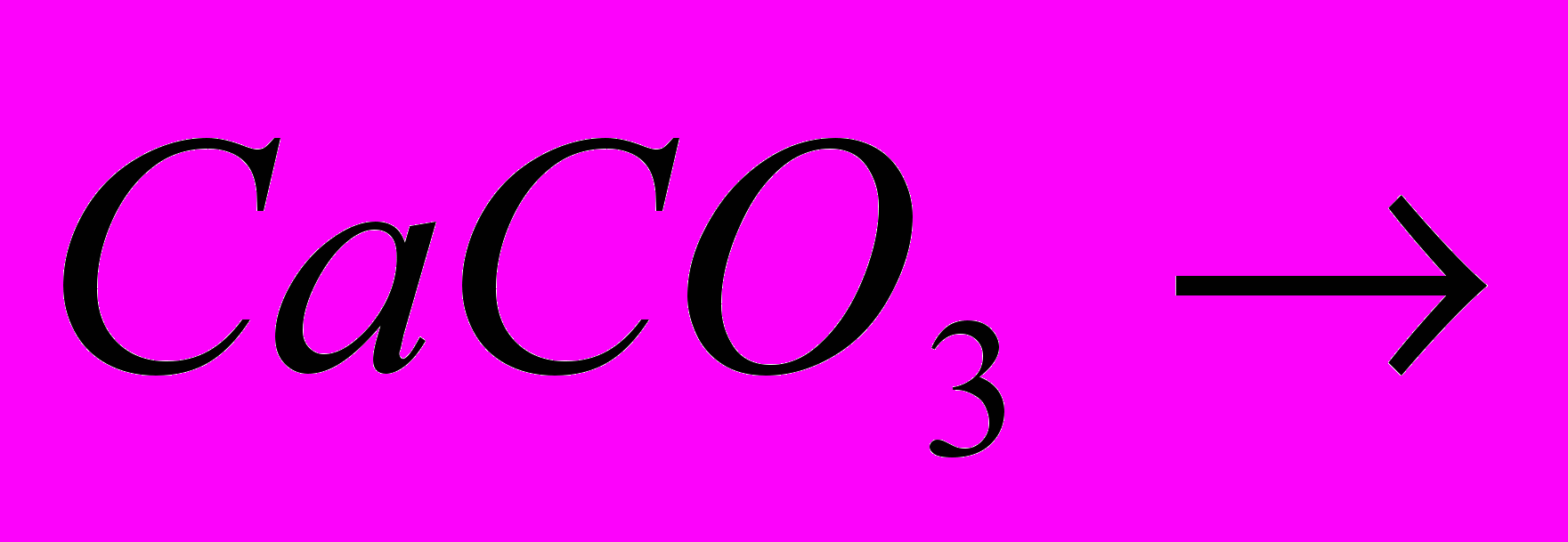 |
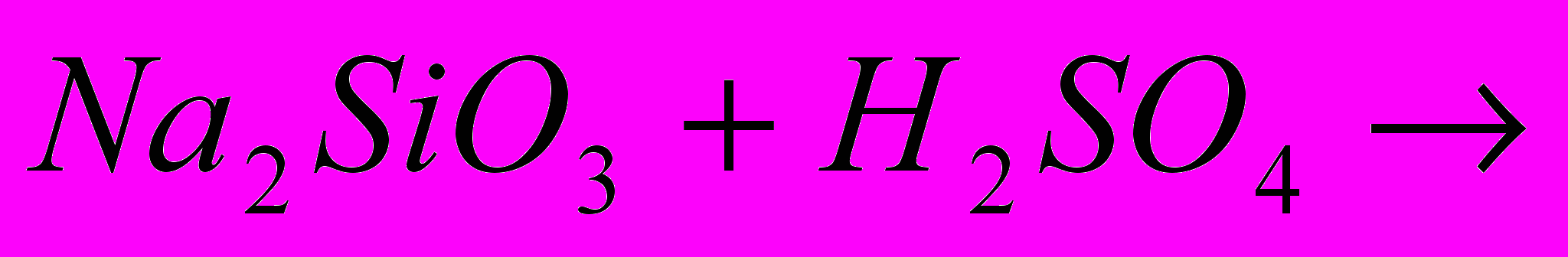 |  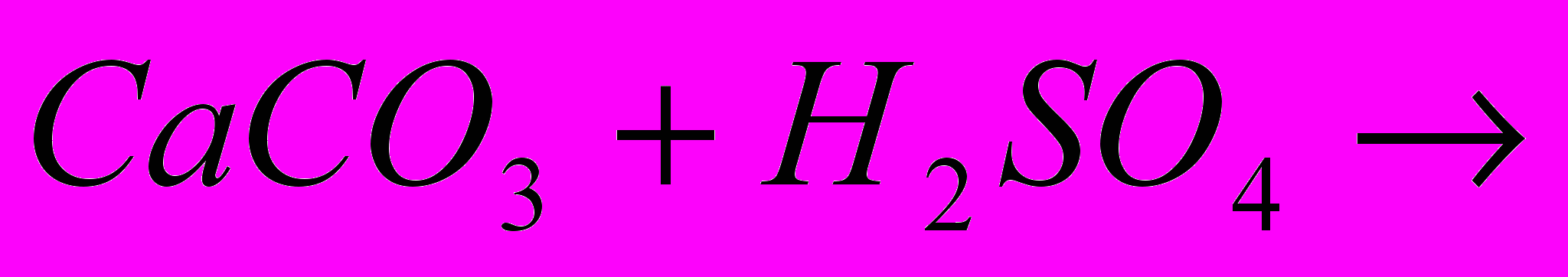 | 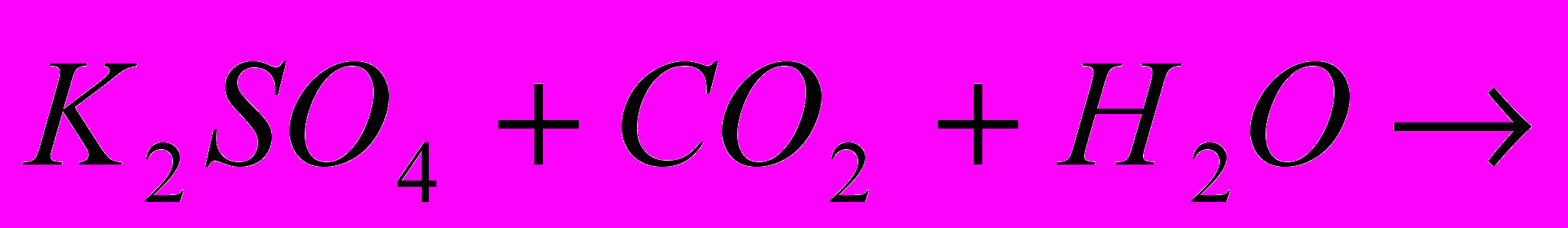 |
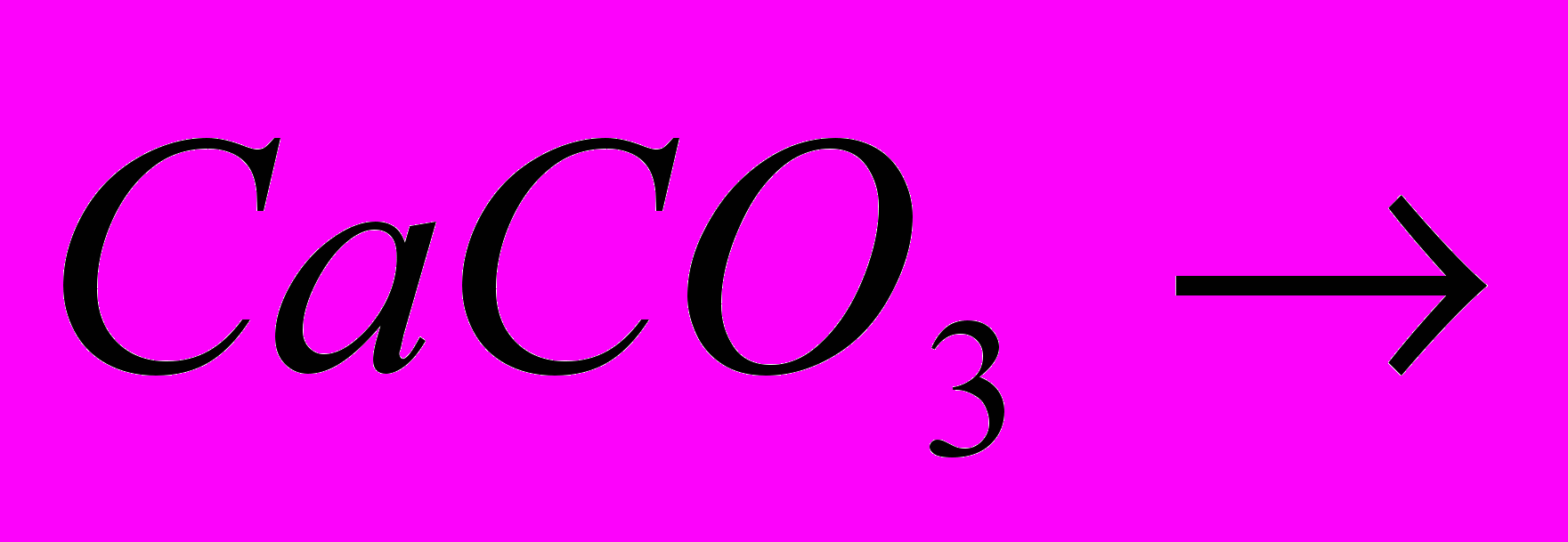 | 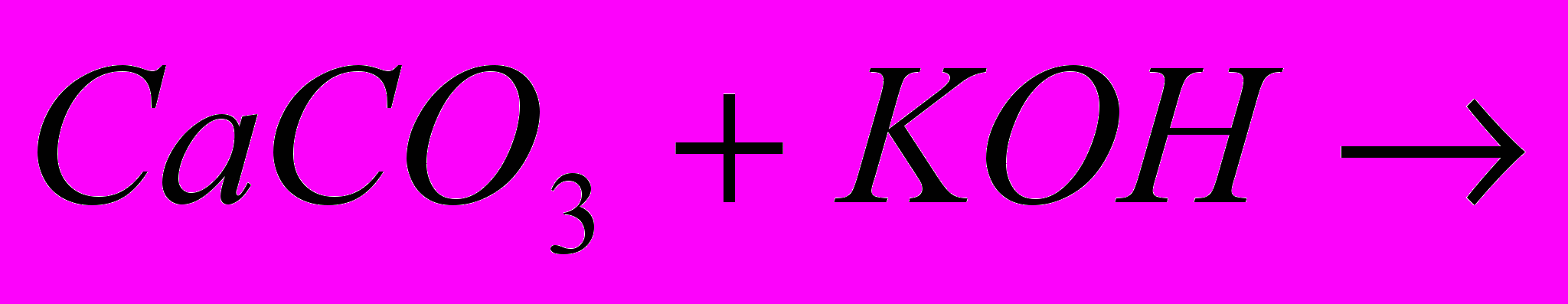 | 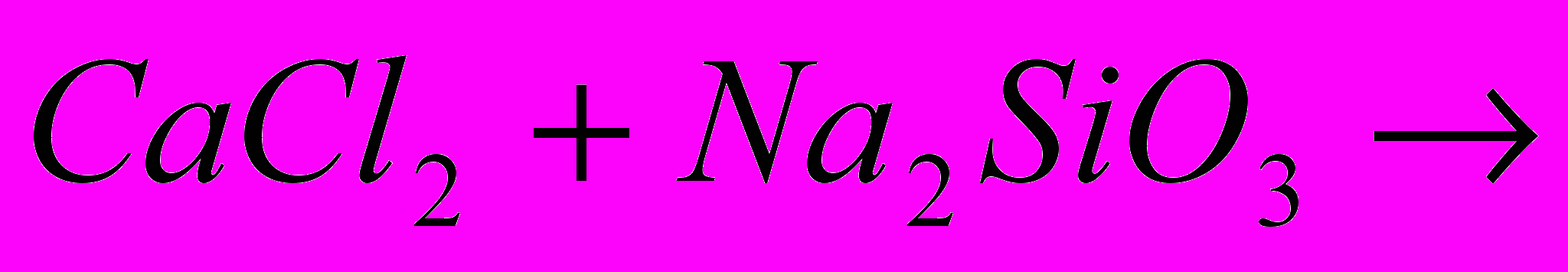 |
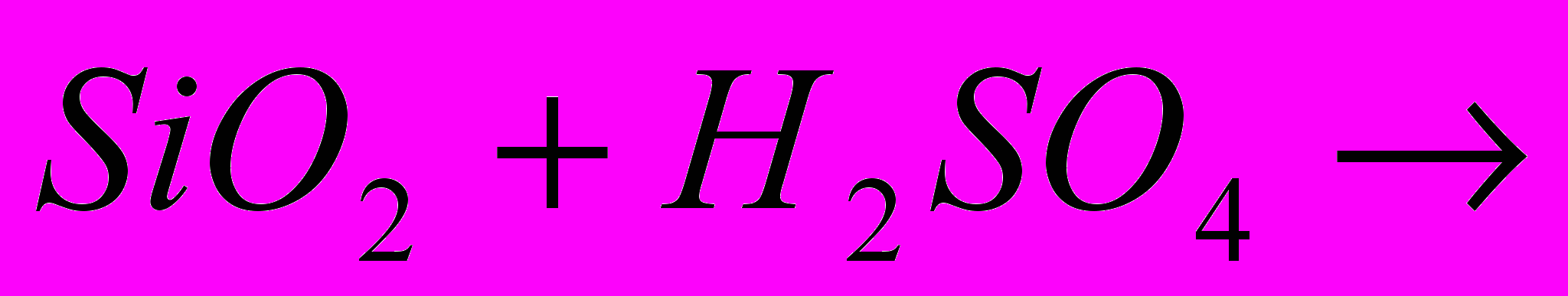 | 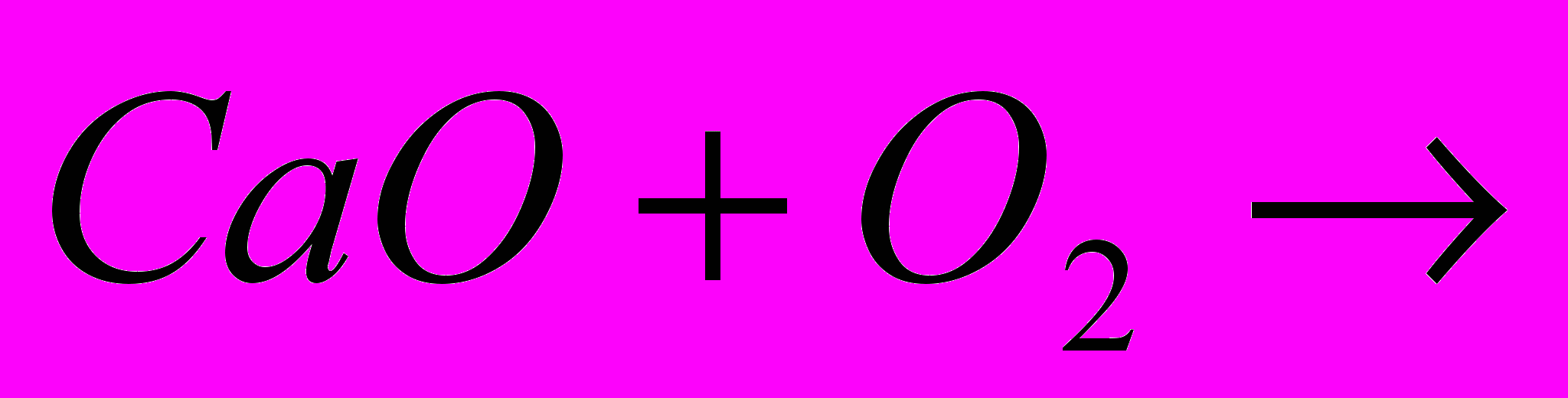 | 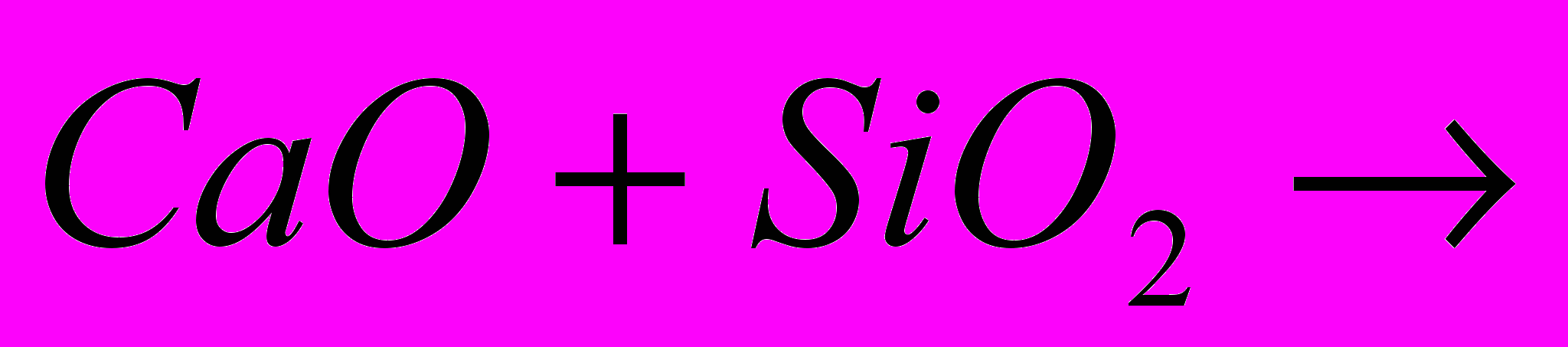 |
| Задача: При відновленні заліза (ІІІ) оксида карбоном, було отримано 10,08 г заліза, що склало 90% від теоретично можливого виходу. Яка маса оксида заліза (ІІІ))? | Задача: Скільки силікату натрію отримаємо при сплавленні оксида силіція (IV) з 64,2 кг соди, в якій міститься 5% домішок | Задача: При дії хлоридної кислоти на 50 г карбонату кальцію отримали 20 г оксиду карбону (IV). Який вихід оксиду карбону (IV) ( в %) від теоретично можливого? |
5 етап – Розповідь - фантазія.( 10 слайд)
Пофантазуйте і уявіть, що на землі не стало елементів карбону і силіція. Що відбудеться?
Поки підводяться підсумки КВН, можна запропонувати додаткові питання, розгадування кросворду (за умови наявності часу).
Кросворд. (Слайди 13-23)
По вертикалі:
1. Сіль карбонової кислоти.
По горизонталі:
1.Має формулу SiO2. Зустрічається в природі в вигляді піску.
При накалюванні суміші піску з вуглем отримують карборунд, який використовують для виготовлення точильних каменів.
2.Формула CaCO3 входить до складу вапнякових порід. Прозорий різновид – ісландський шпат, використовують для виготовлення призм в оптичних приладах.
3.Сама розповсюджена гірська порода. Складається з кварцу, польового шпату і слюди. Містить до 70% кремнезему. Гарний будівельний матеріал
4.3MgO*2H2O*2SiO3-природний силікат магнію, відрізняється вогнестійкістю. Використовується в якості тепло - і електроізоляційного матеріалу.
5.
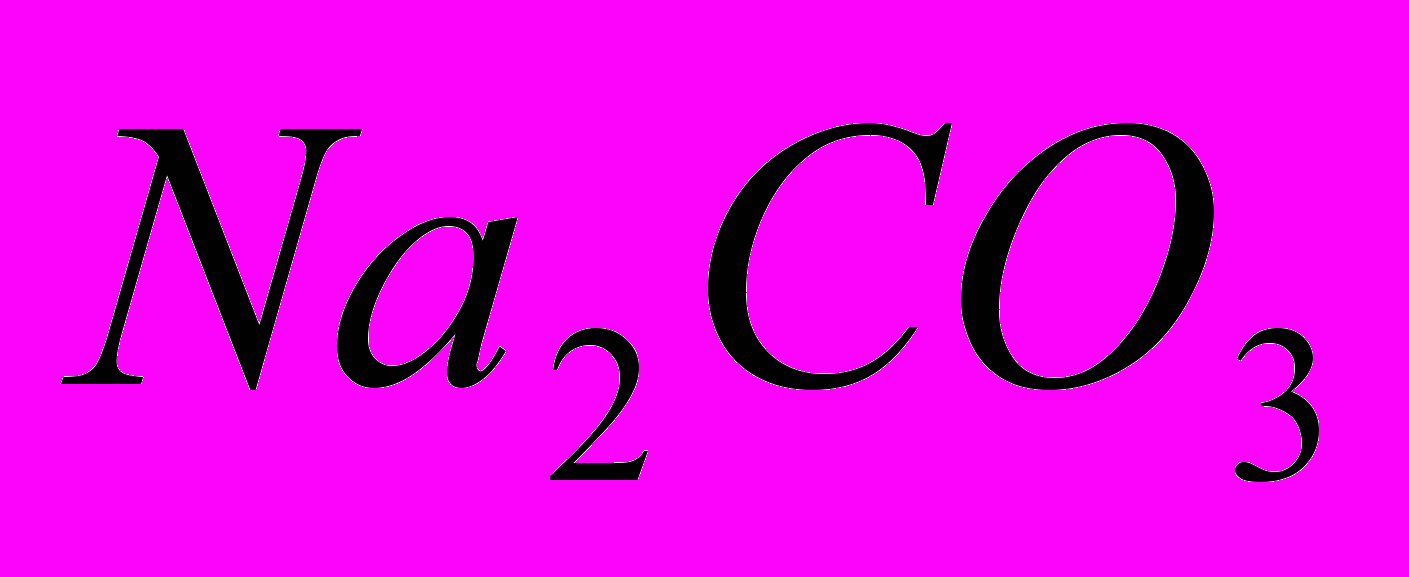 .безбарвна кристалічна речовина. Належить до найважливіших хімічних продуктів. У дуже великій кількості застосовується в ссылка скрыта, ссылка скрыта, ссылка скрыта і ссылка скрыта, а також у паросиловому господарстві для пом’якшення води і в домашньому побуті.
.безбарвна кристалічна речовина. Належить до найважливіших хімічних продуктів. У дуже великій кількості застосовується в ссылка скрыта, ссылка скрыта, ссылка скрыта і ссылка скрыта, а також у паросиловому господарстві для пом’якшення води і в домашньому побуті.6.Al2 O3*2SiO2*2H2O. Слугує основною сировиною в керамічній промисловості, в якій виготовляють фарфор и фаянс.
7.(CuOH)2CO3. Свою назву цей мінерал зеленого кольору отримав від грецького слова отримав «малхе», що значить «трава».В древності печатки з цього мінералу відрізнялися чіткістю відтисків.
8.3MgO*H2O*4SiO2-природний магнія силікат. Використовується в паперовій, парфумерній промисловості, в медицині.
| | 1 | к | в | а | р | ц | | ||
|---|---|---|---|---|---|---|---|---|---|
| | | 2 | к | а | л | ь | ц | и | т |
| 3 | г | р | | а | н | і | т | ||
| 4 | а | с | б | е | с | т | | ||
| | 5 | с | о | д | а | | |||
| 6 | г | л | и | н | а | | |||
| | | 7 | м | а | л | а | х | і | т |
| | 8 | т | а | л | ь | к | | ||
В кінці уроку підведення підсумків, поздоровлення і нагородження переможців. (11-12 слайд)
