Українська академія аграрних наук
| Вид материала | Документы |
- Українська академія аграрних наук, 516.21kb.
- Українська академія аграрних наук, 468.19kb.
- Українська академія аграрних наук, 349.15kb.
- Українська академія аграрних наук, 2736.22kb.
- Українська академія аграрних наук Інститут птахівництва Шаповалов Сергій Олегович, 510.49kb.
- Українська академія аграрних наук, 314.53kb.
- Міністерство агропромислової політики україни українська академія аграрних наук інститут, 1034.09kb.
- Державний комітет україни по земельних ресурсах міністерство сільського господарства, 589.46kb.
- Національний науковий центр „інститут аграрної економіки” національної академії аграрних, 319.01kb.
- Програма для вищих аграрних закладів освіти ІІІ іv рівнів акредитації із спеціальності, 165.25kb.
*- р 0,05; **- р 0,01; при U - 0,05; тпорівняно з контролем
Отримані дані підтверджують положення про те, що вітаміни А та Е є важливими антиоксидантами печінки, що прямо або опосереднювано впливають на ферментні системи детоксикації та антиоксидантного захисту організму від впливу вільних радикалів, що накопичуються в тканинах при дії Т-2 токсину й аурофузарину. Вміст вітаміну А в печінці в курей, що одержували зеараленон, був значно нижче норми протягом всього експерименту. Виключення зеараленону з корму птиці не привело до підвищення вмісту вітаміну А в печінці, рівень його залишався вірогідно нижче контрольних значень на 14-у добу після припинення введення токсину. Можливо, вітамін А бере участь у фізіологічних компенсаторних механізмах, що мобілізують внутрішні резерви організму, після дії зеараленону. Під дією токсину до 30-ї доби відбувалося вірогідне зниження в печінці рівню -токоферолу і вітаміну С. Але вже через 2-а тижні після зняття добавки зеараленону концентрація вітамінів Е та С у печінці практично відновилася. Після виключення токсинів з корму через 14-ть днів вміст вітамінів у печінці практично відновився, хоча при Т-2 токсикозі концентрація вітаміну Е залишалася все-таки нижче контролю.
Таким чином, було встановлено, що мікотоксини викликають другорядну вільнорадикальну форму патологій, що виражається в зниженні нативних антиоксидантів (вітамінів А, Е, С), підвищенні продуктів ПОЛ та істотному збільшенні активності антиоксидантних ферментів.
3.3.3. Цілісність клітинних мембран при мікотоксикозах
Проведені дослідження дозволяють зробити припущення, що розвиток мікотоксикозів супроводжується порушенням цілісності клітинних мембран, зміною їхніх структурно-функціональних характеристик, з чим зв'язана зміна активності мембранозв’язаних ферментів. На прикладі мембран еритроцитів показано, що в умовах дії аурофузарину, зеараленону та Т-2 токсину змінюються показники стійкості і проникності еритроцитарних мембран, їхні бар'єрні властивості й електричні характеристики в умовах дії зовнішнього електричного поля. При вивченні стабільності мембран еритроцитів до кислотного гемолізу і зміни їх електричних параметрів при аурофузаринтоксикозі, встановлено, що на 14 добу збільшується час і знижується швидкість проникнення гемолітика через мембрану при обох концентраціях кислоти (табл. 3.13). При зростанні концентрації гемолітика час гемолізу збільшується на 75% (р 0,01).
При тривалому введенні токсину та активації процесів пероксидації, проникливість мембран еритроцитів різко збільшилась, час гемолізу скорочувався відповідно в 1,4 та 1,1 рази (р0,01). Виявлено підвищення “жорсткості” та зниження еластичності, текучості еритроцитарних мембран в умовах патології.
Відбувалися зміни морфометричного складу еритроцитів (табл. 3.15). При дії токсину зростала неоднорідність популяції еритроцитів периферичної крові з переважанням на 14-у і 21-у добу макроформ. Про це свідчать дані розподілу еритроцитів за об’ємом та діаметром (максимуми гістограм розподілу).
Збільшення кількості макроцитів у крові може бути ознакою розвитку в організмі компенсаторної реакції еритропоезу на зміну фізіологічного стану організму в умовах інтоксикації.
Таблиця 3.13
Значення показників кислотного гемолізу еритроцитів при мікотоксикозах
| Показники | Групи | Тривалість введення токсинів, доба | ||
| 14 | 21 | 30 | ||
Час гемолізу0,0028N HCl, секунди | 1 (К) | 497,5 12,5 | 669,0 41,58 | 752,0 16,0 |
| Т-2 токсин | 440,0 22,1 * | 481,4 40,3 ** | 511,0 46,6 ** | |
| аурофузарин | 500,7 21,58 | 467,0 12,5 ** | 678,0 69,1 ** | |
| Зеараленон | 588,0 48,0 | 501,4 14,2** | 497,8 22,9 ** | |
Швидкістьгемолізу0,0028N HCl,D . c-1 | 1 (К) | 2,21 0,25 | 2,63 0,49 | 2,55 0,31 |
| Т-2 токсин | 1,42 0,27 * | 2,20 0,30 | 1,94 0,2* | |
| аурофузарин | 1,96 0,51 | 2,52 0,18 | 2,49 0,35* | |
| Зеараленон | 2,18 0,58 | 2,89 0,63 | 2,46 0,14 | |
| Час гемолізу 0,009N HCl, секунди | 1 (К) | 242,6 32,34 | 480,4 25,23 | 556,6 35,9 |
| Т-2 токсин | 383,0 20,9 ** | 398,4 40,78 | 372,6 34,2 ** | |
| аурофузарин | 426,0 15,9 ** | 410,6 3,78 * | 470,6 30,88 | |
| Зеараленон | 419,6 8,34 ** | 428,8 13,47 | 291,6 19,7 ** | |
| Швидкість гемолізу 0,009N HCl, D . c-1 | 1 (К) | 3,90 0,42 | 1,95 0,29 | 2,67 0,42 |
| Т-2 токсин | 2,59 0,57 | 1,63 0,60 | 2,11 0,12 | |
| аурофузарин | 1,82 0,10 ** | 2,45 0,21 | 4,83 0,79 | |
| Зеараленон | 1,90 0,24 ** | 2,08 0,29 | 3,98 0,56 * | |
*- р 0,05; **- р 0,01; при U - 0,05; тпорівняно з контролем
Збільшувались показники електричної стабільності мембран еритроцитів в дослідній групі: сила струму та напруга пробою мембрани були значно вище на 21-у добу введення токсину (табл. 3.14).
Таким чином, проведені дослідження дозволяють припустити, що в основі механізмів розвитку патологічних змін при дії аурофузарину лежить посилення процесів ПОЛ у тканинах, специфічним проявом якого є накопичення гідроперекисей.
Показано, що аурофузарин значно активує глутатіонзалежну систему детоксикації клітини. Отримані дані свідчать про зміни конформаційних та функціональних властивостей мембран клітин в умовах попадання в організм аурофузарину, виявлені зміни їх проникності та електричної провідності.
Вивчення функціонального стану мембран при дії низьких концентрацій зеараленону показало, що максимальні зміни проникності мембран і їхня стійкість до дії гемолітика спостерігається на більш довготривалому надходженню токсину (табл. 3.13).
Таблиця 3.14
Динаміка біофізичних показників еритроцитів курей
| Показники | Групи | Тривалість введення токсинів, доба | ||
| 14 | 21 | 30 | ||
Сила струму пробоюмембрани(mkА) | 1 (К) | 253,0 1,8 | 231,07 2,85 | 262,4 25,7 |
| Т-2 токсин | 234,0 2,14** | 242,75 3,48 ** | 231,6 3,1 | |
| аурофузарин | 248,5 4,54 | 242,04 3,31 * | 262,8 7,53 | |
| Зеараленон | 241,9 4,23 * | 231,90 1,52 | 251,4 6,09 | |
| Напруга пробою мембрани (mV) | 1 (К) | 0,630 0,01 | 0,622 0,0 | 0,693 0,07 |
| Т-2 токсин | 0,632 0,0 ** | 0,622 0,0 | 0,616 0,01 | |
| аурофузарин | 0,662 0,01 | 0,650 0,01 * | 0,688 0,02 | |
| Зеараленон | 0,632 0,0 | 0,622 0,0 | 0,660 0,01 | |
| Опір цитоплазми (Ом) | 1 (К) | 1,49 0,11 | 1,14 0,05 | 0,79 0,17 |
| Т-2 токсин | 1,54 0,06 | 1,24 0,02 | 1,26 0,24 | |
| аурофузарин | 1,19 0,06 * | 1,11 0,05 | 1,06 0,1 | |
| Зеараленон | 1,52 0,06 | 1,18 0,02 | 1,20 0,15 | |
*- р 0,05; **- р 0,01; при U - 0,05; тпорівняно з контролем
Час гемолізу еритроцитів при мінімальній концентрації кислоти скорочувався на 25% і 34% на 21-у і 30-у добу (р0,01) і при зростанні концентрації гемолітика швидкість гемолізу зростала у цей період в 1,5 рази (р 0,05).
При цьому показники електричної міцності мембран практично не змінилися (табл. 3.14). Отримані дані свідчать про наявність структурних перебудов у мембранах еритроцитів під дією зеараленону, що призводять до збільшення проникності і порушення функціонального стану еритроцитів, вкорочення тривалості їхнього життя. Ці зміни носять стійкий характер. При цьому змінюються морфометричні показники еритроцитів (табл. 3.15). На 14-у добу в популяції еритроцитів переважають клітини, значно більші в об’ємі та діаметрі. Розвиток явища макроцитозу на 14-у добу введення може розглядатися як компенсаторна реакція еритропоезу на зміну фізіологічного стану організму в умовах активації процесів ПОЛ і зниження системи антиоксидантного захисту.
Усі три токсини обумовлювали скорочення часу і зміну швидкості кислотного гемолізу еритроцитів (табл. 3.13), що залежать від термінів введення і виду токсину. Максимальні зміни параметрів проникності мембран спостерігалися при Т-2 токсикозі.
Таблиця 3.15
Морфометричні показники еритроцитів курей
| Показники | Групи | Тривалість введення токсинів, доба | ||
| 14 | 21 | 30 | ||
| Об’єм еритроцитів (мікрони) | 1 (К) | 88,21 3,11 | 100,75 0,62 | 96,71 4,2 |
| Т-2 токсин | 94,73 1,56 | 96,52 0,9 ** | 94,66 1,6 | |
| аурофузарин | 95,20 1,79 * | 96,47 1,61 * | 92,38 1,6 | |
| Зеараленон | 96,92 1,52 ** | 98,52 0,41 * | 92,33 1,8 | |
| Діаметр еритроцитів (мікрон 10) | 1 (К) | 52,35 0,15 | 59,79 0,35 | 52,5 0,17 |
| Т-2 токсин | 54,35 0,62 * | 54,80 0,65 ** | 54,4 0,50** | |
| аурофузарин | 55,12 0,41 ** | 57,02 0,40 ** | 53,66 0,50 * | |
| Зеараленон | 54,39 0,74 ** | 54,80 0,74 ** | 54,06 0,46 ** | |
| Розподіл за об’ємом, . Z-1 . 100% | 1 (К) | 25,81 0,28 | 28,84 0,37 | 25,28 1,19 |
| Т-2 токсин | 24,15 1,56 | 27,22 0,38 * | 28,18 1,20 | |
| аурофузарин | 30,78 1,06 ** | 24,98 1,84 * | 22,61 1,65 | |
| Зеараленон | 24,84 1,95 | 24,9 0,58 ** | 25,67 2,73 | |
| Розподіл за діаметром, . Z-1 . 100% | 1 (К) | 8,65 0 ,96 | 18,4 0,58 | 14,48 0,02 |
| Т-2 токсин | 16,40 2,08 ** | 17,3 0,58 | 19,53 0,80 | |
| аурофузарин | 19,49 0,51 ** | 17,4 1,36 | 12,17 1,12 | |
| Зеараленон | 15,99 1,20 *** | 17,0 0,32 * | 13,32 1,43 | |
*- р 0,05; **- р 0,01; при U - 0,05; тпорівняно з контролем
Таким чином, проведені дослідження свідчать про те, що мікотоксини викликають серйозні порушення фізіолого-біохімічних процесів в організмі. Патологія розвитку мікотоксикозів визначається активацією процесів ПОЛ і зміною активності системи антиоксидантного захисту. Крім цього, спостерігається зниження вмісту вітамінів А, Е, С та активація глутатіонзалежних ферментів. Можливо, стимуляція глутатіонової системи детоксикації є одним зі шляхів метаболічної інактивації мікотоксинів в організмі. Спостерігається активація процесів ПОЛ - зміна структурно функціональних характеристик клітинних мембран, порушення їхньої проникності й електричних властивостей, що лежить в основі універсального механізму ушкодження тканин, порушення їхнього метаболізму і розвитку патологічних станів.
3.4. Вплив Т-2 токсину та біологічно активних речовин на ПОЛ
в умовах in vitro
Як показав огляд літератури, протягом останніх років значна увага приділяється дослідженню процесів вільнорадикального окиснення, серед яких особливу увагу привертає процес перекисного окиснення ліпідів - процес, що відбувається за нормальних фізіологічних умов, необхідний для оновлення клітинних мембран і синтезу ряду біологічно активних речовин. Надлишкове утворення вільних радикалів та взаємодія з активними формами кисню може відбуватися за рахунок впливу різних факторів: іонізуючої радіації, токсичних речовин, мікотоксинів, стресу, злоякісних утворень, старіння та ін. [26, 12, 102]. Інтенсивне забруднення навколишнього середовища ксенобіотиками висуває ряд проблем по вивченню дії різних стрес-агентів на організм людини та тварин, пошук засобів, які знижують їх негативну дію. У зв'язку з цим має практичне значення дослідження дії різноманітних токсичних речовин і препаратів в умовах in vitro.
В сучасних уявленнях про молекулярні механізми дії мікотоксинів важливе місце відводиться вільнорадикальним реакціям ушкодження біоструктур. Широко поширена думка про деструктивну на цитомембрани Т-2 токсину, який обумовлює активацію процесів перекисного окиснення ліпідів [216, 118]. При цьому існує припущення, відповідно до якого підвищення активності ПОЛ є “пусковим механізмом” дії всіх мікотоксинів [213] та було показано, що Т-2 токсин підвищує ПОЛ у різних тканинах курей [118].
Дослідження проводили з використанням гомогенату мозку ембріонів курей, який був обраний, як тканина, що є найбільш чутливою до ПОЛ [191]. Мозок птиці характеризується високим рівнем поліненасичених жирних кислот, аскорбінової кислоти, іонів заліза і низькою концентрацією вітаміну Е. Після декапітації 16-17-добових ембріонів відбирали великі півкулі, промивали холодним фізрозчином і готували 10%-ний гомогенат на 0,15 М фосфатному буфері (рН=7,4). Визначення концентрації малонового діальдегіду проводили як у свіжому, так і в замороженому матеріалі. Встановлено, що швидке заморожування зразків у рідкому азоті і наступне швидке відтаювання не впливає на інтенсивність забарвлення при аналізі [219]. У якості ініціатора ПОЛ вивчався Т-2 токсин. Токсин у кристалічному виді розчиняли в невеликій кількості 96% етанолу, доводили дистилятом до потрібної концентрації. У модельних дослідах використовувалися кінцеві концентрації Т-2 токсину: від 510-6М до 510-4М, які вносили у систему у різних кількостях – від 1 до 100 мкл. У якості антиоксидантних мембранопротекторів використовували -токоферілацетат і -токоферол-спирт, вітамін А-кислоту та чистий ретинол, вітамін К1 і селен у вигляді селеніту натрію. Була проведена оцінка антиоксидантної дії лютеїну, -каротину, зеаксантину та лікопіну. Концентрації антиоксидантних мембранопротекторів підбиралися з реально існуючих концентрацій даної речовини в тканинах організму. Проведені серії дослідів по вивченню впливу Т-2 токсину на процеси ПОЛ показали, що Т-2 токсин не тільки в живому організмі [175], але й в умовах in vitro є активним стимулятором утворення кінцевого продукту ПОЛ - малонового діальдегіду (рис. 3.10). Встановлено, що концентрація Т-2 токсину в тканині мозку 5 10-6М викликає перекисне окиснення ліпідів, можливо використані концентрації є мінімальними, при яких спостерігається деструктивна дія Т-2 токсину, що виражається в порушенні фосфоліпідного матриксу біомембран клітин мозку. При чому показано, що концентрація Т-2 токсину, яка ініціює ПОЛ in vitro у мозку, на порядок нижче, ніж концентрація, що викликає ПОЛ у гепатоцитах [102]. Численними дослідженнями переконливо показано, що «органами-мішенями» для Т-2-токсину є кістковий мозок, селезінка, вилочкова залоза, лімфоїдна тканина, а у птиці - фабрицієва сумка [102]. В той же час у літературі не виявлено даних, які показують зміни у тканинах головного мозку при Т-2 токсикозі. Слід зазначити, що в більшості досліджень встановлена імунодепресивна властивість Т-2 токсину [86, 102]. У дослідженнях in vitro також була показана висока чутливість лімфоїдних клітин до токсичної дії Т-2-токсину [113, 59, 203].
В наших дослідженнях відзначено невелике збільшення МДА при концентрації Т-2 токсину від 1 до 5 10-5 М. Максимальна концентрація МДА спостерігалася при концентрації Т-2 токсину 5 10-4 М. Далі вона незначно зменшувалася і знаходилася у визначеному діапазоні. Стимулювання процесів ПОЛ Т-2 токсином показало, що він виявляє виражені прооксидантні властивості на рівні або вище ПОЛ при стимулюванні іонами Fe++ і аскорбінової кислоти.
Ц
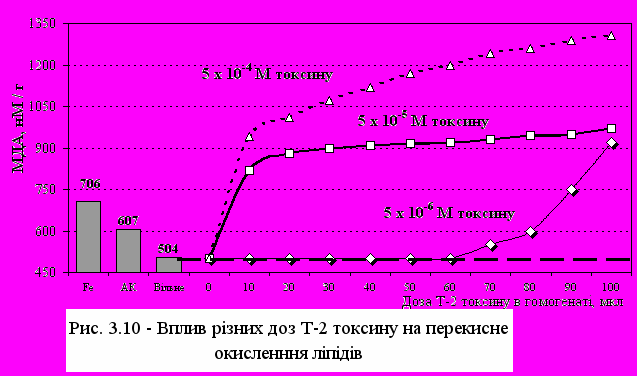
е співадає з літературними даними, де показано, що у якості руйнівника клітинних мембран використовується Т-2 токсин [53]. Таким чином, активація процесів ПОЛ відбувається при дії Т-2 токсину як in vivo, так і in vitro. Повноцінне функціонування антиоксидантної системи може знижувати негативну дію Т-2 токсину та інших ініціаторів ПОЛ, тому отримані результати дозволяють проводити цілеспрямований пошук найбільш активних компонентів антиоксидантного захисту, необхідного для попередження різних патологій, індукованих процесами перекисного окиснення ліпідів.
Серед аліментарних факторів, спроможних знижувати мембраноушкоджуючу дію Т-2 токсину та інших ініціаторів ПОЛ, варто виділити вітаміни Е та С, мікроелемент селен [238, 203].
В останні роки було показано, що каротиноїди можуть розривати ланцюги поширення ПОЛ в умовах in vitro [219], при цьому оксикаротиноїди перевершують -каротин по їхній активності зв'язувати синглетний кисень. Серед них, наприклад, лікопін по своїй активності в зазначених системах зв'язування синглетного кисню в 2 рази перевершує активність -каротину і більше, ніж у 10 разів активність -токоферолу [203]. До подібного висновку прийшли також Chopra M. зі співавт. [145], які показали, що лікопін та кріптоксантин є більш сильними антиоксидантами, ніж -каротин у їхній здатності “ловити” ліпідні пероксидрадикали і більш ефективні в умовах in vitro у порівнянні з -токоферолом. Відомо, що будова деяких каротиноїдів має істотний вплив на розташування й орієнтацію в середині подвійного прошарку мембран фосфоліпідів. Ряд каротиноїдів, таких як -каротин і лікопін, локалізовані цілком усередині гідрофобної частини мембрани, тоді як багато ксантофілів, наприклад, лютеїн і зеаксантин, мають мембраннозв'язану орієнтацію і їхні пастки радикалів перетинають усю ширину подвійного поля [195]. Виходячи з вищесказаного, одним із завдань даної роботи було вивчення впливу ряду біологічно активних речовин на процеси ПОЛ в умовах in vitro.
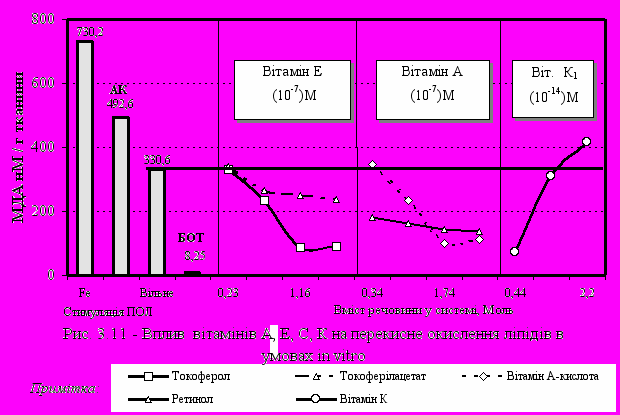
При дослідженні впливу на процеси ПОЛ різноманітних біологічно активних речовин (різних форм вітамінів Е, А, К, селену та ряду каротиноїдів) було показано, що введення в середовище вітаміну Е знижувало ПОЛ у 2,5-3 рази (рис. 3.11). Аналогічну антиоксидантну дію виявили різні форми вітаміну А. Вітамін К1 (філлохінон) виявив антиоксидантні властивості тільки при мінімальних концентраціях, при підвищених концентраціях він мав прооксидантну дію на тканину мозку. Найбільш виражену антиоксидантну дію вітаміну Е було відзначено при використанні -токоферолу. Більш високі концентрації вітаміну Е в формі ацетату незначно знижують ПОЛ.
У той же час навіть мінімальні концентрації спиртової форми вітаміну А знижують ПОЛ. Вітамін А-кислота знижує ПОЛ пропорційно до збільшення його концентрації в системі. Для порівняння дії Т-2 токсину, іонів Fe++ та аскорбату як ініціаторів ПОЛ та для зменшення негативної дії Т-2 токсину в систему були введені вітаміни Е та А (рис. 3.12). Як мінімальна так і максимальна концентрації вітаміну Е знижують ПОЛ у присутності у системі Т-2 токсину, а середні концентрації знижують окиснення у порівнянні з Т-2 токсином, але знаходяться вище рівня вільного проц
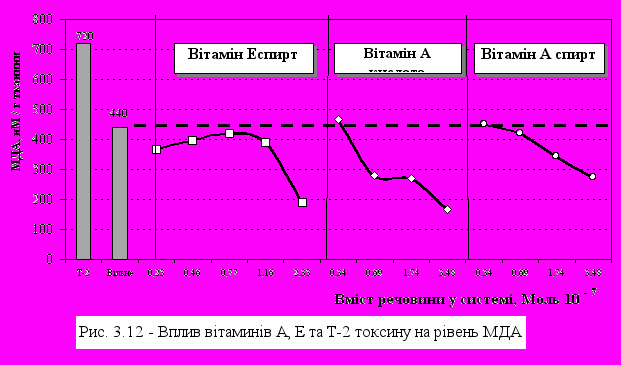
есу ПОЛ. Було показано, що вітамін А знижує ПОЛ у клітинах мозку як у формі кислоти, так і у формі спирту.
Крім того, було проведено порівняльне дослідження антиоксидантних властивостей деяких каротиноїдів в умовах in vitro (рис. 3.13). У наших дослідженнях було показано, що зеаксантин знижує ПОЛ у клітинах мозку найбільш ефективно, у порівнянні з іншими каротиноїдами. Всі використані каротиноїди виявляли виражений інгібуючий ефект на утворення МДА.
П

ри вивченні впливу каротиноїдів на перекисне окиснення ліпідів мозку було показано, що в нормальних фізіологічних умовах концентрація МДА складала 750 нМ, в ведення у систему іонів Fe2+, ініціювало перекисне окиснення в 1,5 рази.
Лютеїн в концентрації нижче 1,7 10-9М не мав істотної дії на процес окиснення ліпідів. Просліджується тенденція зниження рівня МДА в тканині, що пропорційно збільшенню концентрації введеного інгібітору. Можливо, лютеїн сприяє гальмуванню ланцюгової реакції окиснення шляхом інактивації цього процесу. Дані, отримані в нашому експерименті, свідчать про те, що інгібіруюча активність зеаксантину в мозку істотно вище, ніж інших вивчених каротиноїдів. Багато дослідників, що працюють в області вивчення антиоксидантних властивостей каротиноїдів, сходяться на думці, що суміші різних каротиноїдів набагато більш ефективні, ніж окремі речовини. Це припущення було підтверджено в результаті проведених нами досліджень. Так, було показано, що спільне введення в гомогенат мозку лютеїну і зеаксантину в мінімальних досліджуваних концентраціях 1,7 10-9 і 0,85 10-9 М відповідно в середовище інкубації сприяло значно більшому зниженню вмісту МДА у порівнянні з окремим введенням кожного з них. Так, використання суміші двох оксикаротиноїдів призвело до зменшення рівня МДА до 82 нМ, а при збільшенні концентрації зеаксантину в 2 рази (1,7 10-9 М та 1,7 10-9 М) - до 63 нМ. В той же час, спільне введення -каротину і зеаксантину не вплинуло на рівень МДА, що був практично рівним показнику визначеному для чистого зеаксантину - 215 і 212 нМ відповідно. Таким чином, в умовах in vitro був переконливо підтверджений антиоксидантний захисний ефект різних каротиноїдів і їх активність на моделі гомогенату мозку. В цілому, лютеїн і зеаксантин, як два головних каротиноїди ж
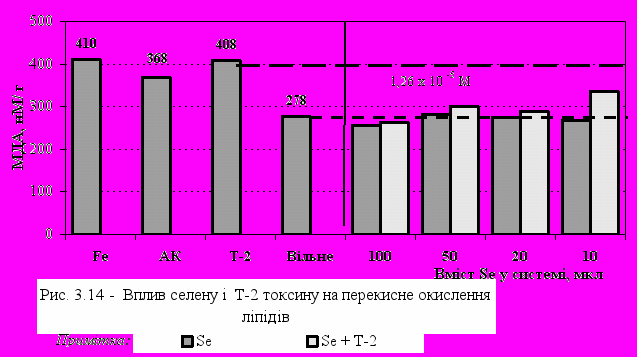
овтка яєць і тканин птиці, виявили достатньо високу активність у їх антиоксидантному захисті. Лютеїн, як головний каротиноїд раціону птиці, жовтку яєць і тканин є кращим атиоксидантом у порівнянні з -каротином у “гасінні” перекисів ліпідів і може бути ефективнішим в умовах in vitro, ніж -токоферол, що узгоджується з дослідженнями Rice-Evans C.A. [203]. Вивчення дії селену як інгібітора ПОЛ при концентрації 1,26 х 10-5М показало, що введення його в систему практично не вплинуло на накопичення МДА, у той же час спостерігався ефект зниження ПОЛ при одночасному введенні з Т-2 токсином (рис. 3.14). Найбільший ефект виявися при 10-ти кратній концентрації іонів металу в системі як при стимулюванні Т-2 токсином, так і при вільному ПОЛ. Виражене збільшення інтенсивності ПОЛ констатовано при введенні мінімальної концентрації селену, який в нормі присутній в ембріональній тканині мозку. Ці дані узгоджуються з дослідженнями, які показали, що введення пацюкам на фоні Т-2 токсину (в концентрації 3,6 мг/кг маси тіла), вітамінів Е, С та Se виявляють захисний ефект на кору головного мозку від дії Т-2 токсину і діють у цьому органі як суцільна антиоксидантна система, спрямована на зниження вільнорадикальних явищ [112].
3.5. Пошук засобів підвищення антиоксидантного статусу організму курей при Т-2 токсикозі
3.5.1. Застосування пробіотиків при Т-2 токсикозі
Біохімічні критерії стану процесів перекисного окиснення ліпідів, отримані в наших дослідженнях в умовах Т-2 токсикозу, свідчать про виражену інтенсифікацію окисних процесів в організмі. Це підтверджується значним накопиченням кінцевого продукту перекисного окиснення ліпідів - малонового діальдегіду в печінці (табл. 3.16).
Таблиця 3.16
Вміст МДА в печінці курей при Т-2 токсикозі та добавці пробіотиків,
нМ/г тканини
| Рівень МДА | Групи курей | |||
| 1 (К) | Т-2 токсин | Т-2 токсин + Lactobacillus sp. | Т-2 токсин + Saccharomyces cerevisiae | |
| Fe2+–стимульоване ПОЛ | 70,8 3,05 | 86,1 5,84* | 82,2 2,9 | 79,4 6,48 |
| Аскобат-стимульоване ПОЛ | 59,7 6,58 | 73,8 4,48 | 71,4 5,9 | 76,5 2,92 |
| Вільне ПОЛ | 36,3 3,43 | 66,6 5,5** | 63,0 4,6 | 55,5 1,34 a |
Примітка: *- р 0,05; **- р 0,01;проти контролю, a - р 0,05; b- р 0,01; проти 2-ї дослідної групи
Особливо це виявляється у випадку вільного ПОЛ при відсутності в середовищі будь-яких ініціаторів окиснення. Введення в комбікорм курей культури дріжджів Saccharomyces cerevisiae призводить до деякого уповільнення процесу накопичення МДА, знову ж у випадку вільного окиснення ліпідів, тоді як при використанні інших стимуляторів окиснення змін практично не було відзначено.
Наявність Т-2 токсину в кормі птиці викликає практично дворазове зниження вмісту ретинолу в печінці, використані добавки пробіотиків не сприяли відновленню А-вітамінного статусу організму птиці (табл. 3.17). Трохи понизився рівень каротиноїдів у печінці птиці в присутності Т-2 токсину в кормі, хоча зміни були невірогідними.
Таблиця 3.17
Вміст вітамінів у печінці курей при Т-2 токсикозі
і добавці пробіотиків, мкг/г
| Показники | Групи курей | |||
| 1 (К) | Т-2 токсин | Т-2 токсин + Lactobacillus sp. | Т-2 токсин + Saccharomyces cerevisiae | |
| Вітамін А | 630,0 54,5 | 336,0 7,9* | 346,2 45,9** | 372,1 93,7** |
| Вітамін Е | 12,6 0,2 | 9,3 0,3* | 9,4 0,2 | 9,6 0,3 |
| Каротиноїди | 19,7 3,71 | 15,1 4,3 | 17,2 2,6 | 16,7 1,9 |
| Аскорбінова к-та | 208,0 19,8 | 236,1 10,0 | 230,8 30,0 | 267,6 23,7 |
| Дегідроаскобі- нова кислота | 88,8 12,22 | 84,0 7,21 | 76,8 12,1 | 90,7 8,06 |
| Вітамін С (АК+ДАК) | 296,9 18,2 | 320,1 9,91 | 307,6 25,8 | 357,1 17,7 |
Примітка: *- р 0,05; **- р 0,01;проти контролю, a - р 0,05; b- р 0,01; проти 2-ї дослідної групи
Підвищення активності перекисних процесів у другій групі призвело до значного (у 2,9 рази) зниження пулу глутатіону, за рахунок його активної відновленої форми, як у крові, так і в печінці птиці (табл. 3.18), тоді як концентрація окисленого глутатіону була на рівні контролю.
Використання культур мікроорганізмів Lactobacillus sp., а в більшій мірі дріжджів Saccharomyces cerevisiae, призвело до дворазового збільшення вмісту глутатіону в печінці та крові на 24%, що свідчить про позитивний вплив даних пробіотиків на функціонування даної ділянки антиоксидантного захисту.
Зниження запасів відновленого глутатіону істотно відбивається на активності всіх трьох дослідженні глутатіонзалежних ферментів, яка вірогідно підвищується при наявності в кормі Т-2 токсину (2-а дослідна група) (табл. 3.19) і постійно росте протягом досліду.
Таблиця 3.18
Вміст глутатіону в крові і печінці при Т-2 токсикозі і добавці пробіотиків
| Концентрація глутатіону | Групи курей | |||
| 1 (К) | Т-2 токсин | Т-2 токсин + Lactobacillus sp. | Т-2 токсин + Saccharomyces cerevisiae | |
| Кров, мг/мл | ||||
Відновлений | 0,3680,01 | 0,1280,01 ** | 0,2470,03 ** | 0,2630,1 |
| Окиснений | 0,3220,04 | 0,3120,05 | 0,2450,06 b | 0,211,05** b |
| Загальний | 0,6900,04 | 0,4400,05 ** | 0,4900,06 b | 0,4700,14b |
| Печінка, мг% | ||||
| Відновлений | 141,0 9,3 | 103,4 7,6** | 119,714,9 | 125,74,6 b |
Примітка: *- р 0,05; **- р 0,01;проти контролю, a - р 0,05; b- р 0,01; проти 2-ї дослідної групи
Таблиця 3.19
Активність ферментів еритроцитів при Т-2 токсикозі і добавці пробіотиків
Ферменти | Групи | Термін відбору проб після введення добавок, доба | ||
| 7 | 14 | 21 | ||
Глутатіон-пероксидаза,нМ NADPH/хв./мкг Hb | 1 | 1,16 0,17 | 1,81 0,27 | 2,34 0,41 |
| 2 | 2,14 0,39 ** | 5,80 0,81 ** | 7,82 0,86 ** | |
| 3 | 2,13 0,36 ** | 2,67 0,57 b | 2,87 0,69 | |
| 4 | - | - | 1,48 0,22 b | |
Глутатіон-редуктаза,нМ NADPH/хв./мг Hb | 1 | 9,61 1,48 | 9,97 1,25 | 8,96 1,26 |
| 2 | 16,26 0,88 ** | 16,21 0,37 ** | 13,65 3,14 | |
| 3 | 18,12 3,4 * | 18,88 4,33 * | 13,23 2,02 | |
| 4 | - | - | 12,15 1,45** | |
Глутатіон-S-трансфераза,мМ ДХНБ/хв./мг Hb | 1 | 12,21 1,49 | 15,72 3,17 | 19,64 3,13 |
| 2 | 51,27 4,63 ** | 47,63 4,62 ** | 60,90 7,56 ** | |
| 3 | 44.51 7.26 ** | 34.87 2,1 ** b | 32,13 5,65** b | |
| 4 | - | - | 32,87 6,36 b | |
Каталаза,мМ Н2О2/хв./мг Hb | 1 | 24,09 3,04 | 21,55 3,84 | 30,55 5,12 |
| 2 | 52,63 10,52 ** | 49,64 14,03 | 75,75 18,74 * | |
| 3 | 53,10 24,4 ** | 42,04 8,49 * | 47,43 7,30 | |
| 4 | - | - | 45,68 10,83 | |
Супероксид-дисмутаза,U/хв./мг Hb | 1 | 15,87 0,59 | 15,13 1,34 | 10,31 1,23 |
| 2 | 16,60 1,18 | 17,51 0,82 | 19,78 2,62 ** | |
| 3 | 21,30 1,18 ** | 17,76 0,55 | 18,841 0,48 | |
| 4 | - | - | 19,05 0,93 ** | |
Примітка: *- р 0,05; **- р 0,01;проти контролю, a - р 0,05; b- р 0,01; проти 2-ї дослідної групи
Особливо це характерно для глутатіонпероксидази, активність якої зросла через три тижні з початку внесення токсину в 3,6 рази. Це пояснюється, імовірно, тим, що підвищення концентрації перекисних сполук при індукції процесів ПОЛ призводить до активації глутатіонпероксидазної реакції, що є основним джерелом окисленого глутатіону. Зростання рівня GSН стимулює активність глюкозо-6-фосфатдегідрогенази шляхом нейтралізації інгібіруючої дії NADPH і викликає наступні відповідні реакції глутатіонпероксидазної системи. У наших дослідженнях було показано, що використання культур Saccharomyces cerevisiae і Lactobacillus sp. призводило до зниження інтенсивності накопичення перекисних продуктів окиснення ліпідів на 21-у добу досліду, що нормалізувало активність глутатіонзалежних ферментів. Так, активність GPx була навіть нижче контрольних значень (4-та дослідна група), а активність каталази, СОД, GSH-S-T були нижче від групи, яка отримувала Т-2 токсин.
Як було відзначено в попередніх наших дослідженнях при Т-2 токсикозі спостерігається постійне підвищення активності каталази та СОД в еритроцитах протягом усього досліду. Активність СОД не змінювалася в нашому досліді під впливом використовуваних пробіотиків, а от активність каталази практично поверталася до контрольних показників, зокрема, при використані культури дріжджів (табл. 3.19).
Таким чином, можна зробити висновок про те, що Т-2 токсин є екзогенним чинником ініціації вільнорадикальних процесів, що відбуваються в організмі птиці і є одним з головних проявів окисних ушкоджень при цьому. Використання культур Saccharomyces cerevisiae і Lactobacillus sp. для зниження впливу Т-2 токсину на організм курей є перспективним шляхом детоксикації кормів, завдяки гальмуванню процесів перекисного окиснення ліпідів і нормалізації активності антиоксидантних ферментів в організмі. Відомо, що ознакою токсичної поразки організму є зміна стану та конформаційних властивостей мембран еритроцитів. Так, у 2-й групі курей, де в корм вносився Т-2 токсин, відзначено тенденцію до зниження вмісту гемоглобіну в крові і кількості еритроцитів у порівнянні з контрольною групою. При цьому вміст гемоглобіну становив відповідно 78,07,99 проти 98,810,5 г/л, а кількість еритроцитів 2,50,28 проти 3,10,4 тис. в 1мм3. В умовах введення пробіотиків на фоні Т-2 токсикозу спостерігалося поліпшення гематологічних показників крові. Так, на 21-у добу в 4-й дослідній групі відзначене збільшення рівня гемоглобіну на 19 % у порівнянні з 2-ю групою (95,7 2,03 г/л) і на 13 % - кількості еритроцитів (2,90,08 тис. в 1мм3), а при використанні Lactobacillus sp. (3-а група) відзначено збільшення вмісту гемоглобіну на 15 % (92,01,10 г/л) і на 7 % - кількості еритроцитів (2,7 0,06 тис. в 1мм3). Таким чином, використання пробіотиків сприяло нормалізації клінічної картини крові дослідної птиці. Відомо, що різні зміни структури еритроцитів відбиваються на властивостях їхньої клітинної мембрани й у значній мірі визначають електричні характеристики клітини (табл. 3.20).
Таблиця 3.20
Динаміка біофізичних показників еритроцитів при Т-2 токсикозі
і добавці пробіотиків
| Показники | Групи | Термін відбору проб після введення добавок, доба | ||
| 7 | 14 | 21 | ||
| Сила струму пробою мембрани, mkА | 1 | 241,05 10,7 | 231,3 3,61 | 244,5 4,21 |
| 2 | 257,30 14,8 | 240,8 2,52 * | 282,2 3,42 ** | |
| 3 | 227,27 3,5 b | 237,1 2,67 a | 230,3 6,47 a | |
| 4 | - | - | 270,9 2,89** a | |
| Напруга пробою мембрани, mV | 1 | 0,63 0,03 | 0,60 0,017 | 0,7 0,01 |
| 2 | 0,67 0,04 | 0,65 0,006 ** | 0,7 0,01 ** | |
| 3 | 0,59 0,01c | 0,69 0,006 ** a | 0,6 0,20** a | |
| 4 | - | - | 1,0 0,01** a | |
| Опір цитоплазми, Ом | 1 | 1,56 0,29 | 2,72 0,073 | 1,4 0,12 |
| 2 | 1,14 0,23 | 1,79 0,068 ** | 1,2 0,05 | |
| 3 | 1,34 0,15 | 1,23 0,085 ** a | 1,2 0,09 a | |
| 4 | - | - | 1,1 0,07 ** a | |
Примітка: *- р 0,05; **- р 0,01;проти контролю, a - р 0,05; b- р 0,01; проти 2-ї дослідної групи
Зміна структури клітинної мембрани, викликана різними факторами, і, в першу чергу, активацією процесів перекисного окиснення ліпідів (табл. 3.16), істотно впливає на величину електричного пробою та електричної ємності мембрани (табл. 3.20). Показано, що при розвитку Т-2 токсикозу відбувалися значні зміни електричних властивостей мембран еритроцитів, обумовлених зниженням їхньої стійкості і підвищенням проникності. Уже на ранніх етапах розвитку Т-2 токсикозу відбувалося вірогідне підвищення величини струму і напруги електричного пробою мембрани еритроцитів, і ці показники залишалися високими протягом усього досліду, а також зниження показників питомого опору і відносної провідності цитоплазми клітин. Ці дані підтверджувалися і посиленням кислотного гемолізу еритроцитів (табл. 3.21).
Ці дані свідчать про те, що Т-2 токсин призводить до порушення зниження цілісності мембран не тільки загальної популяції еритроцитів, а й "молодих", найбільш стійких клітин.
