Українська академія аграрних наук
| Вид материала | Документы |
- Українська академія аграрних наук, 516.21kb.
- Українська академія аграрних наук, 468.19kb.
- Українська академія аграрних наук, 349.15kb.
- Українська академія аграрних наук, 2736.22kb.
- Українська академія аграрних наук Інститут птахівництва Шаповалов Сергій Олегович, 510.49kb.
- Українська академія аграрних наук, 314.53kb.
- Міністерство агропромислової політики україни українська академія аграрних наук інститут, 1034.09kb.
- Державний комітет україни по земельних ресурсах міністерство сільського господарства, 589.46kb.
- Національний науковий центр „інститут аграрної економіки” національної академії аграрних, 319.01kb.
- Програма для вищих аграрних закладів освіти ІІІ іv рівнів акредитації із спеціальності, 165.25kb.
Динаміка активності каталази у печінці гусей і особливо качок, як і ембріонів курей (табл. 3.4 і 3.5) характеризується тенденцією до підвищення її активності в процесі розвитку з різким збільшенням на останніх етапах онтогенезу з піком при переході ембріону на легеневий тип дихання.
Аналогічна динаміка була відзначена і для інших тканин. У індиків такої закономірності не виявлено (табл. 3.6). Динаміка змін активності каталази у печінці гусаків і особливо качок, як і ембріонів курей (табл. 3.4 і 3.5) характеризується тенденцією до підвищення її активності в процесі розвитку з різким збільшуванням на останніх етапах онтогенезу з піком при переході ембріону на легеневий тип дихання. Аналогічна динаміка була відзначена і для інших тканин. У індиків такої закономірності не виявлено (табл. 3.6).
Онтогенетичні особливості антиоксидантної системи ембріонів усіх вивчених видів мають значні відмінності для печінки й мозку.
У мозку активність каталази на протязі ембріогенезу поступово та повільно підвищувалась у всіх трьох видів птиці (гусей, індиків, качок), а у добового молодняку відзначено зниження активності майже в 2 рази в порівнянні з ембріонами.
Таблиця 3.3
Активність глутатіонпероксидази в тканинах ембріонів курей, U/год/мг білку
Тканини | Доба інкубації ембріонів | ||||||||
| 14 | 16 | 18 | 20 | Вивід | Добові | ||||
Загальна GPx | |||||||||
| Печінка | 430,7 29,62 | 363,2 30,11 | 245,3 20,16 | 179,5 15,12 | 246,7 21,13 | 478,2 45,6 | |||
| Мозок | 140,2 13,7 | 233,7 20,1 | 236,1 18,7 | 280,4 22,1 | 487,7 41,1 | 560,8 48,0 | |||
| Ніжні м'язи | 515,9 42,3 | 420,6 31,1 | 148,5 11,9 | 84,1 7,12 | 76,5 5,23 | 477,7 43,3 | |||
| Грудні м'язи | 432,3 29,3 | 429,9 36,1 | 155,8 13,2 | 140,2 13,7 | 112,2 9,22 | 420,6 37,7 | |||
| Мембрана жовткового міхура | 362,4 3,12 | 201,9 18,6 | 199,0 15,2 | 168,4 12,1 | 171,4 16,3 | 227,4 31,1 | |||
| Грудні м'язи | 432,3 29,3 | 429,9 36,1 | 155,8 13,2 | 140,2 13,7 | 112,2 9,22 | 420,6 37,7 | |||
| Нирки | - | 487,0 41,5 | 171,4 14,1 | 181,4 15,1 | 463,3 40,6 | 731,0 62,3 | |||
Se-залежна GPx | |||||||||
| Печінка | 175,0 15,2 | 144,2 12,4 | 84,1 7,33 | 44,9 5,16 | 15,0 1,22 | 153,5 13,6 | |||
| Мозок | 52,6 4,72 | 140,2 12,2 | 118,1 10,6 | 102,0 9,44 | 109,7 8,33 | 163,6 14,8 | |||
| Ніжні м'язи | 22,4 2,17 | 175,3 16,4 | 148,5 11,9 | 84,1 7,12 | 25,5 2,11 | 93,5 8,33 | |||
| Грудні м'язи | 35,1 3,02 | 93,5 8,77 | 155,8 13,2 | 42,1 4,02 | 28,0 2,66 | 70,1 6,13 | |||
| Мембрана жовткового міхура | 25,9 2,14 | 33,7 3,16 | 113,1 10,7 | 42,1 3,77 | 23,4 2,11 | 18,7 1,73 | |||
| Нирки | - | 369,0 33,1 | 62,3 5,13 | 33,0 2,95 | 329,2 31,1 | 170,2 15,1 | |||
Se-незалежна GPx | |||||||||
| Печінка | 255,7 24,6 | 219.0 20.13 | 161.2 17.22 | 134.6 12.64 | 231.8 22.19 | 324.7 30.33 | |||
| Мозок | 87,6 7,14 | 93.5 8.19 | 118.1 12.12 | 178.4 16.13 | 377.9 33.14 | 397.2 35.13 | |||
| Ніжні м'язи | 493,5 48,2 | 245,4 27,1 | - | - | 51,0 4,88 | 384,2 36,6 | |||
| Грудні м'язи | 397,2 35,1 | 336,5 30,1 | - | 98,1 8,14 | 84,1 7,12 | 350,5 33,1 | |||
| Мембрана жовткового міхура | 336,5 30,4 | 168,2 15,2 | 85,9 7,16 | 126,4 11,1 | 148,0 15,1 | 208,7 22,1 | |||
| Нирки | - | 118,1 14,3 | 109,1 11,6 | 148,4 12,1 | 134,1 12,6 | 560,8 50,1 | |||
Таблиця 3.4.
Активність антиоксидантних ферментів у тканинах ембріонів гусей
Тканина | Доба інкубації | ||||||||||
| 15 | 20 | 23 | 28 | Добові гусенята | |||||||
| Супероксиддисмутаза, U/хв/мг білку | |||||||||||
| Мозок | 23,2 1,0 | 15,2 0,6 | 20,9 1,6 | 23,9 2,4 | 25,2 1,7 | ||||||
| Печінка | 6,7 1,7 | 6,4 0,4 | 5,9 0,3 | 7,3 0,1 | 6,7 0,1 | ||||||
| Грудні м`язи | 21,4 3,3 | 17,5 0,7 | 24,4 3,0 | 29,1 1,7 | 27,0 0,2 | ||||||
| Нирки | 12,8 0,5 | 13,6 0,1 | 15,7 1,8 | 19,0 0,1 | 20,7 0,6 | ||||||
| Каталаза, мМ Н2О2/год/мг білку | |||||||||||
| Мозок | 80,3 5,4 | 124,8 5,6 | 117,3 0,5 | 164,5 36,0 | 103,7 35,0 | ||||||
| Печінка | 297,3 24,6 | 426 2,7 | 331,8 18,3 | 363,3 43,0 | 333,0 91,5 | ||||||
| Грудні м`язи | 374,5 11,3 | 221 52,5 | 209,9 33,2 | 481,7 72,5 | 424,5 31,2 | ||||||
| Нирки | 569,5 0,9 | 654,3 18,9 | 806 45,0 | 904,5 42,4 | 499,3 17,8 | ||||||
| Глутатіонпероксидаза, U/год/мг білку | |||||||||||
| Мозок | 318,6 12,2 | 383,7 10,6 | 413,6 4,6 | 570 13,1 | 741,5 19,5 | ||||||
| Печінка | 492,1 13,9 | 315,4 2,4 | 283,4 4,0 | 224,6 3,4 | 513,0 2,4 | ||||||
| Грудні м`язи | 203,7 5,9 | 89,5 6,5 | 90,1 5,2 | 98,8 8,2 | 237,4 11,2 | ||||||
| Нирки | 552,8 4,0 | 201,9 5,3 | 278,3 21,5 | 604,3 12,7 | 714,9 13,5 | ||||||
Слід підкреслити, що активність каталази у печінці ембріонів індиків і гусей була вищою, ніж у ембріонів курей. Це може бути пояснено значно меншим рівнем вітаміну Е, як природного антиоксиданту, у печінці індиків в порівнянні з курми. Така ж закономірність відзначена і для інших тканин цих двох видів птиці. На перших етапах інкубації активність каталази, в порівнянні з ембріонами, нижча середини та останніх днів інкубації, тоді як і глутатіонпероксидазна активність збільшується на протязі всього ембріогенезу в усіх видів птиці (табл. 3.4 - 3.6). Активність супероксиддисмутази в тканинах індиків, гусаків та качок була високою на протязі всього терміну розвитку ембріонів і мало залежала від віку ембріонів. На відміну від цих видів птиці в печінці перепелів, як і курей, активність цього ферменту на протязі ембріогенезу поступово збільшувалась: з 7,6 до 10,6 U/хв./мг білку.
Таблиця 3.5
Активність антиоксидантних ферментів у тканинах ембріонів качок
-
Тканина
Доба інкубації
13
21
25
Добові
каченята
Супероксиддисмутаза, U/хв/мг білку
Мозок
18,7 3,4
32,1 6,3
12,2 1,7
14,4 0,2
Печінка
11,1 0,4
11,9 2,4
9,0 0,1
9,2 0,1
Грудні м`язи
50,8 1,0
23,6 1,1
19,6 0,4
26,1 0,5
Нирки
-
27,8 0,1
21,6 0,9
23,2 0,4
Каталаза, мМ Н2О2/год/мг білку
Мозок
64,7 3,8
96,0 30,5
109,4 1,2
89,3 47,0
Печінка
199,6 28,0
236,5 25,0
423,6 17,6
295,5 60,0
Грудні м`язи
307,0 13,0
324,9 25,0
109,5 18,5
68,8 23,0
Нирки
-
93,3 15,3
219,9 7,5
224,7 10,0
Глутатіонпероксидаза, U/год/мг білку
Мозок
445,4 7,2
463,7 10,6
409,7 8,3
524,1 34,7
Печінка
557,9 35,8
326,1 17,6
133,6 0,1
582,3 22,4
Грудні м`язи
439,8 14,1
237,4 6,9
126,8 16,4
476,7 10,2
Нирки
-
224,7 10,5
432,0 0,9
518,6 7,8
Таблиця 3.6
Активність антиоксидантних ферментів у тканинах ембріонів індиків
-
Тканина
Доба інкубації
13
21
25
Добові
індиченята
Супероксиддисмутаза, U/хв/мг білку
Мозок
26,9 1,5
12,4 0,1
8,8 1,0
25,9 0,3
Печінка
9,2 2,4
10,0 0,1
10,5 0,3
10,5 0,1
Грудні м`язи
18,3 3,5
16,5 1,6
21,0 1,0
22,0 0,2
Нирки
-
19,8 2,2
24,6 0,4
26,5 0,2
Каталаза, мМ Н2О2/год/мг білку
Мозок
35,9 4,5
30,1 18,5
60,2 10,0
31,8 9,5
Печінка
350,1 26,5
160,2 24
304,5 4,0
111,1 6,5
Грудні м`язи
92,8 0,5
15,3 3,0
31,8 4,5
198,1 53,5
Нирки
-
203,9 5,5
203,9 49,0
188,8 22,5
Глутатіонпероксидаза, U/год/мг білку
Мозок
213,423,24
346,93,5
473,02,3
664,9 45,6
Печінка
647,815,0
529,255,1
682,11,2
775,414,6
Грудні м`язи
650,625,2
399,38,4
514,217,6
543,914,9
Нирки
383,7 13,8
394,1 29,1
413,3 7,7
610,3 26,8
Слід особливо підкреслити той факт, що динаміка активності кожного з досліджуваних ферментів у всіх видів сільськогосподарської птиці має один і той же характер, що вказує на існування одних загальнобіологічних закономірностей формування антиоксидантної системи.
Таким чином, для різних етапів розвитку ембріонів різних видів птиці були встановлені характерні зміни активності антиоксидантних ферментів, що відображає процес формування активності цих ферментів у ранньому онтогенезі птиці. Після вивчення їх активності представляло інтерес вивчення ступеню взаємодії між активністю різних антиоксидантних ферментів у тканинах ембріонів курей та вмістом антиоксидантів і процесами перекисного окиснення ліпідів. Найвищий рівень кореляції (r>0,95), встановлено між активністю каталази і супероксиддисмутази в печінці і вмістом -токоферолу в ембріогенезі курчат: чим вищою була концентрація вітаміну Е, тим більші були показники активності цих ферментів.
Підсумовуючи вищенаведене, можна констатувати, що формування антиоксидантної системи птиці відбувається на самих ранніх етапах онтогенезу. Період їх ембріогенезу характеризується високими рівнями -токоферолу в печінці і АК у мозку при незначній активності антиоксидантних ферментів, що може свідчити про захищеність ембріонів від зовнішніх впливів. Існування відмінностей в ендогенних рівнях вітамінів С і Е в мозку і печінці, різна активність антиоксидантних ферментів і чутливість цих органів до ПОЛ свідчать про тканинні особливості функціонування антиоксидантної системи в ембріогенезі та ранньому постнатальному онтогенезі птиці.
3.1.3. Видові особливості розвитку ферментативної антиоксидантної системи ембріонів сільськогосподарської птиці
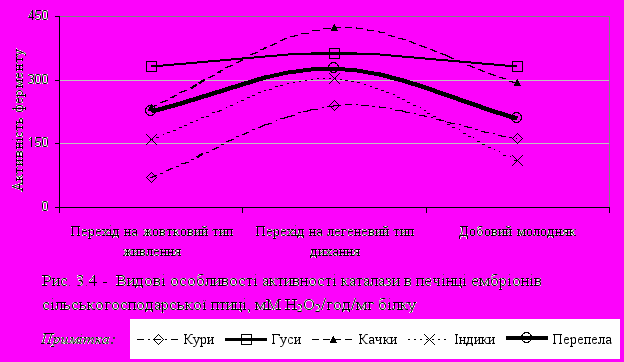
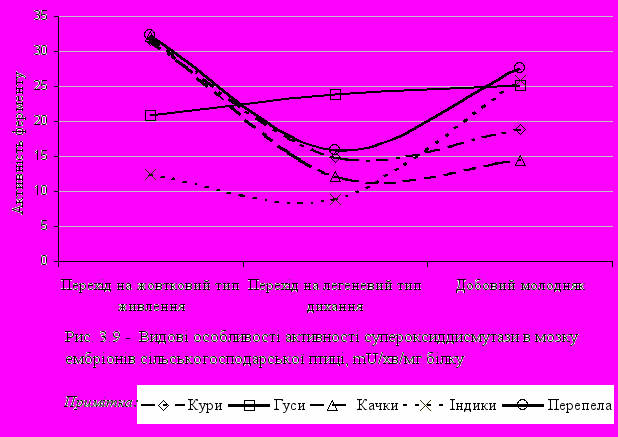
При порівняльному аналізі активності досліджуваних ферментів у тканинах ембріонів різних видів птахів було показано, що практично в усіх видів у печінці відзначається схожа динаміка. Так, активність каталази (рис. 3.4) була найбільшою при переході ембріону на легеневий тип дихання. Менш виражено це було в ембріонів гусей. Слід зазначити, що найбільша активність каталази як при переході з білкового типу живлення на жовтковий, так і на виводі молодняку була у водоплавної птиці – качок і гусей.
Активність каталази у ембріонів перепелів була нижча активності ембріонів гусаків, качок, але вища, ніж у ембріонів курей.
П
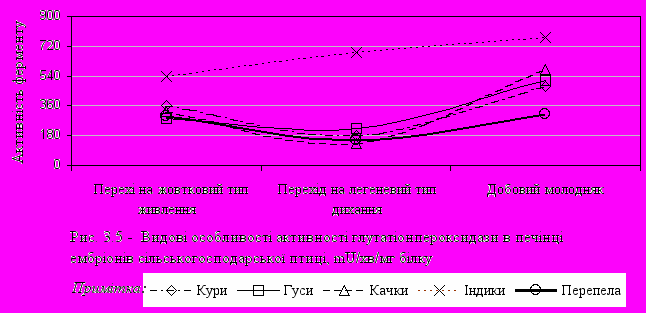
ротилежна тенденція спостерігається при порівнянні активності глутатіонпероксидази. Так, на рис. 3.5 показано, що при переході ембріону на легеневий тип дихання активність цього ферменту знижується більше, ніж у 2 рази, а при виводі - підвищується. Виняток складає показник активності GPx у ембріонів гусей, де протягом усього досліджуваного періоду вона підвищується майже в 1,5 рази. Різна динаміка двох пероксидаз (каталази і GPx) у печінці, ймовірно, пояснюється тим, що GPx більш ефективно працює при низьких концентраціях перекисів, в той же час у захисті клітин від окисного стресу, викликаного високими концентраціями перекису водню, ключова роль належить каталазі [89].
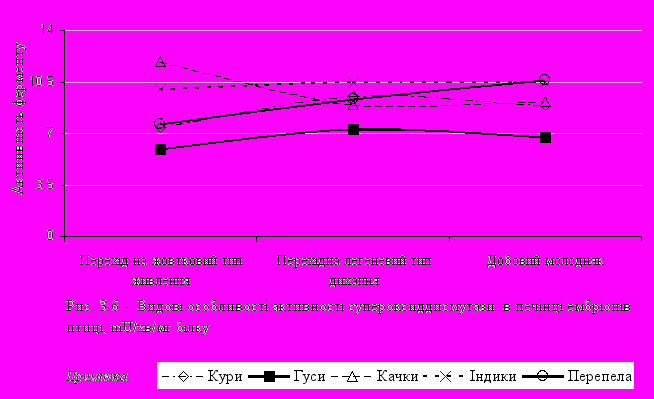
Таким чином, можна висловити припущення про те, що при переході ембріонів на легеневий тип дихання в печінці відбувається інтенсивне накопичення продуктів ліпопероксидації. Вивчення активності СОД у печінці показало, що найменша активність цього ферменту була у ембріонах гусей (рис. 3.6).
Т
аким чином, відзначена в наших дослідженнях підвищена активність каталази і GPx і різна активність СОД у формуванні антиоксидантної системи в ембріогенезі обумовлена специфічною функціональною активністю даної системи. Відзначено підвищення активності СОД у печінці ембріонів перепелів на момент виводу.
О

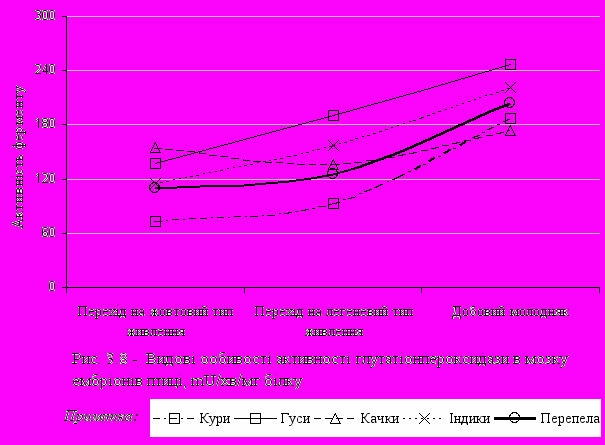
собливої уваги заслуговує вивчення ферментативної активності антиоксидантної системи мозку. Так, на рис. 3.7 показано, що активність каталази вище у ембріонів гусей та качок у порівнянні із куріними видами, така ж закономірність була раніше описана й для печінки. У ембріонів курей при переході на легеневий тип дихання активність каталази знижується і залишається на однаковому рівні аж до виводу. Активність GPx у мозку підвищується в усіх видів сільськогосподарської птиці (рис. 3.8).
Можливо, це є особливістю обміну речовин цієї тканини, що властиво всій птиці в період ембріонального розвитку. При порівнянні активності СОД у мозку в усіх видів сільськогосподарської птиці (рис. 3.9), спостерігалася тенденція до зниження активності СОД при переході ембріону на легеневий тип дихання і підвищення активності досліджуваного ферменту до моменту виводу. Виняток склали показники активності СОД у ембріонах гусей, в яких вони з моменту виводу збільшилися на 5 mU/хв/мг білку.
Таким чином, виявлені загальнобіологічні особливості розвитку антиоксидантного захисту у різних видів сільськогосподарської птиці та показана тканиноспециіфчність в активності антиоксидантних ферментів.
3.2. Видові особливості розвитку антиоксидантної системи дорослої птиці
Результати вивчення видових особливостей функціонування окремих ланок антиоксидантної системи дорослої птиці свідчать про те, що швидкість процесів ПОЛ, яку оцінювали по вмісту МДА в еритроцитах, найбільша в організмі перепелів і індиків у порівнянні з іншими видами птиці (табл. 3.7). Можливо, це може бути пояснене тим, що у перепелів значно активніше проходять всі процеси обміну речовин, а у індиків відзначено знижений вміст основних нативних антиоксидантів - -токоферолу та аскорбінової кислоти. При цьому активність глутатіонредуктази та глутатіонтрансферази у перепелів вище, ніж у інших видів. Значно менше значення відіграє в антиоксидантому захисті каталаза, супероксиддисмутаза, глутатіонпероксидаза, активність яких у перепелів найменша. Як свідчать дані, наведені в табл. 3.8, у перепелів з віком відбувається посилення процесів утворення перекисів в організмі, як у печінці, так і в мозку. Тканинні особливості при цьому зберігаються.
Таблиця 3.7
Вміст МДА (нМ/г тканини) та активність антиоксидантних ферментів в еритроцитах різних видів птиці
| Показники | Кури | Індички | Гуси | Перепели |
| МДА (Fe++-залежне ПОЛ) | 121,8 8,3 | 170,1 6,4 | 122,1 3,9 | 199,5 4,3 |
| МДА (АК-залежне ПОЛ) | 118,5 6,4 | 162,2 1,7 | 109,3 4,2 | 144,3 4,5 |
| МДА (вільне ПОЛ) | 107,4 5,4 | 102,5 8,9 | 87,3 1,47 | 72,3 2,9 |
Глутатіонпероксидаза,нМ NADPH/хв./мкг Hb | 3,73 0,51 | 4,89 0,95 | 7,64 1,79 | 2,43 0,16 |
| Глутатіонредуктаза, нМ NADPH/хв./мг Hb | 8,55 1,30 | 15,4 3,20 | 10,2 1,80 | 16,9 2,98 |
| Глутатіон-S-трансфераза, мМ ДХНБ/хв./мг Hb | 10,87 2,2 | 13,8 0,16 | 12,5 6,11 | 21,61 4,6 |
| Каталаза, мМ Н2О2/хв./мг Hb | 24,74 2,4 | 22,3 1,90 | 24,2 2,33 | 16,75 3,1 |
| Супероксиддисмутаза, U/хв./мг Hb | 26,64 0,5 | 24,43,70 | 25,8 2,31 | 13,12 2,2 |
Інтенсивність перекисного окиснення ліпідів у дорослих перепелів мала наступну закономірність щодо досліджуваних органів: мозок серце м'язи печінка еритроцити. Активність антиоксидантних ферментів у дорослих перепелів була в одному діапазоні з активністю у курей і індиків. Так, активність GPx склала - 2,430,168 нМоль NADPH/хвмкг Hb, активність глутатіонредуктази - 16,902,98 нМоль NADPH/хвмг Hb, глутатіонтрансферази - 21,61 4,62 мкМоль ДХНБ/хвмг Hb, каталази - 16,753,16 мкМоль Н2О2/хвмг Hb, активність СОД- 13,122,21 U/хв мг Hb.
Таблиця 3.8
Рівень МДА в тканинах перепелів, нМ/г тканини
Тканини | Fe – стимульоване ПОЛ | АК – стимульоване ПОЛ | ВільнеПОЛ |
Добовий молодняк | |||
| Печінка | 142,5 2,7 | 111,0 3,9 | 79,5 10,1 |
| Мозок | 487,5 3,9 | 450,2 2,5 | 376,5 1,2 |
Дорослі перепели | |||
| Еритроцити | 199,5 4,30 | 144,3 4,56 | 72,3 2,90 |
| Печінка | 269,4 6,71 | 228,6 8,03 | 162,9 10,84 |
| Серце | 506,1 45,58 | 286,8 34,73 | 137,1 19,14 |
| Мозок | 924,0 18,8 | 598,2 13,31 | 452,1 93,52 |
Слід відзначити, що вміст токоферолу, ретинолу, аскорбінової кислоти і глутатіону, тобто головних жиро- і водорозчинних антиоксидантів організму у перепелів значно вище, ніж у курей (більше, ніж у 2 рази) і особливо у індиків. Це також свідчить про високий рівень обмінних процесів у тканинах перепелів.
Так, вміст вітаміну А в печінці препелів склав 728,0 89,8; каротиноїдів - 17,24 1,3 мкг/г тканини; вітаміну С в печінці й мозку 315,06 26,7 і 400,60 14,74 мкг/г тканини відповідно, відновленого глутатіону - 149,3 6,82 і 32,2 2,37 мг% відповідно. Ці дані знаходять своє підтвердження в інших роботах. Так, було показано, що аналіз вмісту каротиноїдів і вітаміну А в жовтку каліброваних за масою яєць різних видів сільськогосподарської птиці свідчить про те, що найбільша концентрація вітаміну А виявляється в жовтку перепелиних яєць, де вона в 2-2,5 рази вище, ніж у жовтку яєць інших видів птиці. При цьому концентрація каротиноїдів у жовтку перепелиних яєць істотно не відрізняється від такої у курей. Рівень вітаміну А в жовтку курячих, індичачих і гусячих яєць вірогідно не розрізнявся. Найвища концентрація вітаміну Е відзначена в жовтку перепелиних яєць, трохи нижче вона була у курей. Яйця інших видів домашніх птахів мали рівень -токоферолу в 3-6 разів менше [42].
3.3. Вивчення впливу мікотоксинів на антиоксидантну систему ембріонів курей і дорослої птиці
3.3.1. Вплив Т-2 токсину, зеараленону, аурофузарину на інтенсивність ПОЛ і активність антиоксидантних ферментів курей
Практично всі три досліджуваних мікотоксини виявили могутні прооксидантні властивості, що виражалися в вірогідному збільшенні вмісту кінцевого продукту перекисного окиснення ліпідів – малонового діальдегіду (табл. 3.9).
Таблиця 3.9
Вплив різних мікотоксинів на концентрацію МДА, нМ /г тканини
Групи | Перекисне окиснення ліпідів | ||
| Fe++-залежне ПОЛ | Аскорбат-залежне ПОЛ | ВільнеПОЛ | |
| 1 (К) | 231,3 7,04 | 175,8 5,60 | 85,5 9,87 |
| Т-2 токсин | 360,6 23,08 | 264,9 6,61 | 173,7 9,00 |
| Аурофузарин | 286,2 15,45 | 216,0 18,51 | 138,0 9,00 |
| Зеараленон | 302,1 4,05 | 202,2 12,98 | 115,2 3,56 |
*- р 0,05; **- р 0,01; при U - 0,05; тпорівняно з контролем
Нами показано, що Т-2 токсин, аурофузарін і зеараленон викликають цілий ряд реакцій окисного стресу. Наслідком цього впливу є зниження або порушення функціонування захисних систем організму і розвиток окисного ушкодження тканини. Найбільший вплив на накопичення МДА було виявлено при Т-2 токсикозі, концентрація якого була вище в 2 рази при нативних процесах ПОЛ і в 1,5 рази при стимуляції іонами Fe2+ і аскорбіновою кислотою. Меньш сильний вплив на процеси перекисного окиснення ліпідів, у порівнянні з Т-2 токсином, виявили аурофузарин і зеараленон. У наших дослідженнях було показано, що введення аурофузарину до корму призводить до вірогідного підвищення рівня малонового діальдегіду в печінці курей: нативне або вільне ПОЛ при дії цього мікотоксину збільшилося більше, ніж на 40%. Дані, представлені в таблиці 3.9, свідчать про стійке підвищення інтенсивності процесів ПОЛ в групі, що одержувала з кормом зеараленон. Це виражалося в підвищенні рівня Fe++- і аскорбат-стимульованого ПОЛ на 15-35% (р 0,01) через 30 днів з початку введення токсину. Ці результати погоджуються з даними літератури, де відзначено підвищення ПОЛ до 87% (р 0,05) на 70-ту добу введення токсину, що пов'язують з високим вмістом ліпідів у печінці і підвищенням відносної маси печінки на 62% у порівнянні з контролем [66]. Проведеними дослідженнями встановлено, що введення мікотоксинів у раціон курей активізує функціонування глутатіонової гілки антиоксидантного захисту організму, що виявляється в підвищенні активності ферментів при Т-2 токсикозі, зеараленон- і аурофузаринтоксикозі. Таблиця 3.10.
Активність ферментів еритроцитів при мікотоксикозах
| Фермент | Група | Час відбору зразків після початку введення токсинів, доба | ||
| 14 | 21 | 30 | ||
| Глутатіон- пероксидаза, (нМ NADPH/мкг Hb) | 1 (К) | 3,45 1,46 | 2,03 0,57 | 2,88 0,57 |
| Т-2 токсин | 6,76 0,71 * | 7,62 1,88 ** | 8,67 1,43 *** | |
| аурофузарин | 3,96 0,68 | 3,85 1,20 | 5,23 1,19 | |
| зеараленон | 7,65 0,60 ** | 8,26 3,14** | 8,12 1,64 ** | |
| Глутатіон- редуктаза, (нМ NADPH/мг Hb) | 1 (К) | 1,40 0,62 | 1,76 0,53 | 2,08 0,46 |
| Т-2 токсин | 7,62 0,9 ** | 5,73 1,29 ** | 7,33 2,05 * | |
| аурофузарин | 3,69 1,18 | 3,51 1,30 | 4,46 3,74 | |
| зеараленон | 4,01 0,2 ** | 4,14 1,53 | 3,09 0,61* | |
| Глутатіон- трансфераза, (мкМ ДХНБ/мг Hb) | 1 (К) | 28,98 2,94 | 21,54 3,73 | 22,84 1,16 |
| Т-2 токсин | 61,6 8,9 ** | 42,88 7,91 * | 34,04 4,97 * | |
| аурофузарин | 32,14 3,14 | 23,76 9,07 | 29,47 4,69 | |
| зеараленон | 58,1 8,5 ** | 41,48 9,00 | 39,60 9,15 | |
| Каталаза, (мкМ Н2О2/мг Hb) | 1 (К) | 34,41 8,12 | 35,42 5,47 | 49,28 7,40 |
| Т-2 токсин | 69,51 11,3 * | 87,08 27,20 * | 83,26 5,9 ** | |
| аурофузарин | 69,8512,5 * | 78,518,98 ** | 63,853,10 * | |
| зеараленон | 83,16 25,2 * | 64,06 17,08 | 64,74 2,53 * | |
| Супероксид- дисмутаза, (U/мг Hb) | 1 (К) | 28,30 1,78 | 28,43 1,37 | 28,55 0,60 |
| Т-2 токсин | 35,820,18 ** | 37,93 2,18 ** | 41,76 3,35 ** | |
| аурофузарин | 31,35 1,78 | 31,77 1,15 | 31,36 1,20 * | |
| зеараленон | 30,51 1,36 | 33,42 2,30 | 34,22 1,03 ** | |
*- р 0,05; **- р 0,01; при U - 0,05; тпорівняно з контролем
Встановлено, що на 14-у добу введення токсинів (табл. 3.10) найбільша активність глутатіонзалежних ферментів відзначена при Т-2 токсикозі (р0,01).
Через 7 днів зберігалася та сама тенденція, однак максимальна активність глутатіонпероксидази була в групі, що одержувала зеараленон. На 30-ій добі введення токсинів відзначається вірогідне підвищення активності глутатіонпероксидази в 4 рази при Т-2 токсикозі і зеараленонтоксикозі. Слід зазначити, що з 14-ї до 30-ї доби введення токсинів, спостерігається вірогідне постійне підвищення активності глутатіонпероксидази при Т-2 токсикозі. Активність глутатіонредуктази була найбільша при Т-2 токсикозі. Однак у групі, що одержувала зеараленон, на 30-у добу спостерігається зниження активності цього ферменту в порівнянні з 14-ю та 21-ю добою (табл. 3.10). Крім цього встановлено підвищення активності глутатіонтрансферази. Відомо, що глутатіон-S-трансфераза бере участь у знешкодженні мікотоксинів, каталізуючи реакцію їхньої кон'югації з GSH [248]. Цей факт був підтверджений в наших дослідженнях, у яких відзначена більш висока активність цього ферменту в еритроцитах при зеараленонтоксикозі та Т-2 токсикозі.
Однак активність глутатіонтрансферази при зеараленонтоксикозі знижується на 30-у добу. Підвищення активності глутатіон-S-трансферази в присутності зеараленону та Т-2 токсину може бути використано як маркер при діагностиці і профілактиці цих мікотоксикозів. Показано, що дія аурофузарину на організм характеризується підвищенням активності глутатіонзалежних ферментів в еритроцитах протягом всіх етапів дослідження при одночасному зниженні пулу відновленого глутатіону. Відзначено вірогідне підвищення активності каталази в еритроцитах. При цьому максимальна активність ферменту спостерігалася на 21-у добу введення токсину, коли показники активності були підвищені на 55 % у порівнянні з контролем. Показано незначне підвищення активності супероксиддисмутази. Можливо, в організмі при дії аурофузарину накопичуються переважно перекиси та гідроперекиси, а не вільні форми кисню. Підвищення активності глутатіонзалежних ферментів є важливим фактором запобігання порушення цілісності еритроцитарних мембран і підтримки пулу відновленого глутатіону, дія якої використовується для знешкодження вільних радикалів, що утворилися при активації процесів ПОЛ. Активація зеараленоном процесів ПОЛ узгоджуються з даними інших досліджень, що відзначають дезинтегруючий вплив зеараленону на якісний склад і кількісний вміст фосфоліпідів у мембранах клітин [49]. Вивчення функціонального стану синоптичних структур показало, що зеараленон ушкоджує мембрани гладком’язових волокон [104].
Імовірно, що накопичення продуктів пероксидації відбилося на ферментативній активності антиоксидантних ферментів. Так, спостерігалося підвищення активності в еритроцитах глутатіонзалежних ферментів при введенні зеараленону, а саме: GPx на 14-у добу – в 2 рази, на 21-у і 30-у добу - в 4 рази, глутатіонредуктази в середньому в 4 рази на 14-21-у добу. Це співпадає з даними про зниження пулу відновленого глутатіону в еритроцитах у 1,5 рази в цей термін (табл. 3.11). Активність GSH-S-T - ферменту, що здійснює детоксикацію багатьох ксенобіотиків шляхом їхньої кон'югації з глутатіоном [35], залишається вище контролю в 2 рази протягом усього досліду. У той же час, підвищення активності СОД було вірогідно тільки на 30-у добу введення зеараленону, тоді як активність каталази, що більш чутлива до дії гідроперекисей ліпідів у порівнянні із СОД, на 14-у добу була вище в 2,5 рази, на 21-у добу - в 2 рази, на 30-у добу – в 1,3 рази, що свідчить про зниження рівню вільнорадикального окиснення ліпідів при тривалому введенні токсину. Встановлено, що у курей, які отримували з кормом досліджувані мікотоксини, рівень GSH в еритроцитах був вірогідно нижче контролю (табл. 3.11).
Таблиця 3.11
Вміст глутатіону в еритроцитах і печінці при мікотоксикозах
Концентраціяглутатіону | Групи курей | |||
1 (К) | Т-2 токсин | Аурофузарин | Зеараленон | |
Еритроцити, мг/мл | ||||
| Відновлений | 0,309 0,04 | 0,1450,02** | 0,198 0,02** | 0,200 0,20** |
| Окиснений | 0,410 0,02 | 0,380 0,07 | 0,239 0,04** | 0,360 0,02* |
| Загальний | 0,720 0,09 | 0,530 0,01* | 0,437 0,04** | 0,560 0,05* |
Печінка, мг% | ||||
| Відновлений | 140,9 17,3 | 98,6 8,3 * | 109,64 12,9 | 116,8 1,10 |
*- р 0,05; **- р 0,01; при U - 0,05; тпорівняно з контролем
Можливо, це пов'язано з активною витратою GSH у процесах антиокисного захисту, тому що відновлена форма глутатіону відіграє важливу роль у детоксикації різних токсинів в організмі. Відновленню вихідного рівня GSH сприяє підвищення активності глутатіонредуктази і глутатіонпероксидази, що найбільш виражено при Т-2 токсикозі. Разом з тим виявлено зниження окисленої форми глутатіону при мікотоксикозах, що може бути пояснено незворотним використанням усіх форм глутатіону в реакціях кон'югації, що каталізуються глутатіонтрансферазою [248]. Оскільки глутатіон є основним компонентом окислювально-відновної буферної системи клітини, зниження його рівня відбивається на тіол-сульфідному статусі структурних і розчинних білків. При аурофузаринтоксикозі встановлена позитивна кореляція з інтенсифікацією переокиснення ліпідів, зниження таких показників як сумарний вміст відновленої (на 36%) і окисленої форм глутатіону (на 42%) у крові та печінці птиці (табл. 3.11). Загальновизнано, що GSH необхідний для нормального функціонування еритроцитів і кровотворної тканини, в той же час окиснення GSH, може викликати токсичні наслідки, що підсилять дію самого мікотоксину. Нами відзначено, що клітинний GSH бере участь в підтримці пулу відновленої форми аскорбінової кислоти - антиоксиданту, що здійснює захист елементів системи крові, який грає ключову роль серед інших водорозчинних антиоксидантів у захисті ліпопротеїдів плазми крові. Відзначене зниження пулу відновленого глутатіону в печінці на 20% при зеараленонтоксикозі, очевидно, пояснюється активними витратами його в реакціях детоксикації, що каталізує GPx. У той же час накопичення в тканинах окислених продуктів ПОЛ, зниження рівня відновленого глутатіону призводить до окисної модифікації ряду ферментів в умовах розвитку в організмі токсичних реакцій.
Таким чином, проведені дослідження показали, що низькі концентрації зеараленону при тривалому введенні в організм активізують вільнорадикальні процеси і організм птиці не справляється з підтримкою окислювально-відновної рівноваги. Це підтверджується приведеними нижче результатами вивчення рівня жиророзчинних вітамінів А, Е та каротиноїдів, що є найважливішими антиоксидантами в печінці, які прямо чи опосередковано впливають на ферментні системи детоксикації й антиоксидантного захисту організму при дії зеараленону. Підвищення активності еритроцитарних антиоксидантних ферментів при мікотоксикозах характерне при дозах токсинів, що найбільш часто зустрічаються в кормах, і які були використані в наших дослідженнях. При вищих концентраціях чи модулюванні гострих токсикозів шляхом введення токсинів через зонди відзначається різке зниження активності антиоксидантних ферментів [59]. Можливо, підвищення ПОЛ у всіх тканинах, створює стан, подібний до стресового, при якому організму необхідний час для прояву адаптивних механізмів щодо вільнорадикального впливу. З іншого боку, більш вищі дози здатні пригнічувати синтез білку [55], що, в свою чергу, знижує вироблення цілого ряду ферментів, порушуючи процеси ферментолізу різних систем.
Таким чином, отримані результати дають підставу стверджувати, що різноманітні функціональні порушення в організмі курей під дією мікотоксинів є наслідком активізації процесів перекисного окиснення ліпідів.
3.3.2. Вітамінна забезпеченість організму курей при мікотоксикозах
Виходячи з того, що вітаміни Е, С та А є найважливішими нативними антиоксидантами печінки [224], які прямо чи опосередковано впливають на ферментні системи детоксикації та антиоксидантного захисту організму від впливу вільних радикалів, що накопичуються в тканинах при дії мікотоксинів, представляє також інтерес дослідження рівня жиророзчинних вітамінів при мікотоксикозах. Антиоксидантний потенціал ліпідної фази клітини подано двома основними класами сполук: вітаміном А і його попередниками - каротиноїдами, а також -токоферолом та убіхінонами. В наших дослідженнях показано, що всі три досліджуваних мікотоксини спричиняють через місяць після початку введення значне зниження вмісту вітаміну А в печінці, його основному депо (табл. 3.12). Найістотніші зміни вмісту в печінці були відзначені при Т-2- та аурофузаринтоксикозі для ретинолу, концентрація якого не піднялася до початкового рівня навіть після 2-х тижневого виключення токсину аурофузарину з корму. В той же час варто зазначити, що в перші 14-ть діб згодовування аурофузарину рівень вітаміну не змінився, що, мабуть, пояснюється великими його запасами в печінці, а також захисною дією -токоферолу, рівень якого знизився в цій групі в цей період у 1,4 рази. Це свідчить про підвищену витрату вітаміну Е в якості антиоксиданту при активації процесів ПОЛ. Наступні відновні процеси в організмі призвели до того, що концентрація вітаміну Е поступово підвищувалася і через два тижні після зняття добавки аурофузарину практично досягла контрольного рівня.
Таблиця 3.12.
Вміст вітамінів Е, А, С та каротиноїдів в печінці курей при введенні в корм різних мікотоксинів, мкг/г
| Термін відбору проб при введенні та після Зняття добавки міко-токсинів (МК), доба | Групи курей | |||||||||
| 1 (К) | Т-2 токсин | Аурофузарин | Зеараленон | |||||||
| Вітамін С | ||||||||||
| 14 - введення МК | 201,1 20,4 | 201,9 17,3 | 190,6 16,6 | 177,3 14,5 | ||||||
| 30 - введення МК | 267,6 15,2 | 217,9 13,2 | 239,9 15,0 | 227,4 9,66 | ||||||
| 14 - зняття МК | 203,1 1,9 | 201,0 19,6 | 192,7 6,5 | 202,3 14,0 | ||||||
Вітамін А | ||||||||||
| 14 - введення МК | 533,1 24,8 | 342,2 26,1 | 532,2 18,4 | 415,6 36,3 | ||||||
| 30 - введення МК | 415,5 14,3 | 296,6 13,8 | 365,2 12,2 | 362,3 14,1 | ||||||
| 14 - зняття МК | 513,4 10,1 | 418,2 15,3 | 416,1 16,6 | 482,2 8,1 | ||||||
Вітамін Е | ||||||||||
| 14 - введення МК | 13,8 0,3 | 8,4 0,5 | 9,4 0,8 | 12,1 0,8 | ||||||
| 30 - введення МК | 14,0 0,4 | 7,7 0,6 | 12,4 1,2 | 12,8 0,8 | ||||||
| 14 - зняття МК | 13,8 0,2 | 10,3 0,3 | 13,4 0,6 | 13,2 0,7 | ||||||
Каротиноїди | ||||||||||
| 30 - введення МК | 18,3 2,4 | 16,7 2,7 | 17,5 0,23 | 16,3 0,11 | ||||||
