Українська академія аграрних наук
| Вид материала | Документы |
- Українська академія аграрних наук, 516.21kb.
- Українська академія аграрних наук, 468.19kb.
- Українська академія аграрних наук, 349.15kb.
- Українська академія аграрних наук, 2736.22kb.
- Українська академія аграрних наук Інститут птахівництва Шаповалов Сергій Олегович, 510.49kb.
- Українська академія аграрних наук, 314.53kb.
- Міністерство агропромислової політики україни українська академія аграрних наук інститут, 1034.09kb.
- Державний комітет україни по земельних ресурсах міністерство сільського господарства, 589.46kb.
- Національний науковий центр „інститут аграрної економіки” національної академії аграрних, 319.01kb.
- Програма для вищих аграрних закладів освіти ІІІ іv рівнів акредитації із спеціальності, 165.25kb.
Вітамін С. Друга за значимістю антиоксидантна система біологічних рідин - система аскорбінової кислоти (АК). Антиоксидантні властивості аскорбату визначені на функціонуванні одноелектронних циклічних переходів між дигідро-, семидигідро- та дегідро-аскорбатними формами, чому сприяють дуже рухливі протони [9]. Відновлена форма характеризується здатністю безпосередньо взаємодіяти з активними формами кисню, а також участю у відновленні інших низькомолекулярних антиоксидантів (-токоферол, GSH) за допомогою неферментативних і ензиматичних реакцій [6, 9]. У різних радикалгенеруючих системах методами хемілюмінесценції й електронного парамагнітного резонансу показано, що аскорбат - найкращий гаситель О2˙– [6]. Н2О2 може відновлюватися аскорбатом як безпосередньо, так і за допомогою ферменту аскорбатпероксидази. Аскорбат відіграє ключову роль серед інших водорозчинних антиоксидантів у захисті ліпопротеїдів крові [3]. ПОЛ, індуковане t-бутилгідропероксидом і куменгідропероксидом у мембранах еритроцитів, ефективно запобігалося введенням аскорбата в досить низьких концентраціях. Так, уже при 20 мкм вихідний рівень ПОЛ знижувався на 50%, а при 120 мкм на 93%. Ще більш вражаючі результати отримані і для інтактних еритроцитів, інкубованих з t-бутилгідропероксидом. Слід, однак, відзначити, що в крові різних донорів захисний ефект аскорбату значно варіював [8]. Імовірно, це явище вказує на генетичну детермінацію резистентності еритроцитів до вільнорадикального окиснення й у деяких ситуаціях може бути використане як інтегральний тест індивідуальної стійкості до окисного стресу. У крові і клітинах присутні всі три форми аскорбінової кислоти (відновлена, семидегідро- і дегідро-форми), однак у фізіологічних умовах рівновага дуже зміщена убік найбільш відновленого компоненту – аскорбінової кислоти. Цей стан і характеризує резервні можливості антиоксидантної буферної системи, її здатність у визначених межах стабілізувати прооксидантно-антиоксидантну рівновагу в біологічних рідинах, зв'язуючи та інактивуючи активні форми кисню: О2˙–, 'ОН [188], органічні пероксиди [68], зменшуючи кількість продуктів ПОЛ [173]. Система аскорбінової кислоти взаємодіє із системою глутатіону [27], іншими вітамінами [18], селеном [245], при цьому досягаються посилення та пролонгація дії, загальне збільшення антиоксидантної активності (рис. 1.2). Звідси випливає, що зазначені антиоксиданти здатні відновлювати токофероксильний радикал у його активну форму і, у результаті цього, навіть низькі концентрації вітаміну Е, при їхній ефективній рециклізації, здатні здійснювати ефективний антиоксидантний захист. Звичайно, концентрація вітаміну Е в мембранах клітин знаходиться у межах 0,05-0,1 мг/мг білка, це менше, ніж 1 молекула на 1000-2000 одиниць фосфоліпідів мембран. Ефективність рециклізації антиоксидантів завжди нижче 100%. Так, частина токоферолу в радикальній формі окислюється далі з утворенням токоферилхінону; дегідроаскорбінова кислота окислюється до дикетогулонової кислоти, і ці два продукти окиснення не відновлюються. Мембранний транспорт видаляє частину GSHG з місця рециклізації і тим самим позбавляє його можливості бути відновленим. Згадана втрата антиоксидантів у процесі їх рециклізації (див. рис. 1.2) свідчить про необхідність їхнього постійного надходження для підтримки фізіологічних концентрацій у клітині.
Р
токоферол
Глюкозо-
6-фосфат
NADP+
NADPH
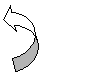
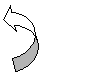
GSH
GSНG


ДАК
АК
ТФ
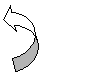
ТФ*
GSНG
GSH
Дикетогулонова кислота
втрата

Мембранний транспорт (втрата)
Токоферилхінон
(втрата)

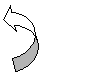

Пентозо-фосфатний цикл
 ис. 1.2. Принципова схема рециклізації антиоксидантів в організмі птиці (Packer L., 1992)
ис. 1.2. Принципова схема рециклізації антиоксидантів в організмі птиці (Packer L., 1992) пентози
+СО2
Аскорбінова кислота
Дегідроаскорбінова кислота
Велике значення мають також іони металів зі змінною валентністю, що відносяться до числа біотичних макро- та мікроелементів, входять до складу багатьох ферментних систем, виконуючи в активних центрах оксидоредуктаз каталітичну роль і безпосередньо беруть участь у здійсненні більшості окислювально-відновних реакцій. Такі метали, як Zn2+, Мо2+, Мn2+, Cu2+ і особливо Se2+ діють як фактори, що стримують розвиток вільнорадикального окиснення.
Узагальнюючи наведені дані, можна скласти деяку схему дії антиоксидантної системи організму в цілому. У живих системах постійно відбувається генерація вільних радикалів, що сприяють перекисному окислюванню ліпідів в цих процесах є невід'ємною частиною живих систем, а в деяких випадках, наприклад, при синтезі простагландинів, перекиси ліпідів необхідні. Таким чином, взаємодію між антиоксидантами і системою генерації вільних радикалів у живих системах можна представити у вигляді своєрідних терезів з дуже точним регулюванням і високою чутливістю, і навіть незначна перевага правої частини призводить до істотних порушень у багатьох життєво важливих системах, що, в остаточному підсумку, виражається у зниженні продуктивних і відтворних якостей тварин, а при більш глибоких порушеннях навіть призводить до смерті.
1.3. Формування антиоксидантної системи птиці в онтогенезі.
Формування антиоксидантної системи, що виконує захисну функцію в організмі відбувається на ранніх етапах онтогенезу. Центральне місце в цій системі належить ферментам: ліпоксигеназі, супероксиддисмутазі, каталазі, пероксидазі, глутатіонзалежним ензимам. Активність цих ферментів виявляється вже в ембріональний період, що свідчить про ранню експресію їхніх генів. Так, І.І. Руднєва-Тітова [84] показала, що прояв активності антиоксидантних ферментів спостерігається вже на ранніх етапах розвитку ікри риб, але активність їх у цей період невелика, а близькі значення середніх коефіцієнтів кореляції у різних видів риб свідчать про подібність процесів формування системи антиоксидантних ферментів і про універсальність її дії вже на ранніх етапах онтогенезу [85]. Аналогічні тенденції в динаміці активності антиоксидантних ферментів відзначені в процесі онтогенезу комах [140], амфібій [243], ссавців [198], тобто спостерігаються загальнобіологічні закономірності розвитку і функціонування елементів антиоксидантної системи.
Ембріональний розвиток птиці характеризується рядом фізіологічних особливостей, що роблять цей процес унікальною моделлю для вивчення біологічної ролі природних антиоксидантів. Насамперед, ембріональний розвиток здійснюється у відносно замкнутій системі, де відбувається лише газо- і водообмін із зовнішнім середовищем. У процесі ембріонального розвитку птиці ліпіди, що поглинаються з жовтка мембраною жовткового міхура, характеризуються високим ступенем ненасиченості. Такий стан підвищеної ненасиченості ліпідів ембріональних тканин може бути результатом переважного -окиснення насичених жирних кислот у ембріонів. Незважаючи на важливу роль ПНЖК в ембріональному розвитку птахів, сам факт підвищення їхньої концентрації в тканинах зв'язаний з підвищеною чутливістю таких тканин до ПОЛ [230]. У цілому, процес виводу курчат може розглядатися як фізіологічний стрес, пов'язаний з впливом біьш високої концентрації атмосферного кисню при переході на легеневе дихання і істотне підвищення метаболічної активності тканин [145].
У таких умовах ембріональний мозок може бути особливо чутливим до впливу вільних радикалів, оскільки тканини цього органу характеризуються найвищим ступенем поліненасиченості ліпідів [201]. Розвиток специфічного захворювання птиці у ранньому постнатальному онтогенезі (енцефаломаляція) підтверджує важливу роль вільних радикалів в ушкодженні тканин мозку [97]. Таким чином, формування ефективної антиоксидантної системи в ембріональних тканинах птиці є життєво важливою функцією не тільки у процесі ембріогенезу, але й у ранньому постнатальному онтогенезі птахів [229].
Калітка В.В. і Донченко Г.В. [47] відзначають, що в другій і третій декаді життя курчат-бройлерів їхня антиоксидантна система вимагає стимуляції екзогенними антиоксидантами, що в даний час знаходить своє вираження в 3-5-кратному збільшенні норм введення вітаміну Е у раціони сільськогосподарської птиці. У подальших дослідженнях ці автори показали ряд вікових особливостей функціонування антиокисної системи курчати в постнатальному онтогенезі in vivo та in vitro. Згідно з наведеними даними, високу супероксиддисмутазну активність в органах і тканинах добових курчат варто розглядати як компенсаторний захист при переході від гіпоксії кінця ембріонального розвитку до відносної гіпероксії перших днів життя. У ранньому постнатальному онтогенезі супероксиддисмутазна активність знижується, тоді як пероксидазна, каталазна та глутатіонпероксидазна активність зростають. Зазначені зміни досягають максимуму в 20- і 30-денному віці. Автори приходять до висновку, що недостатність захисту організму курчат від активних форм кисню в цей період призводить до зміщенню окисних процесів у бік вільнорадикальних, зменшенню концентрації ліпідів, ретинолу, інгібірування біосинтезу білка, причому інтенсифікація ПОЛ починається до зниження рівня -токоферолу в тканинах.
Дослідження Sheehy Р. і співавт. [215] по розподілу вітаміну Е в органах і тканинах курчат дозволили розташувати їх у такій послідовності: серце > легені > печінка > м'язи стегна > мозок. Авторами також був підтверджений факт підвищеної чутливості мозку до зміни Е-вітамінного статусу організму у порівнянні з іншими тканинами. У той же час Chung E.J. [132] встановив, що концентрація -токоферолу у мозку курчати мало змінюється при використанні у раціоні різних доз вітаміну Е. Добавки вітаміну Е у раціон не впливають також на розподіл вітаміну Е по тканинах мозку мишей і пацюків. Утримання пацюків на напівсинтетичному раціоні з високими рівнем n-3 поліненасичених жирних кислот викликає зниження рівня вітаміну Е в серці, печінці та внутрішньому жирі, але не в мозку. Можливо, ці відмінності характерні тільки для тканини мозку і можуть бути пояснені різним рівнем використання токоферолу цією тканиною. Зменшення ж інтенсивності процесу ПОЛ в мозку ембріону перед виводом курчат пов'язують з ростом концентрації -токоферолу в ньому у цей період. Мeydani M. [183] показали, що вітамін Е in vitro і, можливо, in vivo відіграє головну роль у захисті мозку від ПОЛ.
Жовток пташиних яєць містить жиророзчинні вітаміни А, Е, Д, К [76]. При цьому жовток перепелиних яєць відрізняється значно вищою концентрацією альфа-токоферолу у порівнянні з іншими видами сільськогосподарської птиці. Так, концентрація -токоферолу у жовтку яєць перепелів, голубів, курей, мускусних качок, українських білих качок, фазанів, гусей та індичок складала 252,4; 162,1; 110,3; 66,8; 54,6; 45,7; 45,6 і 34,9 мкг/г відповідно [42]. Такі розходження, ймовірно, відображають більш високу ефективність поглинання і транспорту вітаміну Е перепелами. Підтвердженням цьому припущенню є дані про те, що навіть при однаковому вмісті вітаміну Е у раціоні концентрація цього антиоксиданту у жовтку курячих яєць значно вище у порівнянні з яйцями індичок, качок та гусей [230]. При цьому знижена концентрація вітаміну Е у тканинах і жовтку яєць індичок пояснюється більш інтенсивним обміном цього вітаміну і, як результат, підвищеним виведенням з організму продуктів його обміну [220].
Необхідність і важливість високих концентрацій АК у мозку ембріонів була показана також і після підрахунку значень індексу вітамін С/вітамін Е (молярний рівень АК/-токоферолу) у їхніх тканинах [150]. У 17-денних курячих ембріонів цей індекс становив для мозку - 800, для печінки - 10,5; нирок - 124,5; легень - 132; м’язів - 85 і серця - 31. Після виводу курчат індекс збільшився для мозку - до 845 і зменшився для більшості інших тканин: печінки, нирок, легень, м’язів і серця - 26; 57; 52; 48 і 27 відповідно. У дорослих курей-несучок значення цього індексу для мозку зменшилось в 4 рази, порівняно з ембріонами. Ці дані вказують на те, що АК відіграє одну з ключових ролей в захисті тканин мозку ембріона від ПОЛ. Спільне ж використання АК і вітаміну Е є ще ефективнішим прийомом у захисті ПНЖК мембран від окиснення. Ці висновки узгоджуються з даними Reiber H. та ін. [202], які показали, що в гомогенатах мозку свиней АК наявна у великій кількості (більше 1 мМ/л). Зниження ж концентрації АК до рівня, меншого за 100 мкМ/л, може призвести до появи прооксидантної дії.
Рівень АК у мозку ембріонів щурів збільшується майже вдвічі за період з 15 до 21 дня вагітності і залишається на цьому рівні до моменту народження потомства [171]. У мозку плоду людини рівень АК дещо знижується наприкінці вагітності [249]. У плоду корови найбільша концентрація АК спостерігається у мозку та надниркових залозах. Введення великих доз АК (до 8%) в раціон мишей не призводило до зміни рівня цього вітаміну в мозку [194]. Певно, організм тварин здатний регулювати рівень АК в нервовій тканині у вузьких межах і можна говорити про існування механізму, який утримує наростання її концентрації в мозку.
У роботі Gaal N. та ін. [150] підсумовані результати щодо визначення концентрації деяких антиоксидантів у тканинах молодняка птиці, а також ембріонів, що розвиваються. Показані відмінності антиоксидантних систем печінки і мозку: у печінці виявлені високі рівні вітамінів А і Е, тоді як мозок характеризується високим рівнем вітаміну С. За даними цих дослідників рівень АК у мозку ембріонів курей збільшується з 3,33 нМ/мг у 12-денному віці до 4,11 нМ/мг у 15-денних ембріонів. Після цього відзначалася тенденція до незначного зниження рівня вітаміну С у процесі інкубації. Протягом ембріогенезу рівень АК знижується в усіх тканинах, за виключенням мозку і нирок, де він залишався практично незмінним. Результати вивчення аскорбат-залежного ПОЛ у печінці ембріонів курей свідчать про прискорення цього процесу на 51% з 10-ї до 14-ї діб інкубації. Надалі до моменту виводу курчат швидкість ПОЛ суттєво знижується при одночасному збільшенні вмісту альфа-токоферолу [231].
Згідно з іншими даними [82] в кінці ембріонального розвитку в тканинах ембріонів курей інтенсивність аскорбат-залежного ПОЛ збільшується, особливо в крові. Згідно з даними Noda Y. та ін. [193] відзначена характерна схильність мозку до ПОЛ в ембріогенезі курей і деяке зменшення її лише після виводу курчати. З віком інтенсивність ПОЛ у мозку наростає і кількість речовин, які реагують з тіобарбітуровою кислотою (ТБК-реактивних продуктів), у гомогенатах мозку збільшується [208]. Внутрішньочеревне введення щурам генератора вільних радикалів збільшує рівень ПОЛ у печінці, нирках, серці, але концентрація ТБК-продуктів у мозку залишається при цьому незмінною, певно завдяки наявності бар'єру кров-мозок [125].
Інтенсивність ПОЛ в гомогенаті мозку in vitro може бути знижена завдяки введенню в раціон вітаміну Е і збільшена при його дефіциті [184]. Зменшення ж інтенсивності процесу ПОЛ у мозку ембріона перед виводом курчат пов'язують з ростом концентрації -токоферолу в ньому у цей період. Meydany M. et al. [183] показали, що вітамін Е in vitro і, напевно, in vivo відіграє головну роль у захисті мозочка від ПОЛ.
Онтогенетичні особливості антиоксидантної системи ембріонів курей мають значні відмінності для печінки й мозку. Активність глутатіонпероксидази і супероксиддисмутази і концентрація Sе (як кофактора глутатіонпероксидази) були в 3-5 разів вище в печінці порівняно з мозком [232]. За даними цих авторів [227] активність каталази мозку ембріонів курей з 10-го по 19-й день розвитку була приблизно на одному рівні до 19-го дня розвитку, потім вона різко зменшувалась і залишалась на цьому рівні до моменту виводу. Активність глутатіонпероксидази збільшується у 1,6 разів з 10 по 19 день розвитку, знижується на 24% у момент виводу, а активність СОД збільшується з 10-го по 15-й день розвитку ембріону і поступово знижується до моменту виводу. Аналогічна тенденція в динаміці активності АО-ферментів відзначена в онтогенезі ссавців [198] і амфібій [244].
1.4. Вплив мікотоксинів на організм птиці та їхнє потомство
Інтенсифікація сільського господарства пов’язана з залученням у круговорот природи величезної кількості небезпечних для здоров'я людини і тварин хімічних речовин, багато з яких є ксенобіотиками. По ланцюгу повітря - ґрунт - рослина - тварина - людина мігрує близько 70 тис. ксенобіотиків, переважна більшість яких фактично не перевірена на канцерогенність, мутагенність та терратогенність [109]. Забруднення продуктів рослинного і тваринного походження мікотоксинами є одним з найважливіших деструктивних екологічних факторів. Економічний збиток, нанесений мікотоксинами, значний і визначається високим ступенем летальності і змушеним забоєм тварин, особливо при складності встановлення правильного і швидкого діагнозу; помітним зниженням їхньої продуктивності; зниженням відтворних якостей та ін. [238, 55, 210]. Проблема мікотоксикозів вивчається більш ніж у 130 країнах світу. У зв'язку з цим створення уніфікованої системи моніторингу продуктів тваринництва і рослинництва з метою оцінки контамінації мікотоксинами і впливу їх на біологічні системи організму представляє важливу проблему.
Традиційно критеріями мікотоксикозів є результати дослідження контамінантів чи їхніх метаболітів у біологічному матеріалі, а також кормах і продуктах харчування. Пошук перспективних біологічних індикаторів, маркерів негативного впливу контамінантів на біологічні системи організму повинний враховувати специфічність і високу чутливість методів [60], поряд із простотою відтворення, а також забезпечувати оцінку ступеню впливу на стан організму [210, 174].
З усіх відомих мікотоксинів найбільш розповсюдженими та небезпечними вважаються афлатоксини, охратоксини, дезоксиніваленол, зеараленон і Т-2 токсин [56]. Небезпеку для організму птиці представляють корми, забруднені продуктами життєдіяльності грибів, що відносяться до роду Fusarium, які продукують трихотеценові мікотоксини [17, 246]. Трихотецени відносяться до сильнодіючих інгібіторів синтезу протеїну в еукаріотів - грибів, рослин і тварин. Трихотецени можуть також ігібірувати синтез полінуклеотидів, однак інгібірування синтезу ДНК і РНК є вторинним ефектом, викликаним первинним блоком синтезу протеїну в клітині.
У літературі накопичені численні дані про вплив мікотоксинів на фізіолого-біохімічні процеси організму птахів. У той же час дотепер не існує загальновизнаної теорії, що розкриває особливості механізмів токсичного впливу мікотоксинів.
Т-2 токсин. Описано випадок фузаріотоксикозу курей, що характеризується зниженням поїдання корму, заплідненості яєць, зменшенням у 2,5 рази несучості, розвитком некрозів у стравоході і відходом 11 % поголів'я [149]. Вміст вітаміну А і каротину в яйцях зменшується до 1/10 та 1/3 норми, відповідно. Є опис фузаріотоксикозу у бройлерів, качок, індиків, голубів [246, 17].
Сахацький І.М. та ін. [88] вказує, що молодняк курей, які одержували Т-2 токсин, має знижений імунітет. Ishigami N. et al. [164] уперше виявили властивість цього мікотоксину індукувати в ембріонів мишей апоптоз. Дорослі кури більш стійкі до Т-2 токсину, ніж курчата. Досліди показали, що навіть при дуже високих концентраціях Т-2 токсину в кормі - 16 і 32 мг/кг - збереженість протягом 3-х тижнів становила 100%. Однак при цьому різко знизилася несучість: від 57,1 до 10% і від 77,1 до 1,4% відповідно. Більш низькі концентрації (1-8 мг/кг) також впливають на несучість птиці. Наявність Т-2 токсину в кормі негативно позначається на масі яєць, викликає зниження живої маси курей і виводимості яєць [55]. Одним із клінічних ознак Т-2 токсикозу є некротичний стоматит, що виявляється при 0,25-1,0 мг Т-2 токсину/кг корму; що відповідає мінімальному діючому рівню. Затримка росту виявляється при концентраціях - 0,6-4,0 мг/кг. Інші симптоми у курей і курчат виявляються при більш високих концентраціях Т-2 токсину. При рівні Т-2 токсину більше 0,5 мг/кг корму у курчат відзначають істотне зниження вмісту в плазмі вітаміну Е [162]. Автори висловили припущення про те, що різні рівні вітаміну Е в кормі або препаратах впливають на обмін вітаміну Е та можуть послабляти Т-2 токсикоз.
Зеараленон. Відповідно до наявних даних, дотепер залишається недостатньо вивченим характер токсичної дії мікотоксину зеараленону на структурну організацію клітинних мембран [102, 223, 239]. Зеараленон є єдиним мікотоксином, що має естрогену дію, яка супроводжується істотними порушеннями функціональної активності мембран клітин [49]. Птиця є стійкою до дуже високих (15 г/кг маси) концентрацій зеараленону. Повідомляється, що в експериментальних умовах відносно низькі концентрації зеараленону в кормі (5-10 мг/кг) значно можуть підвищувати відтворні якості птиці [224]. Специфічність такого прояву, можливо, пояснюється подібністю структури зеараленону та вітаміну Е [152]. На практиці ж наявність у кормах невеликих кількостей зеараленону викликає в птиці зниження репродуктивних якостей, зростання ембріональної смертності і загибель курячих ембріонів переважно в останні дні інкубації [2, 58].
ЛД50 зеараленону для курячих ембріонів складає 109 мкг. Не відзначається накопичення мікотоксину в яких-небудь органах і тканинах, що свідчить про відсутність кумулятивних властивостей токсину [66]. Дози зеараленону (30 і 100 мкг/ембріон) викликали аритмію, і навіть зупинку серця [241]. При вивченні впливу низьких концентрацій токсину на птицю відмічено зміну ряду біохімічних показників, у тому числі порушення вітамінного обміну і процесів перекисного окиснення ліпідів [58].
Аурофузарин. Аурофузарин - вторинний метаболіт гриба Fusarium graminearum, що відноситься до групи мікотоксинів, біологічно активним початком якого є нафтохінонова основа. Потрапляючи з кормом в організм птиці, даний мікотоксин викликає синдром погіршення якості яєць [57]. Характерними ознаками отруєння курей є зниження споживання корму, коричневе забарвлення жовтку яєць і його плямистість, білок іноді з зеленуватим відтінком. Показано прояв інгібіруючого ефекту аурофузарину в курчат на антиоксидантну систему, що виражався в активації процесів ПОЛ, зменшенні рівня вітамінів А і Е, зниженні активності каталази [20].
Стан токсикозу, викликаного аурофузарином, обумовлює розвиток імунодефицитного стану в добових курчат і викликає затримку росту [87]. Деякі гістопатологічні зміни виявлені в печінці, нирках, селезінці, сліпих відростках і залозистому шлунку [55]. М'ясо птиці, що одержувала 3% культури Fusarium graminearum (880 мг/кг аурофузарину), у порівнянні з контрольною групою містило менше білку, жиру, вуглеводів і більше води, знижений вміст суми амінокислот [34]. Однак патогенетичні механізми дії аурофузарину залишаються не з'ясованими.
1.4.1. Особливості антиоксидантного статусу організму при мікотоксикозах і способи його корекції
Переважна більшість дослідників зв'язують різні функціональні порушення в організмі під дією мікотоксинів з активізацією перекисного окиснення ліпідів. Т-2 токсин вбудовується в ліпідо- чи протеїнвміщуючі компоненти клітинних мембран. Інтерференція з функцією клітинної мембрани виявлена in vitro на еритроцитах, міобластах і фібробластах. При цьому Т-2 токсин викликає залежну від дози стимуляцію окиснення ліпідів у пацюків і мишей. Окиснення ліпідів, у свою чергу, веде до зниження рівня SH-глутатіону в печінці і/або утворення вільних радикалів.
Показано, що трихотеценові мікотоксини можуть інактивувати тіол-вміщуючі ензими [54]. У пацюків після введення в шлунок Т-2 токсину виявлено значне зниження активності лізосомальних ензимів печінки та ензимів біотрансформації цього токсину поряд зі збільшенням активності епоксидних гідролаз і UDP-глюкуронозилтрансферази [102]. Припускають, що «пусковим механізмом» у розвитку ряду патологій при мікотоксикозах є активація ПОЛ [213]. При дослідженні впливу малих доз зеараленону (1,6 мг/кг корму) на курчатах показане збільшення концентрації МДА на 87% у порівнянні з контрольною групою [58]. При дії аурофузарину також показана активація ПОЛ печінки курей [20].
Одним з напрямків зниження негативної дії мікотоксинів, що виражається в активації процесів ліпопероксидації, є застосування різних антиоксидантів. Однак дані літератури досить різноманітні і суперечливі. Дія природних і синтетичних антиоксидантів визначається їхньою здатністю зв'язувати вільні радикали при наявності процесів пероксидації, що можуть ушкоджувати тканини, і підсилювати ензиматичну детоксикацію шкідливих речовин у печінці. Так, деякі мікотоксини викликають мембранні ушкодження, збільшуючи швидкість протікання ПОЛ. Вітаміни Е, С та селен виявляють захисні властивості проти дії Т-2 токсину та дезоксиніваленолу, які індукують ушкодження мембран у пацюків [118]. Їх добавки в корм привели до збільшення рівня глутатіону та ДНК у корі головного мозку та селезінці, а дефіцит вітамінів Е, С та селену вів до їхнього зниження. Дослідження впливу цих біологічно активних речовин при Т-2 токсикозі на несучість курей показали, що підвищений вміст вітаміну Е, С и селену у кормі сприяє частковій нейтралізації несприятливого впливу Т-2 токсину [238].
При дослідженні процесів ПОЛ, викликаних афлатоксином у печінці пацюків, було виявлене збільшення рівня МДА і дієнових кон’югатів у гомогенатах печінки відразу ж на 1 день після введення токсину. Введення комплексу вітамінів Е, С та селену сповільнювали процеси ПОЛ у клітинах печінки. Результати цих досліджень показали, що афлотоксин ініціює ПОЛ в печінці пацюків, що є одним з механізмів порушення цілісності мембрани клітини. Афлотоксин виявляє виражені гепатотоксичні та гепатоканцерогенні властивості, механізм дії якого на клітинні ушкодження ще цілком не вивчений. У зв'язку з цим вважають, що активізація процесів ПОЛ - один з головних проявів окисного ушкодження, що відіграє ведучу роль при проявах токсикозів [216].
Роботи на ізольованих м'язах лабораторних тварин (стравохід, шлунок, тонка кишка, матка, сім'япровід, сечовий міхур) показали, що зеараленон значно впливає на передачу імпульсу в нервово-м'язових з'єднаннях [104]. Зміна функціонального стану гладком’язових органів, викликаних зеараленоном, носить аналогічний характер як у дослідах in vivo, так і in vitro і залежали від віку лабораторних тварин. Зміна функціонального стану синоптичних структур під дією зеараленону, очевидно, виникає насамперед у результаті його дії, що ушкоджує мембрани волокон.
Реакція кон'югації токсину з відновленою формою глутатіону, яка каталізується глутатіонтрансферазою, є одним з важливих шляхів детоксикації в організмі Т-2 токсину, а також інших трихотеценових мікотоксинів. Посилення прояву дії Т-2 токсину, що виражається в зниженні активності антиоксидантних ферментів і зниженні вмісту глутатіону в печінці, може бути зумовлено незбалансованим вітамінним живленням птиці, зокрема надлишком вітаміну А [59], тобто великі дози вітаміну А можуть підсилювати дію мікотоксинів. Досліди на культурі зародкових хондроцитів людини і водних екстрактів зерна, забруднених культурою Fusarium, показали наявність ушкоджень клітин і збільшення процесів ПОЛ. Введення селену у культуру тканини сприяє підвищенню активності СОД, зниженню ПОЛ [197]. Виявлено, що високі концентрації мікотоксинів на фоні раціону з низьким вмістом вітаміну Е та Se викликають активацію глутатіонпероксидази. Роль селену як кофактора Se-залежної Gрx виявляється в процесі детоксикації гідроперокисів ліпідів, а також у збільшенні активності Gрx. Відмічено, що селен підсилює утворення водорозчинних кон’югатів афлатоксину, що сприяє виведенню його з організму, а також росту курчат [55].
D.Hoehler і R.Marquardt [161] досліджували вплив підвищених доз вітамінів Е та С на продуктивність курчат при вмісті в їхньому кормі 4 мг/кг кристалічного Т-2 токсину. Було відзначено, що Т-2 токсин викликав значне збільшення в плазмі крові концентрації сечової кислоти, а у печінці рівня малонового діальдегіду. Введення вітамінів Е та С незначно знижувало це збільшення. Однак, на думку авторів, добавки вітамінів Е та С при Т-2 токсикозі курчат виявляють лише мінімальний ефект. Для забезпечення ефективного клітинного захисту проти окисних ушкоджень важливо повноцінне функціонування антиоксидантної системи цитоплазми і мембран клітин, у яких визначальну роль відіграє ферментативна гілка.
Серед аліментарних факторів, здатних знижувати мембранопошкоджувальну дію токсинів, варто також виділити вітаміни групи В [137] і деякі мікроелементи: мідь, цинк [178], кобальт [60]. Цілий ряд антиоксидантних ферментів містить у своєму складі мікроелементи, обмаль яких у раціоні може знижувати антиоксидантний потенціал організму в цілому. Тому, доцільність застосування комплексу мікроелементів в умовах мікотоксикозів може бути обумовлена їх здатністю підвищувати неспецифічну стійкість організму.
Одним з нових напрямків корекції порушення обміну речовин при мікотоксикозах є використання пробіотиків. Аналіз літературних даних свідчить про багатогранний вплив пробіотиків на мікроекологію травного тракту. Найбільш важливими аспектами взаємодії пробіотичних штамів з мікрофлорою кишечнику й організмом тварини є утворення антибактеріальних речовин, конкуренція за поживні речовини і місця адгезії, зміна мікробного метаболізму (збільшення чи зменшення ферментативної активності), стимуляція імунної системи. Наприклад, молочнокислі бактерії продукують безліч антагоністичних факторів, що включають метаболічні кінцеві продукти, антибіотикоподібні речовини і бактериоцини [100]. Вивчення ж особливостей обміну трихотеценів у тваринному організмі (на ссавцях) показало, що відбувається їхня трансформація з утворенням менш токсичних продуктів, яку можна різними способами підвищити [55]. Деякі інші мікроорганізми також виявилися здатними трансформувати трихотецени.
Інтерес до мікробної трансформації мікотоксинів посилився після того, як були відкриті способи детоксикації Т-2 токсину, основані на утворенні нетоксичних епокси-форм, а також після повідомлення про здатність ґрунтових бактерій трансформувати трихотеценові мікотоксини. Сприятливий вплив культури живих дріжджів на процеси обміну речовин і зокрема компонентів антиоксидантної системи птиці при афлатоксикозі вперше описали в 1992 році Gardner R. с співавт. [151]. Наступні роботи підтвердили їх ефективність [222]. Ахметов Ф.Г і ін. [7] показали, що введення різних комбінацій білково-вітамінних добавок, цеолітів і бентонітів, бурштинової кислоти на фоні Т-2 токсикозу та афлотоксикозу сприяє зниженню негативної дії цих токсинів, що виражається в нормалізації рівня МДА, глюкози і цілого ряду гематологічних показників.
При мікотоксикозах перспективним є також використання різних гемосорбентів. Як метод детоксикації та корекції гуморального гомеостазу організму їх застосовують при порушеннях обміну речовин, викликаних мікотоксинами, зокрема Т-2 токсином [19]. Було показано адсорбційні ефекти сферичного карбоніту і гранульованого делігандизуючого гемосорбенту при Т-2 токсикозі. Відзначено, що при введенні білим мишам 5% розчину Т-2 токсину (5 мг/кг маси) після інкубації з 50 мг цих сорбентів життєздатність тварин склала 100%.
Підсумовуючи вище викладене, слід зазначмти, що розвиток досліджень в вивченні антиоксидантного заахисту організму птиці є досить актуальним як при розумінні біологічних механізмів так і практичної регуляції деяких механізмів антиоксидантного захисту при дії факторів ініціації вільних радикалів, зокрема мікотоксинів.
Е К С П Е Р И М Е Н Т А Л Ь Н А Ч А С Т И Н А
РОЗДІЛ 2
МЕТОДОЛОГІЯ, МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕНЬ
2.1. Схема досліджень
Дослідження виконані в лабораторії фізіології і біохімії Інституту птахівництва УААН. Для рішення поставлених задач у період з 1997 по 2001 р. проведені експерименти на ембріонах і дорослій птиці: курях породи род-айленд, індичках білої широкогрудої породи, гусаках великої сірої породи, качках української сірої породи, японських перепелах.
Основна частина досліджень проводилася в Інституті птахівництва УААН і його дослідному господарстві "Борки". Птиця утримувалась в кліткових батареях пташників і віварії лабораторії. Групи формувалися за принципом аналогів за віком і живою масою, птицю різних груп кільцювали і мітили стійкими органічними барвниками. Годівля птиці здійснювалася сухими повнораціонними комбікормами, збалансованими за всіма основним поживними і біологічно активним речовинам відповідно до існуючих рекомендацій [83].
Добавки вітамінів, мікроелементів, пробіотиків, мікотоксинів у корм вводилися в дозах, зазначених у схемі кожного досліду. Дослідження проводилися відповідно до нижче приведеної схеми (рис. 2.1).
На першому етапі досліджень були вивчені тканинні особливості накопичення та розподілу ряду природних антиоксидантів: вітамінів А, Е, С в ембріогенезі курей в залежності від стадії розвитку ембріонів курей. Була також вивчена динаміка зміни активності ряду антиоксидантних ферментів у тканинах ембріонів і добового молодняку курей, гусаків, індиків, качок, перепелів.
Інкубація яєць проводилася в лабораторних інкубаторах (ІЛУ-Ф-0.3) при витримуванні стандартних умов за температурою та вологістю. Для рішення поставленої задачі було проведено 2 закладки по 250 яєць курей породи род-айленд. Для досліджень у ембріонів відбиралися: печінка, мембрана жовткового міхура, залишковий жовток, мозок, нирки, грудні та ніжні м'язи.
