Українська академія аграрних наук Інститут птахівництва Шаповалов Сергій Олегович
| Вид материала | Автореферат |
- Українська академія аграрних наук, 516.21kb.
- Українська академія аграрних наук, 314.53kb.
- Українська академія аграрних наук, 2871.29kb.
- Українська академія аграрних наук, 468.19kb.
- Міністерство агропромислової політики україни українська академія аграрних наук інститут, 1034.09kb.
- Українська академія аграрних наук, 349.15kb.
- Українська академія аграрних наук, 2736.22kb.
- Національний науковий центр „інститут аграрної економіки” національної академії аграрних, 319.01kb.
- Національна академія аграрних наук україни Національний науковий центр «Інститут ґрунтознавства, 133.79kb.
- Інститут сільськогосподарської мікробіології Української академії аграрних наук Цикл, 180.26kb.
Українська академія аграрних наук
Інститут птахівництва
Шаповалов Сергій Олегович
УДК 57.05: 577.121: 591.3: 636.082.474
ОСОБЛИВОСТІ становлення антиоксидантного захисту та вплив Мікотоксинів на
організм птиці в онтогенезі
03.00.13 – фізіологія людини і тварин
Автореферат
дисертації на здобуття наукового ступеня
кандидата біологічних наук
Харків – 2003
Дисертацією є рукопис
Робота виконана в Інституті птахівництва Української академії аграрних наук
Науковий керівник: доктор сільськогосподарських наук
Іонов Ігор Анатолійович,
Інститут птахівництва УААН,
завідувач відділом біохімії, фізіології та живлення птиці
Офіційні опоненти: доктор біологічних наук, професор
Смолянінов Борис Вікторович,
Одеський державний аграрний університет,
завідувач кафедрою фізіології та біохімії сільськогосподарських тварин.
кандидат біологічних наук
Кукленко Тетяна Василівна,
Харківський державний університет харчування і торгівлі, старший викладач кафедри охорони праці та екології
Провідна установа: Донецький національний університет
Міністерства освіти і науки України
Захист відбудеться "___"____________2003 р. о “___” годині на засіданні спеціалізованої вченої ради Д 64.051.17 Харківського національного університету ім. В.Н. Каразіна Міністерства освіти і науки України за адресою:
61077, м. Харків, м. Свободи, 4, ауд. ІІІ-15.
З дисертацією можна ознайомитись у Центральній науковій бібліотеці Харківського національного університету ім. В.Н. Каразіна Міністерства освіти і науки України за адресою:
61077, м. Харків, м. Свободи, 4
Автореферат дисертації розісланий "____"_____________2003 р.
Вчений секретар
спеціалізованої вченої ради,
кандидат біологічних наук Падалко В.І.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Проблема підвищення життєздатності організму і регуляція гомеостазу залишається однією з головних проблем сучасної біології. Інтенсивність вільнорадикальних процесів в організмі і вплив на них різних факторів свідчить про те, що їх роль знаходить найбільший прояв у тих біологічних системах, де швидкість метаболізму найбільш висока. Показано, що зсув балансу антиоксиданти-прооксиданти убік останніх відбувається на різних “критичних” етапах онтогенезу птахів [Яремко Р. М, 1999] і під впливом різних екзогенних факторів: ксенобіотиків [Гірін С. В., 1999], зокрема мікотоксинів [Schuster A., та ін. 1987], важких металів [Каліман П. А., та ін. 1998], канцерогенів [Барсуков В. Ю., та ін. 1998], а також і ендогенних факторів: оксидативному стресі, інфекційних і запальних процесах [Аносов А. К., та ін. 1989] та старінні [Harman D., 1994]. Метаболічні порушення, у виді визначеної патології, значною мірою впливають на протікання фізіологічних процесів, а стан антиоксидантної системи виступає в ролі одного з найбільш інтегральних критеріїв якості навколишнього середовища. У зв'язку з цим розкриття сутності функціональних змін в організмі і пошук способів впливу на клітинний гомеостаз є важливою проблемою. Основним шляхом попередження порушень є забезпечення високої активності системи антиоксидантного захисту [Іонов І.А., 1997]. Функціонування антиоксидантної системи поряд із системами детоксикації, репарації, імунною системою, закріплено генетично і має кілька шляхів реалізації. Підвищенню активності антиоксидантної системи сприяє застосування природних антиоксидантів – вітамінів А, Е, С та каротиноїдів [Іонов І.А., та ін. 2000, Surai P.F., та ін. 2000], мікроелементів, [Крючина Є. А., 2000], а також пробіотиків - кормових добавок живих мікроорганізмів, здатних знижувати негативну дію ксенобіотиків та ендогених метаболітів, що активують процеси окислювання [Тараканов Б. А., 2000]. З огляду на темпи забруднення навколишнього середовища ксенобіотиками, більшість з яких негативно впливають на метаболізм, підвищуючи рівень продуктів перекісного окислювання ліпідів у тканинах, актуальним є проведення досліджень в цьому напрямку. Крім того, велике практичне значення має підтримка високого рівня антиоксидантного захисту організму в ембріональний період його розвитку і ранньому постнатальному онтогенезі, коли відбувається закладка захисних систем організму. Підвищена інтенсивність вільнорадикального окислення ліпідів призводить до таких порушень, як дестабілізація мембран, інактивація ферментів, інгібування ділення клітин, що відразу ж позначається на продуктивності птиці, і в першу чергу відтворних якостях [Aydemir T. та ін., 2000]. Передбачається, що підвищення активності перекисного окислення ліпідів є пусковим механізмом дії більшості мікотоксинів. Оцінка дії ксенобіотиків в організмі сільськогосподарської птиці не є сталою. Вона поглиблюється по мірі накопичення та аналізу інформації з даного питання. Крім того, вивчення динаміки ферментативного та не ферментативного антиоксидантного захисту організму в ембріогенезі, ранньому постнатальному онтогенезі і корекція вільнорадикальних порушень при дії мікотоксинів має важливе практичне значення в плані підвищення продуктивних якостей.
Зв’язок роботи з науковими програмами, планами, темами. Дана робота є складовою частиною досліджень, виконаних згідно до плану науково-дослідних робіт лабораторії фізіології, біохімії та живлення птиці Інституту птахівництва УААН протягом 1995-2001 р. у межах виконання таких завдань: 1995-2000 р. Тема 01.03.01. “Вивчити особливості розвитку антиоксидантної системи в сільськогосподарської птиці в ембріогенезі та ранньому постнатальному онтогенезі” № державної реєстрації 0197V009424.
Мета і задачі дослідження. Метою цієї роботи було визначити тканинні, видові та вікові особливості становлення антиоксидантної системи сільськогосподарської птиці в онтогенезі, впливу кормових мікотоксинів на її функціонування, а також пошук шляхів підвищення антиоксидантного статусу організму. Для досягнення мети були поставлені завдання:
- вивчити тканинну і вікову динаміку вмісту вітамінів А та Е в ембріогенезі і ранньому постнатальному онтогенезі різних видів птиці;
- вивчити динаміку активності антиоксидантних ферментів в ембріогенезі та у дорослої сільськогосподарської птиці різних видів;
- виявити особливості реакцій перекисного окислення ліпідів у тканинах різних видів птиці;
- вивчити вплив мікотоксинів на антиоксидантну систему ембріонів курей і дорослої птиці;
- визначити можливість зниження токсичної дії мікотоксинів в організмі курей завдяки підвищенню антиоксидантного потенціалу їх організму.
Наукова новизна одержаних результатів. У результаті проведених досліджень вперше проведено порівняльне вивчення динаміки активності антиоксидантних ферментів в ембріогенезі в різних видів сільськогосподарської птиці, вмісту продуктів ПОЛ і жиророзчинних вітамінів. Показано, що на заключних етапах ембріогенезу перед виводом молодняку птиці відбувається збільшення активності більшості АО-ферментів і накопичення основного жиророзчинного антиоксиданту клітини – альфа-токоферолу. Встановлено, що токсини, які вивчалися є активатором перекисних процесів. Встановлено кореляційний звязок при мікотоксикозах курей між рівнем продуктів ПОЛ в організмі птиці та активністю антиоксидантних ферментів і вмістом вітамінів А, Е, С та каротиноїдів. Розроблено методику оцінки антиоксидантних властивостей різних форм вітамінів А, Е, каротиноїдів, мікроелементів та дослідження процесів перекісного окислення ліпідів при дії Т-2 токсину в умовах in vitro на клітинах ембріонального мозку. Встановлена мінімальна концентрація Т-2 токсину, яка здатна активувати процеси ліпопероксидації. Дані, які висвітлюють одночасно інтенсивність ПОЛ і показники антиоксидантної системи крові курей у динаміці аліментарного мікотоксикозу, отримані вперше. Визначено можливість підвищених доз вітамінів Е, С та селену на фоні Т-2 токсикозу курей запобігати активації ПОЛ та їх різну біологічну активність щодо окремих ланок антиоксидантної системи крові та інших тканин. Вперше здобуто нові дані про те, що за допомогою мікроелементних композицій - препарату «Біотам» як профілактичного засобу, так і в умовах розвитку Т-2 токсикозу в значній мірі підвищується антиоксидантний статус організму, стабілізується стан клітинних мембран. Використання пробіотиків при Т-2 токсикозі сприяє значному поліпшенню біохімічних показників організму курей.
Теоретичне і практичне значення роботи. Одержані результати розширюють і поглиблюють сучасні уявлення про вікові, видові та тканинні особливості вільнорадикальних процесів, їх знешкодження та корекцію в організмі сільськогосподарської птиці. Встановлені характерні зміни в стані показників про-антиоксидантної рівноваги та функціонального стану печінки при дії різних мікотоксинів дають підстави використовувати їх як критерії оцінки ступеню розвитку токсикозу та детоксикаційної можливості вітамінних та мікроелементних препаратів. Одержані результати поглиблюють та розширюють розуміння механізмів токсичної дії мікотоксинів як стимуляторів ПОЛ, що надійшли аліментарним шляхом до організму сільськогосподарської птиці, і можуть бути основою для розробки науково обґрунтованих схем детоксикації за допомогою різних кормових добавок. Розроблено просту і швидку методику оцінки антиоксидантних властивостей біологічно активних речовин при Т-2-токсикозу в умовах in vitro. На основі одержаних результатів рекомендується використовувати при вільнорадикальних порушеннях, викликаних мікотоксинами, а зокрема Т-2 токсином, добавки підвищених доз вітаміну Е, С та селеніту натрію, мікроелементної композиції “Біотам” та пробіотиків: молочнокислих бактерій - Lactobacilus sp. та дріжджів Saccharomyces cerevisiae у вигляді добавок до раціону.
Особистий внесок здобувача. У закінченій дисертаційній роботі особисто здобувачеві належать: проведення порівняльного вивчення динаміки активності антиоксидантних ферментів, вмісту продуктів ПОЛ і жиророзчинних вітамінів в ембріогенезі і ранньому постнатальному онтогенезі в різних видів сільськогосподарської птиці; пошук критеріїв для поглиблення оцінки мікотоксикозів при аліментарному впливу токсинів. Біофізичні дослідження крові проводилися спільно з Узленковою Н.Є. (Інститут медичної радіології АМНУ).
Апробація результатів дисертації За основними положеннями дисертаційної роботи зроблено доповіді на на Міжнародній конференції "Біологічні основи живлення сільськогосподарських тварин” Львів-1998, 7-й науково-практичній конференції Балтійських країн з птахівництва, Рига-1999, Всеросійській конференції молодих вчених та аспірантів з птахівництва, Сергіїв Посад-1999, IV-у міжнародному симпозіумі "Біологічні механізми старіння ”Харків-2000, V-й міжнародній науково-практичній конференції “Актуальні проблеми інтенсивного розвитку тваринництва” Горки-2000, Міжнародній науково-практичній конференції “Проблеми виробництва екологічно чистої продукції на межі 3-го тисячоліття” Житомир-2000, XXI Міжнародному конгресі з птахівництва, Монреаль-2000, Науково-практичній конференції молодих вчених “Актуальні проблеми фармакології та токсикології” Київ-2000, Міжнародній науковій конференції, присвяченій 25-річному ювілею факультету ветеринарної медицини Дніпропетровського аграрного університету, Дніпропетровськ-2001, III Українській конференції по птахівництву з міжнародною участю, Алушта-2001, Результати наукових досліджень доповідалися на засіданнях вченої заради, ради молодих вчених, аспірантських звітах в Інституті птахівництва УААН (1998-2001 р.).
Публікації. Результати дисертаційної роботи опубліковано в 17-ти друкованих працях у наукових виданнях: 4-х наукових статтях у виданнях, що входять до переліку ВАК України (біологічні науки), 9-ти матеріалах і тезах доповідей конференцій, симпозіуму, конгресу.
Структура й обсяг роботи. Дисертація містить 152 сторінки машинописного тексту і складається з вступу, огляду літератури, опису матеріалів і методів досліджень, чотирьох розділів, у яких представлені результати експериментальної роботи та їх обговорення, загального висновку, висновків і списку використаних джерел, у якому приведено 250 робіт вітчизняних і зарубіжних дослідників. Робота ілюстрована 15 рисунками і містить 43 таблиці.
МАТЕРІАЛи І Методика ДОСЛІДЖЕНЬ
Схема досліджень Дослідження виконані в лабораторії фізіології і біохімії Інституту птахівництва УААН. Для рішення поставлених задач у період з 1997 по 2001 р. проведені експерименти на ембріонах і дорослій птиці: курях породи род-айленд, індичках білої широкогрудої породи, гусаках великої сірої породи, качках української сірої породи, японських перепелах. Групи формувалися за принципом аналогів за віком і живою масою. Для рішення поставленої задачі було проведено 2 закладки по 250 яєць курей породи род-айленд. Терміни відбору зразків тканин у ембріонів курей: 14-й день інкубації - залишковий жовток, мембрана жовткового мішка, мозок, печінка, м'язи грудні і ніжні; 16, 18, 20, 21-й (вивід) день інкубації і добовий молодняк - ті ж зразки + нирки. Аналогічна схема вивчення динаміки рівнів вітамінів і активності антиоксидантних ферментів в ембріогенезі та добового молодняку була використана і в дослідах на інших видах сільськогосподарської птиці - була проведена одна закладка по 150 штук яєць від кожного виду птиці. Для дослідження відбиралися такі органи: печінка, мозок, нирки, а також грудні м'язи. Відбір проб проводили в ключові дні розвитку ембріонів, в залежності від їхнього виду: замикання алантоїсу, перехід живлення ембріона з білкового типу на жовтковий, перехід ембріону на легеневий тип дихання, а також перенос яєць на вивід. При вивченні впливу мікотоксинів на фізіолого-біохімічні показники та антиоксидантний статус організму курей була проведена серія з 5 дослідів. У задачу першого досліду входило вивчення особливостей впливу різних мікотоксинів: Т-2 токсину, зеараленону й аурофузарину на антиоксидантну систему курей-несучок при аліментарному їх надходженні до організму. Для цього в умовах дослідного господарства "Борки" було сформовано 4 групи курей по 30 голів у кожній. Контрольна 1-а група одержувала стандартний комбікорм без внесення добавок мікотоксинів. У раціони дослідних груп курей-несучок були введені за наступною схемою: кури 2-ї групи одержували Т-2 токсин (10 мг/кг корму); кури 3-ї групи – аурофузарин (1,6 мг/кг корму), кури 4-ї групи – зеараленон (880 мг/кг корму). Метою другого досліду було проведення на фоні розвитку Т-2 токсикозу порівняльних випробувань різних пробіотиків, зокрема культури Lactobacillus sp. і дріжджів Saccharomyces cerevisiae з пивного сусла. 1 група - контроль; кури 2, 3, 4-ї груп одержували Т-2 токсин у кількості 6 мг/кг корму; кури 3-ї групи одержували культуру Lactobacillus sp. у кількості 20 млрд. клітин на голову; кури 4-ї групи - дріжджі з пивного сусла в кількості 20 млрд. клітин на голову. У задачу третього досліду входило вивчення впливу підвищених доз вітамінів Е, С та Se (селеніт натрію). Було сформовано 5 груп курей аналогів по 20 голів у кожній за наступною схемою: 1-а група - контроль; кури 2-ї, 3-ї, 4-ї, 5-ї - одержували Т-2 токсин у кількості 6 мг/кг корму; 3-ї, 4-ї, 5-ї групи одержували Se у кількості 0,2 мг/кг корму - 2-х кратна доза; 3-ї групи - 3-х кратну дозу вітаміну С - 150 і вітаміну Е - 30 мг/кг корму; 4-ї групи - 5-ти кратну дозу вітаміну С - 250 і вітаміну Е - 50 мг/кг корму; 5-ї групи - 5-ти кратну дозу вітаміну С - 250 і вітаміну Е - 50 мг/кг корму, перші два тижні на фоні Т-2 токсикозу, а потім один тиждень без токсину. Введення Т-2 токсину і вітамінно-мінеральної добавки проводилося протягом 3 тижнів. Наприкінці досліду від кожної групи курей було закладено на інкубацію по 50 штук яєць для визначення їхніх інкубаційних якостей, а також вивчення становлення антиоксидантної системи в ембріогенезі. Задачею четвертого досліду було вивчення впливу мікроелементних композицій в умовах ураження організму курей Т-2 токсином. Було сформовано 5 груп курей по 50 голів у кожній. Перша група - контроль; кури 2-ї, 4-ї, 5-ї груп одержували Т-2 токсин у кількості 6 мг/кг корму; кури 3-ї та 4-ї груп - препарат «Біотам» у кількості 20 мг/кг маси тіла; кури 5-ї групи - 5-ти кратну дозу препарату «Біотам» (100 мг/кг маси тіла). Введення Т-2 токсину і препарату «Біотам» проводилося одночасно протягом 3-х тижнів. На 7, 14-ту добу введення токсинів і препарату була відібрана кров для біохімічних досліджень. На 21-у добу було забито по 5 голів курей з кожної групи для визначення біохімічних показників у тканинах. У п’ятому досліді вивчали особливості впливу нового удосконаленого препарату «Біотам-2» на антиоксидантну систему курей-несучок при Т-2 токсикозі, а також його впливу на продуктивні і відтворні якості курей. Було сформовано 5 груп курей-аналогів по 50 голів у кожній за наступною схемою: 1 група - контроль; кури 2-ї, 4-ї і 5-ї груп одержували Т-2 токсин у кількості 6 мг/кг корму; кури 3-ї і 4-ї груп - препарат «Біотам-2» у кількості 20 мг/кг маси тіла протягом досліду; кури 5-ї групи - препарат «Біотам-2» у кількості 20 мг/кг маси тіла протягом одного тижня до введення токсину і наступні три тижні на фоні Т-2 токсикозу. Наприкінці досліду від кожної групи курей було закладено на інкубацію по 50 штук яєць для визначення їхніх інкубаційних якостей, а також вивчення становлення антиоксидантної системи в ембріогенезі.
Методи досліджень. Визначення вітамінів А, Е, С проводили за методом Сурая П. Ф., Іонова І. А. (1990), каротиноїдів (Frigg M. et al., 1992). Активність супероксиддисмутази (Чевари С. та ін., 1991), каталази (Королюк М. А. та ін., 1988), глутатіонпероксидази (Надіров Н.К. та ін., 1987), глутатіонредуктази (Панченко Л.Ф. та ін., 1975), глутатіонтрансферази (Younes M. et al., 1992), визначення вмісту дієнових кон’югатів (Стальная М. Д., 1977), малонового діальдегіду (Ohkawa H., 1979) глутатіону (Штурман Ц.М., 1979). Концентрацію гемоглобіну, кількість еритроцитів, гематокрітне число були визначені на гематологічному аналізаторі «Sysmex» (Японія). Стійкість еритроцитів до кислотного гемолізу вивчали на автоматичній установці Kinetic Shapemeter SH-01 (Німеччина). Електричні параметри електоромеханічної стабільності еритроцитарних мембран вивчали шляхом виміру сили струму і напруги електричного пробою мембрани еритроциту ЕЦА-02 (Україна). Статистичну обробку проводили з використанням t-критерію Стъюденту і непараметричного критерію U-Вілкоксона-Манна-Уітні.
Результати досліджень
Динаміка вмісту вітамінів А, Е, С в організмі ембріонів різних видів птиці.
При вивчені видових особливостей вмісту вітаміну Е у печінці ембріонів сільськогосподарської птиці було відзначено, що його концентрація протягом ембріонального розвитку поступово зростає і досягає свого максимуму на виводі молодняка та першу добу життя (рис. 1)
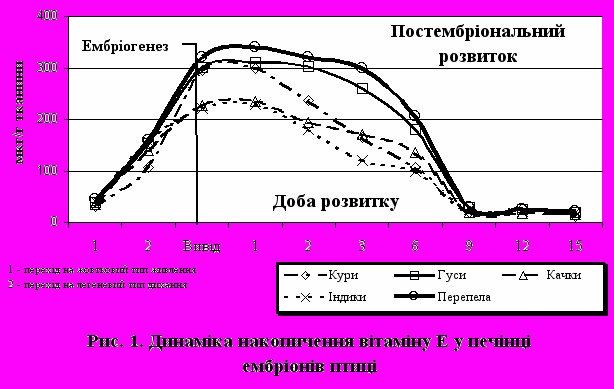
Найвищою вона була у гусаків та перепелів. Показано, що динаміка накопичення цього природного антиоксиданту в ембріогенезі та ранньому постнатальному онтогенезі аналогічна всім вивченим видам птиці. Забезпечення адекватної антиоксидантної здатності, зокрема високої концентрації вітаміну Е в печінці на різних стадіях розвитку ембріонів, необхідно для захисту підвищеного рівня ненасиченості в ліпідах ембріонів. Збільшення концентрації вітаміну Е в ембріональних тканинах, що досягає максимальних величин до моменту виводу молодняку, розглядається в якості еволюційно-закріпленого пристосувального механізму захисту від кисневого стресу в момент виводу. Зміна ембріональної гіпоксії на відносну гіпероксію є еволюційно детермінованою і не в змозі викликати різке порушення гомеостазу. Вивчення динаміки накопичення вітаміну А в ембріогенезі і ранньому постнатальному онтогенезі сільськогосподарських видів птахів показало, що концентрація вітаміну А в печінці ембріонів гусаків і індиків була в 2-2,5 рази більше ембріонів курей і також постійно збільшується в процесі інкубації.
Жовток курячих яєць не містить вітаміну С і C-вітамінна забезпеченість курей у процесі ембріонального розвитку підтримується за рахунок синтезу АК жовтковою мембраною. При вивченні динаміки накопичування та розподілу аскорбінової кислоти курчат в ембріогенезі було відзначено значне збільшення рівня вітаміну С у мозку курчат протягом 11-19-ї діб інкубації: з 130,5 до 665,4 мкг/г, згодом ця величина дещо знижувалася до рівня 603,2 мкг/г на 21-у добу інкубації, а у добових курчат становила 577,3 мкг/г (рис. 2). Особливої уваги заслуговують високі концентрації АК в мозку курчат у процесі їх ембріонального розвитку. Так, концентрація АК у даному органі переважала рівень цього вітаміну в ембріональній печінці курей у 3-5 разів. Максимальне підвищення концентрація АК у мозку виявлялося на 14-ту добу інкубації, що було аналогічно печінці. Момент виводу та до 9-ї доби постнатального розвитку концентрація вітаміну С в мозку зменшувалась, а в печінці збільшувалась. На 11-у добу розвитку вміст цього вітаміну в мозку та печінці був приблизно однаковим.
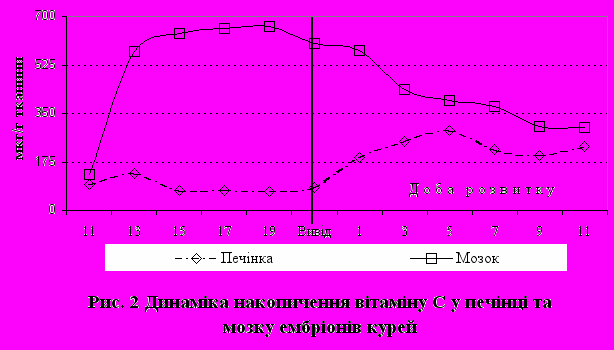
Тканинні особливості активності АО ферментів у ембріонів різних видів птиці
Показано, що динаміка змін активності каталази і супероксиддисмутази в печінці ембріонів курей характеризується тенденцією до збільшенням її активності в процесі розвитку з різким і вірогідним (у 1,5-2,4 рази) збільшуванням на останніх етапах ембріогенезу з піком на 20-добу розвитку ембріонів. Аналогічна динаміка була відзначена і для інших тканин, окрім мозку. За отриманими даними активність каталази мозку ембріонів курей з 14 по 20 день розвитку поступово зменшувалась та залишалася на цьому рівні і у добових курчат. Згідно з наведеними даними, високу супероксиддисмутазну активність в органах і тканинах добових курчат слід розглядати як компенсаторний захист при переході від гіпоксії кінця ембріонального розвитку до відносної гіпероксії перших днів життя. У ранньому постнатальному онтогенезі супероксиддисмутазна і каталазна активність знижується, тоді як і глутатіонпероксидазна активність збільшується. У наших дослідженнях було показано, що онтогенетичні особливості антиоксидантної системи ембріонів курей мають значні відмінності для печінки й мозку. Активність глутатіонпероксидази і каталази були відповідно вище в 2 і 9 разів в печінці порівняно з мозком. Активність глутатіонпероксидази збільшується в 2,6 рази з 14 по 21 день розвитку, і також збільшується у добових курчат на 14%, а активність СОД в мозку поступово знижується з 14 днів до виводу. В інших досліджених тканинах динаміка зміни активності СОД була аналогічною як у печінці. Динаміка змін активності каталази у печінці гусаків і особливо качок, як і ембріонів курей характеризується тенденцією до підвищення її активності в процесі розвитку з різким збільшуванням на останніх етапах онтогенезу з піком при переході ембріону на легеневий тип дихання. Аналогічна динаміка була відзначена і для інших тканин. У індиків такої закономірності не виявлено. Динаміка змін активності каталази у печінці гусаків і особливо качок, як і ембріонів курей характеризується тенденцією до підвищення її активності в процесі розвитку з різким збільшуванням на останніх етапах онтогенезу з піком при переході ембріону на легеневий тип дихання. Аналогічна динаміка була відзначена і для інших тканин. У індиків такої закономірності не виявлено. Онтогенетичні особливості антиоксидантної системи ембріонів усіх вивчених видів мають значні відмінності для печінки й мозку. У мозку активність каталази на протязі ембріогенезу поступово та повільно підвищувалась у всіх трьох видів птиці, а у добового молодняка відзначено зниження активності майже в 2 рази в порівнянні з ембріонами. Слід підкреслити, що активність каталази у печінці індиків і гусаків була в 6-7 разів більше, ніж у ембріонів курей. Це може бути пояснено значно меншим рівнем вітаміну Е, як природного антиоксиданту, у печінці індиків в порівнянні з курми. Така ж закономірність відзначена і для інших тканин цих двох видів птиці.
Видові особливості розвитку ферментативної антиоксидантної системи ембріонів сільськогосподарської птиці.
При порівняльному аналізі активності досліджуваних ферментів у тканинах ембріонів різних видів птахів було показано, що практично в усіх видів у печінці відзначається схожа динаміка їхніх змін. Так, активність каталази була найбільшою при переході ембріону на легеневий тип дихання. Менш виражено це було в ембріонів гусаків. Слід зазначити, що найбільша активність каталази (рис. 3) як при переході з білкового типу живлення на жовтковий, так і на виводі молодняку була у водоплавних птахів – качок і гусаків. Активність каталази у ембріонів перепелів була нижча активності ембріонів гусаків, качок, але вища, ніж у ембріонів курей. Протилежна тенденція спостерігається при порівнянні активності глутатіонпероксидази. Показано, що при переході ембріону на легеневий тип дихання активність цього ферменту знижується більше, ніж у 2 рази, а при виводі - підвищується. Виняток складає показник активності GPx у ембріонів гусаків, де протягом усього досліджуваного періоду вона підвищується в 1,5 рази. Різна динаміка двох пероксидаз (каталази і GPx) у печінці, ймовірно, пояснюється тим, що GPx більш ефективно працює при низьких концентраціях перекисів, в той же час у захисті кліток від окисного стресу, викликаного високими концентраціями перекису водню, ключова роль належить каталазі. Таким чином, можна висловити припущення про те, що при переході ембріонів на легеневий тип дихання в печінці відбувається інтенсивне накопичення продуктів ліпопероксидації. Вивчення активності СОД у печінці показало, що найменша активність цього ферменту була у ембріонах гусаків. Таким чином відзначена в наших дослідженнях підвищена активність каталази і GPx і знижена активність СОД у формуванні антиоксидантної системи в ембріогенезі обумовлена специфічною функціональною активністю даної системи. Відзначено підвищення активності СОД у ембріонах перепелів на момент виводу. Особливої уваги заслуговує вивчення ферментативної активності антиоксидантної системи мозку в ембріогенезі. Так, показано, що активність каталази переважає у ембріонів гусаків та качок у порівнянні із сухопутними видами, така ж закономірність була раніше описана й у печінці. У курей при переході ембріону на легеневий тип дихання активність каталази знижується і залишається на однаковому рівні аж до виводу. Активність GPx у мозку (рис.4) підвищується в усіх видів сільськогосподарської птиці. Можливо, це є особливістю обміну речовин, що властиве всій птиці в період ембріонального розвитку. При порівнянні активності СОД у мозку в усіх видів сільськогосподарської птиці, спостерігалася тенденція зниження активності СОД у при переході ембріону на легеневий тип дихання і підвищення активності досліджуваного ферменту до моменту виводу.
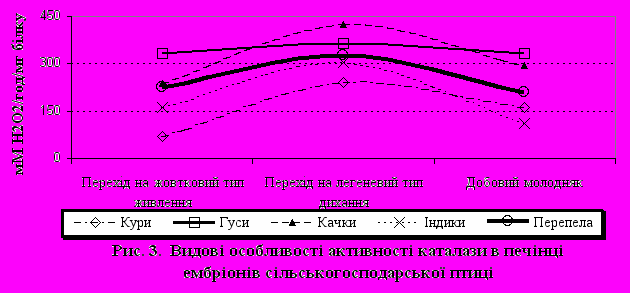
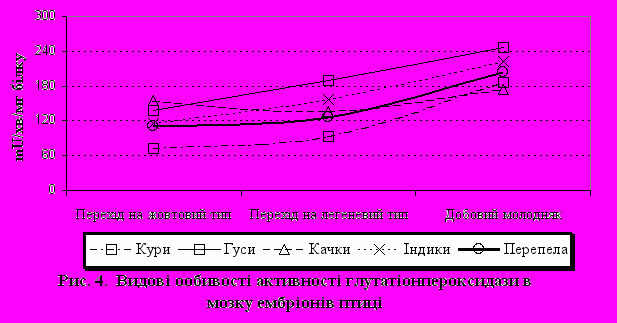
Вплив Т-2 токсину, зеараленону, аурофузарину на інтенсивність ПОЛ і активність антиоксидантних ферментів курей
Практично всі три досліджуваних мікотоксини виявили могутні прооксидантні властивості, що виражалися в достовірному збільшенні змісту кінцевого продукту перекисного окислювання ліпідів – малонового діальдегіду (табл.1). Показано, що Т-2 токсин, аурофузарін і зеараленон викликають цілий ряд реакцій окисного стресу, під яким розуміють порушення тканинного балансу антиоксидантів і прооксидантів у бік останніх. Наслідком цього впливу є зниження або порушення функціонування захисних систем організму і розвиток окисного ушкодження тканини. Найбільший вплив на накопичення МДА було виявлено при Т-2 токсикозі, його концентрація була вище в 2 рази при нативних процесах ПОЛ і в 1,5 рази при стимуляції іонами Fe2+ і аскорбіновою кислотою. Менш сильний вплив на процеси перекисного окислювання ліпідів, у порівнянні з Т-2 токсином, виявили аурофузарин і зеараленон. У наших дослідженнях було показано, що введення аурофузарину до корму призводить до достовірного підвищення рівня малонового діальдегіду в печінці курей: нативне або вільне ПОЛ при дії цього мікотоксину збільшилося більше, ніж на 40%.
Таблиця 1
Вміст малонового діальдегіду в печінці 30-денних курей у присутності різних токсинів, нМ /г
Групи | Перекисне окислювання ліпідів | ||
| Fe++-залежне ПОЛ | Аскорбат-залежне ПОЛ | ВільнеПОЛ | |
| 1 (К) | 231,3 7,04 | 175,8 5,60 | 85,5 9,87 |
| Т-2 токсин | 360,6 23,08 | 264,9 6,61 | 173,7 9,00 |
| Аурофузарин | 286,2 15,45 | 216,0 18,51 | 138,0 9,00 |
| Зеараленон | 302,1 4,05 | 202,2 12,98 | 115,2 3,56 |
*- р 0,05; **- р 0,01; при U - 0,05; тут та далі порівняно з контролем
У проведених дослідженнях встановлено, що введення мікотоксинів у раціон курей активізує функціонування глутатіонової гілки антиоксидантного захисту організму, що виявляється в підвищенні активності ферментів при Т-2 токсикозі, зеараленон- і аурофузаринтоксикозі. Встановлено, що на 14-у добу введення токсинів (табл. 2) найбільша активність глутатіонзалежних ферментів відзначена при Т-2 токсикозі (р 0,01). Через 7 днів зберігалася та сама тенденція, однак максимальна активність глутатіонпероксидази була в групі, що одержувала зеараленон. На 30-ій добі введення токсинів відзначається достовірне підвищення активності глутатіонпероксидази в 4 рази при Т-2 токсикозі і зеараленонтоксикозі. Слід зазначити, що з 14-ї до 30-ї доби введення токсинів, спостерігається достовірне постійне підвищення активності глутатіонпероксидази при Т-2 токсикозі. Активність глутатіонредуктази була найбільша в присутності у кормі Т-2 токсину. Однак у групі, що одержувала зеараленон, на 30-у добу спостерігається зниження активності цього ферменту в порівнянні з 14-ю та 21-ю добами. Крім цього встановлено підвищення активності глутатіонтрансферази. Відзначена більш висока активність цього ферменту в еритроцитах при зеараленонтоксикозі та Т-2 токсикозі. Однак активність глутатіонтрансферази при зеараленонтоксикозі знижується на 30-у добу. Підвищення активності глутатіон-S-трансферази в присутності зеараленону та Т-2 токсину може бути використано як маркер при діагностиці цих мікотоксикозів. Проведені дослідження показали, що дія аурофузарину на організм характеризується підвищенням активності глутатіонзалежних ферментів в еритроцитах протягом всіх етапів дослідження при одночасному зниженні пулу відновленого глутатіону. Встановлено, що у курей, які отримували з кормом досліджувані мікотоксини, рівень GSH в еритроцитах був вірогідно нижче контролю (табл. 3). Можливо, це пов'язано з активною витратою GSH у процесах антиокисного захисту, тому що відновлена форма глутатіону відіграє важливу роль у детоксикації різних токсинів в організмі.
Таблиця 2
Активність ферментів еритроцитів при мікотоксикозах
| Фермент | Група | Час відбору зразків після початку введення токсинів, доба | ||
| 14 | 21 | 30 | ||
| Глутатіонпероксидаза (нМ NADPH/мкг Hb) | 1 (К) | 3,45 1,46 | 2,03 0,57 | 2,88 0,57 |
| Т-2 токсин | 6,76 0,71 * | 7,62 1,88 ** | 8,67 1,43 ** | |
| аурофузарин | 3,96 0,68 | 3,85 1,20 | 5,23 1,19 | |
| зеараленон | 7,65 0,60 ** | 8,26 3,14 | 8,12 1,64 ** | |
| Глутатіонпредуктаза (нМ NADPH/мг Hb) | 1 (К) | 1,40 0,62 | 1,76 0,53 | 2,08 0,46 |
| Т-2 токсин | 7,62 0,9 ** | 5,73 1,29 ** | 7,33 2,05 * | |
| аурофузарин | 3,69 1,18 | 3,51 1,30 | 4,46 3,74 | |
| зеараленон | 4,01 0,2 ** | 4,14 1,53 | 3,09 0,61* | |
| Глутатіонтрансфераза (мкМ ДХНБ/мг Hb) | 1 (К) | 28,98 2,94 | 21,54 3,73 | 22,84 1,16 |
| Т-2 токсин | 61,6 8,9 ** | 42,88 7,91 * | 34,04 4,97 * | |
| аурофузарин | 32,14 3,14 | 23,76 9,07 | 29,47 4,69 | |
| зеараленон | 58,1 8,5 ** | 41,48 9,00 | 39,60 9,15 | |
| Каталаза (мкМ Н2О2/мг Hb) | 1 (К) | 34,41 8,12 | 35,42 5,47 | 49,28 7,40 |
| Т-2 токсин | 69,51 11,3 * | 87,08 27,20 * | 83,26 5,9 ** | |
| аурофузарин | 69,8512,5 * | 78,518,98 ** | 63,853,10 * | |
| зеараленон | 83,16 25,2 * | 64,06 17,08 | 64,74 2,53 * | |
| Супероксиддисмутаза (U/мг Hb) | 1 (К) | 28,30 1,78 | 28,43 1,37 | 28,55 0,60 |
| Т-2 токсин | 35,820,18 ** | 37,93 2,18 ** | 41,76 3,35 ** | |
| аурофузарин | 31,35 1,78 | 31,77 1,15 | 31,36 1,20 * | |
| зеараленон | 30,51 1,36 | 33,42 2,30 | 34,22 1,03 ** | |
В наших дослідженнях показано, що всі три досліджуваних мікотоксини викликають через місяць після початку введення значне зниження змісту вітаміну А в печінці, що є основним місцем його депонування (табл. 4). Найбільш істотні зміни вмісту в печінці були відзначені при Т-2- та аурофузаринтоксикозі для ретинолу, концентрація якого не піднялася до початкового рівня навіть після 2-х тижневого виключення токсину аурофузарину з корму.
Таблиця 3
Вміст глутатіону в еритроцитах і печінці при мікотоксикозах
ПулГлутатіону | Групи кур | |||
1 (К) | Т-2 токсин | Аурофузарин | Зеараленон | |
Еритроцити, мг/мл | ||||
| Відновлений | 0,309 0,04 | 0,1450,02** | 0,198 0,02** | 0,200 0,20** |
| Окислений | 0,410 0,02 | 0,380 0,07 | 0,239 0,04** | 0,360 0,02* |
| Загальний | 0,720 0,09 | 0,530 0,01* | 0,437 0,04** | 0,560 0,05* |
Печінка, мг% | ||||
| Відновлений | 140,9 17,3 | 98,6 8,3 ** | 109,64 12,9 | 116,8 1,10* |
