Українська академія аграрних наук Інститут птахівництва Шаповалов Сергій Олегович
| Вид материала | Автореферат |
- Українська академія аграрних наук, 516.21kb.
- Українська академія аграрних наук, 314.53kb.
- Українська академія аграрних наук, 2871.29kb.
- Українська академія аграрних наук, 468.19kb.
- Міністерство агропромислової політики україни українська академія аграрних наук інститут, 1034.09kb.
- Українська академія аграрних наук, 349.15kb.
- Українська академія аграрних наук, 2736.22kb.
- Національний науковий центр „інститут аграрної економіки” національної академії аграрних, 319.01kb.
- Національна академія аграрних наук україни Національний науковий центр «Інститут ґрунтознавства, 133.79kb.
- Інститут сільськогосподарської мікробіології Української академії аграрних наук Цикл, 180.26kb.
В той же час варто зазначити, що в перші 14-ть діб згодовування аурофузарину рівень вітаміну не змінився, що, мабуть, пояснюється великими його запасами в печінці, а також захисною дією -токоферолу, рівень якого знизився в цій групі в цей період у 1,4 рази. Це свідчить про підвищену витрату вітаміну Е в якості антиоксиданту при активації процесів ПОЛ. Наступні відновні процеси в організмі призвели до того, що концентрація вітаміну Е поступово підвищувалася і через дві тижні після зняття добавки аурофузарину практично досягла контрольного рівня. Вміст вітаміну А в печінці в курей, що одержували зеараленон, було значно нижче норми протягом всього експерименту. Виключення зеараленону з корму птиці не привело до підвищення вмісту вітаміну А в печінці, рівень його залишався вірогідно нижче контрольних значень на 14-у добу після припинення введення токсину. Вміст вітаміну А в печінці в курей, що одержували зеараленон, було значно нижче норми протягом всього експерименту.
Таблиця 4
Вміст вітамінів Е, А, С, каротиноїдів в печенці курей при введенні в корм мікотоксинів,мкг/г
| | Групи кур | |||||||||
| 1 (К) | Т-2 токсин | Аурофузарин | Зеараленон | |||||||
| Вітамін С | ||||||||||
| 14 - введення МК | 201,1 20,4 | 201,9 17,3 | 190,6 16,6 | 177,3 14,5 | ||||||
| 30 - введення МК | 267,6 15,2 | 217,9 13,2 | 239,9 15,0 | 227,4 9,66 | ||||||
| 14 - зняття МК | 203,1 1,9 | 201,0 19,6 | 192,7 6,5 | 202,3 14,0 | ||||||
Вітамін А | ||||||||||
| 14 - введення МК | 533,1 24,8 | 342,2 26,1 | 532,2 18,4 | 415,6 36,3 | ||||||
| 30 - введення МК | 415,5 14,3 | 296,6 13,8 | 365,2 12,2 | 362,3 14,1 | ||||||
| 14 - зняття МК | 513,4 10,1 | 418,2 15,3 | 416,1 16,6 | 482,2 8,1 | ||||||
Вітамін Е | ||||||||||
| 14 - введення МК | 13,8 0,3 | 8,4 0,5 | 9,4 0,8 | 12,1 0,8 | ||||||
| 30 - введення МК | 14,0 0,4 | 7,7 0,6 | 12,4 1,2 | 12,8 0,8 | ||||||
| 14 - зняття МК | 13,8 0,2 | 10,3 0,3 | 13,4 0,6 | 13,2 0,7 | ||||||
Каротиноїди | ||||||||||
| 30 - введення МК | 18,3 2,4 | 16,7 2,7 | 17,5 0,23 | 16,3 0,11 | ||||||
Виключення зеараленону з корму птиці не привело до підвищення вмісту вітаміну А в печінці, рівень його залишався вірогідно нижче контрольних значень на 14-у добу після припинення введення токсину. Можливо, вітамін А бере участь у фізіологічних компенсаторних механізмах, що мобілізують внутрішні резерви організму, після дії зеараленону. Під дією токсину до 30-м доби відбувалося достовірне зниження в печінці рівня -токоферолу і вітаміну С. Але вже через 2-а тижні після зняття добавки зеараленону концентрація вітамінів Е и С у печінці практично відновилася. Після виключення токсинів з корму через 14-ть днів вміст вітамінів у печінці практично відновлювався, хоча при Т-2 токсикозі концентрація вітаміну Е залишалася все-таки нижче контролю. Проведені дослідження дозволяють припустити, що розвиток мікотоксикозів супроводжується порушенням цілісності клітинних мембран, зміною їхніх структурно-функціональних характеристик, з чим зв'язана зміна активності мембранозв’язуючих ферментів. На прикладі мембран еритроцитів показано, що в умовах дії аурофузарину, зеараленону та Т-2 токсину змінюються показники стійкості і проникності еритроцитарних мембран, їхні бар'єрні властивості й електричні характеристики в умовах дії зовнішнього електричного поля. При тривалому введенні аурофузарину, проникливість мембран еритроцитів різко збільшилась, час гемолізу скорочувався відповідно в 1,4 та 1,1 рази (р 0,01). Незважаючи на відсутність вірогідних змін у кількості еритроцитів і вмісту гемоглобіну в умовах досліду, відбувалися зміни морфометричного складу еритроцитів. При дії токсину зростала неоднорідність популяції еритроцитів периферичної крові з переважанням на 14-ту і 21-у добу макроформ. Про це свідчать дані розподілу еритроцитів за об’ємом та діаметром (максимуми гістограм розподілу). Збільшення кількості макроцитів у крові може бути ознакою розвитку в організмі компенсаторної реакції еритропоезу на зміну фізіологічного стану організму в умовах інтоксикації. Збільшувались показники електричної сталості мембран еритроцитів в дослідній групі: сила струму та напруга пробою мембрани були значно вище на 21-у добу введення аурофузарину. Отримані дані свідчать про зміни конформаційних та функціональних властивостей мембран клітин в умовах попадання в організм аурофузарину, виявлені зміни їх проникності та електричної провідності. Вивчення функціонального стану мембран при дії низьких концентрацій зеараленону показало, що максимальні зміни проникності мембран і їхня стійкість до дії гемолітика спостерігається на більш пізніх термінах вводу токсину. При зростанні концентрації гемолітика швидкість гемолізу зростала у цей термін в 1,5 рази. При цьому показники електричної міцності мембран практично не змінилися. Отримані дані говорять про наявність структурних перебудов у мембранах еритроцитів під дією зеараленону, що призводять до збільшення проникності і порушення функціонального стану еритроцитів, вкорочення тривалості їхнього життя. Відзначено, що ці зміни носять стійкий характер. При цьому змінюються морфометричні показники еритроцитів. На 14-у добу в популяції еритроцитів переважають клітини, значно більші в об’ємі та діаметрі. Розвиток явища макроцитозу на 14-у добу введення може розглядатися як компесаторна реакція еритропоезу на зміну фізіологічного стану організму в умовах активації процесів ПОЛ і зниження системи антиоксидантного захисту.
Вплив Т-2 токсину та біологічно аквних речовин в умовах in vitro
Вивчення впливу Т-2 токсину на процеси ПОЛ показали, що Т-2 токсин не тільки в живому організмі, але й в умовах in vitro є активним стимулятором утворення кінцевого продукту ПОЛ - малонового діальдегіду. Встановлено, що концентрація Т-2 токсину в тканині мозку 5 10-6 викликає перекисне окислювання ліпідів, можливо ці концентрації є мінімальними, при яких спостерігається деструктивна дія Т-2 токсину, що виражається в порушенні фосфоліпідного матрексу біомембран клітин мозку. Відзначено невелике збільшення МДА при концентрації Т-2 токсину від 1 до 5 10-5 М. Максимальна концентрація МДА спостерігалася при концентрації Т-2 токсину 5 10-4 М. Стимулювання процесів ПОЛ Т-2 токсином показало, що він виявляє виражені прооксидантні властивості на рівні або вище ПОЛ при стимулюванні іонами Fe++ і аскорбінової кислоти. При дослідженні впливу на процеси ПОЛ різноманітних біологічно активних речовин (різних форм вітамінів Е, А, К, селену та ряду каротиноїдів) було показано, що введення в середовище вітаміну Е знижувало ПОЛ у 2,5-3 рази. Аналогічну антиоксидантну дію виявили різні форми вітаміну А. Найбільш виражену антиоксидантну дію вітаміну Е було відзначено при використанні -токоферолу. Більш високі концентрації вітаміну Е в формі ацетату незначно знижують ПОЛ. У той же час навіть мінімальні концентрації спиртової форми вітаміну А знижують ПОЛ. Вітамін А-кислота знижує ПОЛ пропорційно до збільшення його концентрації в системі. Для порівняння дії Т-2 токсину, іонів Fe++ та аскорбату як ініціаторів ПОЛ та для зменшення негативної дії Т-2 токсину в систему були введені вітаміни Е та А. Як мінімальна так і максимальна концентрації вітаміну Е знижують ПОЛ у присутності у системі Т-2 токсину, а середні концентрації знижують окислення у порівнянні з Т-2 токсином, але знаходяться вище рівня вільного процесу ПОЛ. Було показано, що вітамін А знижує ПОЛ у клітинах мозку як у формі кислоти, так і у формі спирту. Проте, спостерігається більш ефективне зниження ПОЛ при внесенні вітаміну А-кислоти. Крім того, було проведено порівняльне дослідження антиоксидантних властивостей деяких каротиноїдів в умовах in vitro. У наших дослідженнях було показано, що зеаксантин знижує ПОЛ у клітинах мозку найбільш ефективно, у порівнянні з іншими каротиноїдами. Всі використані каротиноїди виявляли виражений інгібуючий ефект на утворення МДА. При вивченні впливу каротиноїдів на перекисне окислювання мозку було показано, що в нормальних фізіологічних умовах концентрація МДА складала 750 нМ, введення у систему іонів Fe2+, ініціювало перекисне окислювання в 1,5 раза. Концентрації лютеїну нижче 1,7 10-9М не виявили істотної дії на процес окислювання ліпідів. Просліджується тенденція зниження рівня МДА в тканині, що пропорційна збільшенню концентрації введеного інгібітору. Можливо, лютеїн сприяє гальмуванню ланцюгової реакції окислювання шляхом інактивації цього процесу. Дані, отримані в нашому експерименті, свідчать про те, що інгібіруюча активність зеаксантину в мозку істотно вище, ніж у інших вивчених каротиноїдів. Багато дослідників, що працюють в області вивчення антиоксидантних властивостей каротиноїдів, сходяться на думці, що суміші різних каротиноїдів набагато більш ефективніші, ніж окремі речовини. Це припущення було підтверджено в результаті проведених нами досліджень. Так, було показано, що спільне введення в гомогенат мозку лютеїну і зеаксантину в мінімальних досліджуваних концентраціях 1,7 10-9 і 0,85 10-9 М відповідно в середовище інкубації сприяло значно більшому зниженню вмісту МДА у порівнянні з окремим введенням кожного з них. Так, використання суміші двох оксикаротиноїдів призвело до зменшення рівня МДА до 82 нМ, а при збільшенні концентрації зеаксантину в 2 рази (1,7 10-9 М та 1,7 10-9 М) - до 63 нМ. В той же час, спільне введення -каротину і зеаксантину не вплинуло на рівень МДА, що був практично рівним показнику визначеному для чистого зеаксантину - 215 і 212 нМ відповідно. Таким чином, в умовах in vitro був переконливо підтверджений антиоксидантний захисний ефект різних каротиноїдів і їх активність на моделі гомогенату мозку. В цілому, лютеїн і зеаксантин, як два головних каротиноїди жовтка яєць і тканин птиці, виявили достатньо високу активність у їх антиоксидантному захисті.
Застосування пробіотиків при Т-2 токсикозі
Введення в комбікорм курей культури дріжджів Saccharomyces cerevisiae призводить до деякого уповільнення процесу накопичення МДА, у випадку вільного окислювання ліпідів, тоді як при використанні інших стимуляторів окислювання змін практично не було відзначено. Наявність Т-2 токсину в кормі птиці викликає практично дворазове зниження вмісту ретинолу в печінці, а використані добавки пробіотиків не сприяли відновленню А-вітамінного статусу організму птиці. Знизився рівень каротиноїдів у печінці птиці в присутності Т-2 токсину в кормі, хоча зміни були недостовірними. Збільшення активності перекисних процесів у другій групі призвело до значного (у 2,9 рази) зниження пулу глутатіону, за рахунок його активної відновленої форми, як у крові, так і в печінці птиці, тоді як концентрація окисленого глутатіону була на рівні контролю. Використання культур мікроорганізмів, як Lactobacillus sp., а в більшому ступені і дріжджів Saccharomyces cerevisiae, призвело до дворазового збільшення вмісту глутатіону, що свідчить про позитивний вплив даних пробіотиків на функціонування даної ділянки антиоксидантного захисту. Зниження запасів відновленого глутатіону істотно відбивається на активності всіх трьох досліджуваних глутатіонзалежних ферментів, що вірогідно підвищується при наявності в кормі Т-2 токсину і постійно росте протягом досліду. Особливо це наочно для глутатіонпероксидази, активність якої зросла з початку внесення токсину через три тижні в 3,6 рази. Це пояснюється, імовірно, тим, що підвищення концентрації органічних гідроперекисів при індукції процесів ПОЛ призводить до активації глутатіонпероксидазної реакції, що є основним джерелом окисленого глутатіону. У наших дослідженнях було показано, що використання культур дріжджів і Lactobacillus sp. призводило до зниження інтенсивності накопичення перекисних продуктів окислювання ліпідів, що нормалізувало активність глутатіонзалежних ферментів. Так, активність GPx була нижче контрольних значень, а значення активності інших глутатіонзалежних ферментів наближалися до контрольного. Як було відзначено в попередніх наших дослідженнях, при Т-2 токсикозі відзначено постійне підвищення активності каталази та СОД в еритроцитах протягом усього досліду. Активність СОД не змінювалася під впливом використовуваних пробіотиків, а активність каталази практично поверталася до контрольних показників, зокрема, при використані культури дріжджів. Таким чином, використання пробіотиків сприяло нормалізації картини крові дослідної птиці. Введення пробіотиків на фоні розвитку Т-2 токсикозу викликало достовірне збільшення міцності еритроцитарних мембран, найбільш виражено це проявилося після тритижневого використання дріжджів. Використання ж культури Lactobacillus sp. призводило до зниження інтенсивності гемолітичних процесів, викликаних Т- 2 токсином, тільки на перших етапах її введення.
Використання підвищених доз вітамінів Е, С та селену при Т-2 токсикозі
В групі курей, що одержували Т-2 токсин, відзначено збільшення концентрації дієнових кон’югатів та МДА в еритроцитах, печінці і мозку. У групах, в яких додатково вводилися вітаміни, відзначено достовірне зниження продуктів ПОЛ, особливо воно виражено в мозку. У групі, що одержувала Т-2 токсин, активність ферментів збільшується в порівнянні з контролем, а в групах, де були введені вітаміни, відбувається зниження, причому чим вище доза вітамінів що вводяться, тим помітніше відбувається зниження. Вивчення функціонального стану мембран показало, що максимальні зміни проникності мембран і їхня стійкість до дії гемолітику спостерігається в групі, що одержувала Т-2 токсин. Час гемолізу еритроцитів при мінімальній концентрації кислоти був знижений на 13%, а при максимальній концентрації кислоти було знижено на 3,8%. При цьому в групах, де на фоні Т-2 токсину вводилися вітаміни, показники (активність антиоксидантних ферментів, перекисне окислювання ліпідів при різному стимулюванні) наближалися до контрольних значень, особливо це проявилося в групах з 5-ти кратною дозою вітамінів. Введення вітамінно-мінеральних добавок на фоні розвитку токсикозу значно стабілізує гематологічні показники крові. Було показано, що введення вітамінів на фоні Т-2 токсикозу сприяє підвищенню пулу відновленого і загального глутатіону до рівня контрольних значень. Для вивчення неферментативної гілки антиоксидантних процесів вивчали рівень вітамінів А, С та каротиноїдів у тканинах. Було показано, що при Т-2 токсикозі в печінці знижується рівень вітаміну А та каротиноїдів. У той же час спостерігається підвищення аскорбінової кислоти та її форм. Використання 5-ти кратної дози вітамінів Е, С сприяло підвищенню концентрації вітаміну А та каротиноїдів у печінці до рівня контрольних значень. Будь-яких закономірностей в рівні аскорбінової кислоти та її форм у печінці в 3-5 групах нами не було виявлено. Від 5-ти груп були зібрані яйця, що були закладені на інкубацію, для вивчення розвитку антиоксидантних процесів в ембріогенезі. Дослідження проводилися на ембріонах і добовому молодняку курей. У результаті проведених досліджень було показано, що у добового молодняка, отриманого від курей, що одержували Т-2 токсин, спостерігається активація процесів ПОЛ в печінці і мозку. У той же час у групах курей, де на фоні Т-2 токсикозу вводилися вітамінно-мінеральний комплекс, відзначається зниження рівня МДА як у печінці, так і в мозку, особливо це виражено в 5-й дослідній групі. Можна припустити, що кури, яким вводили підвищені дози вітамінів Е, С та селен, перед внесенням Т-2 токсину, мали підвищену резистентність організму до дії вільних радикалів, ініційованих Т-2 токсином, що відбилося на розвитку ембріонів. Активність глутатіонпероксидази як у мозку, так і в печінці ембріонів, що розвивалися з яєць курей, які одержували Т-2 токсин, була нижче від контролю. Звертає на себе увага той факт, що в добовому віці у ембріонів дослідних груп активність цього ферменту вірогідно підвищується в печінці. У мозку ембріонів просліджується така ж тенденція, за винятком молодняка птиці від курей, що одержували Т-2 токсин, де активність вірогідно вище контролю й інших дослідних груп. Відзначено зниження активності каталази в печінці дослідних груп, що протягом усього досліду залишається нижче контрольних значень. Виражених змін активності антиоксидантних ферментів у ембріонів в групах курей, що одержували вітамінно-мінеральний комплекс на фоні Т-2 токсикозу, не виявлено. Рівень активності каталази в мозку ембріонів курей, що одержували Т-2 токсин, був нижче контролю, а в групі, що одержувала вітаміни і селен, активність ферменту була на рівні контролю. Така ж закономірність виявлялася у відношенні СОД у мозку і печінці. Показники активності ключових антиоксидантних ферментів дозволяють припустити, що існують різні механізми захисту тканин від ПОЛ в ембріогенезі. Можливо, сукупність цих факторів впливає на розвиток не тільки антиоксидантної системи, але і на розвиток інших систем, що виявляється в розвитку ембріональної патології і підвищеної смертності ембріонів курей при Т-2 токсикозі. Введення вітамінів Е, С і селену знижує рівень ембріональної смертності і сприяє більш стабільному розвитку ембріонів птахів.
Вплив мікроелементних композицій на антиоксидантний статус
курей при Т-2 токсикозі
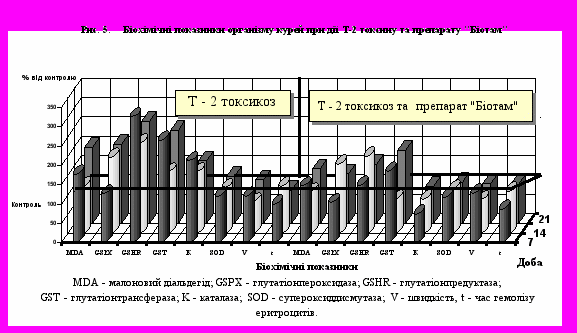
В результаті проведених досліджень, встановлено, що на 21-у добу після введення Т-2 токсину в печінці вірогідно підвищується зміст МДА на 37-52%, мозку - на 16-23% і еритроцитах - на 37-96% в порівнянні з контролем. При цьому найбільш чутливими відзначаються еритроцити. При спільному введенні Т-2 токсину і препарату «Біотам» відзначено значне зниження інтенсивності накопичення МДА: у гепацитах його вміст збільшився всього лише на 4-10%, у мозку - на 0,6-2,3% і еритроцитах на 2,7- 40% щодо контрольної групи, що було істотно нижче показників при введенні Т-2 токсину. Введення власне препарату «Біотам» в раціон курей призводило до зниження вмісту МДА в гепацитах на 9-19%, у тканинах мозку - він був на рівні контролю. Таким чином, препарат «Біотам» нівелював негативну дію Т-2 токсину на накопичення МДА в тканинах, виявляючи антиоксидантний ефект. З цією метою була вивчена динаміка вмісту МДА в еритроцитах при Т- 2 токсикозі і застосуванні препарату «Біотам». Протягом усього досліду при Т-2 токсикозі спостерігається підвищення вмісту МДА до 96 %, однак, на 14 добу помітно невелике зниження процесів ПОЛ до 14-22 %. Підтвердженням цього є дані про підвищений вміст дієнових кон’югатів у плазмі крові до рівня 17,58 1,07 мкг/ мл (р 0,01) в групі, що одержувала Т-2 токсин щодо контролю 9,35 1,18 мкг/ мл. Препарат «Біотам» при Т-2 токсикозі знижував рівень ПОЛ на 7-у добу на 15-25%, на 14-у - на 17-30%, на 21-у – на 35-50%. При введенні 5-кратної дози препарату «Біотам» відзначено достовірне зниження ПОЛ до рівня контролю на 14-у добу досліду. Власне препарат «Біотам» сприяв підвищенню пулу відновленого глутатіону на 94%, а у випадку наявності у кормі Т-2 токсини підтримує його на рівні контролю. Особливо помітний захисний ефект «Біотаму» виявляється при введенні 5-кратної кількості цього препарату. При цьому звертає на себе увагу підвищення активності GSH-S-T. Зменшення вмісту відновленого глутатіону і збільшення активності GSH-R свідчить про підвищення кон'югації трипептиду з алкіруючим агентом, що викликає утворення відповідних кон’югатів на ранніх термінах надходження токсину в організм. Можливо, зниження рівня відновленого глутатіону може бути пояснено й утворенням тіолових кон’югатів з різними формами Т-2 токсину. Не виключена можливість, крім ферментативного зв'язування, і прямої взаємодії відновленого глутатіону з Т-2 токсином. Посилення активності GSH-R пояснюється також тим, що фермент відіграє стабілізуючу роль у підтримці клітинного пулу відновленого глутатіону, що необоротно витрачається у процесі кон'югації з Т-2 токсином і вільними радикалами, що утворилися у результаті ліпорероксидації. У 4-5 групах, де вводився препарат «Біотам» разом з Т-2 токсином, відзначалося також підвищення активності цього ферменту, але вона була значно нижче, ніж у групі, що одержувала Т-2 токсин. При введенні препарату відзначалося підвищення відновленої форми глутатіону у всіх досліджуваних тканинах і нормалізація активності глутатіонзалежних ферментів в еритроцитах. При розвитку інтоксикації відбувалося зменшення часу гемолізу навіть при низьких концентраціях (0,0028 N) соляної кислоти, одночасно при збільшенні майже в у рази швидкості проникнення гемолітика через мембрану. У більш тривалому періоді використання препаратів, відбувалася нормалізація показників кислотного гемолізу. "Біотам" викликав вірогідне збільшення міцності еритроцитарних мембран, час гемолізу збільшувався на 117 %, при зниженні швидкості на 82%. При цьому значення часу і швидкості було на рівні контрольних значень. Той самий ефект зберігався в умовах спільного застосування Т-2 токсину та "Біотаму" (Рис. 5). Таким чином, внесення препарату «Біотам» у раціон батьківського стада птиці, впливає на інтенсивність процесів ПОЛ тканин курей та їхніх ембріонів, і в кінцевому результаті на життєздатності курчат.