Українська академія аграрних наук
| Вид материала | Документы |
- Українська академія аграрних наук, 516.21kb.
- Українська академія аграрних наук, 468.19kb.
- Українська академія аграрних наук, 349.15kb.
- Українська академія аграрних наук, 2736.22kb.
- Українська академія аграрних наук Інститут птахівництва Шаповалов Сергій Олегович, 510.49kb.
- Українська академія аграрних наук, 314.53kb.
- Міністерство агропромислової політики україни українська академія аграрних наук інститут, 1034.09kb.
- Державний комітет україни по земельних ресурсах міністерство сільського господарства, 589.46kb.
- Національний науковий центр „інститут аграрної економіки” національної академії аграрних, 319.01kb.
- Програма для вищих аграрних закладів освіти ІІІ іv рівнів акредитації із спеціальності, 165.25kb.




Н
О
Р
М
А



П
О
Р
У
Ш
Е
Н
Н
Я









Рис. 2.1. Схема проведення досліджень
Дослідження активності ферментів та вмісту вітамінів в тканинах ембріонів курей проводилися через день, починаючи з 14-денного віку.
Терміни відбору зразків тканин у ембріонів курей:
- 14-й день інкубації - залишковий жовток, мембрана жовткового мішка
мозок, печінка, м'язи грудні і ніжні;
- 16, 18, 20, 21-й (вивід) день інкубації і добовий молодняк - ті ж зразки + нирки;
Аналогічна схема вивчення динаміки рівнів вітамінів і активності антиоксидантних ферментів в ембріогенезі та добового молодняку була використана і в дослідах на інших видах сільськогосподарської птиці. У кожному досліді була проведена одна закладка по 150 штук яєць від кожного виду птиці. Для дослідження відбиралися такі органи: печінка, мозок, нирки, а також грудні м'язи. Відбір проб проводили в ключові дні розвитку ембріонів в залежності від їхнього виду: замикання алантоїсу, перехід живлення ембріона з білкового типу на жовтковий, а також перенос яєць на вивід. В індиків і качок це відповідало 13, 21 і 25-му дням розвитку; у гусей - 15, 23 і 28-му дню розвитку; у перепелів 11, 17-му дню розвитку.
Терміни відбору зразків тканин у гусенят:
- 15, 23, 28-й день інкубації і добовий молодняк - мозок, печінка, м'язи грудні, нирки.
Терміни відбору зразків тканин у індичат та каченят:
- 13-й день інкубації - мозок, печінка, м'язи грудні;
- 21, 25-й день інкубації і добовий молодняк - ті ж зразки + нирки.
Терміни відбору зразків тканин у перепелів:
- 11, 17-й (вивід) день інкубації і добовий молодняк - мозок, печінка.
За умов вивчення особливостей впливу різних мікотоксинів: Т-2 токсину, зеараленону й аурофузарину на антиоксидантну систему курей-несучок при аліментарному їх надходженні до організму. Для цього в умовах дослідного господарства "Борки" було сформовано 4 групи курей по 30 голів у кожній. Вік птиці на початок досліду - 150 днів. Тривалість досліду склала 6 тижнів.
Контрольна (1-а) група одержувала стандартний комбікорм без внесення добавок мікотоксинів. У раціони дослідних груп курей-несучок були введені мікотоксини: Т-2 токсин (3 - гідрокси – 4 , 15 – диацетокси - 8 - (3 - метил бутрилокси) 12, 13 - епокситрихотецен); аурофузарин – метаболіт нафтохінонової природи гриба Fusarium graminearum [мол. маса 474, C30H18O12, УФ-спектр в етанолі (з=96%) - 243, 268, 378; ІК-спектр (см-1) – 1677(СО-незв’яз.), 1662 (СО-пірон), 1612 (СО-хелат), 1597 (подвійний зв'язок); основні піки в мас-спектрі, m/z, % - 570 (26), 550 (56), 540 (45), 525 (100), 511 (10)], а також зеараленон [мол. маса 318, C18H22O5 Т0пл. = 163 °С, УФ-спектр в метанолі (з=22,9 М/л), мах; нм (): 315 (6240), 274 (13270), 236 (29400)], належить до бета-лактонів резорцинової кислоти, що є метаболітом гриба Fusarium sроrоtrісhіоіdes 2m-15-278 на зерні. Всі фузаріотоксини, що використовувалися в дослідженнях, було виготовлено в лабораторії мікотоксикології Інституту птахівництва УААН. Т-2 токсин і зеараленон вносили до комбікорму методом поступового змішування. Мікотоксини в кристалічному вигляді розчиняли в етиловому спирті для досягнення певної концентрації мікотоксину. Готували кормову добавку шляхом внесення необхідного об’єму спиртового розчину токсину в 1 кг корму. Після випарювання спирту добавку вносили до основної маси корму, ретельно змішували, і такий корм згодовували піддослідним курям. Концентрація Т-2 токсину в кормі дорівнювала 10 мг/кг, зеараленону – 1,6 мг/кг. Аурофузарин вносили до корму у вигляді культури Fusarium graminearum, оскільки кристалічний аурофузарин є розчинним лише в гарячому фенолі або хлороформі, наявність яких у кормах є неприпустимою. Для цього розмелену культуру, із розрахунку 3% від маси корму (вміст аурофузарину в культурі дорівнював 880 мг/кг), ретельно змішували з комбікормом і згодовували птиці. Концентрація аурофузарину в кормі, таким чином, дорівнювала 26,4 мг/кг. Мікотоксини були введені за наступною схемою: кури 2-ї групи одержували Т-2 токсин; кури 3-ї групи - аурофузарин, кури 4-ї групи - зеараленон. Для проведення біохімічних досліджень на початку даного досліду і всіх наступних було забито 5 голів курей з метою визначення вихідних значень різних біохімічних показників. На 14, 21, 30-у добу введення токсинів була відібрана кров для біохімічних досліджень. На 14, 30-у добу введення токсинів і на 14-у добу після виключення їх з корму було забито по 5 голів курей з кожної групи для визначення біохімічних показників у тканинах.
Приймаючи до уваги результати, отримані в першому досліді, метою другого досліду було проведення на фоні розвитку Т-2 токсикозу порівняльних
випробувань різних пробіотиків, зокрема культури Lactobacillus sp. і дріжджів Saccharomyces cerevisiae. Вік птиці на початку досліду - 150 днів. Було сформовано 4 групи курей-аналогів по 30 голів у кожній за наступною схемою: 1 група - контроль; кури 2, 3, 4-ї груп одержували Т-2 токсин у кількості 6 мг/кг корму; кури 3-ї групи одержували культуру Lactobacillus sp. у кількості 20 млрд. клітин на голову; кури 4-ї групи - дріжджі з пивного сусла в кількості 20 млрд. клітин на голову. Введення Т-2 токсину і культур живих мікроорганізмів проводилося протягом трьох тижнів. На 7, 14, 21-у добу введення токсинів і пробіотиків була відібрана кров для біохімічних досліджень. На 21-у добу було забито по 5 голів курей з кожної групи для визначення біохімічних показників у тканинах.
Вивчення впливу мікроелементних композицій в умовах ураження організму курей Т-2 токсином за наступною схемою: був використаний препарат «Біотам», розроблений в Інституті фармакології і токсикології АМН (м. Київ). Препарат містить композицію мікроелементів, у якій знаходяться індивідуальні комплекси металів Zn2+, Cu2+, Co2+, Cr3+, Fe3+, Mn2+ з N-2,3-диметілфенілантраніловою (мефенаміновою) кислотою, а також глюконат кальцію. Вміст мікроелементів в 1 грамі: Zn2+ - 17 мг, Cu2+ - 3,7 мг, Co2+ - 0,35 мг, Cr3+ - 0,3 мг, Fe3+ - 14,5 мг, Mn2+ - 4 мг, N-2,3-диметилфенілантранілової кислоти - 412 мг, глюконат кальцію – 180 мг, та крохмаль, цукор, аеросил до 1 г. Вік птиці на початок досліду - 290 днів. Було сформовано 5 груп курей по 50 голів у кожній. Перша група - контроль; кури 2-ї, 4-ї, 5-ї груп одержували Т-2 токсин у кількості 6 мг/кг корму; кури 3-ї та 4-ї груп - препарат «Біотам» у кількості 20 мг/кг маси тіла; кури 5-ї групи - 5-ти кратну дозу препарату «Біотам» (100 мг/кг маси тіла). Введення Т-2 токсину і препарату «Біотам» проводилося одночасно протягом 3-х тижнів. На 7, 14, 21-у добу введення токсинів і препарату була відібрана кров для біохімічних досліджень. На 21-у добу було забито по 5 голів курей з кожної групи для визначення біохімічних показників у тканинах.
Вивчення особливостей впливу нового удосконаленого препарату «Біотам-2» на антиоксидантну систему курей-несучок при Т-2 токсикозі, а також його впливу на продуктивні і відтворні якості курей проводили за наступною схемою: препарат «Біотам-2» являє собою композицію мікроелементів, створену на основі препарату «Біотам», з додаванням сполучень V5+, Mo6+, Se4+ у виді натрієвих солей: Na2Se3, NaVO3, Na2Mo4. 2H2O. Вміст мікроелементів: V5+ - 0,05 мг, Mo6+ - 0,75 мг, Se4+ - 0,25 мг. Вік птиці на початок досліду - 290 днів. Було сформовано 5 груп курей-аналогів по 50 голів у кожній за наступною схемою: 1 група - контроль; кури 3-ї, 4-ї і 5-ї груп одержували Т-2 токсин у кількості 6 мг/кг корму; кури 2-ї і 4-ї груп - препарат «Біотам-2» у кількості 20 мг/кг маси тіла протягом досліду; кури 5-ї групи - препарат «Біотам-2» у кількості 20 мг/кг маси тіла протягом одного тижня до введення токсину і наступні три тижні на фоні Т-2 токсикозу. Наприкінці досліду від кожної групи курей було закладено на інкубацію по 50 штук яєць для визначення їхніх інкубаційних якостей, а також вивчення становлення антиоксидантної системи в ембріогенезі.
Вивчення впливу підвищених доз вітамінів Е, С та Se, на фоні Т-2 токсину. Вік птиці на початок досліду - 290 днів. Було сформовано 5-ть груп курей аналогів по 20 голів у кожній за наступною схемою: 1-а група - контроль; кури 2-ї, 3-ї, 4-ї, 5-ї - одержували Т-2 токсин у кількості 6 мг /кг корму; 3-ї, 4-ї, 5-ї групи одержували Se у кількості 0,2 мг/кг корму - 2-х кратна доза; 3-ї групи - 3-х кратну дозу вітаміну С - 150 мг/кг корму і вітаміну Е - 30 мг/кг корму; 4-ї групи - 5-ти кратну дозу вітаміну С - 250 мг/кг корму і вітаміну Е - 50 мг/кг корму; 5-ї групи - 5-ти кратну дозу вітаміну С - 250 мг/кг корму і вітаміну Е - 50 мг/кг корму, перші два тижні на фоні Т-2 токсикозу, а потім один тиждень без токсину. Введення Т-2 токсину і вітамінно-мінеральної добавки проводилося протягом 3 тижнів. Наприкінці досліду від кожної групи курей було закладено на інкубацію по 50 штук яєць для визначення їхніх інкубаційних якостей, а також вивчення становлення антиоксидантної системи в ембріогенезі.
Дослідження in vitro проводили з використанням гомогенату мозку ембріонів курей, який був обраний, як тканина, що є найбільш чутливою до ПОЛ [191]. Після декапітації 16-17-добових ембріонів відбирали великі півкулі, промивали холодним фізрозчином і готували 10%-ний гомогенат на 0,15 М фосфатному буфері (рН=7,4). Визначення концентрації малонового діальдегіду проводили як у свіжому, так і в замороженому матеріалі. Встановлено, що швидке заморожування зразків у рідкому азоті і наступне швидке відтаювання не впливає на інтенсивність забарвлення при аналізі [219]. У якості ініціатора ПОЛ вивчався Т-2 токсин. Токсин у кристалічному виді розчиняли в невеликій кількості 96% етанолу, доводили дистилятом до потрібної концентрації. У модельних дослідах використовувалися кінцеві концентрації Т-2 токсину: від 510-6М до 510-4М, які вносили у систему у різних кількостях – від 1 до 100 мкл. У якості антиоксидантних мембранопротекторів використовували -токоферілацетат і -токоферол-спирт, вітамін А-кислоту та чистий ретинол, вітамін К1 і селен у вигляді селеніту натрію. Була проведена оцінка антиоксидантної дії лютеїну, -каротину, зеаксантину та лікопіну. Концентрації антиоксидантних мембранопротекторів підбиралися з реально існуючих концентрацій даної речовини в тканинах організму.
2.2. Методи досліджень
Визначення вітаміну А в печінці проводили за методом Сурая П.Ф. та Іонова І.А. [96]. Принцип методу полягає в тому, що вітамін А-спирт і вітамін А-ефір реагують з ефіратом трифториду бору з утворенням комплексного з'єднання синього кольору, швидкість розпаду якого прямо пропорційна концентрації вітаміну А в пробі. Фотометрування проводили при довжині хвилі =610 нм.
Визначення вітаміну Е проводили за методом Еммері-Енгеля у модифікації Сурая П.Ф. [96] на пластинках “Силуфол”. Суть методу заключається у проведенні лужного гідролізу дослідного зразка, вилученні -токоферолу із фракції, яка не обмилюється органічним розчинником, нанесенні зразка на пластинку і проведенні тонкошарової хроматографічної очистки -токоферолу від супровідних речовин у хлороформі. Для виявлення хроматограми використовували суміш розчинів хлориду заліза (III) і 2,2'-діпіріділу в спирту з утворенням рожево-червоного забарвлення. Для подальшого визначення вітаміну Е забарвлений комплекс елюювали сумішшю речовин, яка складалась з етанолу, соляної і фосфорної кислот і дистильованої води у співвідношенні 6:3:1:2. Після фільтрування одержаний забарвлений розчин колориметрували при = 530 нм.
Визначення вітаміну С в тканинах птиці проводили за модифікованим методом Девятніна В.А. [96]. Принцип методу ґрунтується на екстракції аскорбінової (АК) і дегідроаскорбінової (ДАК) кислот із тканин за допомогою трихлороцтової кислоти. При цьому використовується утворення забарвленого продукту при реакції ДАК с 2,4-дінітрофенілгідразином. Аскорбінова кислота окислюється до ДАК за допомогою 2,6-дихлорфеноліндофеноляту натрію, потім визначається сума АК+ДАК. Вміст АК визначають за різницею між сумою і ДАК.
Визначення каротиноїдів проводили за методом Frigg M. et al. [146] Екстракцію проводили гексаном. Визначали поглинання отриманого розчину на спектрофотометрі при = 442 нм. Розрахунок вели за графіком, побудованому по чистому лютеїну (Sigma) з урахуванням наважки тканини й об’єму отриманого екстракту.
Активність каталази в тканинах визначали за методом Королюка М.А. та ін. [130]. Принцип методу заснований на здатності перекису водню утворювати із солями молібдену стійкий забарвлений комплекс. Інтенсивність забарвлення, вимірювали на спектрофотометрі при = 410 нм. Активність ферменту у еритроцитах виражали в мкМ Н2О2/хв/мг гемоглобіну еритроцитів та у тканинах в мМ Н2О2/годину/мг білку.
Глутатіонпероксидазну активність в тканинах оцінювали спектрофотометрично [74] при = 340 нм (37°С) у спряженій системі з гідроперекисом кумолу як субстрату. Середовище інкубації включало: З мМ ЕДТА; 0,1% тритону Х-100 на 0,1 М трис-HCl буфері з рН-7,0; 50 мкл 50 мМ спиртового розчину кумолу; 10 мкл 25 мМ відновленого глутатіону (GSH), 10 мкл 12 мМ NADPH; 10 мкл зразка (гемолізату еритроцитів або гомогенату печінки) та 10 мкл глутатіонредуктази (“Sigma” США, фермент вносився у надлишку). Активність виражали в U/годину/мг білка, або нМ окисленого NADPH/хв/мкг гемоглобіну еритроцитів.
Глутатіонредуктазну активність в еритроцитах визначали спектрофотометрично при =340 нм (37°С) з окисленим глутатіоном як субстратом. Принцип методу заснований на швидкості окиснення відновленого NADPH2 [77]. До гемолізату додавали 2,5 мл середовища, яке включало: 1 мМ ЕДТА, 0,1% тритону Х-100, 56 мкМ NADPH2 на 50 мМ трис-НС1 буфері рН-7,4. Реакцію ініціювали окисленим глутатіоном до кінцевої концентрації 0,215 мМ. Активність ферменту виражали в нМ окисленого NADP/хвмг гемоглобіну еритроцитів.
Глутатіонтрансферазную активність в еритроцитах визначали спектрофотометрично [247]. Кінетику утворення кон’югованого GSH вимірювали при =340 нм (25°С) по утворенню кон’югатів GSH з 1-хлор-2,4-динітробензолом (ХДНБ). Реакційна суміш містила: 10 мМ глутатіон (відновлений), 1мМ 1-хлор-2,4-динітробензол, 0,1% - й тритон Х-100, 1мМ ЕДТА на 100 мМ К-фосфатному буфері рН-7,4. Активність виражали в мкМ ХДНБ/хв/1 мг гемоглобіну еритроцитів.
Визначення вмісту дієнових кон’югатів у плазмі крові. Концентрацію кон’югованих жирних кислот у плазмі крові визначали за методом І. Стальної [94]. В основі методу лежить властивість спряжених подвійних зв'язків поглинати випромінювання при довжині хвилі 233 нм. При визначені кількості дієнових кон’югатів жирних кислот використовували коефіцієнт молярної екстинції 2,2 х 10-5 М-1 см-1. Концентрацію дієнових кон’югатів виражали в мкМ/л.
Визначення вмісту малонового діальдегіду в тканинах.
Визначення в тканинах малонового діальдегіду як одного з кінцевих продуктів ПОЛ здійснювали за методом Ohkawa H. et al. [195]. Зразок тканини гомогенізували в 0,15М фосфатному буфері, потім до гомогенату додавали для стимуляції перекисного окиснення іони Fe++ та аскорбінову кислоту і інкубували розчин на бані при 37 оС протягом 30 хвилин. Після зупинки реакції за допомогою трихлороцтової кислоти розчин центрифугували і до рідини над осадом додавали 0,7% розчин тіобарбітурової кислоти (ТБК), виготовленої на 0,3% розчині додецилсульфату натрію. Після закінченні інкубації проби на киплячій водяній бані з'являється червоне забарвлення, яке вимірювали при 532 нм.
Визначення вмісту глутатіону в тканинах. Принцип методу полягає в тому, що глутатіон, реагуючи з надлишком аллоксану, утворює з'єднання, що має максимум поглинання при довжині хвилі 305 нм і тому умовно назване «аллоксан-305» [115]. При цьому комплекс, що утворився: «аллоксан-305» прямо пропорційний вмісту відновленого глутатіону в пробі. Вміст глутатіону в тканинах виражали в мг%. Визначення форм глутатіону в крові проводили за методом Вудварда і Фрі, описаному Петрунькіною А.М. [80]. Вміст глутатіону в еритроцитах виражали в мг/мл.
Визначення біофізичних і клінічних параметрів еритроцитів та крові.
Визначення біофізичних і клінічних параметрів еритроцитів та крові проводили на базі лабораторії протирадіаційних препаратів Інституту медичної радіології АМНУ. Вміст гемоглобіну (Hb), кількість еритроцитів, гематокрітне число (Ht), визначали на гематологічному аналізаторі «Sysmex» (Японія).
Стійкість еритроцитів до кислотного гемолізу вивчали на автоматичній установці Kinetic Shapemeter SH-01 (Німеччина) за часом гемолізу еритроцитів і швидкості проникнення гемолітика через мембрану при двох різних концентраціях НСl з одержанням графічного зображення процесу гемолізу на IBM-PC. Електричні параметри електромеханічної стабільності еритроцитарних мембран вивчали шляхом виміру сили струму і напруги електричного пробою (Ima, Umv), відношення провідності та питомого опору еритроцитів до і після електричного пробою мембран, що виникає під впливом зовнішнього електричного поля, а також морфологічні зміни еритроцитів: величину середнього об’єму та діаметру, гістограми їхнього розподілу, досліджували на електроцитоаналізаторі ЕЦА-02 (Україна).
Статистичну обробку проводили з використанням t-критерію Стъюдента [67] і непараметричного критерію U- Вілкоксона-Манна-Уітні [30]. При обробці даних використовували програми Statistica 5.5A і Matlab V.6.0.
- Характеристика використаних реактивів
В роботі використовувались такі реактиви: нітротетразолій синій, NADPH, феназинметасульфат, трис(оксиметіл)амінометан (Reanal, Угоршина); тритон Х-100 (Ferak, Німеччіна); глутатіонредуктаза, глутатіон окисленний та відновлений, гідроперекис кумолу, FeSO4 (Sigma, США) і реактиви вітчизняного виробництва кваліфікації ЧДА, ХЧ і ОСЧ.
РОЗДІЛ 3
ОСНОВНІ РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ
3.1. Вікові і тканинні особливості функціонування антиоксидантної системи у птиці в ембріогенезі
3.1.1. Динаміка вмісту вітамінів А, Е, С в організмі ембріонів різних видів птиці
П
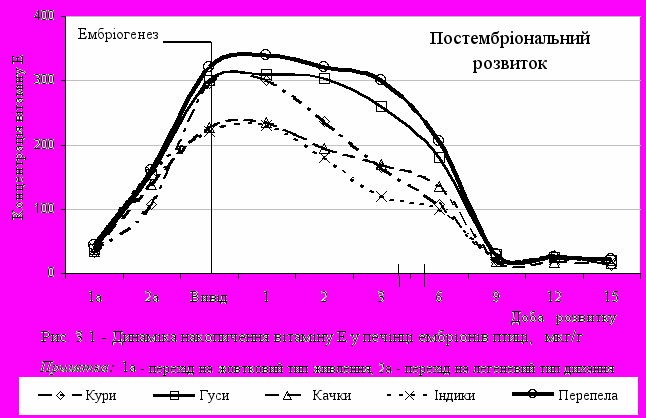
ри вивчені видових особливостей вмісту вітаміну Е у печінці ембріонів сільськогосподарської птиці було відзначено, що його концентрація протягом ембріонального розвитку поступово зростає і досягає свого максимуму на момент виводу молодняку та першу добу життя (рис. 3.1): у курчат вона становила 296,2 - 300,9 мкг/г; індичат 221,8 - 230,7 мкг/г; гусенят 301,5 - 305,7 мкг/г; каченят- 227,1 - 235,5 мкг/г; перепелят- 320,4 - 340,2 мкг/г. Найвищою вона була у гусенят та перепелів.
Нами показано, що до 9-ї доби постнатального розвитку концентрація вітаміну Е поступово знижується у всих видів птиці і потім знаходиться у визначеному діапазоні.
Як слідує з даних, представлених на рисунку 3.1 динаміка накопичення цього природного антиоксиданту в ембріогенезі та ранньому постнатальному онтогенезі аналогічна у всіх вивчених видів птиці. Печінка була обрана як орган, що характеризується найвищою концентрацією вітамінів А, Е і каротиноїдів [226]. Крім того, печінка відрізняється досить високою концентрацією аскорбінової кислоти і відновленого глутатіону. Після першої доби постнатального розвитку нами було показано, що концентрація вітаміну Е поступово зменшується у всіх вивчених видів сільськогосподарської птиці. На 9-ту добу розвитку вміст цього природного антиоксиданту стає практично однаковим у всієї птиці.
Приведені результати узгоджуються з літературними джерелами. Так, у дослідженнях Іонова І.А. [42] динаміки рівню вітаміну Е в печінці ембріонів курчат було показано, що концентрація -токоферолу максимальна в цьому органі у добових курчат зростаючи з 76,7 мкг/г у 15- добових ембріонів до 336,6 мкг/г у момент виводу при одночасному зниженні рівня цього вітаміну в залишковому жовтку (з 80,9 до 34,8 мкг/г протягом 12-21 доби інкубації). Після виявлення перерозподілу вітаміну Е між залишковим жовтком, мембраною жовткового міхура та печінкою ембріону в процесі інкубації було висловлено припущення, що мембрана жовткового міхура, яка служить продовженням шлунково-кишкового тракту ембріонів птиці. Також було показано, що вона приймає активну участь в адсорбції поживних речовин, включаючи вітаміни, із залишкового жовтка, і, таким чином, стає зрозумілим механізм накопичення вітаміну Е у печінці в момент виводу. Спочатку вітамін Е адсорбується мембраною жовткового міхура із жовтка. Це відбувається на більш ранніх стадіях інкубації. Після цього вітамін Е з мембрани жовткового міхура через кровоносну систему ембріону переходить в печінку, де й здійснюється його накопичення. У наших дослідженнях таку високу концентрацію вітаміну Е у печінці добового молодняку можна пояснити рядом факторів. По-перше, практично весь запас вітаміну Е яєчного жовтка перерозподіляється через жовткову мембрану в печінку ембріону. Загальна ж кількість токоферолу в середньому жовтку курячого яйця (біля 16 г) досягає 2000-2500 мкг. Певно, така кількість вітаміну Е необхідна для використання його в перші дні після виводу з яйця і повинна виконувати роль "стартового запасу" -токоферолу, а також для забезпечення адекватного антиоксидантного статусу на момент виводу. По-друге, іншою причиною високої концентрації -токоферолу в печінці добових курчат є відсутність у їхній печінці активної форми NADH-залежної хiнонредуктази, що забезпечує подальшу утилізацію -токоферилхiнону – головного продукту обміну вітаміну Е. Внаслідок цього останній накопичується в печінці і, таким чином, надалі гальмує перетворення -токоферолу. Забезпечення адекватної антиоксидантної здатності, зокрема високої концентрації вітаміну Е в печінці на різних стадіях розвитку ембріонів, необхідне для захисту підвищеного рівня ненасиченості в ліпідах ембріонів. Роботи в цьому напрямку були розпочаті недавно і являють собою лише перші спроби пояснити захисний механізм дії вітаміну Е у тканинах курчат в ембріогенезі. Вивчення фізіологічної ролі високих концентрацій природного антиоксиданту, яким є вітамін Е, у печінці добових курчат пов'язане з високою інтенсивністю ПОЛ в їхніх тканинах на цей період [42]. При цьому необхідно особливо відзначити, що разом із зростанням концентрації -токоферолу в печінці ембріонів до моменту виводу відбувається одночасне зниження рівня малонового діальдегіду в ній. У цілому, слід зазначити, що накопичення вітаміну Е в печінці ембріону відіграє вирішальну роль у забезпеченні цим вітаміном курчат перших днів життя [76]. Наведені результати дозволяють по-новому поглянути на функцію вітаміну Е в ранній постнатальний період розвитку курчат. Враховуючи той факт, що момент виводу є дуже сильним стрес-фактором, висока концентрація вітаміну Е в печінці - органі, який активно приймає участь в метаболізмі та регуляції розподілу вітаміну Е між іншими тканинами - є цілком зрозумілою. До того ж потрібно враховувати високий рівень ПНЖК ліпідів тканин курчат у момент виводу. Слід особливо підкреслити, що вітамін Е присутній у печінці ембріонів та добового молодняку виключно у формі альфа-токоферолу-спирту [42], а відомо, що вітамін Е здатний виконувати свої антиоксидантні функції лише у такій формі. У той же час активність ферментів ацилювання-деацилювання в організмі курчат у момент виводу дуже низька, і ця ферментна система практично не функціонує [32]. Це і є біологічним сенсом високої концентрації вітаміну Е саме у формі вільного токоферолу. Збільшення концентрації вітаміну Е в ембріональних тканинах, що досягає максимальних величин до моменту виводу молодняку, розглядається в якості еволюційно-закріпленого пристосувального механізму захисту від кисневого стресу в момент виводу [225, 229]. Зміна ембріональної гіпоксії на відносну гіпероксію є еволюційно детермінованою і не в змозі викликати різке порушення гомеостазу. Взаємозв'язок між процесом перекисного окиснення ліпідів та рівнем -токоферолу визначений також у роботі Калітки В. В. і Донченка Г. В. [47], в якій виявлені вікові особливості функціонування ферментативної антиоксидантної системи курчат у постнатальному онтогенезі. Показано, що недостатність захисту організму курчат від активних форм кисню в другій та третій декадах життя призводить до зміщення окислювальних процесів у бік вільнорадикальних. У ранньому постнатальному онтогенезі відзначається зниження концентрації вітаміну Е в печінці усіх видів птиці. Ці дані погоджуються з даними інших дослідників, які показали, що після виводу курчат за перші два тижні постнатального розвитку концентрація вітаміну Е в їхній печінці знижується більше, ніж у 10 разів [229]. Аналогічні дані отримані на індичатах, каченятах і гусенятах [225].
Вивчення динаміки накопичення вітаміну А в ембріогенезі і ранньому постнатальному онтогенезі сільськогосподарських видів птиці показало, що концентрація вітаміну А в печінці ембріонів гусей і індиків була в 2-2,5 рази більше ніж у печінці ембріонів курей і також постійно збільшується в процесі інкубації (рис. 3.2). У дослідженнях Іонова І.А. [42] також встановлено постійне збільшення концентрації вітаміну А в печінці ембріонів курей у процесі інкубації. Так, на 12-ту добу інкубації ця величина становила 12 мкг/г, в момент виводу курчат вона збільшилася до 21 мкг/г, в добовому віці вже була 22,8 мкг/г. Одночасно з цим було також відзначено зменшення концентрації вітаміну А в мембрані жовткового міхура (з 15 до 5 мкг/г) та залишковому жовтку (з 2,4 до 0,5 мкг/г) у 12-добових ембріонів та добових курчат відповідно.
Ж

овток курячих яєць не містить вітаміну С і C-вітамінна забезпеченість ембріонів курей у процесі ембріонального розвитку підтримується за рахунок синтезу АК жовточною мембраною. Синтез АК у жовточній мембрані, певно, розпочинається на ранніх стадіях ембріогенезу, оскільки вже на 10-ту добу інкубації в мембрані спостерігається найвища концентрація цього вітаміну. Надалі відбувається швидке зниження концентрації АК в мембрані та після виведення у 3-денних курчат виявити вітамін С в ній не вдалося. Таку динаміку АК у мембрані можна пояснити з одного боку - активним транспортом синтезованого вітаміну до тканин для забезпечення їх потреб у цьому вітаміні в процесі розвитку. З іншого боку - не виключено, що синтетична активність мембрани з віком знижується, досягаючи мінімуму після появи пташенят, коли вищезгадану функцію починають здійснювати нирки. На користь останнього свідчать існуючі літературні дані про те, що активність гулонолактоноксидази - ферменту, який забезпечує синтез АК у нирках ембріонів курей, істотно підвищується в період 17-19-ї доби інкубації [42].
При вивченні динаміки накопичення та розподілу аскорбінової кислоти в ембріогенезі курчат було відзначено значне збільшення рівня вітаміну С у мозку курчат протягом 11-19-ї діб інкубації: з 130,5 до 665,4 мкг/г, згодом ця величина дещо знижувалася до рівня 603,2 мкг/г на 21-у добу інкубації, а у добових курчат становила 577,3 мкг/г (рис. 3.3).
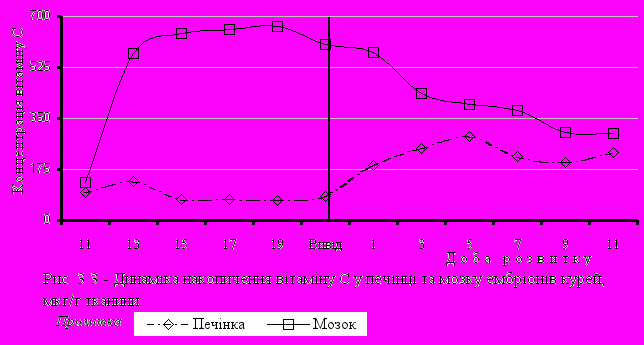 Особливої уваги заслуговують високі концентрації АК в мозку ембріонів курчат у процесі їх розвитку. Так, концентрація АК у даному органі переважала рівень цього вітаміну в ембріональній печінці у 3-5 разів. Максимальне підвищення концентрація АК у мозку виявлялося на 14-ту добу інкубації, аналогічно печінці. З моменту виводу та до 9-ї доби постнатального розвитку концентрація вітаміну С в мозку зменшувалась, а в печінці збільшувалась. На 11-у добу розвитку вміст цього вітаміну в мозку та печінці був приблизно однаковим. Печінка відіграє важливу роль у метаболізмі АК людини та тварин. Вона є головним органом, який забезпечує перерозподіл цього вітаміну між органами та тканинами в процесі розвитку. Однією з філогенетичних особливостей птиці є синтез АК у нирках, на відміну від ссавців та інших видів тварин, у яких вітамін С синтезується в печінці. Важливість накопичення антиоксидантів в ембріональній печінці пов'язана не тільки з підвищеною метаболічною активністю цього органу і високим ступенем поліненасиченості ліпідів, але також відображає необхідність захисту від високих концентрацій заліза в цьому органі, що в стрес-умовах може стимулювати ПОЛ. Виключно висока концентрація АК в ембріональному мозку курчат ставить питання про її значну фізіологічну роль у цей період розвитку. Ембріональний мозок птиці є особливо чуттєвими до окисних ушкоджень з причини дуже високої концентрації високополіненасичених (С20-С22) жирних кислот у фосфоліпідах нейронів [190]. Ендогенні рівні природних антиоксидантів, таких як вітамін Е, здатних зв'язувати вільні радикали, відіграють важливу роль у підтримці цілісності мембран клітин мозку [176].
Особливої уваги заслуговують високі концентрації АК в мозку ембріонів курчат у процесі їх розвитку. Так, концентрація АК у даному органі переважала рівень цього вітаміну в ембріональній печінці у 3-5 разів. Максимальне підвищення концентрація АК у мозку виявлялося на 14-ту добу інкубації, аналогічно печінці. З моменту виводу та до 9-ї доби постнатального розвитку концентрація вітаміну С в мозку зменшувалась, а в печінці збільшувалась. На 11-у добу розвитку вміст цього вітаміну в мозку та печінці був приблизно однаковим. Печінка відіграє важливу роль у метаболізмі АК людини та тварин. Вона є головним органом, який забезпечує перерозподіл цього вітаміну між органами та тканинами в процесі розвитку. Однією з філогенетичних особливостей птиці є синтез АК у нирках, на відміну від ссавців та інших видів тварин, у яких вітамін С синтезується в печінці. Важливість накопичення антиоксидантів в ембріональній печінці пов'язана не тільки з підвищеною метаболічною активністю цього органу і високим ступенем поліненасиченості ліпідів, але також відображає необхідність захисту від високих концентрацій заліза в цьому органі, що в стрес-умовах може стимулювати ПОЛ. Виключно висока концентрація АК в ембріональному мозку курчат ставить питання про її значну фізіологічну роль у цей період розвитку. Ембріональний мозок птиці є особливо чуттєвими до окисних ушкоджень з причини дуже високої концентрації високополіненасичених (С20-С22) жирних кислот у фосфоліпідах нейронів [190]. Ендогенні рівні природних антиоксидантів, таких як вітамін Е, здатних зв'язувати вільні радикали, відіграють важливу роль у підтримці цілісності мембран клітин мозку [176]. Особливо треба підкреслити відносно низьку концентрацію вітаміну Е в мозку ембріону (2-3 мкг/г), що практично не змінюється на протязі всього періоду ембріонального розвитку і збільшується лише в момент виводу курчат [277]. В той же час ембріональний мозок характеризується дуже високим ступенем ненасиченості ліпідів [240, 242]. Таким чином, антиоксидантна система мозку функціонує з високою напругою і цілком природною є поява випадків енцефаломаляції курчат раннього віку, які споживають корм, дефіцитний за вітаміном Е. Ембріональний мозок практично не містить каротиноїдів і характеризується присутністю іонів заліза в високих концентраціях [204].
Антиоксидантна система мозку відіграє важливу роль у захисті цієї тканини від окисних ушкоджень, які призводять до розвитку специфічного захворювання - енцефаломаляції [98, 180]. Дане захворювання розвивається в умовах Е-вітамінної нестачі при підвищеному рівні ПНЖК [138], пов'язане з інтенсифікацією ПОЛ у мозочку [145] і характеризується локальними гемораргіями та некротичними змінами в мозочку, що призводять до атаксії з наступною смертю курчат [159, 199].
Таким чином, у результаті проведених досліджень встановлено, що в печінці зародків курчат у процесі інкубації відбувається збільшення концентрації вітамінів А, Е. Даний процес забезпечує максимальне накопичення вітамінів А, Е в печінці курчат до моменту виводу. Такий вміст вітаміну С в мозку, можливо сприяє регулюванню процесів ПОЛ в мозку. Крім цього висока концентрація вітаміну С у мозку, можливо, необхідна для підтримки інтенсивного відновлення токоферолу при його рециулізації. Шляхи антиоксидантного захисту ембріонального мозку від посиленого ПОЛ в момент виводу курчат, коли має місце значне підвищення рівня кисню, доступного для тканинних ліпідів, залишаються поки що не з'ясованими. Деяку ясність в це питання внесли отримані нами дані, які свідчать, про те, що ембріональний мозок характеризується дуже високою концентрацією аскорбінової кислоти.
3.1.2. Тканинні особливості активності антиоксидантних ферментів у
ембріонів різних видів птиці
Крім вмісту нативних водо- та жиророзчинних антиоксидантів у клітинах ембріонів, одним з важливих показників антиоксидантної статусу організму є активність антиоксидантних ферментів, яка регулює інтенсивність вільнорадикальних процесів. Інтенсифікація процесів переокиснення ліпідів призводить до накопичення перекисних сполук, які порушують структуру і властивості мембран, викликають інактивацію ферментів, що взагалі, змінює клітинний метаболізм.
За умови промислового утримання сільськогосподарської птиці різні технологічні заходи призводять до порушення гомеостазу, відбувається постійне пристосування організму до дії стрес-факторів, де ПОЛ виступає, як індикатор адаптаційних реакцій. Зміна ПОЛ в межах фізіологічної норми здійснюється завдяки збереженню антиоксидантного гомеостазу. Діяльність усіх компонентів антиоксидантної системи спрямована на збалансування про- і антиоксидантної рівноваги. Нами було вивчено активність ферментів супероксиддисмутази, глутатіонпероксидази, каталази.
Показано, що динаміка активності каталази і супероксиддисмутази в печінці ембріонів курей (табл. 3.1 і 3.2) характеризується тенденцією до збільшення її активності в процесі розвитку з різким і вірогідним (у 1,5-2,4 рази) збільшенням на останніх етапах ембріогенезу з піком на 20-добу розвитку ембріонів. Аналогічна динаміка була відзначена і для інших тканин, окрім мозку. За отриманими даними активність каталази мозку ембріонів курей з 14-ї по 20-у добу розвитку поступово зменшувалась та залишалася на цьому рівні і у добових курчат.
Таблиця 3.1
Активність каталази в тканинах ембріонів курей, мМ H2O2/год/мг білку
| Тканини | Доба інкубації | |||||
| 14 | 16 | 18 | 20 | Вивід | Добові курчата | |
| Печінка | 100,7 8,1 | 69,6 5,14 | 124,2 11,7 | 240,0 23,1 | 193,2 18,2 | 162,6 15,1 |
Мозок | 40.6 4.19 | 37.7 3.65 | 20.9 2,71 | 18,0 1,33 | 21,4 1,98 | 20,3 2,14 |
| Ніжні м'язи | 21,9 3,14 | 25,9 2,79 | 6,7 0,52 | 10,0 1,27 | 12,0 1,88 | 13,2 1,22 |
| Грудні м'язи | 19,8 1,66 | 19,3 1,72 | 8,6 0,73 | 8,1 0,64 | 10,4 1,03 | 9,6 0,82 |
| Мембрана жовткового міхура | 45,4 3,78 | 42,2 4,35 | 41,3 5,19 | 47,1 3,44 | 41,7 4,21 | 31,9 2,88 |
| Нирки | - | 147,2 13,2 | 119,2 10,1 | 135,3 12,6 | 166,9 15,1 | 164,0 15,9 |
