Українська академія аграрних наук
| Вид материала | Документы |
- Українська академія аграрних наук, 516.21kb.
- Українська академія аграрних наук, 468.19kb.
- Українська академія аграрних наук, 349.15kb.
- Українська академія аграрних наук, 2736.22kb.
- Українська академія аграрних наук Інститут птахівництва Шаповалов Сергій Олегович, 510.49kb.
- Українська академія аграрних наук, 314.53kb.
- Міністерство агропромислової політики україни українська академія аграрних наук інститут, 1034.09kb.
- Державний комітет україни по земельних ресурсах міністерство сільського господарства, 589.46kb.
- Національний науковий центр „інститут аграрної економіки” національної академії аграрних, 319.01kb.
- Програма для вищих аграрних закладів освіти ІІІ іv рівнів акредитації із спеціальності, 165.25kb.
О Р Г А Н І З М

Природні
антиоксиданти
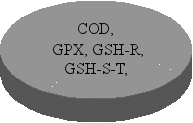
Ферментативна
антиоксидантна система

Низькомолекулярні антиоксиданти

Фермент-
імітуюча дія

Репараційна
система

Металозалежна система



Ксенобіотики
Токсини
Мікотоксини
Авітамінози:
Стрес
Ендотоксини
Хвороби:


Важкі метали
Температура
УФ
А, Е, С
Мікроелементози:
вірусні
Фактори ініціації та генерації
вільних радикалів
Аліментарні
фактори
Екологічні
фактори
Ендогенні
фактори
Гіпероксія
Радіація
Zn, Se, Mn, Mo
Гіпервітамінози
бактеріальні
Алергії
Рис. 1.1. Взаємодія антиоксидантної системи і системи генерації вільних радикалів
1.2. Антиоксидантна система захисту клітинних структур
в організмі тварин
Захист організму тварин від деструктивної дії продуктів перекисного окиснення ліпідів забезпечує антиоксидантна система. У процесі еволюції в організмі тварин виникли захисні системи проти активних форм кисню і вільних радикалів, які діляться на дві групи: неферментативну (сполуки фенольного ряду, сірковмісні сполуки, антиоксидантні вітаміни) та ферментативну (каталаза, супероксиддисмутаза, глутатіонпероксидаза, глутатіон-S-трансфераза). Кожний з наведених компонентів антиоксидантної системи діє у тісному взаємозв'язку між собою і забезпечує регуляцію перекисних процесів в організмі тварин. Стосовно до теми дисертаційної роботи в огляді літератури розглядається роль вітамінів Е, С і А, глутатіонпероксидази, глутатіонредуктази, глутатіонтрансферази, каталази і супероксиддисмутази у регуляції процесів ПОЛ в клітині.
1.2.1. Біологічна роль антиоксидантних ферментів.
Супероксиддисмутаза (СОД) (КФ 1.15.1.1); каталізує реакцію:
О2˙– + О2˙– + 2Н+ 1 О2 + Н2О2
У результаті цієї реакції утворюється пероксид водню, здатний інактивувати СОД [126, 135]. Тому СОД локалізована і функціонує звичайно разом з каталазою, яка ефективно розкладає Н2О2. Активний центр ферменту містить атоми металів зі змінною валентністю. У залежності від структури ферменту і металу, що входить в активний центр ферменту, виділяють Сu, Zn-СОД (знаходиться у цитоплазмі, у меншій кількості - в мітохондріях та ядрах; інгібірується ціанідами). У матриксі мітохондрій присутня марганцевовміщуюча СОД (Мn-СОД). У загальному об’ємі супероксиддисмутазної активності частка Мn-СОД невелика і складає близько 15% [169]. Fe-СОД у еукаріотів міститься лише в невеликій кількості у мітохондріях. Введення Сu та Zn у вигляді високодисперсних порошків змінює активність СОД, особливо виражені антиоксидантні властивості має Zn-СОД [36]. СОД відноситься до числа дуже стійких ферментів.
При рН-11,4 і температурі 24 °С СОД зберігає активність 24 од., а в 86 % етанолі через 3 год. зберігається 90 % її активності [146].
Таким чином, Мn,Сu,Zn-СОД - найважливіші антиоксидантні ферменти, що здійснюють інактивацію супероксидного радикалу і відповідно зменшують загальний токсичний ефект кисню, його активних форм.
Каталаза (КФ 1.11.1.6) - гемопротеїд, який каталізує реакцію:
Н2О2 + Н2О2 О2 + 2Н2О
Реакція протікає у дві стадії: спочатку утворюється комплекс ферменту з однією, потім - із другою молекулою пероксиду водню. Каталаза здатна реагувати і з іншими донорами водню; у цьому випадку комплекс ферменту з однією молекулою пероксиду реагує із субстратами подібно пероксидазі [103]:
Каталаза + Н2О2 + RH R' + 2Н2О + Каталаза
Швидкість каталізу винятково велика: одна молекула каталази в секунду розкладає до 44 тис. молекул пероксиду водню; пероксидазна активність каталази істотно нижче [70]. Основна функція каталази в клітині - розкладання пероксиду водню, що утвориться при дисмутації супероксидного аніон-радикалу [133]. Найбільш висока активність каталази відзначена у гепатоцитах, у пероксисомах останніх фермент складає до 40 % усього білка [209]. Таким чином, СОД і каталаза, функціонуючи разом, інактивують активні форми кисню, що утворюються як у процесі нормальної життєдіяльності клітин, так і в умовах значної активації ПОЛ, у тому числі патологічно обумовленої. Однак найбільш ефективно ПОЛ активується в ліпідних (фосфоліпідних) структурах біомембран і супроводжується утворенням ліпідних пероксидів, які недостатньо усуваються системою СОД - каталаза. Крім того, навіть в умовах успішної дезактивації супероксиду (СОД) і пероксиду водню (каталаза) існує небезпека утворення особливо високо реактивного радикалу 'ОН за реакцією Хабер-Вайсса [158].
Н2О2 + О2˙– ОН– + О2 +˙ОН
Час життя 'ОН настільки мізерний, що його ферментна інактивація, мабуть, неможлива; потрібні інші механізми захисту. Очевидно, наявності цих двох ферментів недостатньо для повного й ефективного антиоксидантного захисту. Глутатіонзалежна антиоксидантна система включає три глутатіонзалежні ферменти: глутатіонпероксидаза (GPx), глутатіонредуктаза (GSH-R) і глутатіонтрансфераза (GSH-S-T). Центральне місце системи - трипептид глутатіон, що має і власну антиоксидантну активність і функціонує у якості кофактора донора водню, метаболіту і субстрату з ферментами системи також із СОД та каталазою. З функціональної точки зору в антиоксидантній системі глутатіону можна виділити чотири ланки:
1) забезпечення функціонування системи - GSH-R;
2) детоксикації пероксидних сполук - GPx і каталаза;
3) антирадикального захисту - СОД і GSH;
4) детоксикації електрофільних сполук - GSH-S-T.
Глутатіонредуктаза (GSH-R) (К.Ф. 1.6.4.2) каталізує реакцію:
2 NADPH + GSНG 2 NADP + 2GSH
Центральне місце цього ферменту в метаболізмі глутатіону та всієї його системи зв'язане з тим, що він здійснює єдиний відомий механізм відновлення GSH з його окисленої форми GSНG. Інші ферменти, крім глютатіонсинтетаз, є споживачами відновленого глютатіону. GSH-R - класичний цитозольний фермент усіх еукаріотичних клітин. Основне біологічне значення GSH-R полягає у підтримуванні високого рівня GSH і низького GSHG і, отже, високого відношення GSH/GSHG [168, 250], що дозволяє значно зменшити потребу в синтезі GSH. Важливість і ефективність функціонування GSH-R підкреслюється трьома основними фактами: 1) швидкість відновлення GSHG у більшості тканин вище, ніж синтезу GSH [28]; 2) у клітині рівень GSH є переважним; 3) GSH-R утилізує більше NADPH, ніж інші реакції. Робота GSH-R завжди сполучена з ферментами, що окисляють GSH у GSHG у результаті відновлення як перекисів (GPx і GSH-S-T), так і дисульфідів.
Глютатіонпероксидаза (GPх) (К.Ф.11.1.9), каталізує реакцію:
2GSH + Н2О2 GSНG + 2 Н2О
GPX – селенопротеїн, GPх знешкоджує не тільки Н2О2, але й органічні, у тому числі ліпідні, пероксиди, що утворюються в організмі при активації ПОЛ [72, 133, 157].
2GSH + ROOH GSНG + 4ROOH
Фермент локалізовано переважно у цитозолі клітин, у незначній кількості він знаходиться також у мікросомах [133]. Функціонує спільно з GSH-R, захищаючи клітини від генеруючого поза їхньою дією пероксиду водню [155]. Активний центр GPх містить чотири ковалентно зв'язаних атоми Se у формі селеноцистеїну. При нестачі Se у раціоні харчування зменшується рівень GPх у клітинах, що знижує стійкість тварин до окисного ураження [139] і може призводити до розвитку аналогічної авітамінозу Е вільнорадикальної патології (білом’язова хвороба), для якої характерні некроз та ожиріння печінки, руйнування еритроцитів [214]. Спорідненість GPх до Н2О2, вище, ніж у каталази, тому перша ефективніше працює при низьких концентраціях субстрату, у той же час як у захисті клітин від окисного стресу, викликаного високими концентраціями Н2О2, ключова роль належить каталазі [139, 214].
Глутатіонтрансфераза (GSH-S-T) (К.Ф.2.5.18), каталізує реакції типу:
RX + GSH НХ + GSR
GSH-S-T локалізовані переважно у цитозолі клітин; у печінці людини вони складають 2-4% від загальної кількості цитозольного білка [73]. Основна функція GSH-S-T - захист клітин від ксенобіотиків і продуктів ПОЛ за допомогою їхнього відновлення, приєднання до субстрату молекули GSH чи нуклеофільного заміщення гідрофобних груп. На відміну від Se-вмісної GPх, для якої кращими субстратами є гідрофільні гідропероксиди з малим розміром молекули, GSH-S-T не взаємодіє з Н2О2 і в той же час ефективно відновлює гідрофобні гідропероксиди з великим об’ємом молекули: гідроперекиси поліненасичених жирних кислот, фосфоліпідів, а також гідропероксиди мононуклеїдів та ДНК, беручи тим самим участь у їхній репарації [73]. Крім того, GSH-S-T кон’югує з GSH, чим сприяє виведенню з організму токсичних продуктів ПОЛ. Таким чином, GSH-S-T є важливим компонентом антиоксидантного захисту, що функціонує на стадії видалення метаболітів, що утворюються при окисному стресі, [73, 93].
Глутатіон. Очевидно, що глутатіон відіграє найважливішу роль у життєдіяльності. Функції його широкі і різноманітні: 1) захист від активних сполук О2; 2) відновлення й ізомеризація дисульфідів; 3) вплив на активність ферментів та інших білків; 4) підтримування функцій мембран; 5) коферментні функції; 6) участь в обміні ейкозаноїдів; 7) резерв цистеїну; 8) вплив на біосинтез ДНК і, можливо, білка; 9) метаболізм ксенобіотиків; 10) підвищення резистентності клітин до шкідливих впливів; 11) вплив на проліферацію [65]. Пероксидний стрес, тобто надлишкове накопичення у клітині активних форм О2, у тому числі H2O2, стимулює функціонування GPх і в результаті призводить до нагромадження GSHG і його посиленого експорту з клітин. Так, надходження GSHG у жовч зростає у 2-20 разів. У плазмі крові є всі три основні форми глутатіону. Основним, але не єдиним джерелом GSH є печінка [105, 206]. Зміни концентрації GSH у тканинах відбуваються при дуже багатьох станах і впливах. Голод знижує вміст GSH у печінці пацюків та мишей у 2-3 рази, але не змінює концентрацію GSHG [206, 182, 101]. Різні види стресу знижують концентрацію GSH у тканинах і збільшують у крові GSH, особливо GSHG [160]. Глутатіон - це головний низькомолекулярний тіол (90-95%) у більшості клітин [182]. Концентрація GSH у різних видах клітин - 1-10 мМ. Антиоксидантні властивості відновленого глутатіону визначаються як безпосередньою взаємодією з активними формами кисню й обмінних реакцій з дисульфідними зв'язками, так і функціонуванням ряду ферментів глутатіонового циклу, з яких основні - глутатіонпероксидаза і глутатіон-S-трансфераза. Є повідомлення про здатність GSH безпосередньо реагувати з H202 [205]. Глутатіоновий статус тканини відіграє важливу роль при гіпероксичних станах. Коли концентрація О2- у системі виявляється нижче, ніж вміст GSH, відбувається обрив ланцюгів і регенерація радикалів у вихідну молекулу RH. Відношення сумарного вмісту відновленої та окисленої форм глутатіону позитивно корелює з інтенсифікацією окиснення ліпідів [237]. Накопичення GSHG у печінці розглядається як індикатор окисного стресу [165]. Навпаки, підвищення вмісту відновленої форми свідчить про розвиток адаптивної відповіді тканини на окисний стрес [236]. Окисний стрес, індукований введенням курям хлоридів важких металів викликав у кістковому мозку адаптаційні зміни, що виражаються в активації глутатіонпероксидази, глутатіонредуктази і підвищенні рівня GSH. Загальновизнано, що GSH необхідний для нормального функціонування еритроцитів та кровотворної тканини. У крові виявляється досить високий вміст GSH, 96% якого знаходиться у відновленій формі. При цьому в нормі практично весь GSH асоційований з форменими елементами, а в плазмі крові відсутній [24]. Відновлення GSH відбувається за допомогою ферменту глутатіонредуктази, а також через NADPH і в основному залежить від активності пентозофосфатного шунта [153]. Роль GSH не обмежується формуванням основного низькомолекулярного антиоксидантного потенціалу еритроцитів і кровотворних клітин, що дозволяє протистояти гемоглобін- і ферментзалежній генерації активних форм кисню. Крім того, GSH бере участь у підтримці пулу відновленого аскорбату - антиоксиданту, що здійснює захист елементів системи крові ззовні [236].
1.2.2. Антиоксидантний ефект вітамінів А, Е, С в організмі тварин і птиці
Вітамін Е. З числа жиророзчинних мембранопротекторів найважливішу роль відіграє -токоферол. Концепція антиоксидантного механізму біологічної дії токоферолу вперше була сформульована A.L.Tappel у 1953 р. [234], хоча дані його властивості були відомі набагато раніше. Захищаючи мембрани, токоферол сприяє збереженню активності мембранозв’язаних ферментів [91]. Відповідно до загальноприйнятого уявлення, рухливий гідроксил у положенні 6-хроманового ядра молекули токоферолу безпосередньо взаємодіє з пероксидами і вільними радикалами з утворенням токоферилхінону та димерів -токоферолу, перериваючи тим самим процес вільнорадикального ПОЛ. Токоферол виконує кілька функцій, що дають у сукупності антиоксидантний ефект. Він взаємодіє з гідроксильним радикалом 'ОН, найбільш сильнодіючим і короткоживучим з активних форм кисню, має дію гасіння стосовно синглетного кисню [144], приєднує також супероксид О2-' [181], інгібірує ліпідні радикали структури R' та ROO", радикали амінокислот [123], захищає від токсичної дії озону, блокуючи породжувані ним радикальні реакції [154]. Присутність інших антиоксидантів, наприклад аскорбінової кислоти, сприяє відновленню токоферолу і його антиоксидантної активності [211]. Кожна молекула токоферолу здатна захистити від ПОЛ до 220 молекул полієнових жирних кислот [147]. Аліментарна недостатність вітаміну Е може бути охарактеризована як синдром пероксидації, що виявляється збільшенням концентрації вільних радикалів у печінці, серці, м'язах [166]. Роль токоферолів у реакціях ПОЛ докладно досліджена у дослідах на Е-дефіцитних тваринах in vivo, у яких виявлене підвищення вмісту продуктів ПОЛ в крові і різних органах [36]. Посилення інтенсивності чи процесу вкорочення індукційного періоду (у 5-6 разів) спостерігалося при запуску ПОЛ in vitro у мембранах, виділених від Е-дефіцитних тварин [128]. Внесок -токоферолу в сумарну антиокисну активність тканин і органів тварин та людини дуже значний, але важко піддається точному визначенню, зокрема, у зв'язку з ефектами взаємодії між різними антиоксидантами. За даними В.Н. Ушкалової та співавт. на частку -токоферолу приходиться 10-60% сумарної антиоксидантної активності ліпідів тканин [105], а за даними Н.П. Пальміна - 30-100% [69]. В даний час вітамін Е розглядається в якості головного жиророзчинного антиоксиданту біологічних мембран [127]. До того ж вітамін Е здатний безпосередньо стабілізувати мембрани шляхом фізико-хімічної взаємодії з ПНЖК, незалежно від його антиоксидантних властивостей [189]. Ще однією з важливих властивостей вітаміну Е є можливість його рециклізації з окисленої форми за рахунок вітаміну С, відновленого глютатіону, убіхінону чи каротиноїдів [122, 169, 200]. Таким чином, зазначені антиоксиданти здатні відновлювати токофероксильний радикал у його активну форму, і у результаті цього навіть низькі концентрації вітаміну Е при їхній ефективній рециклізації здатні здійснювати ефективний антиоксидантний захист, наприклад, в ембріональному мозку курчат [230].
-Тос + OH* Тос* + H2O
Тос* + OH* стабільний продукт
З представленої схеми видно, що одна молекула токоферолу здатна знешкодити два радикали. У випадку рециклізації токофероксильного радикалу (Тос*) ефективність дії вітаміну Е значно зростає. Антиоксидантна дія -токоферолу в мембранах клітинних органел значною мірою впливає на їхню функцію [90]. Структурну і функціональну стабільність мембран еритроцитів зв'язують з фізіологічним рівнем -токоферолу, а також з стійкістю еритроцитів до гемолітичних агентів [1]. Вважається, що стабілізація біологічних мембран токоферолами забезпечується шляхом їх комплексоутворення з жирними кислотами [31], а включення молекул токоферолів у фосфоліпідний бішар призводить до зміни його фазового стану [38]. Про це свідчить також здатність -токоферолу захищати біологічні мембрани від ушкоджень, що виявляються при накопиченні в них вільних жирних кислот [91]. Таким чином, -токоферол належить до числа найважливіших універсальних жиророзчинних антиоксидантів. При взаємодії з антиоксидантами інших класів, він є найважливішим регулятором окисного гомеостазу клітин та організмів [75], найважливішим компонентом антиоксидантного захисту тканин.
Вітамін А. Важлива роль антиоксидантної активності належить вітаміну А та його провітамінам – каротиноїдам. Антиоксидантний потенціал ретиналю, його здатність до відновлення після світлового імпульсу сприяє захисту фоторецепторів сітківки ока та відіграє найважливішу роль у самому сприйнятті зорової інформації [8]. Вітамін А та каротиноїди, з одного боку, виступають як антиокислювачі не тільки у сітківці, вони беруть участь в антиоксидантному захисті будь-яких біологічних мембран від ушкодження активними формами кисню [167, 78], синглетним киснем, пероксидними радикалами [37], канцерогенами, з іншого боку беруть участь у регуляції мікросомального окиснення, інгібіруючи, зокрема, метаболічну активацію канцерогенів [71]. Фізіологічне місце дії ретиноїдів - біологічні мембрани, також синтез і метаболізм глікопротеїнів, хроматин клітинного ядра, через які реалізується вплив вітаміну А на проліферацію і диференціацію клітин, насамперед епітеліальних, біотрансформація ксенобіотиків [89]. У більшості цих механізмів істотну роль відіграють антиоксидантні властивості ретиноїдів, точніше, їхня здатність до легкого оборотного окиснення-відновлення. По здатності до окиснення жиророзчинний вітамін А нагадує водорозчинну аскорбінову кислоту, але по швидкості окиснення при доступі повітря і на світлі значно її перевершує. Вітамін А та каротин, нормалізуючи структуру і функції біомембран, покращують також обмін тіолових сполук [179]. Антиоксидантна дія вітаміну А залежить від його концентрації у тканинах тварин. Зокрема, при нормальному фізіологічному рівні у тканинах вітаміну А концентрація продуктів ПОЛ зменшується у порівнянні з дефіцитним станом [48]. Автори зв'язують це з його участю в обміні тіолових сполук та стабілізуючою дією на клітинні мембрани. Як показали досліди, проведені на курчатах, низький вміст вітаміну А в печінці викликає посилення ПОЛ [24]. Вітамін А та каротиноїди виявляють також антирадіаційну, антиканцерогенну, антимутагенну та геропротекторну дію [185]. Здатність каротиноїдів, окислюючись, запобігати окисленню інших речовин у реакційному середовищі було відоме досить давно [170]. Деякі природні каротиноїди та ксантофіли перевершують -каротин за здатністю зв'язувати синглетний кисень. Серед них, наприклад, лікопін за своєю активністю зв'язування синглетного кисню у 2 рази перевершує активність -каротину і більш ніж у 10 разів - активність -токоферолу [136, 218]. До подібного висновку прийшли також Chopra M. et al. [131, 172], які показали, що лікопін і криптоксантин є більш сильними антиоксидантами, ніж -каротин у їхній здатності інактивувати ліпідні пероксирадикали та більш ефективні в умовах in vitro у порівнянні з токоферолом. Крім того, каротиноїди можуть також прямо реагувати з пероксил- та алкоксил-радикалами, запобігаючи ПОЛ [242]. Крім того, каротиноїди здатні, можливо, виконувати і мембранно-стабілізуючу дію. Так, гемоліз еритроцитів, викликаний додаванням у середовище гідроперекису холестеролу, інгібірувався додаванням у середовище малих кількостей -каротину чи -токоферолу. Біологічна дія каротиноїдів, можливо, у більшому ступені визначається хімічними реакціями каротиноїдів, що приводять до окиснення цих пігментів [218]. Необхідно підкреслити, що у біологічних системах каротиноїди зв'язані з іншими елементами антиоксидантної системи, включаючи їх специфічну взаємодію з вітаміном Е. Введення в раціон каротиноїдів призводить до підвищення концентрації аскорбінової кислоти у крові [140]. Аналогічним чином, добавки вітаміну С у раціон призводять до підвищення рівня бета-каротину у плазмі крові.
