Дворникова Наталия Борисовна учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
- Шрамкова Наталия Борисовна, доцент учебно-методический комплекс, 525.95kb.
- Плотникова Елена Борисовна учебно-методический комплекс, 484.93kb.
- Ирина Борисовна Бархатова, доцент кафедры вокального искусства института музыки, театра, 252.18kb.
- Швед Наталия Гавриловна, Доцент кафедры связей с общественностью и журналистики ргтэу, 234.14kb.
- Новая система оплаты труда – ключевой механизм модернизации образования горбачева наталия, 76.45kb.
- И. Л. Литвиненко учебно-методический комплекс по дисциплине международный туризм ростов-на-Дону, 398.8kb.
- Учебно-методический комплекс умк учебно-методический комплекс общие основы педагогики, 974.02kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Логика" Ростов-на-Дону 2010 Учебно-методический, 892.49kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Юридическая логика" (для студентов, 1003.39kb.
- И. Д. Алекперов учебно-методический комплекс дисциплины "информатика" Ростов-на-Дону, 952.05kb.
ПРОГРАММА ЭКЗАМЕНА
Пояснительная записка
Итоговая аттестация дисциплины «химия» включает в себя сдачу курсового экзамена, который предназначен для определения теоретической и практической подготовленности специалиста – эколога к выполнению профессиональных задач, установленных ГОС высшего профессионального образования по специальности 020801.65 «Экология».
Курсовой экзамен по химии предполагает проверку знаний теоретических основ химии, умений применять эти основы при решении задач. В программу экзамена включены вопросы, представленные в программе дисциплины.
Основные требования, предъявляемые к курсовому экзамену по химии
Студент, обучающийся по направлению 110900.62 «Водные биоресурсы и аквакультура», в плане предметной подготовки по химии должен:
- знать основные законы и понятия химии;
- знать классификацию и номенклатуру основных классов неорганических соединений;
- владеть методами химической идентификации веществ, уметь обращаться с лабораторным оборудованием;
- понимать особенности влияния химических веществ на живые организмы;
- уметь применять научные знания и умения при решении практических заданий.
Все экзаменационные билеты включают в себя два теоретических вопроса, отражающих важнейшие положения химии и практическое задание.
Критерии оценки
Оценка «отлично» ставится за изложение сущности вопросов на 90 % и более.
- Оценка «хорошо» ставится за изложение вопросов билета на 60–70%.
- Оценка «удовлетворительно» ставится за изложение вопросов билета на 40 – 50 %.
- Оценка «неудовлетворительно» ставится за изложение вопросов билета на 30 % и менее.
Структура АПИМ дисциплины "Химия " для направления 110900.62 "Водные биоресурсы и аквакультура".
| № п. п. | Наименование дидактической единицы дисциплины ПрОП | Наименование темы задания | Требования ГОС к уровню подготовки | ||
| Степень освоения ДЕ | Уровень Деятельности при контроле ДЕ | ||||
| 1 | 2 | 3 | 4 | 5 | |
| 1 | Общая и неорганическая химия | 1.1 | Строение атома и периодическая система | уметь | Применять в типовых ситуациях |
| 1.2 | Химическая связь и строение вещества | ||||
| 1.3 | Классы неорганических соединений | уметь | Применять в типовых ситуациях | ||
| 1.4 | Способы выражения состава растворов | ||||
| 1.5 | Равновесия в растворах электролитов | ||||
| 1.6 | Окислительно-восстановительные реакции | уметь | Применять в типовых ситуациях | ||
| 2 | Аналитическая химия | 2.1 | Теоретические основы аналитической химии | уметь | Применять в типовых ситуациях |
| 2.2 | Качественный химический анализ | ||||
| 2.3 | Количественный анализ | уметь | Применять в типовых ситуациях | ||
| 2.4 | Физико-химические и физические методы анализа | ||||
| 3 | Физическая химия | 3.1 | Основы химической термодинамики | Уметь | Применять в типовых ситуациях. |
| 3.2 | Химическая кинетика и катализ | ||||
| 3.3 | Химическое равновесие | ||||
| 3.4 | Общие свойства растворов | ||||
| 3.5 | Электрохимические процессы. Гальванический элемент. Коррозия металлов | Уметь | Применять в типовых ситуациях | ||
| 3.6 | Электрохимические процессы. Электролиз |
Последовательность предъявления заданий и критерии «зачета» освоения ДЕ для одного варианта тест-билета АПИМ дисциплины "Химия" (для направления 110900.62 "Водные биоресурсы и аквакультура")
| № п. п. | Наименование дидактической единицы дисциплины ПрОП | Наименование темы задания | Критерий зачета | № задания в варианте тест-билета | |
| 1 | 2 | 3 | 4 | 5 | |
| 1 | Общая и неорганическая химия | 1.1 | Строение атома и периодическая система | 2 | 1 |
| 1.2 | Химическая связь и строение вещества | 2 | 2 | ||
| 1.3 | Классы неорганических соединений | 2 | 3 | ||
| 1.4 | Способы выражения состава растворов | 2 | 4 | ||
| 1.5 | Равновесия в растворах электролитов | 2 | 5 | ||
| 1.6 | Окислительно-восстановительные реакции | 2 | 6 | ||
| 2 | Аналитическая химия | 2.1 | Теоретические основы аналитической химии | 2 | 7 |
| 2.2 | Качественный химический анализ | 2 | 8 | ||
| 2.3 | Количественный анализ | 2 | 9 | ||
| 2.4 | Физико-химические и физические методы анализа | 10 | |||
| 3 | Физическая химия | 3.1 | Основы химической термодинамики | 2 | 11 |
| 3.2 | Химическая кинетика и катализ | 2 | 12 | ||
| 3.3 | Химическое равновесие | 2 | 13 | ||
| 3.4 | Общие свойства растворов | 2 | 14 | ||
| 3.5 | Электрохимические процессы. Гальванический элемент. Коррозия металлов | 2 | 15 | ||
| 3.6 | Электрохимические процессы. Электролиз | 2 | 16 |
МИНИСТЕРСТВО ОБРАЗОВАНИЯ УТВЕРЖДАЮ
И НАУКИ РЕКТОР ___________Б.Р..МИСИКОВ
РОССИЙСКОЙ ФЕДЕРАЦИИ «__»________________2008 г.
Тестовые задания по дисциплине ХИМИЯ
Направление 110900.62 «ВОДНЫЕ БИОРЕСУРСЫ И АКВАКУЛЬТУРА»
Автор: Дворникова Н.Б.
Утверждено на заседании кафедры химии
Протокол №___ от «_____»___________ 2008 г.
Тесты по дисциплине «Химия» для студентов 1 курса направления 110900.62 «Водные биоресурсы и аквакультура»
Вариант1
Задание № 1 (выберите один вариант ответа).
Электронная структура последнего электронного уровня атома 3s23p3. это атом:
1. сера
2. фосфор
3. титан
4. медь
Задание № 2 (выберите вариант ответа).
В каких молекулах существует неполярная ковалентная связь?
1. I2
2. CO2
3. K2O
4.H2O
5.O2
Задание № 3 (выберите один вариант ответа).
Какой из кислот соответствует название «фосфористая кислота»?
1. H4P2O7
2. HPO3
3. H3PO3
4. H3PO4
Задание № 4 (выберите один вариант ответа).
Найти массы воды и медного купороса CuSO4 ∙ 5H2O, необходимые для приготовления 1л раствора, содержащего 8% безводной соли. Плотность 8% раствора сульфата меди равна 1,084 г\мл.
1. 354 г и 646 г
2. 948,4 г и 51,6 г
3. 995,7 г и 4,3 г
4. 597,9 г и 402,1 г
Задание № 5 (выберите один вариант ответа).
При введении в раствор слабого электролита одноименных ионов степень диссоциации:
1. увеличивается
2. уменьшается
3. не изменяется
Задание № 6 (выберите один вариант ответа).
Коэффициент перед молекулой восстановителя в уравнении реакции
КMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O равен …
1. 1
2. 3
3. 5
4. 2
Задание № 7 (выберите один вариант ответа).
Чем характеризуется 1-ая аналитическая группа катионов?
1. способность к комплексообразованию
2. образование малорастворимых хлоридов
3. отсутствием группового реагента
Задание № 8 (выберите один вариант ответа).
Что составляет предмет качественного анализа?
1. определение элементарного состава вещества
2. определение количества данного элемента в исследуемом объекте
3. извлечение данного элемента из исследуемого объекта
Задание № 9 (выберите один вариант ответа).
В основе метода перманганатометрии лежит:
1. восстановление перманганат - ионом
2. окисление перманганат - ионом
3. восстановление марганцевой кислотой
4. окисление марганцевой кислотой
Задание № 10 (выберите один вариант ответа).
Методом бумажной хроматографии можно определить катионы:
1. 1 аналитической группы
2. 2 аналитической группы
3. 3 аналитической группы
4. 4 аналитической группы
Задание № 11 (выберите один вариант ответа).
Определите тепловой эффект реакции разложения 1 моля CaCO3, если при образовании 10г CaCO3, по реакции СаО + СО2 = СаСО3 выделилось 16 кДж теплоты.
1. выделяется 16 кДж
2. поглощается 160 кДж
3. поглощается 16 кДж
4. выделяется 160 кДж
Задание № 12 (выберите один вариант ответа).
При увеличении давления в системе в 3 раза скорость химической реакции 2NO(г) + O2(г) → 2NO2(г):
1. увеличится в 27 раз
2. не изменится
3. уменьшится в 27 раз
4. увеличится в 9 раз
Задание № 13 (выберите один вариант ответа).
Для смещения равновесия в системе SO2(г) + Cl2(г)
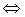 SO2Cl2(г), rH<0 в сторону продуктов реакции необходимо …
SO2Cl2(г), rH<0 в сторону продуктов реакции необходимо …1. понизить температуру
2. понизить давление
3. понизить концентрацию SO2
4. ввести катализатор
Задание № 14 (выберите один вариант ответа).
Осмотическое давление раствора глюкозы c молярной концентрацией 0,1моль/л при 25 0С равно ___ кПа.
- 51,6
- 247,6
- 123,8
- 61,9
Задание № 15 (выберите один вариант ответа).
ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в 0,01М растворы их сульфатов (Е0(Cu2+/Cu) = 0,34В, Е0(Zn2+/Zn)= –0,76 В) равна ____ В.
1. 0,28
2. 0,70
3. 1,10
4. 0,43
Задание № 16 (выберите один вариант ответа).
Уравнение процесса, протекающего на инертном аноде при электролизе водного раствора хлорида натрия, имеет вид …
1. 2Cl– – 2
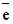 =Cl2
=Cl22. 4OH– –4
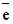 = 4OH–
= 4OH–3. O2 + 2H2O +4
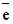 = 4OH–
= 4OH–4. 2H2O – 4
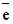 = O2 +4H+
= O2 +4H+ КЛЮЧ к тесту № 1 | ||||||||||||||||
| № вопроса | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| Вариант ответа | 2 | 1,5 | 3 | 2 | 2 | 3 | 3 | 1 | 2 | 2 | 3 | 4 | 2,4 | 3 | 3 | 4 |
