Дворникова Наталия Борисовна учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
- Шрамкова Наталия Борисовна, доцент учебно-методический комплекс, 525.95kb.
- Плотникова Елена Борисовна учебно-методический комплекс, 484.93kb.
- Ирина Борисовна Бархатова, доцент кафедры вокального искусства института музыки, театра, 252.18kb.
- Швед Наталия Гавриловна, Доцент кафедры связей с общественностью и журналистики ргтэу, 234.14kb.
- Новая система оплаты труда – ключевой механизм модернизации образования горбачева наталия, 76.45kb.
- И. Л. Литвиненко учебно-методический комплекс по дисциплине международный туризм ростов-на-Дону, 398.8kb.
- Учебно-методический комплекс умк учебно-методический комплекс общие основы педагогики, 974.02kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Логика" Ростов-на-Дону 2010 Учебно-методический, 892.49kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Юридическая логика" (для студентов, 1003.39kb.
- И. Д. Алекперов учебно-методический комплекс дисциплины "информатика" Ростов-на-Дону, 952.05kb.
Классификация и номенклатура химических соединений. Химические формулы
Вопросы для самостоятельной подготовки:
- Почему простых веществ в природе значительно больше, чем элементов в периодической системе?
- Чем обусловлена явление аллотропии?
- Назовите простые вещества, являющиеся газообразными или жидкими при обычных условиях.
- По каким свойствам отличаются металлы и неметаллов?
- Приведите примеры различных типов бинарных неорганических соединений. Каковы правила построения их названий?
- Какие вещества называются оксидами, пероксидами и супероксидами?
- Каковы правила построения названия оксидов?
- Что лежит в основе классификации солеобразующих оксидов?
- Каковы классификация и номенклатура гидроксидов, диссоциирующих по типу оснований?
- Каковы классификация и номенклатура гидроксидов, диссоциирующих в воде по типу кислот?
Задания для самостоятельной работы:
- С какими из предложенных соединений (CO2, CaO, NaOH, Zn, H2SO4) вступает в реакцию HNO3? Написать уравнение реакций.
- Рассчитать эквивалентные массы соединений MnSO4, Ba(OH)2, H2PbO3.
- К какому типу относится реакция NaOH+ HCl = NaCl + H2O
- С какими из предложенных соединений (Cr2(SO4)3, LiOH, Na2SO4, P2O5, Li2O) вступает в реакцию HCl? Написать уравнение реакций.
- Рассчитать эквивалентные массы соединений Cr2(SO4)3, Sn(OH)4, H2PbO2.
- Приведите пример реакции разложения.
- С какими из предложенных соединений (HNO3, Ca(OH)2, Na2O, K2CO3, H2O) вступает в реакцию Mg(NO3)2? Написать уравнение реакций.
- Рассчитать эквивалентные массы соединений H2TeO2, Fe2(SO4)3, Ni(OH)2.
- Какие реакции называются эндотермическими.
- С какими из предложенных соединений (H2CO3, CO2, NaCl, NaOH, K2O) вступает в реакцию Cu(OH)2? Написать уравнение реакций.
Классификация химических реакций. Составление уравнений реакций. Расчеты по уравнениям
Вопросы для самостоятельной подготовки:
- Какой закон лежит в основе количественных расчетов по уравнениям реакции?
- Что показывают коэффициенты в уравнении реакции?
- Иногда встречаются записи перед формулой вещества, что в реакцию вступает какая-то часть молекулы вещества?
- Какое из исходных веществ определяет выход продуктов реакции, если одно из них взять в избытке?
Задания для самостоятельной работы:
- Сколько можно получить гидроксида железа (III) при взаимодействии 200 г едкого натра при достаточном количестве хлорида железа (III).
- При алюмотермической реакции было получено 20 кг железа. Вычислите, сколько было взято оксида железа (III) и алюминия для этого процесса.
- Из 120 кг природного известняка при взаимодействии с азотной кислотой было получено 180 кг нитрата кальция. Вычислите процентное содержание примесей в указанном известняке.
- Сколько получится сернистого ангидрида из 100 т сернистого колчедана, содержащего 84,2 % FeS2.
- Карбонат кальция, взаимодействуя с соляной кислота, превращается в углекислый газ. Вычислите массу углекислого кальция, необходимого для получения 100 л (при н.у.) углекислого газа.
- К раствору, содержащему 27 г хлорида меди (II), прибавили 12 г железных опилок. Сколько меди можно получить при этом?
- Фосфорная кислота может быть получена действием серной кислоты на фосфат кальция: Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaPO4. Исходя из приведенного уравнения, ответьте на следующие вопросы: а) Сколько молей гипса получиться, если для реакции взять 5 моль фосфата кальция; б) Сколько килограммов фосфорной кислоты можно получить с помощью 6 кмоль серной кислоты (при достаточной количестве фосфата кальция); в) сколько серной кислоты надо взять для взаимодействия с 620 мг фосфата кальция?
- При «растворении» магния в серной кислоте образовалось 36 г сульфата магния. Сколько израсходовано магния? Сколько граммов серной кислоты пошло га его растворение?
- Сколько граммов гидроксида меди (II) было получено при взаимодействии раствора, содержащего 35 г сульфата меди (II) с раствором, содержащим 16 г едкого натра?
Решение задач по темам: «Классификация и номенклатура неорганических соединений», «Генетическая связь между отдельными классами неорганических соединений», «Расчеты по химическим формулам и уравнениям»
1. Химическая классификация и номенклатура органических соединений
Используя химические элементы, приведенные в Вашем варианте задания (обратите внимание на степень окисления элементов), кислород (степень окисления -2) и водород (степень окисления +1), составьте химические формулы (молекулярные или эмпирические) всех возможных оксидов, гидроксидов, бескислотных кислот, солей и выполните следующие задания:
а) назовите и кратко охарактеризуйте полученные соединения, используя названия классов и групп соединений;
б) составьте уравнения всех возможных реакций взаимодействия полученных оксидов друг с другом;
в) составьте уравнения всех возможных реакций взаимодействия полученных гидроксидов (а также бескислородных кислот) друг с другом;
г) составьте уравнения всех возможных реакций взаимодействия полученных оксидов с типичными кислотами (например, H2SO4 или HCl);
д) составьте уравнения всех возможных реакций взаимодействия полученных оксидов с типичными основными гидроксидами (например, Ba(OH)2 или КОН).
| Номер варианта | Названия элементов с указанием степени окисления | ||
| 1 | Литий | Кремний (IV) | Хром (III) |
| 2 | Висмут (III) | Азот (V) | Цинк |
| 3 | Таллий (I) | Азот (III) | Медь (II) |
| 4 | Барий | Углерод (IV) | Скандий (III) |
| 5 | Стронций | Фосфор (V) | Железо (III) |
| 6 | Кальций | Мышьяк (V) | Титан (IV) |
| 7 | Магний | Сера (IV) | Хром (III) |
| 8 | Натрий | Сера (VI) | Цинк |
| 9 | Бериллий | Сурьма (V) | Ванадий (II) |
| 10 | Сурьма (III) | Селен (IV) | Хром (II) |
Методические рекомендации. Выполнение задания следует начинать с составления формул оксидов (+хЭ2Ох, где х=1, 3, 5, 7 или +хЭОх/2, где х=2, 4, 6, 8) и определения химического характера каждого оксида (кислотный, основный или амфотерный оксид). Затем приступайте к составлению формул гидроксидов (+хЭ(ОН)х – для основных и амфотерных оксидов). Здесь наибольшие затруднения обычно вызывает составление формул кислотных гидроксидов (кислородсодержащих кислот). Чтобы составить формулу кислоты, соответствующей данному кислотному оксиду, надо к его формуле прибавить формулу воды. Например:
SO3 (оксид серы (IV) + H2O = Н2 SО4 (серная кислота)
В некоторых случаях одному и тому же кислотному оксиду могут соответствовать две кислоты (орто- и метакислоты), а могут – три кислоты и больше. Например, кислотному оксиду Р2О5 соответствует НРО3 – метафосфорная, Н3РО4 – ортофосфорная, Н4Р2О7 – двуфосфорная. Приступая к составлению формул солей, следует помнить, что многоосновные кислоты могут образовывать как средние, так и кислые соли, а многокислотные основания – средние и основные соли. Для получения формул всех возможных солей, содержащих приведенные в задании химические элементы в указанных степенях окисления, полезно составить таблицу катионов (образующихся при диссоциации оснований и амфотерных гидроксидов по основному типу) и анионов (образующихся при диссоциации кислот и амфотерных гидроксидов по кислотному типу). Затем, комбинируя полученные катионы и анионы (с учетом электронейтральности химических соединений), составьте формулы солей.
2. Генетическая связь между отдельными классами неорганических соединений
Напишите уравнения реакций, при помощи которых можно осуществить приведенные в Вашем варианте превращения. Укажите (при необходимости) условия протекания этих реакций. Назовите каждое из приведенных соединений.
| Номер варианта | «Цепочка» превращений |
| 1 | Fe → Fe2O3 → Fe(NO3)3 → Fe(OH)3 → Fe2O3 →Fe |
| 2 | Al2O3 → KAlO2 → Al(OH)3 → Al2O3 → Al → AlI3 |
| 3 | CH4 → СO2 → CaCO3 → Ca(HCO3)2 → CO2 → CO |
| 4 | SiO2 → Na2SiO3 → H2SiO3 → SiO2 → Si → Mg2Si |
| 5 | Ca3(PO4)2 → P4 → H3PO4 → Ca(H2PO4)2 → Ca3(PO4)2 |
| 6 | P → P2O5 → H3PO4 → Na2HPO4 → Na3PO4 → Ag3PO4 |
| 7 | KHSO3 → K2SO3 → K2SO4 → K2S → H2S → S |
| 8 | Al → AlCl3 → Al(OH)3 → Al(NO3)3 → Al2O3 → KAlO2 |
| 9 | Fe(NO3)2 → FeO → Fe → FeCl3 → Fe(OH)3 → Fe(NO3)3 |
| 10 | FeCO3 → FeO → FeCl2 → FeCl3 → Fe(NO3)3 → Fe2O3 |
Методические рекомендации. Чтобы выполнить задание, надо по формулам соединений, участвующих в «цепочке» превращений, определить, к какому классу соединений относится каждое вещество, и какими свойствами оно может поэтому обладать. Возможно, придется вспомнить не только общие для представителей данного класса свойства, но и свойства специфические для данного соединения.
3. Расчеты по химическим формулам и уравнениям
Закончите химическое уравнение схемы реакции, приведенной в Вашем варианте задания. Используя числовые данные таблицы, выполните необходимые расчеты и заполните таблицу в соответствии с Вашим вариантом.
В таблице использованы следующие обозначения:
V(А) – объем вещества А, занимаемый им при его парциальном давлении Р*(А) и температуре Т(А);
V0(А) – объем вещества А, занимаемый им при нормальных условиях;
n(A) и n(В) – количество вещества А и количество вещества В;
m(В) и m(С) – масса вещества В и масса вещества С;
N(B) – число структурных единиц (атомов, ионов, молекул) вещества В.
| № вар | Схема превращения А+ В + …→ С + Д +… | V (A) | P* (A) | T (A) | V0 (A) | n (A) | m (B) | n (B) | n (B) | n (C) | m (C) |
| 1 | Cl2(г)+KOH(гор.р.)→KCl+KClO3+… | 1,2л | 1,03·105 Па | 323К | | | 5,6г | | | | |
| 2 | Сl2(г)+КОН(хол.р.)→KCl+KClO +… | 1,5л | 104 кПа | 21°С | | | 5,6г | | | | |
| 3 | O2(г)+FeS2(тв)→Fe2O3+SO2 | 1,0л | 506 кПа | 300°С | | | 6,0г | | | | |
| 4 | O2(г)+NH3(г) 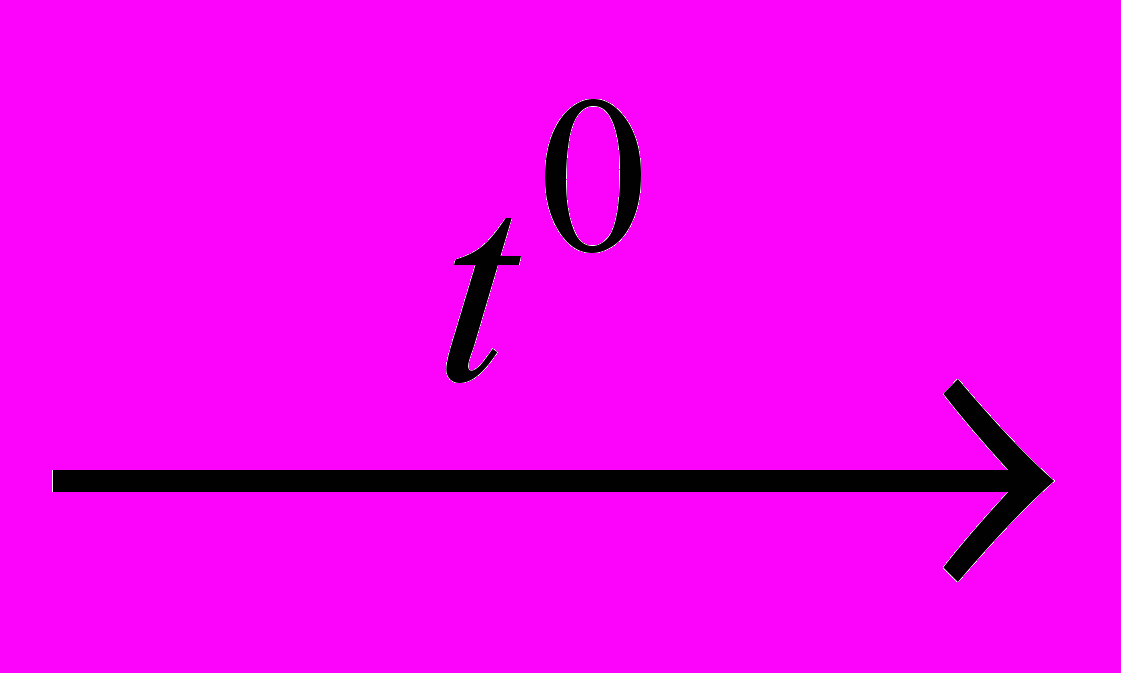 N2+H2O N2+H2O | 2,0л | 104 кПа | 573К | | | 0,51г | | | | |
| 5 | O2(г)+NH3(г) 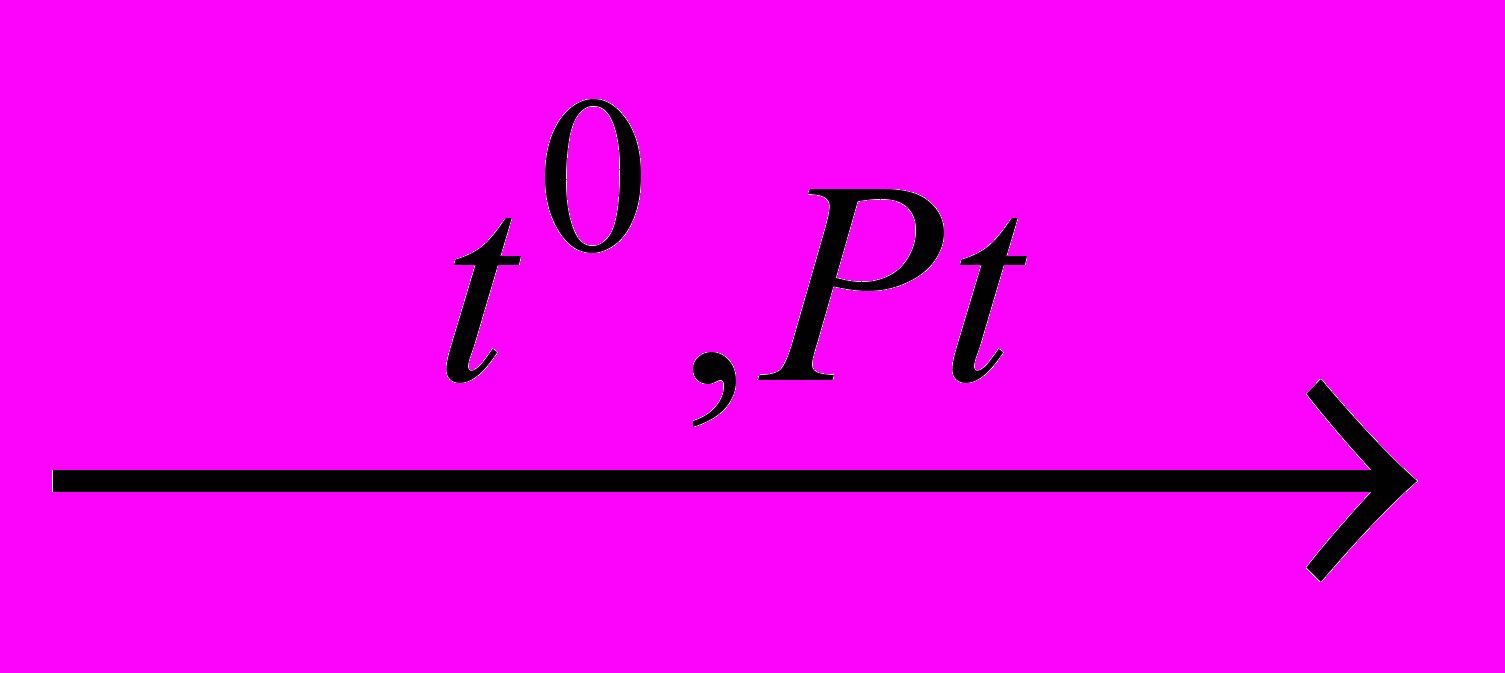 NO+H2O NO+H2O | 2,5л | 1,05·105 Па | 473К | | | 0,68г | | | | |
| 6 | NH3(г)+СuO(тв)→Cu+N2+… | 1,2л | 1,02·105 Па | 21°С | | | 8,0г | | | | |
| 7 | CO2(г)+Al(тв) 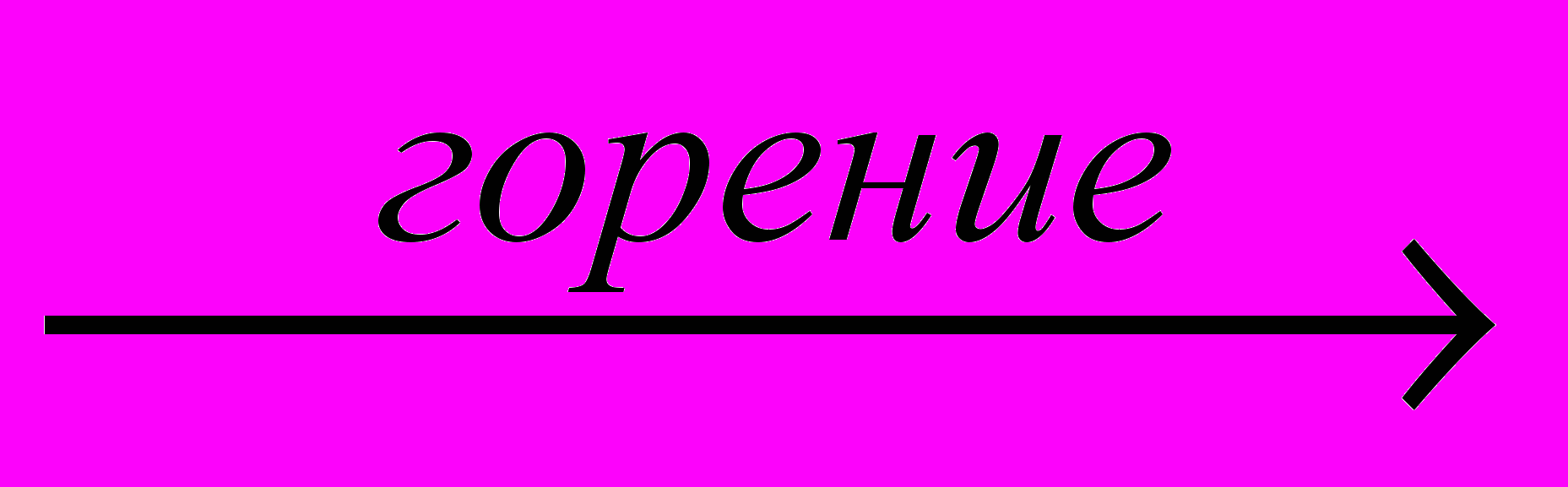 Al2O3+C Al2O3+C | 3,0л | 0,5·105 Па | 22°С | | | 1,62г | | | | |
| 8 | NH3(г)+CrO3(тв)→Cr2O3+N2+… | 1,5л | 101 кПа | 20°С | | | 3,0г | | | | |
| 9 | O2(г)+FeCl2(p)+HCl→FeCl3+… | 2,0л | 103 кПа | 19°С | | | 31,75г | | | | |
| 10 | NO2(г)+NH3(г) 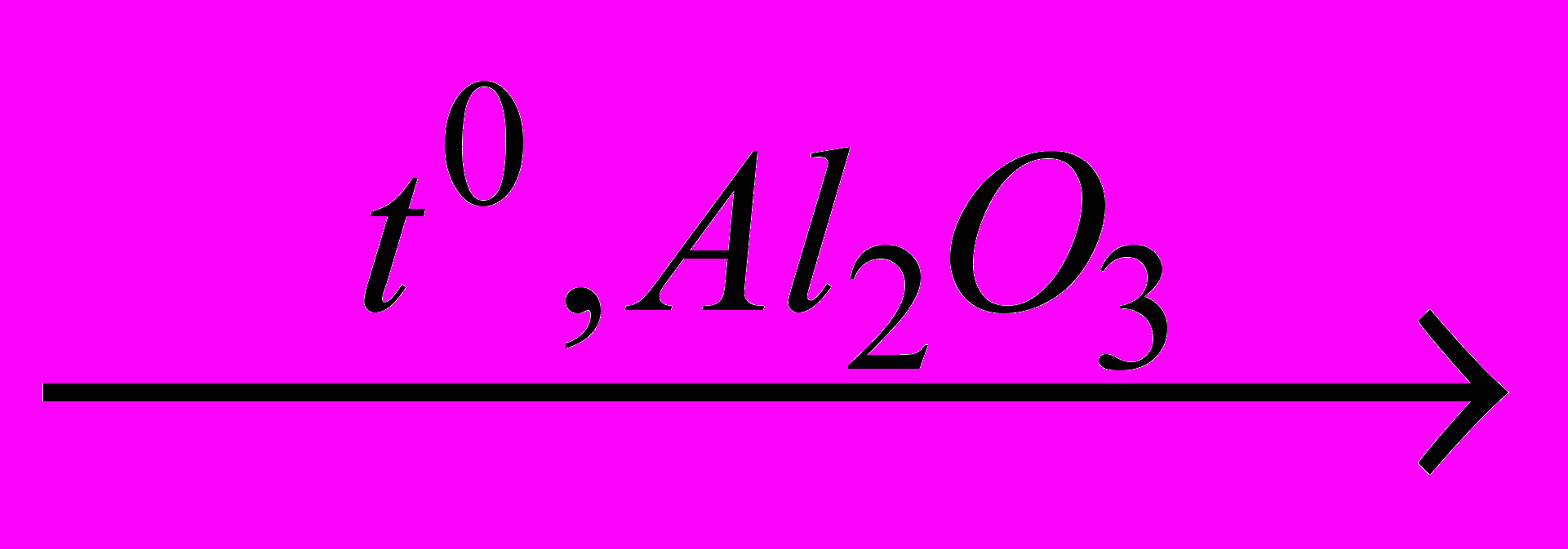 N2+H2O N2+H2O | 0,5л | 1,5·105 Па | 573К | | | 0,68г | | | | |
Методические рекомендации. Чтобы заполнить таблицу, необходимо решить шесть задач: первую – с использованием соотношения, позволяющего привести объем газа к нормальным условиям; вторую – с использованием соотношения, устанавливающего связь между объемом, занимаемым веществом при реальных условиях (давлении и температуре, отличающихся от нормальных), и количеством этого вещества (эту задачу можно решить иначе, используя результат, полученный при решении предыдущей задачи); третью, четвертую и шестую – с использованием соотношений, устанавливающих взаимосвязь между количеством вещества, его массой и числом его частиц; пятую – с использованием соотношений между количествами веществ, участвующих в реакции, согласно уравнению этой реакции. Обратите внимание: чтобы определить количество вещества С, необходимо определить, что находится в недостатке – вещество А или вещество В. Оформляя контрольную работу, приведите ход решения каждой задачи, все математические преобразования и расчеты. Все расчеты должны быть приведены с корректной точностью и правильно выбранными единицами измерения физических величин. Например, универсальная газовая постоянная R, входящая в уравнение Менделеева - Клапейрона (возможно, Вы захотите его применить) имеет значение 8,314 Дж·моль-1·К-1. обратите внимание: объему, взятому в м3, соответствует давление, выраженное в Па, а объему, взятому в л, соответствует давление, выраженное в кПа. Применяя универсальную газовую постоянную, Вам придется, возможно, привести в соответствие единицы объема и давления. Температура Т может быть выражена в °С и в К (Т К = 273 + Т°С), но в ряде случаев (например, в уравнении Менделеева - Клапейрона, уравнении состояния идеального газа) она должна быть выражена и применена только в К. чтобы предотвратить ошибки, связанные с выбором единиц измерения физических величин, математические действия производите не только с числами, но и с единицам измерения.
