Дворникова Наталия Борисовна учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
- Шрамкова Наталия Борисовна, доцент учебно-методический комплекс, 525.95kb.
- Плотникова Елена Борисовна учебно-методический комплекс, 484.93kb.
- Ирина Борисовна Бархатова, доцент кафедры вокального искусства института музыки, театра, 252.18kb.
- Швед Наталия Гавриловна, Доцент кафедры связей с общественностью и журналистики ргтэу, 234.14kb.
- Новая система оплаты труда – ключевой механизм модернизации образования горбачева наталия, 76.45kb.
- И. Л. Литвиненко учебно-методический комплекс по дисциплине международный туризм ростов-на-Дону, 398.8kb.
- Учебно-методический комплекс умк учебно-методический комплекс общие основы педагогики, 974.02kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Логика" Ростов-на-Дону 2010 Учебно-методический, 892.49kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Юридическая логика" (для студентов, 1003.39kb.
- И. Д. Алекперов учебно-методический комплекс дисциплины "информатика" Ростов-на-Дону, 952.05kb.
Твердое состояние. Жидкости. Газообразное состояние вещества. Плазменное состояние вещества. Промежуточное состояние вещества.
Вопросы для самостоятельной подготовки:
- Что называется идеальным газом?
- Каким законам подчиняется идеальный газ?
- Какой физический смысл имеет газовая постоянная?
- Как определяется относительная молекулярная масса газового вещества?
- Каковы отклонения реальных газов от законов идеального газа?
- Дайте общую характеристику жидкого состояния?
- Какова структура жидкости? Какие силы действуют в жидкости?
- Что такое поверхностное натяжение? Объясните его возникновение.
- Что такое вязкость и коэффициент вязкости жидкости? В каких единицах они выражаются?
- Какие виды твердых веществ вам известны? Дайте характеристику свойств твердого вещества.
Задания для самостоятельной работы:
- При нормальных условиях плотность оксида углерода (II) равна 1,25 г/л. Какому давлению надо подвергнуть газ, чтобы плотность его при 0 0С была равна 4 г/л?
- В воздухонагревателях в доменном процессе воздух нагревается до 750 0С. Во сколько раз увеличивается объем воздуха при выходе из воздухонагревателя, если он поступает в него с начальной температурой 17 0С.
- На сколько градусов надо нагреть газ, находящейся в замкнутом сосуде при 27 0С, чтобы давление его увеличилось вдвое?
- При нормальных условиях плотность метана равна 0,7168 г/л. Какова будет плотность газа при -10 0С?
- Смесь, состоящая из 1 объема метана и 4 объемов кислорода, находиться в замкнутом сосуде при 150 0С и давлении 1 · 105 Па. Как измениться давление после взрыва и приведении сосуда к первоначальной температуре?
- Какой объем занимает хлор массой 5 кг при нормальных условиях?
- При температуре 17 0С и давлении 2 · 105 Па объем газа равен 350 см3. Каков объем займет этот газ при температуре -130С и давлении 933,1 Па?
- Какой объем занимает 1 моль азота при температуре 57 0С и давлении 3,03 ·105 Па?
- Определите массу кислорода, находящегося в колбе вместительностью 2 л, при температуре 10 0С и давлении 93,31 кПа.
- Определите объем занимаемый углекислым газом массой 2 кг при температуре 10 0С и давлении 1,5 · 105 Па.
Тема 9. Основы химической термодинамики
Энергетические эффекты химических реакций. Термохимические законы
Вопросы для самостоятельной подготовки:
- Что называется системой? Какие параметры характеризуют состояние системы?
- В чем состоит различие открытых, закрытых и изолированных химических систем? Приведите примеры каждой системы.
- Сформулируйте первый закон термодинамики.
- Какие термодинамические процессы называются изобарными, изохорными, адиабатическими, изотермическими?
- Какой физический смысл имеет функция состояния системы? Можно ли величину внутренней энергии измерить экспериментально?
- Какую функцию состояния называют энтальпией? Что является её мерой?
- Какие факторы влияют на величину изменения энтальпии реакции?
- Зависит ли энтальпия от энергии активации, пути и условий протекания процесса, присутствия катализатора?
- Какие реакции называются экзотермическими, а какие эндотермическими?
- Что определяет понятие «энтальпия образования вещества»?
Задания для самостоятельной работы:
- Рассчитать теплоту образования SO3 (г) по реакции H2O (г) + SO3 (г) = H2SO4 (ж), если по реакции ΔН0реак = -176 кДж\моль, ΔН0298 H2O (г) = 52 кДж\моль, ΔН0298 H2SO4 (ж)= -168 кДж\моль.
- Определить ΔH298 образования CuCl2 (т), если ΔН процесса
CuCl2 (т) + H2O (г) = CuO (т) + 2HCl (г)
равна 356 кДж; ΔН0298 H2O (г) = 136 кДж\моль, ΔН0298 CuO (т) 76кДж\моль, ΔН0298 HCl (г) = 102 кДж\моль
- Исходя из теплового эффекта реакции, определить ΔН0298 образования CaCO3.
CaCO3(т) →t0 CaO (т) + CO2 (г) ΔH = -523 кДж
- Определить ΔH298 образования этилена, используя следующие данные
C2H4 (г) + 3O2 (г) = 2CO2 (г) + 2H2O (г) ΔН0 = -1323 кДж
Сграфит + O2 (г) = CO2 (г) ΔН0 = -393,5 кДж
H2 (г) + 1\2 O2 (г) = H2O (г) ΔН0= -241,8 кДж
- Рассчитать ΔH данного процесса CS2 (ж) + 3O2 (г) = CO2 (г) + 3SO3 (г)
- При восстановлении 12,7 г. CuO углём CuO + C = CO + Cu поглощается 8,24 кДж. Вычислить ΔН0298 образования CuO.
- Сравнить ΔН0298 реакции восстановления оксида железа различными восстановителями при 298 К
А) Fe2O3 (к) + 3H2 (г) = 2Fe (к) + 3H2O (г)
Б) Fe2O3 (к) + 3C (графит) = 2Fe (к) + 3CO (г)
В) Fe2O3 (к) + 3CO (г) = 2Fe (к) + 3CO2 (г)
- Исходя из теплового эффекта реакции определить ΔН0298 образования ортофосфата кальция 3СaO (к) + P2O5 (к) = Ca2(PO4)2 ΔН0 = -739 кДж.
- Исходя из теплоты образования газообразного диоксида углерода, вычислить теплоту образования N2O (г)
C (графит) + 2N2O (г) = CO2(г) + 2N2 (г) – 557,5 кДж
- Вычислить ΔН0298 реакций
2NO (г) + O2 (г) = 2NO2 (г)
2H2S (г)+ 3O2 (г) = 2H2O (ж) + 2SO3 (г)
Движущая сила химических процессов. Энергия Гиббса и ее изменение при химических процессах
Вопросы для самостоятельной подготовки:
- Сформулируйте второй закон термодинамики. Что определяет понятие «энтропия системы»?
- В каких пределах может изменяться энтропия?
- Энтропия какого вещества (твердого или газообразного) увеличивается быстрее при повышении температуры? Почему?
- Что определяет понятие «энергия Гиббса системы» (изобарно-изотермический потенциал)?
- Как можно рассчитать ΔG образования вещества? Укажите условия стандартизации этой величины.
- Изменение какой величины – энтальпии или энтропии – в основном определяет величину ΔG при высоких и при низких температурах?
- Учитывая роль энтальпийного и энтропийного факторов и температуры в определении величины ΔG, определите общие типы реакций, различающихся возможностью и температурными условиями протекания.
- Возможны ли случаи, когда реакции с ΔG<0 практически не идут? Как это можно объяснить?
- Как измениться энергия Гиббса по мере приближения системы к химическому равновесию?
Задания для самостоятельной работы:
Вариант 1
- Определите направление протекания реакции в стандартных условиях:
Al2O3 (т) + 2Cr (т) = Cr2O3 (т) + 2Al (т)
H2 (г) + 2C (т) + N2 (г) = 2HCN
- Рассчитать ΔH, Δ G, ΔS процесса MgCO3 (к) = MgO (т) + CO2 (г) при 500 0С.
Вариант 2
- Определить направление протекания процесса
2PbS (т) + 3O2 (г) = 2PbO (т) + 2SO2 (г)
- Рассчитать ΔH, Δ G, ΔS процесса Al2O3 (т) + 3SO3 (г) = Al2(SO4)3 (т) при 50 0С.
Вариант 3
- В каком направлении процесс может протекать самопроизвольно?
CuO (к) + H2O (ж) = Cu(OH)2 (ж)
- Определить возможность протекания процесса при 72 0С в прямом направлении
4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2(г)
Тема 10. Химическая кинетика и катализ
Понятие о химической кинетике. Скорость химических реакций, ее зависимость от концентрации реагирующих веществ, температуры. Механизм химических реакций. Катализ
Вопросы для самостоятельной подготовки:
- Что понимают под скоростью химической реакции.
- Какие факторы влияют на скорость химической реакции?
- В чем различие гомогенных и гетерогенных процессов?
- Что такое константа скорости реакции?
- Что называется скоростью гомогенной реакции? Чему равна скорость гомогенной реакции?
- Зависит ли значение энергии активации реакции в случае гетерогенного катализа от площади поверхности катализатора и от ее структуры?
- Что называется скоростью гетерогенной реакции?
- Чему равна константа скорости реакции?
- Как формулируется правило Вант-Гоффа.
- Для чего необходима энергия активации?
- Что такое катализатор? Что называется катализом?
- Какой катализ называется гомогенным?
- Что такое ферменты?
- Что называется гетерогенным катализом?
Задания для самостоятельной работы:
1. Во сколько раз изменится скорость реакции 2А + В → А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
2. На сколько градусов нужно понизить температуру для уменьшения скорости реакции в 27 раз, если ее температурный коэффициент равен 3?
3. Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2 (г.) + В2 (г.) = 2А2В(г.), чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась?
4. При 150°С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если проводить ее: а) при 200°С; б) при 80°С.
5. Как изменится скорость реакции 2NО + О2 ↔2NО2, если объем реакционного сосуда увеличить в 2 раза: а) уменьшится в 4 раза; б) уменьшится в 8 раз; в) возрастет в 4 раза; г) возрастет в 8 раз?
6. Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]о = = 0,03 моль/л, [В]о = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции.
7. Чему равен температурный коэффициент реакции, если при повышении температуры на 40° ее скорость увеличивается в 256 раз?
8.Как изменится скорость реакции 2NО(г.) + O2 (г.) → 2NО2 (г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию NO в3 раза?
9. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
10. Определите, как изменится скорость реакции
СО2(г) + С(тв) = 2 СО(г) при уменьшении давления в 4 раза.
Тема 11. Химическое равновесие
Необратимые и обратимые реакции. Химическое равновесие. Смещение химического равновесия. Принцип Ле Шателье.
Вопросы для самостоятельной подготовки:
1. Что такое скорость химической реакции?
2. Чем отличаются средняя и истинная скорость реакции?
3. В соответствии с законом действующих масс составьте выражение для скорости реакции:
а) протекающей в гомогенной системе 2NO + O2 → 2NO2
б) протекающей в гетерогенной системе FeO(к) + CO(г) → Fe(к) + CO2(г)
4. Что такое константа скорости реакции? От каких факторов зависит её величина?
5. Во сколько раз увеличится константа скорости реакции при повышении температуры на 40°, если
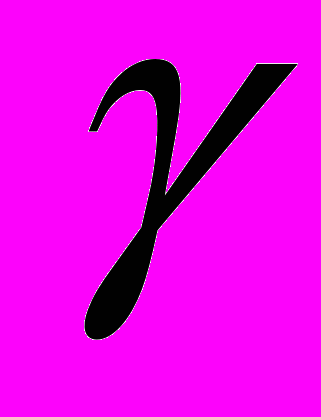 =3?
=3?6. При 20°С скорость некоторой реакции равна 0,1 моль/л. Определите скорость реакции при 70°C, если
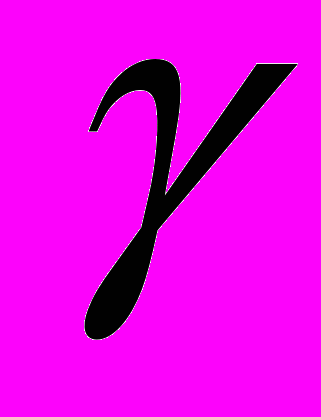 =2.
=2.7. Зависит ли температурный коэффициент скорости реакции от значения энергии активации? Ответ обосновать.
8. Чем объясняется повышение скорости реакции при введении в систему катализатора:
а) увеличением средней кинетической энергии молекул;
б) уменьшением энергии активации;
в) возрастанием числа столкновений молекул?
9.Какие из перечисленных воздействий приведут к изменению значения константы равновесия химической реакции:
а) изменение температуры;
б) изменение концентраций реагирующих веществ;
в) изменение давления;
г) введение катализатора?
10.Составьте математические выражения констант равновесия следующих систем:
а) 4HCl(г) + О2(г) ↔ 2Сl2(г) + 2Н2О(г)
б) 3Fe(к) + 4H2O(г) ↔ Fe3O4(к) + 4H2(г)
Задания для самостоятельной работы:
1. Составьте выражение константы равновесия и вычислите ее значение для реакции С(тв) + Н2О(г) = СО(г) + Н2(г), если равновесные концентрации СО, Н2 и Н2О равны соответственно 5,66 · 10-2; 5,66 · 10-2 и 2·10-1 моль/л.
2. Какие воздействия на систему 4НС1 (г.)+ О2 (г.) ↔ 2 С12 (г.) + 2Н2О(г.) приведут к смещению равновесия влево: а) увеличение концентрации О2; б) увеличение концентрации С12; в) повышение давления; г) возрастание объема реакционного сосуда?
3. В каком направлении сместится равновесие в системе 4Fе(к.) + 3О2 (г.)↔ 2Fе2О3(к.) при увеличении давления: а) в сторону прямой реакции; б) в сторону обратной реакции; в) не сместится?
4. Если объем закрытого реакционного сосуда, в котором установилось равновесие 2SО2 (г.) + О2 (г.) ↔2 SО3 (г.), уменьшить в 2 раза, то: а) скорости прямой и обратной реакций останутся одинаковыми; б) скорость прямой реакции станет в 2 раза больше скорости обратной реакции; в) равновесие не сместится; г) равновесие сместится вправо; д) равновесие сместится влево?
5. В какую сторону смещается равновесие обратимой реакции:
СО(г) + Н2О(г) ↔ СО2(г) + Н2(г); ΔН° = -42,6 кДж, если: а) уменьшить концентрацию паров воды; б) увеличить давление в системе?
6. В каком направлении сместится равновесие реакции А2(г.)+ В2(г.) ↔ 2АВ(г.), если давление увеличить в 2 раза и одновременно повысить температуру на 10 градусов? Температурные коэффициенты скорости прямой и обратной реакций равны соответственно 2 и 3.
7. Как изменится скорость реакции 2NО + О2 ↔2NО2, если объем реакционного сосуда увеличить в 2 раза: а) уменьшится в 4 раза; б) уменьшится в 8 раз; в) возрастет в 4 раза; г) возрастет в 8 раз?
8. В какую сторону смещается равновесие в следующих равновесных системах при повышении температуры:
а) 2NO2(г) ↔N204(г); ΔН° = +9,6 кДж;
б) 2СО (г) + О2(г) ↔ 2СО2(г); ΔН° = -568 кДж;
в) 2NО + О2 ↔ 2NО2; ΔН° = -113 кДж?
Сдвиг химического равновесия
Химическая система находится в замкнутом объеме в состоянии равновесия:
аА + bB ↔ сС + dD.
Определите направление смещения химического равновесия в системе, приведенной в Вашем варианте задания, при изменении условий:
а) при понижении давления;
б) при уменьшении объема;
в) при уменьшении концентрации продуктов реакции;
г) при нагревании.
Укажите, как следует изменить температуру и давление (повысить или понизить), чтобы смещение равновесия привело к повышению выхода продуктов реакции. Все ответы поясните.
-
Номер
варианта
Уравнение обратимой реакции
аА + bB ↔ сС + dD
1
4NH3(г)+5O2(г)=4NO(г)+6H2O(г); ΔH<0
2
2CO(г)+O2(г)=2CO2(г); ΔH<0
3
PCl5(г)=PCl3(г)+Cl2(г); ΔH>0
4
2SO2(г)+O2(г)=2SO3(г); ΔH<0
5
C(к)+H2O(г)=CO(г)+H2(г); ΔH>0
6
C3H8(г)=C2H4(г)+CH4(г); ΔH>0
7
N2(г)+3H2(г)=2NH3(г); ΔH<0
8
2NO(г)+Cl2(г)=2NOCl(г); ΔH<0
9
N2(г)+O2(г)=2NO(г); ΔH>0
10
2CO(г)=CO2(г)+C(к); ΔH<0
Методические рекомендации. Выполняя первые три пункта первой части задания, обратите внимание сначала на фазовые состояния всех участников обратимого процесса, находящегося в состоянии равновесия, а затем – на количества (число моль) всех газообразны веществ в левой части уравнения и на количества (число моль) всех газообразных веществ в правой части уравнения. Выполняя четвертый пункт первой части задания, обратите внимание на знак теплового эффекта для прямой реакции.
Решение задач на темы: «Термодинамика. Термохимические законы», «Скорость химической реакции»
Энергетика и направленность химических процессов
Закончите химическое уравнение схемы реакции, приведённой в Вашем варианте задания в таблице, и выполните следующие задания:
а) вычислите стандартную энтальпию ∆Но298 и стандартную энтропию ∆Sо298 реакции, расчёты приведите (значения ∆Ноf, 298 и ∆Sо298 веществ, участвующих в реакции, возьмите из таблицы приложения D);
б) вычислите приблизительную равновесную температуру Травн. для этой реакции, расчёты приведите и укажите, выше или ниже равновесной температуры реакция может протекать самопроизвольно, ответ поясните;
в) вычислите стандартную энергию Гиббса ∆Gо298 и энергию Гиббса при 1000 К ∆Gо1000 этой реакции и оцените возможность её самопроизвольного протекания при температурах, равных 298 К и 1000 К, ответ поясните;
г) составьте термохимическое уравнение реакции, самопроизвольное протекание которой возможно при стандартных условиях (прямой реакции, схема которой приведена в Вашем варианте задания, или обратной ей реакции)
д) по термохимическому уравнению реакции определите массу первого реагента, которая может быть израсходована в ходе реакции при выделении (или поглощении) теплоты q, равной 10 кДж.
-
№ ва-рианта
Схема превращения
1
PbO2(к)+Zn(к)→ Pb(к)+ZnO(к)
2
Fe3O4(к)+CO(г)→FeO(к)+CO2(г)
3
С2H2(г)+O2(г)→CO2(г)+H2O(ж)
4
H2(г)+CO2(г)→СО(г)+ H2O(ж)
5
NO(г)+О2(г)→NO2(г)
6
СО(г)+Н2(г)→СН3ОН(ж)
7
NH3(г)+O2(г)→NO(г)+H2O(г)
8
СН4(г)+СО2(г)→СО(г)+Н2(г)
9
CO2(г)+H2(г)→CH4(г)+H2O(ж)
10
Fe2O3(к)+H2(г)→Fe(к)+H2O(г)
Методические рекомендации. Выполняя задание, необходимо помнить, что энтальпия, энтропия и энергия Гиббса – величины экстенсивные, зависящие от количества вещества, поэтому энтальпия, энтропия и энергия Гиббса относятся к тем количествам веществ, которые указаны в уравнении реакции. Поэтому первое, что нужно сделать, - это расставить коэффициенты в уравнении реакции. В термодинамике одно и то же уравнение реакции может быть записано как с дробными коэффициентами (если при этом коэффициенты перед большинством веществ равны единице), так и с кратными им наименьшими целочисленными. Вы можете использовать любые удобные вам коэффициенты, лишь бы при этом не нарушалась стехиометрия реакции. Производя вычисления, обратите внимание на то, что в справочных таблицах значения ∆Ноf, 298 приводятся в кДж * моль-1, а значения Sо298 – в Дж * моль-1 * К-1. Поэтому при вычислении ∆GoT реакции ∆Но298 реакции выражают в Дж, температуру – в кельвинах (К), ∆GoT получают в Дж, но ответ дают в кДж. Обратите внимание и на то, что такие вычисления являются приближёнными, и не нужно в значениях ∆Но298, ∆ Sо298 и ∆Go реакции сохранять больше одного знака после запятой, а температуру следует округлять до целых чисел.
Зависимость скорости химических процессов от концентрации реагирующих веществ, давления и температуры
Используя уравнение реакции и числовые данные таблицы, приведённые в Вашем варианте задания, определите, как изменится (уменьшится или увеличится, и во сколько раз) скорость прямой реакции (процесс одностадийный), протекающий по данному уравнению, при изменении следующих условий:
а) при увеличении концентрации первого вещества в «а» раз и одновременном уменьшении концентрации второго вещества в «b» раз;
б) при увеличении давления в системе в «с» раз;
в) при увеличении объёма системы в «d» раз;
г) при понижении (∆t < 0) или повышении (∆t > 0) температуры на «∆t» градусов Цельсия, если условно температурный коэффициент скорости данной реакции γ равен 3,0;
д) при уменьшении энергии активации реакции на «∆Еа» кДж·моль-1 (∆Еа<0) при стандартных условиях.
| № варианта | Уравнения реакций | a | b | c | d | Δt | ΔEa |
| 1 | 2NO(г)+O2(г)=2NO2(г) | 3 | 2 | 3 | 4 | -20 | -25 |
| 2 | 2СO(г)+O2(г)=2СO2(г) | 2 | 3 | 4 | 3 | +30 | -20 |
| 3 | CH4(г)+2O2(г)=CO2(г)+2H2O(ж) | 4 | 3 | 2 | 3 | -40 | -30 |
| 4 | H2(г)+S(к)=H2S(г) | 3 | 4 | 3 | 2 | +50 | -35 |
| 5 | CaO(к)+CO2(г)=CaCO3(к) | 5 | 2 | 3 | 4 | -60 | -40 |
| 6 | Fe2O3(к)+CO(г)=2FeO(к)+CO2(г) | 6 | 3 | 2 | 4 | +20 | -50 |
| 7 | H2(г)+Cl2(г)=2HCl(г) | 4 | 2 | 3 | 2 | -30 | -45 |
| 8 | CO(г)+Cl2(г)=COCl2(г) | 7 | 2 | 4 | 3 | +40 | -55 |
| 9 | CO2(г)+H2(г)=CO(г)+H2O(г) | 8 | 4 | 3 | 5 | -50 | -60 |
| 10 | 2NaBr(к)+Cl2(г)=2NaCl(к)+Br2(ж) | 9 | 8 | 2 | 3 | +60 | -65 |
Методические рекомендации. Выполняя первые три пункта задания, обратите внимание на одностадийность процесса, уравнение которого приведено в Вашем варианте задания. Благодаря тому, что данная реакция протекает в одну стадию, для выражения зависимости скорости этой реакции от концентрации реагентов можно использовать кинетическое уравнение, в котором показатели степеней при молярных концентрациях реагентов равны стехиометрическим коэффициентам перед этими веществами в уравнении реакции. Для многостадийного процесса с этой целью следовало бы использовать эмпирическое кинетическое уравнение, в котором значения показателей степеней при молярных концентрациях реагентов являются результатом экспериментального их определения и, как правило, не равны стехиометрическим коэффициентам в уравнении реакции. Используя молярные концентрации реагентов следует понимать, что если несколько веществ (даже два) образуют одну фазу в химической системе, то можно определить относительное содержание каждого из них в этой фазе, например: количество (число молей) каждого вещества в одном литре этой фазы. Поэтому в кинетическое уравнение гетерогенной реакции, протекающей на границе раздела фаз, не входят концентрации чистых веществ, образующих самостоятельные фазы, не меняющие своих свойств в ходе реакции. И в то же время, скорость гетерогенного процесса сильно зависит от площади поверхности соприкасающихся фаз и процессов массопереноса реагентов, но это уже совсем другие зависимости.
Химическое равновесие. Вычисление константы равновесия, исходных или равновесных концентраций реагирующих веществ
Химическая система, находясь в замкнутом пространстве при стандартном давлении и некоторой температуре, приходит в состояние равновесия
аА + bB ↔ сС + dD
из исходного состояния, в котором она содержит только вещества А и В в их исходных концентрациях. Используя уравнение обратной реакции и числовые данные таблицы, приведенные в Вашем варианте задания, а также справочную таблицу приложения Д, выполните необходимые расчеты (приведите их) и заполните таблицу в соответствии с Вашим вариантом.
В таблице использованы следующие обозначения:
СМ, исх.(А), СМ, исх.(В) – исходные молярные концентрации веществ А и В соответственно, моль·л-1;
СМ, равн.(А), СМ, равн.(В) – равновесные молярные концентрации веществ А и В соответственно, моль·л-1;
КС – константа равновесия при температуре Т, выраженная через молярные концентрации участников реакции;
КN - константа равновесия при температуре Т, выраженная через молярные доли участников реакции;
КР - константа равновесия при температуре Т, выраженная через парциальные давления газообразных участников реакции.
| Номер вари-анта | Уравнение обратимой реакции: аА + bB ↔ сС + dD | СМ, исх.(А) | СМ, исх.(В) | СМ, равн.(А) | СМ, равн.(В) | КС | КN | КР | Т,К |
| 1 | 4HCl(г)+O2(г)↔2Cl2(г)+2H2O(г) | 5,0 | 2,0 | | 1,0 | | | | |
| 2 | 2NO(г)+O2(г)↔2NO2(г) | 4,0 | 2,0 | 2,0 | | | | | |
| 3 | N2(г)+O2(г) ↔2NO | 3,0 | 4,0 | 1,0 | | | | | |
| 4 | CO2(г)+H2(г) ↔CO(г)+H2O(ж) | 10,0 | 7,0 | | 2,0 | | | | |
| 5 | H2(г)+I2(г) ↔2HI(г) | 3,0 | 3,5 | 0,5 | | | | | |
| 6 | 2SO2(г)+O2(г) ↔2SO3(г) | 7,0 | 6,0 | | 4,0 | | | | |
| 7 | C(к)+2H2(г) ↔CH4(г) | | 18,0 | | 2,0 | | | | |
| 8 | N2(г)+3H2(г) ↔2NH3(г) | 4,0 | 7,0 | | 1,0 | | | | |
| 9 | 2H2(г)+O2(г) ↔2H2O(г) | 9,0 | 4,0 | 3,0 | | | | | |
| 10 | 2СO(г)+O2(г) ↔2СO2(г) | 9,0 | 8,0 | | 4,0 | | | | |
Методические рекомендации. Чтобы заполнить таблицу в соответствии со своим вариантом, Вам необходимо решить две задачи. Первая из них связана с тем, что нужно найти либо константу равновесия КС по известным исходным концентрациям реагентов и равновесной концентрации одного из них, либо константу равновесия КС по равновесным концентрациям реагентов и исходной концентрации одного из них, либо равновесные концентрации реагентов по их исходным концентрациям и константе равновесия КС. При решении первой задачи наибольшее затруднение может вызвать установление соотношения между исходной и равновесной молярной концентрацией каждого вещества в системе (точнее, каждого из веществ, находящихся в одной фазе системы) и, следовательно, нахождение неизвестных молярных концентраций тех или иных веществ. Это затруднение легко снять, если использовать принцип наглядности. Для этого необходимо составить вспомогательную таблицу, которая в самом общем виде выглядит так:
| Уравнение реакции | аА + bB ↔ сС + dD | |||
| Вещества | А | В | С | D |
| СМ, исх. , моль·л-1 | | | | |
| ΔСМ , моль·л-1 | | | | |
| СМ, равн. , моль·л-1 | | | | |
В этой таблице использованы следующие обозначения:
СМ, исх.(А), СМ, исх.(В), СМ, исх.(С), СМ, исх.(D) – исходные концентрации веществ А, В, С, D соответственно;
ΔСМ(А), ΔСМ(В) – количества (число молей) исходных веществ А и В в единице объема фазы системы (в одном литре), прореагировавшие согласно уравнению реакции (т.е. в соответствии с ее стехиометрией);
ΔСМ(С), ΔСМ(D) – количества (число молей) продуктов реакции С и Д в единице объема фазы системы (в одном литре), образовавшихся согласно уравнению реакции;
СМ, равн.(А), СМ, равн.(В), СМ, равн.(С), СМ, равн.(D) – равновесные концентрации веществ А, В, С и D соответственно.
В эту таблицу нужно подставить числовые данные условия задачи, например (в самом общем виде):
| Уравнение реакции | аА + bB ↔ сС + dD | |||
| Вещества | А | В | С | D |
| СМ, исх. , моль·л-1 | k | m | 0 | 0 |
| ΔСМ , моль·л-1 | | | | |
| СМ, равн. , моль·л-1 | l | | | |
Затем, решая полученные простейшие задачи, постепенно заполнить всю таблицу:
| Уравнение реакции | аА + bB ↔ сС + dD | |||
| Вещества | А | В | С | D |
| СМ, исх. , моль·л-1 | k | m | 0 | 0 |
| ΔСМ , моль·л-1 | 1) k-l | 2) 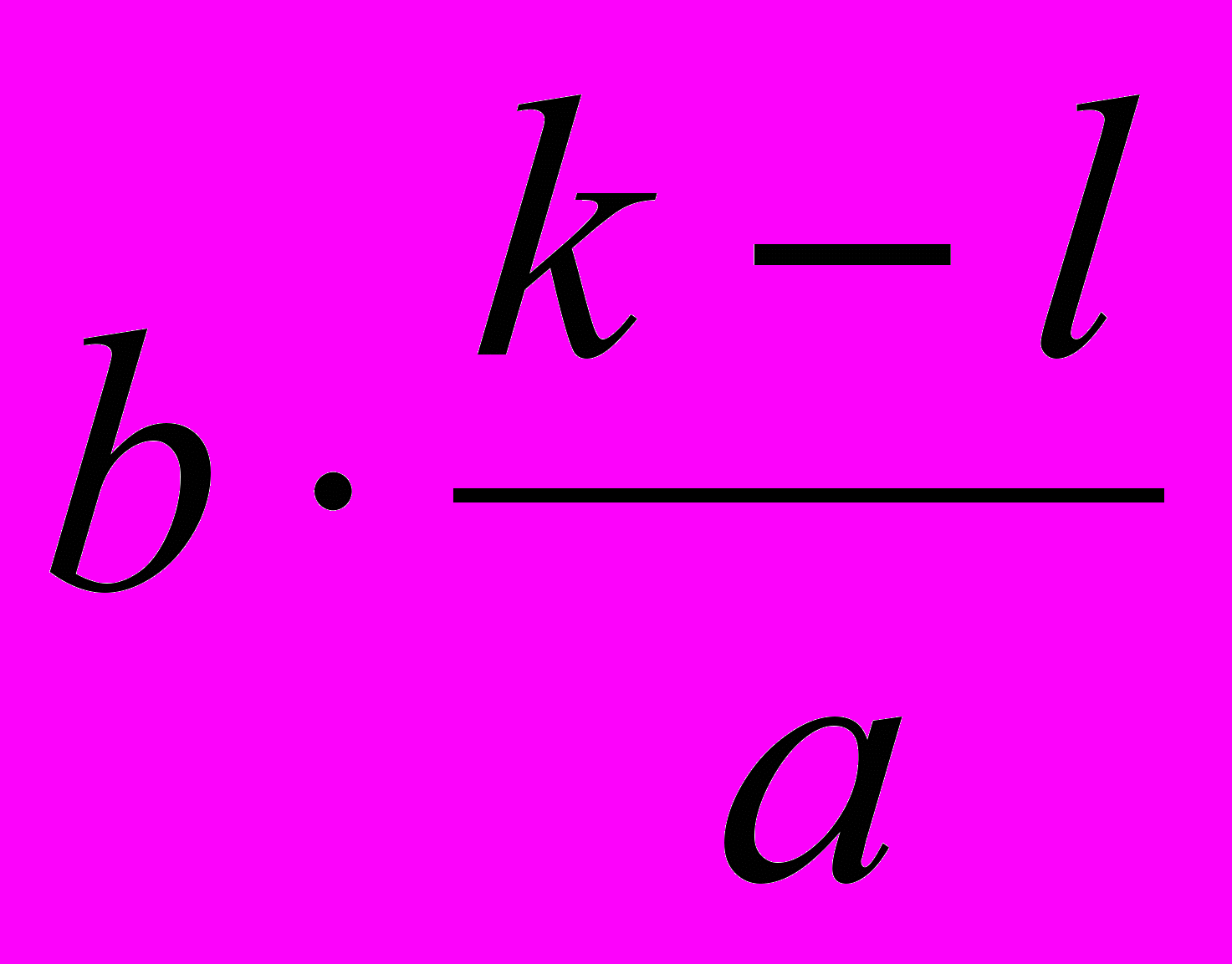 | 4) 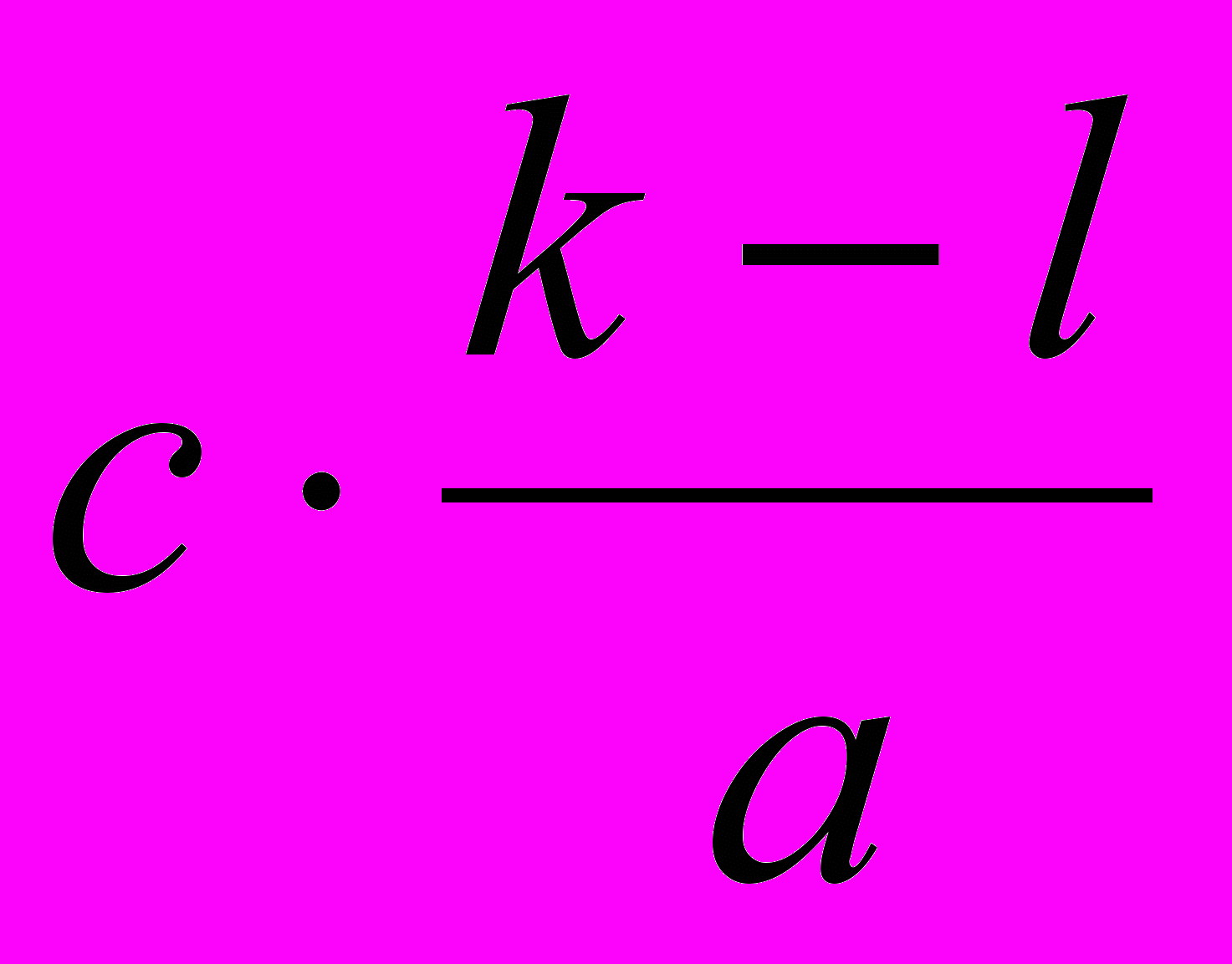 | 6) 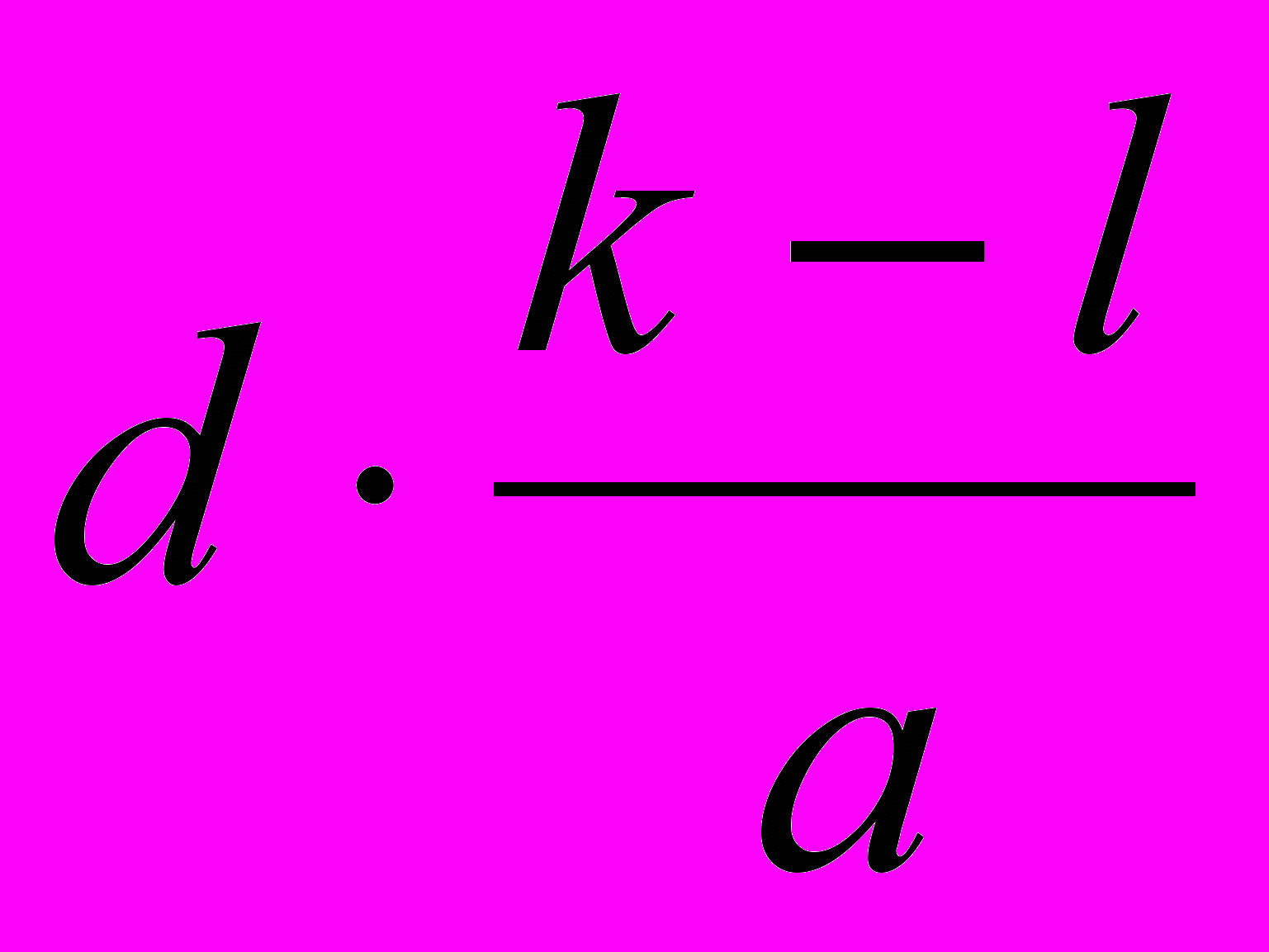 |
| СМ, равн. , моль·л-1 | l | 3) 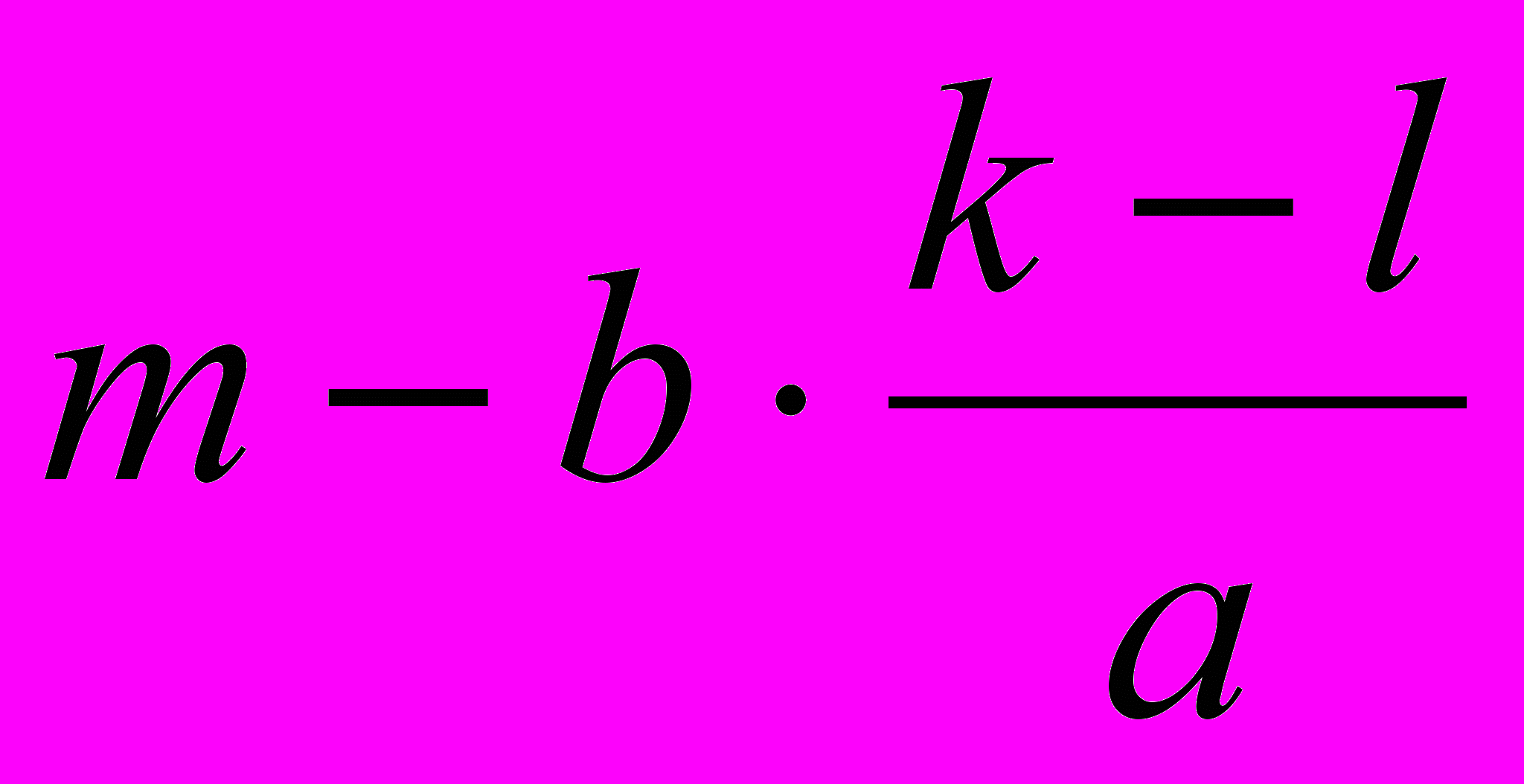 | 5) 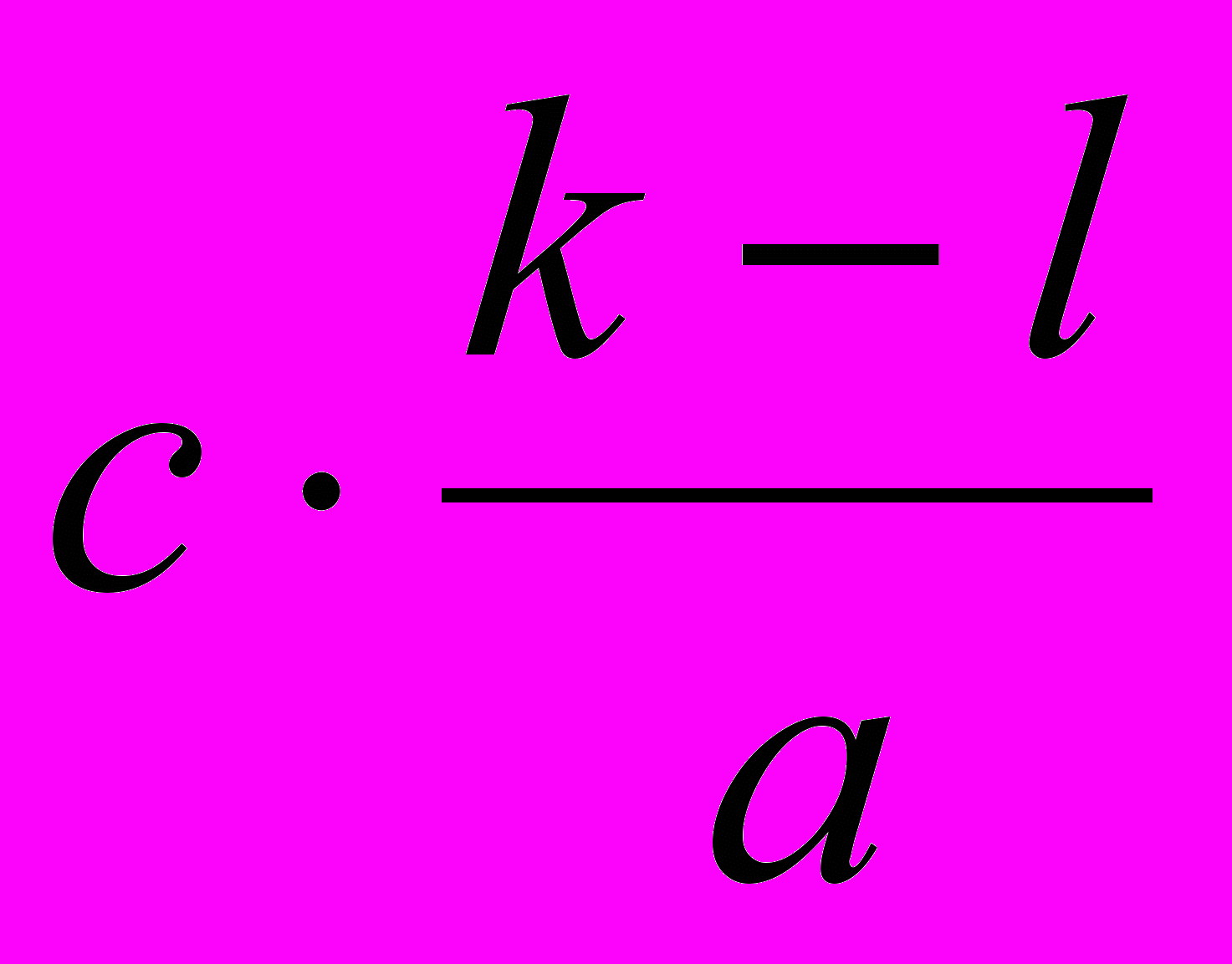 | 7) 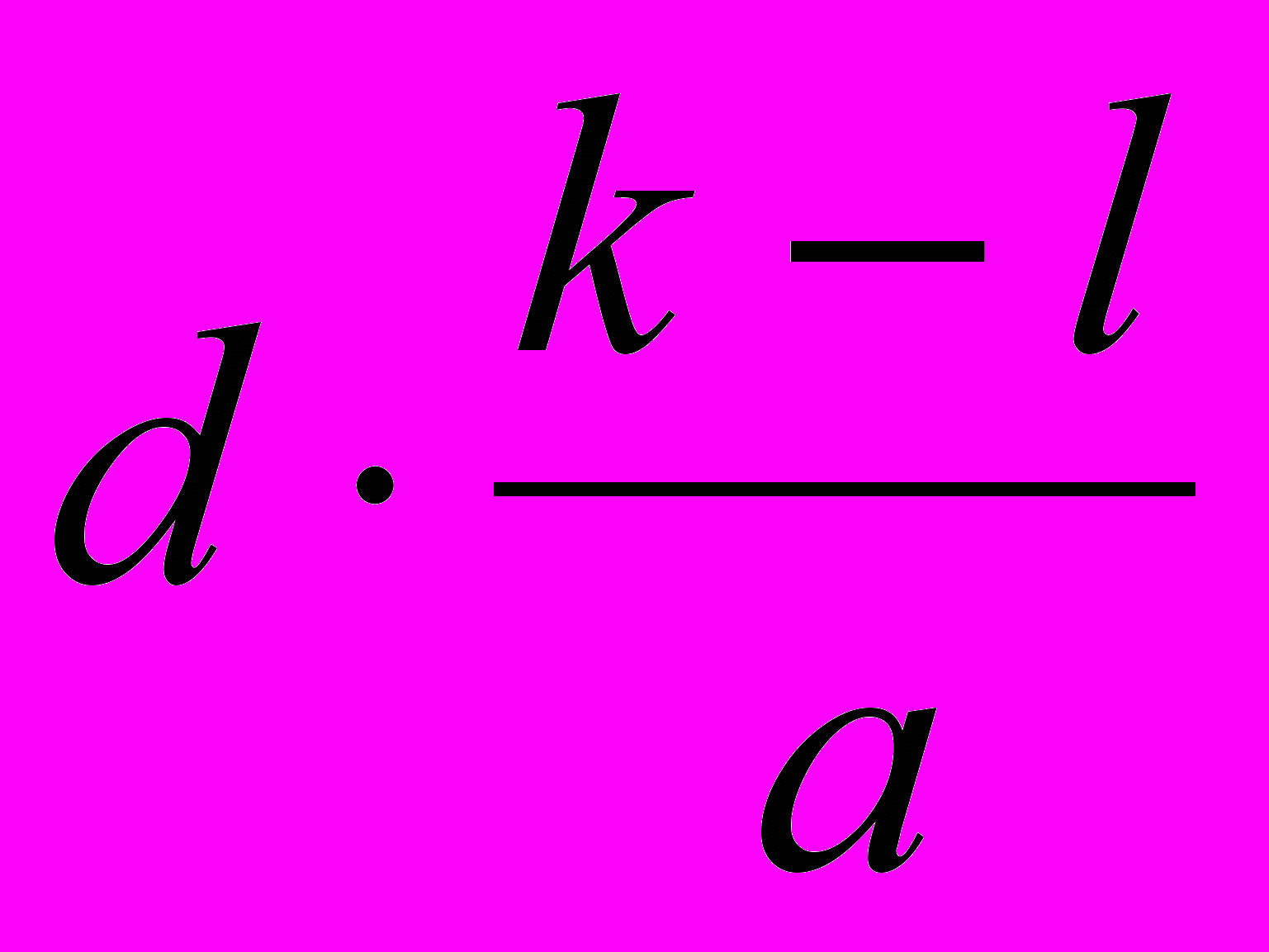 |
Вторая задача связана с нахождением температуры равновесия Травн. по значениям стандартной энтальпии
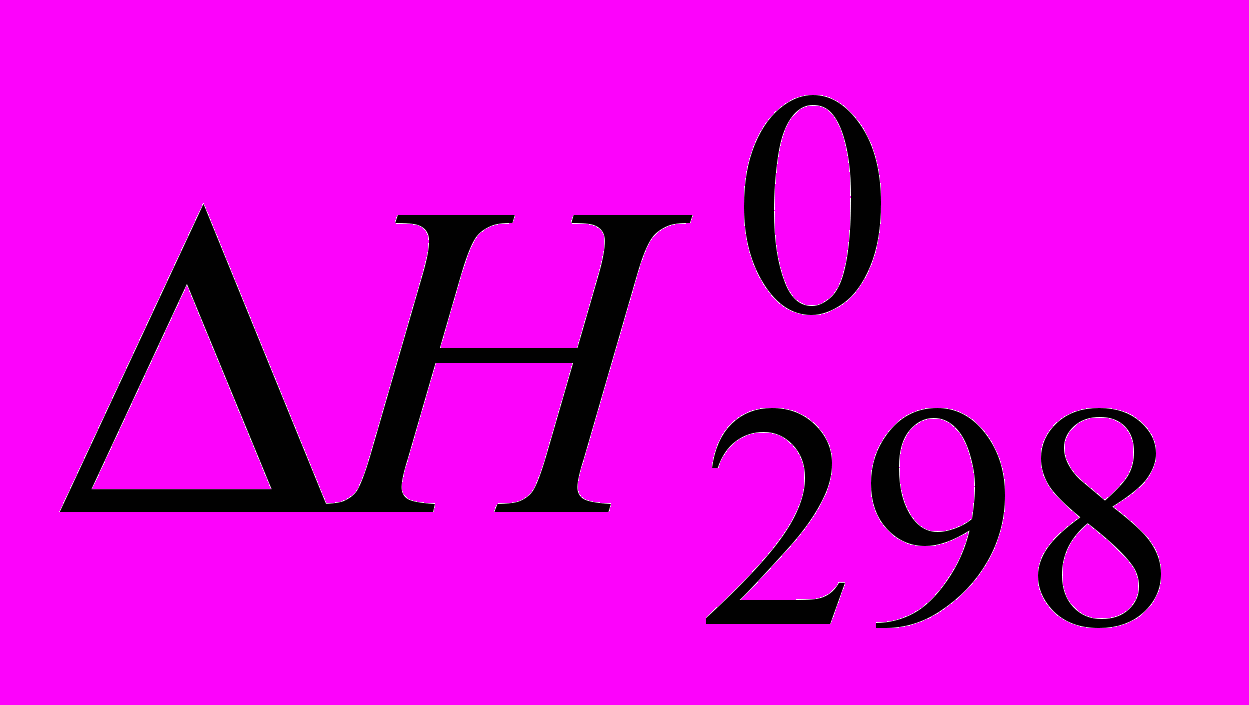 , стандартной энтропии
, стандартной энтропии 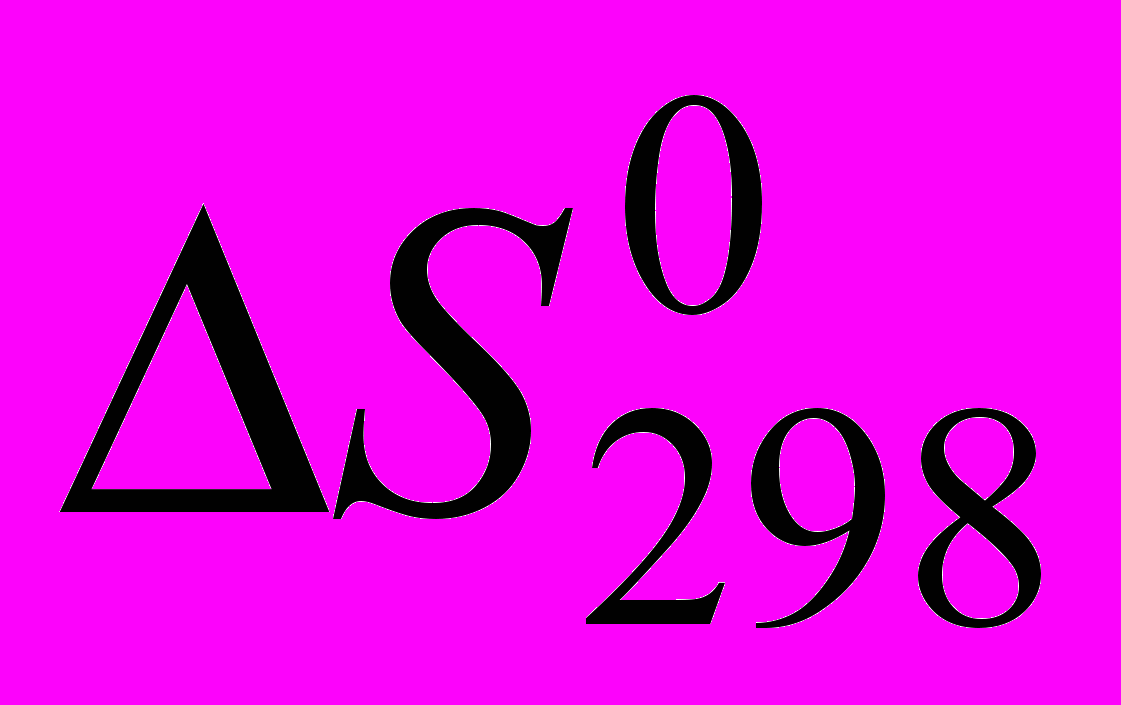 и константы реакции КС или КР. Если реакция идет в растворе, то значениям
и константы реакции КС или КР. Если реакция идет в растворе, то значениям 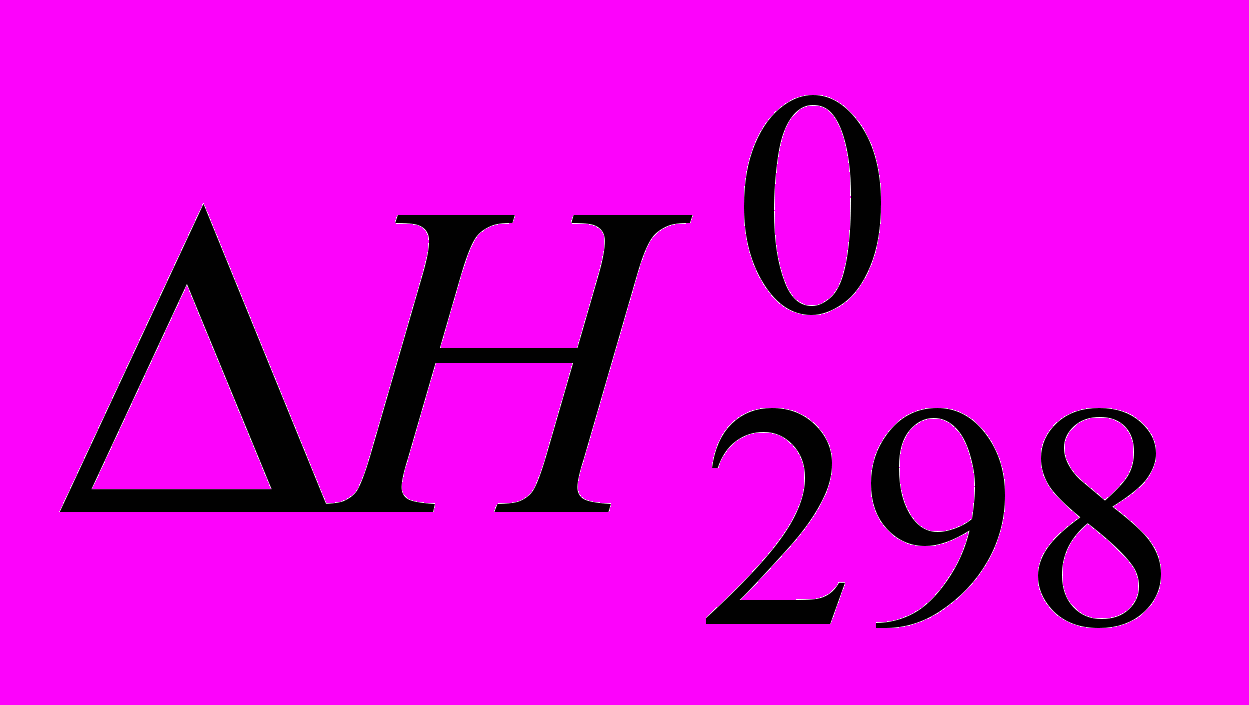 и
и 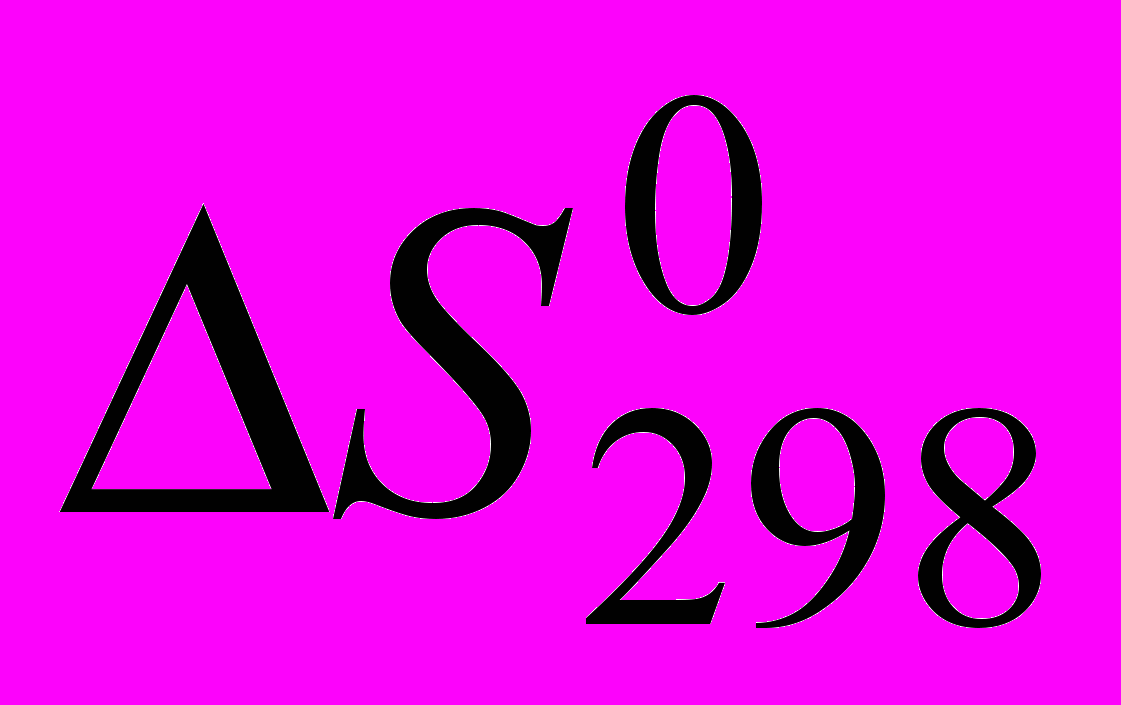 реакции соответствует в уравнении Вант-Гоффа константа реакции, выраженная через молярные концентрации участников реакции. Если реакция идет с участием газовой фазы, то значениям
реакции соответствует в уравнении Вант-Гоффа константа реакции, выраженная через молярные концентрации участников реакции. Если реакция идет с участием газовой фазы, то значениям 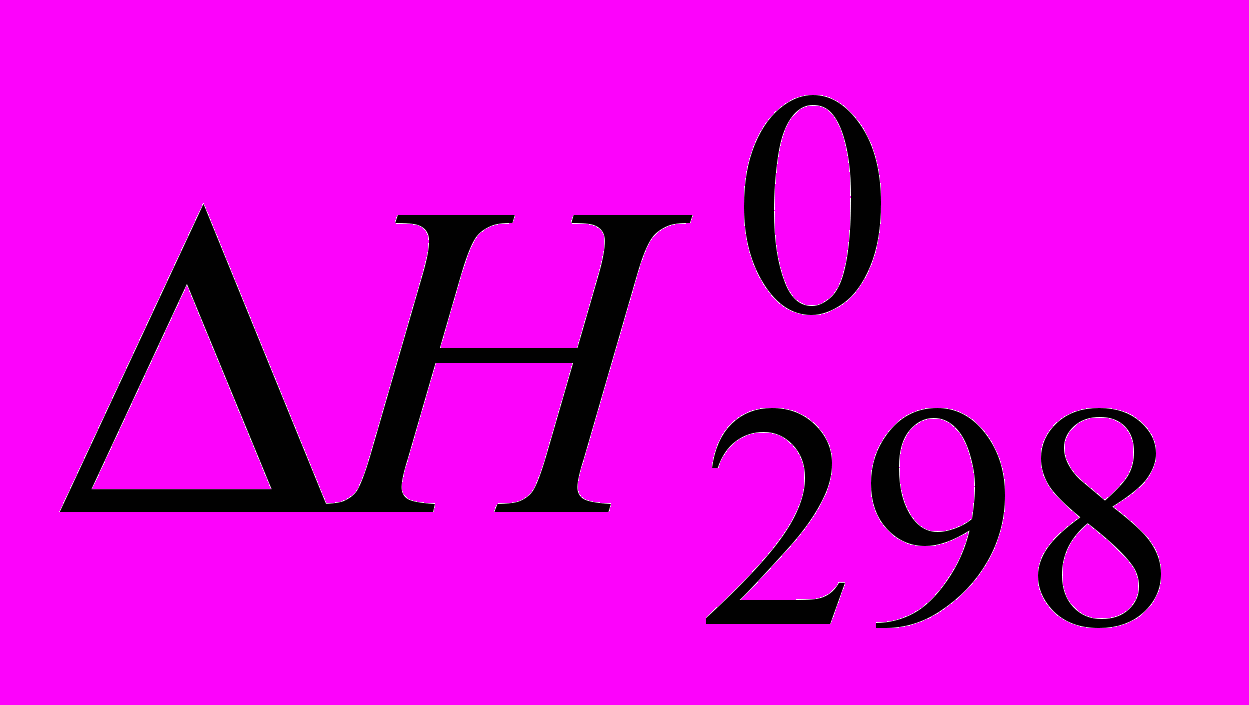 и
и 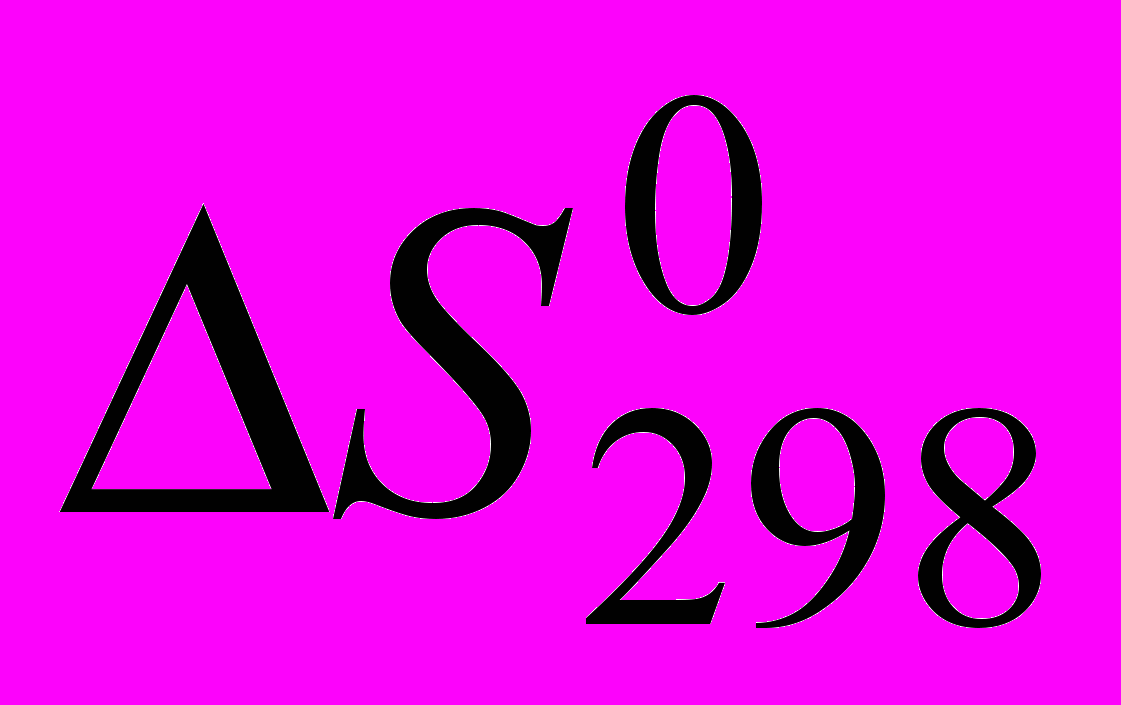 реакции соответствует в уравнении Вант-Гоффа константа равновесия, выраженная через парциальные давления участников реакции, КР. Ее (КР) можно найти, используя следующие соотношения:
реакции соответствует в уравнении Вант-Гоффа константа равновесия, выраженная через парциальные давления участников реакции, КР. Ее (КР) можно найти, используя следующие соотношения:КР = КС (RT)Δn или КР = КNР, где
Δn – изменение числа молей газов в реакции;
Р – общее давление в системе, атм.
Обратите внимание: численное значение КР отвечает давлениям, выраженным в атмосферах. Константу равновесия, выраженную в молярных (мольных) долях участников реакции, (КN) можно найти, пересчитав равновесные молярные концентрации участников реакции СМ равн. на молярные доли каждого из них в системе и подставив полученные значения в выражение константы равновесия КN. Если газовая система состоит только из веществ А, В, С, D, то молярная доля для каждого из них должна быть выражена так:
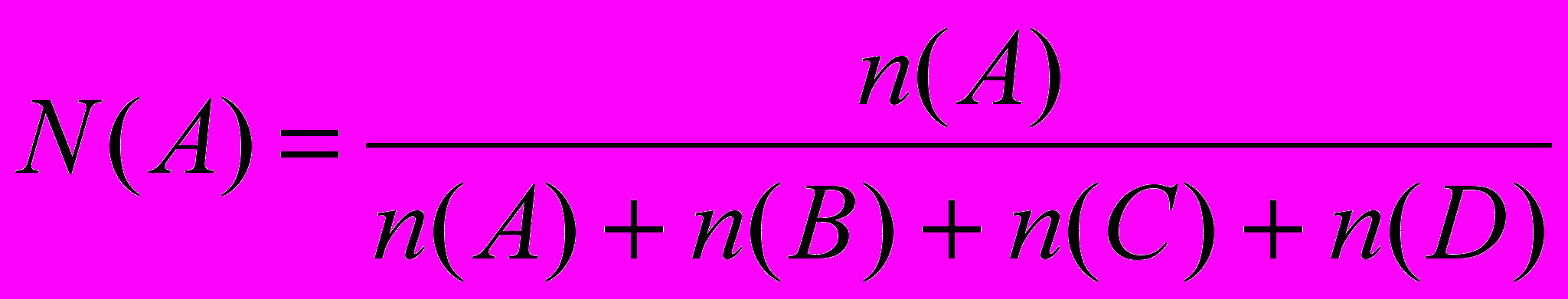 ;
; 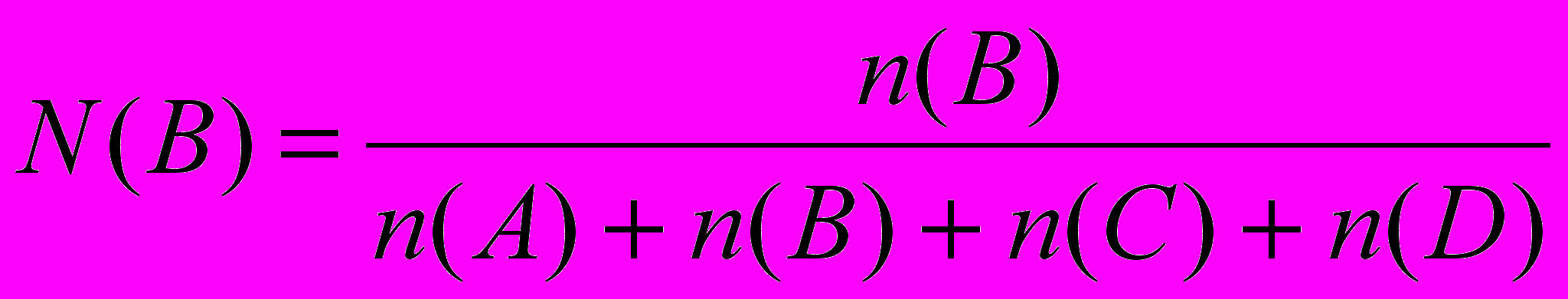 и т.д.
и т.д.