Дворникова Наталия Борисовна учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
- Шрамкова Наталия Борисовна, доцент учебно-методический комплекс, 525.95kb.
- Плотникова Елена Борисовна учебно-методический комплекс, 484.93kb.
- Ирина Борисовна Бархатова, доцент кафедры вокального искусства института музыки, театра, 252.18kb.
- Швед Наталия Гавриловна, Доцент кафедры связей с общественностью и журналистики ргтэу, 234.14kb.
- Новая система оплаты труда – ключевой механизм модернизации образования горбачева наталия, 76.45kb.
- И. Л. Литвиненко учебно-методический комплекс по дисциплине международный туризм ростов-на-Дону, 398.8kb.
- Учебно-методический комплекс умк учебно-методический комплекс общие основы педагогики, 974.02kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Логика" Ростов-на-Дону 2010 Учебно-методический, 892.49kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Юридическая логика" (для студентов, 1003.39kb.
- И. Д. Алекперов учебно-методический комплекс дисциплины "информатика" Ростов-на-Дону, 952.05kb.
Окислительно-восстановительные системы. Степени окисления вещества. Стандартные окислительно-восстановительные потенциалы. Направление окислительно-восстановительных процессов.
Вопросы для самостоятельной подготовки:
- Какие реакции называются окислительно-восстановительными?
- В чем сущность окисления и восстановления с точки зрения электронной теории?
- Какие вещества называются окислителями? Приведите примеры.
- Какие вещества называются восстановителями? Приведите примеры.
- Как измениться степень окисления атомов при восстановлении? При окислении?
- Как измениться количество электронов в атоме элемента при окислении?
- Как измениться количество электронов в атоме элемента при восстановлении?
- Пользуясь понятиями ионизационного потенциала и энергии сродства к электрону, укажите (по периодической системе) элементы, проявляющие свойства окислителей и восстановителей.
- Как влияет величина радиуса атома на его окислительно-восстановительные свойства?
- Как составляются уравнения окислительно-восстановительных процессов с помощью метода электронного баланса?
Задания для самостоятельной работы:
1) Какие из приведенных ниже реакций являются окислительно-восстановительными?
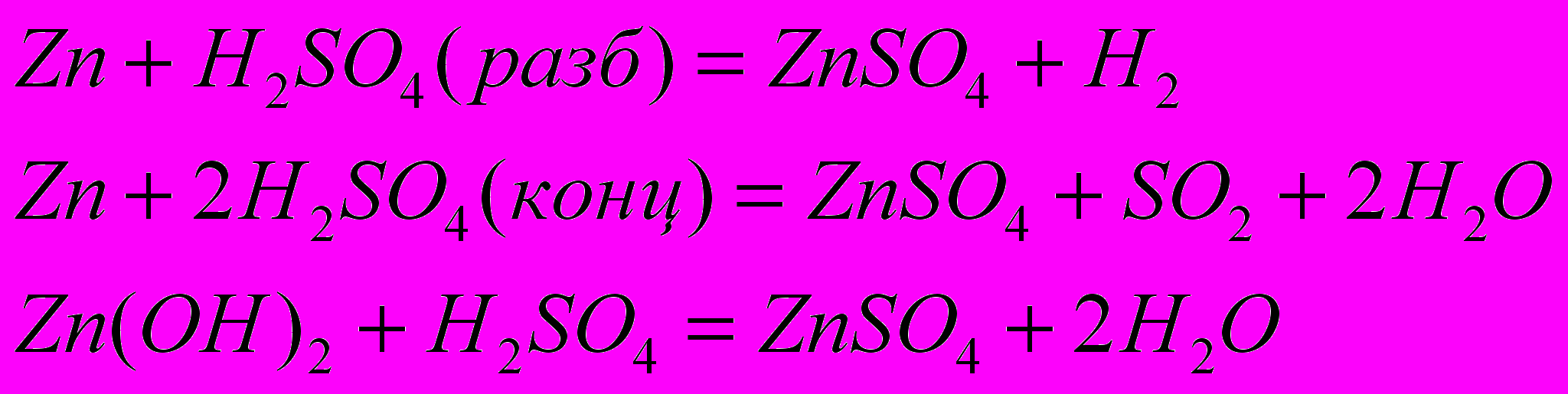
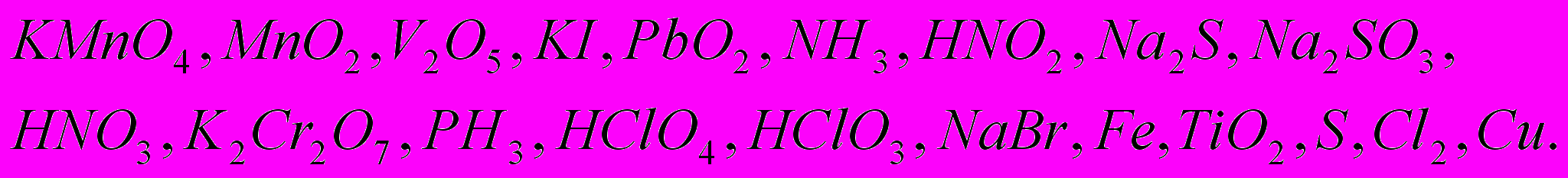
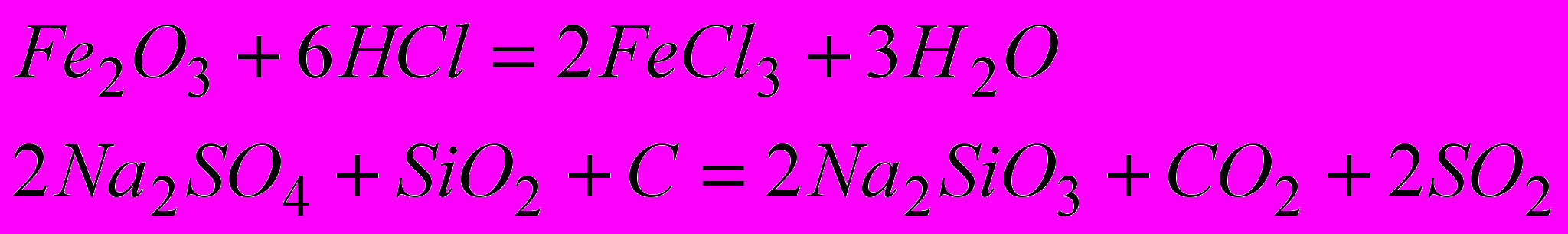
2) Окисление или восстановление происходит при переходах:
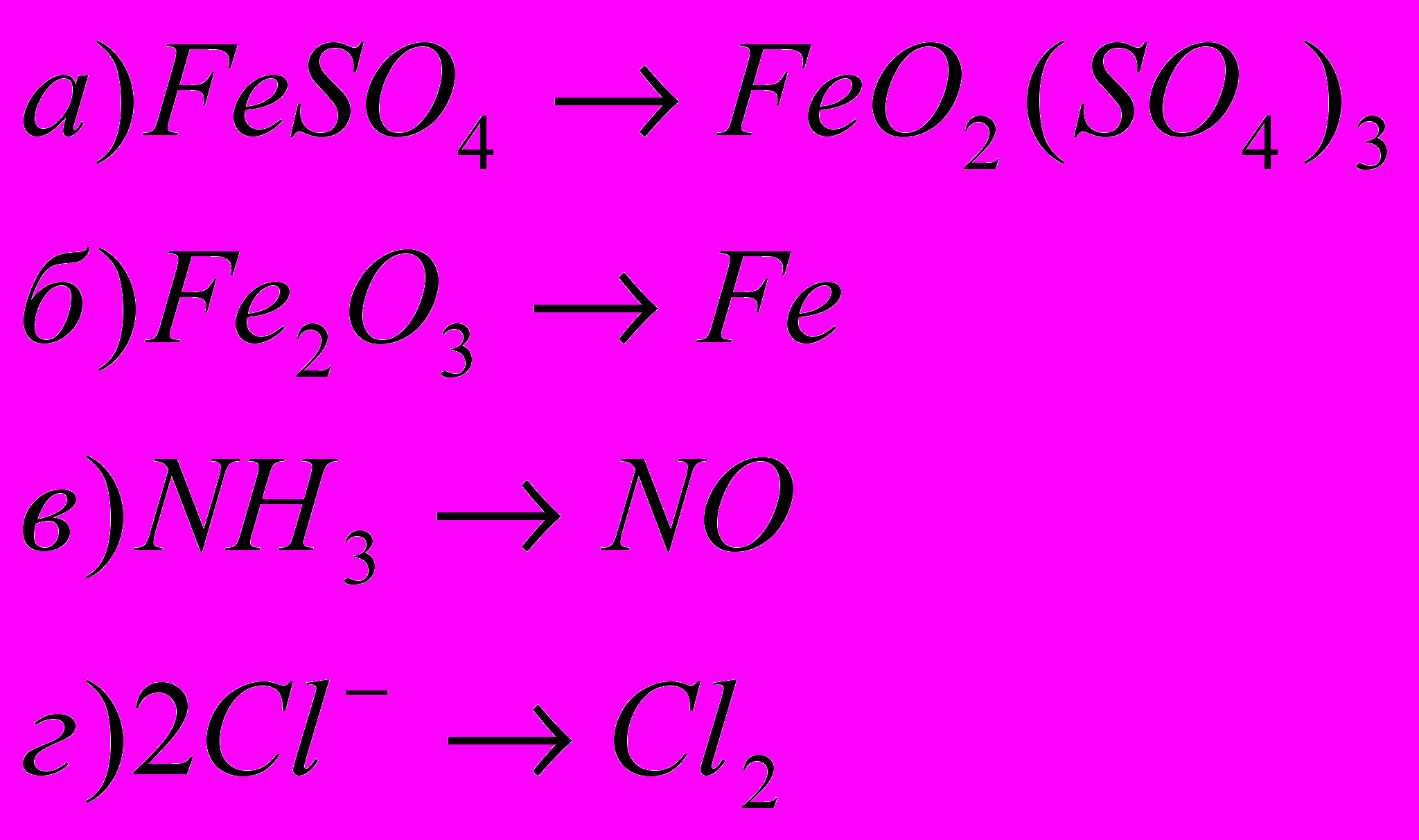
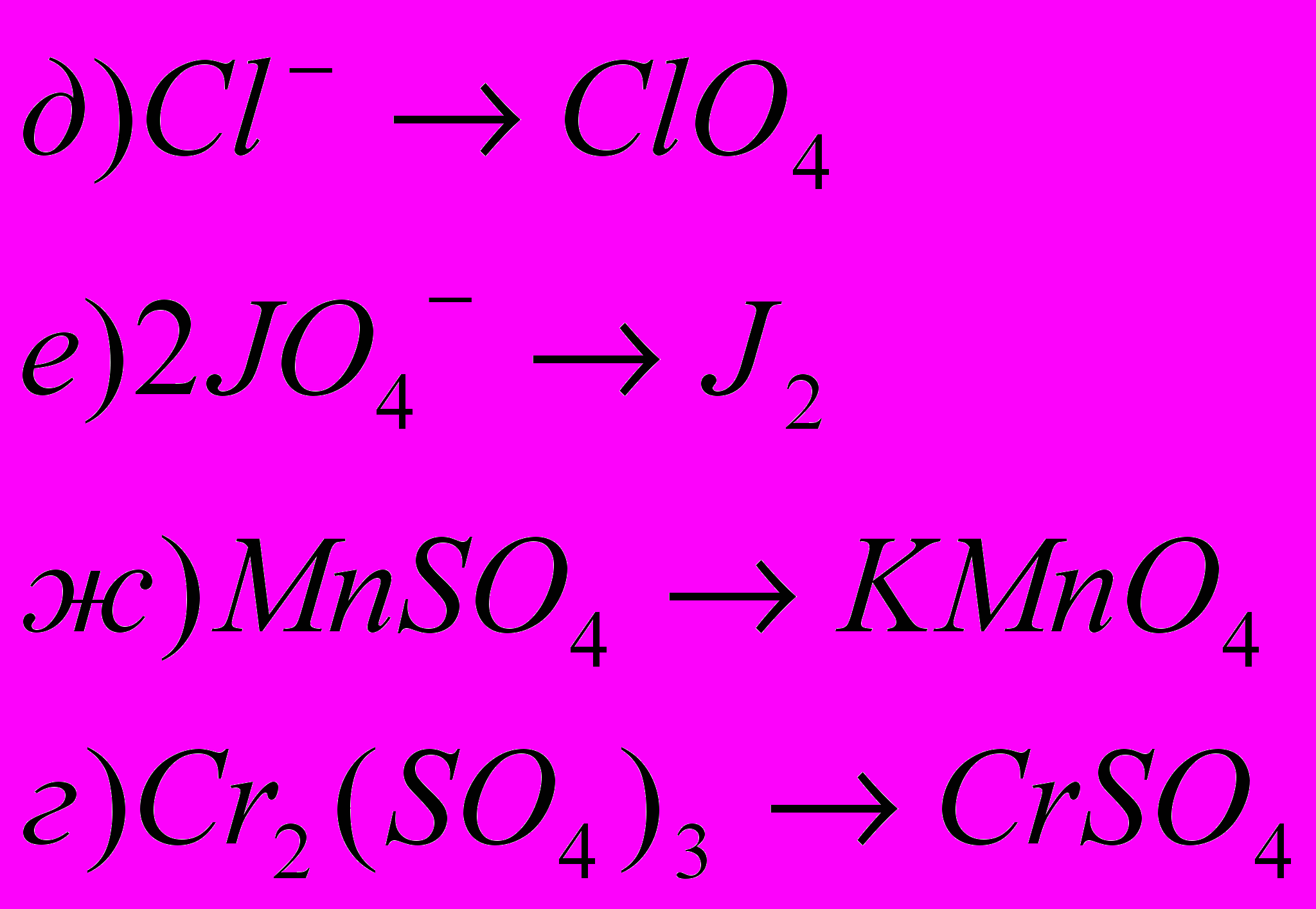
3) Заполните приведенную ниже таблицу, используя следующие вещества:
| Вещества, обладающие | ||
| только окислительными свойствами | только восстановительными свойствами | двойственными окислительно- восстановительными свойствами |
| | | |
4) Подберите коэффициенты и вычислите эквивалентную массу перманганата калия и нитрита натрия в следующих реакциях:
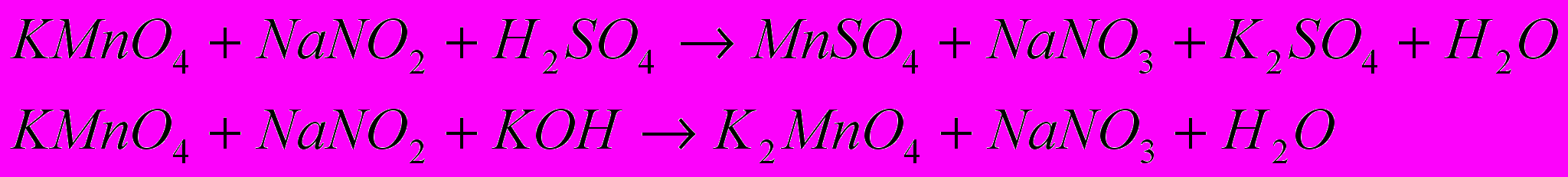
5) Подберите коэффициенты в уравнениях следующих межмолекулярных окислительно-восстановительных реакций:
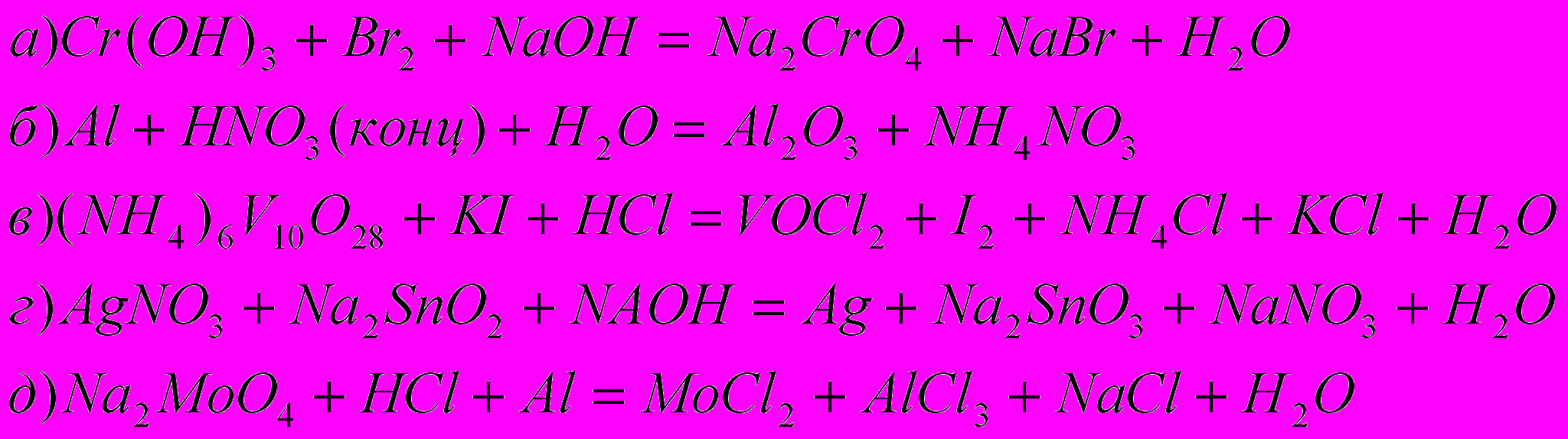
6) Подберите коэффициенты в следующих уравнениях реакций диспропорционирования:
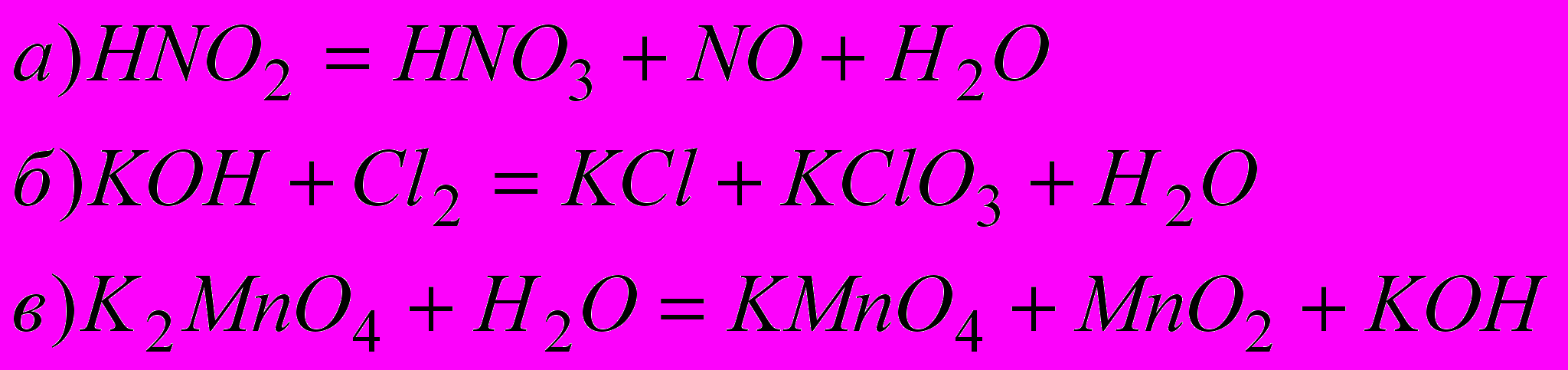
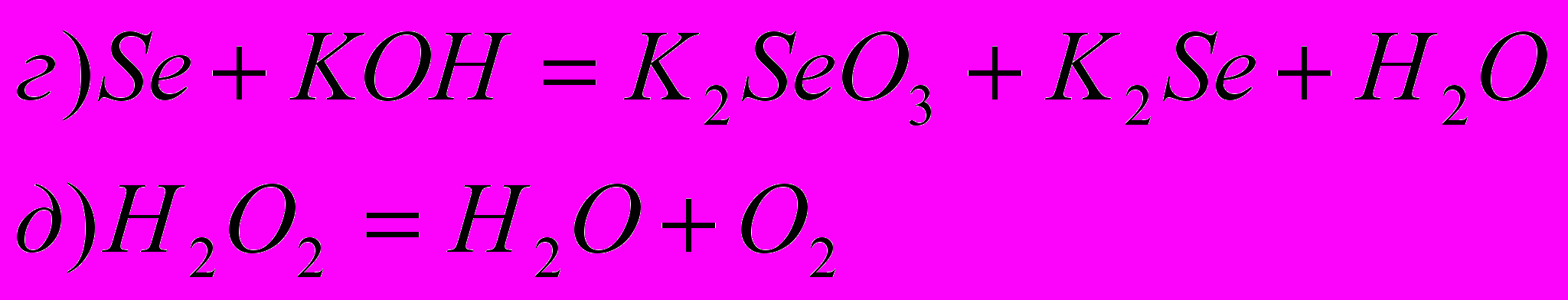
7) Осуществить ряд превращений (укажите необходимые условия):
FeOHSO4 → FeSO4 → FeO → FeS
8) Осуществить ряд превращений (укажите необходимые условия):
FeSO4 → Fe(OH)3 → FeSO4
9) Осуществить ряд превращений (укажите необходимые условия):
H3PO4 → Ca3(PO4)2 → P → H3PO4 → CaHPO4
10) Осуществить ряд превращений (укажите необходимые условия):
Na2CO3 → NaHCO3 → Na2SiO3 → NaHCO3 → Na2CO3 → CaCO3 → CaOCl2 → Cl2 → FeCl2 → HCl → FeCl3
Тема 13. Электрохимические процессы. Гальванический элемент. Коррозия мелаллов.
Электрическая проводимость растворов. Числа переноса.
Вопросы для самостоятельной подготовки:
- Почему металлы и растворы проводят электрический ток? К проводникам какого рода относятся расплавы солей?
- От каких факторов зависит электрическая проводимость раствора?
- Нарисуйте схему прибора, применяемого для определения сопротивления растворов; поставьте стрелками направление тока и напишите формулу, по которой рассчитывается неизвестное сопротивление.
- Что такое постоянная сосуда? Как она определяется на опыте? Для чего она используется?
- Что такое удельная электрическая проводимость? Укажите и объясните, как она изменяется с разбавлением. Начертите соответствующий график.
- Что называется эквивалентной электрической проводимостью? Как она изменяется с разбавлением? Какое объяснение этого изменения дается для слабых и сильных электролитов.
- Как определяется эквивалентная электрическая проводимость при бесконечном разбавлении сильных и слабых электролитов.
- Напишите и укажите математическое выражение закона Кольрауша.
- Что такое абсолютная скорость иона? Как она определяется?
- Что называется числом переноса? Как оно определяется? Для какой цели используется?
Задания для самостоятельной работы:
- Сопротивление раствора нитрата серебра молярной концентрации 0, 307 моль/л при 18°C равно 404,3 Ом. Сопротивление раствора хлорида калия молярной концентрации 0,02 моль/л в том же сосуде при тех же условиях равно 4318 Ом, а удельная электрическая проводимость его σ = 0,002397 См/см. Вычислите удельную и эквивалентную электрические проводимости раствора нитрата серебра.
- Постоянная сосуда для определения для определения сопротивления растворения растворов равна 4,264 см-1. Вычислите сопротивление раствора нитрата калия молярной концентрации 0,2 моль/л, измеренное в этом сосуде при 18 °C. Эквивалентная электрическая проводимость этого раствора равна 98,7 См·см2/моль.
- Удельная электрическая проводимость раствора соляной кислоты массовой долей 30% при 18 °C равна 0,662 См/ см2, а плотность этого раствора равна 1,152 г/см3. Определите эквивалентную электрическую проводимость раствора.
- Удельное сопротивление раствора азотной кислоты молярной концентрации 1,017 моль/л при 18 °C равно 3,2 Ом·см. Эквивалентная электрическая проводимость раствора азотной кислоты при бесконечном разбавлении равна 376,7 См·см2/моль. Определите концентрацию ионов водорода в растворе.
- Удельная электрическая проводимость раствора иодида натрия массовой долей 5% при 18 °C равно 0,0298 См/см, а плотность этого раствора 1,0374 г/см3. Определите коэффициент электрической проводимости иодида натрия в этом растворе. λ∞=110См·см2/моль.
- При 25 °C удельная электрическая проводимость воды равна 5,5·10-8См/см. Подвижность иона водорода и гидроксид-иона при этой температуре соответственно равна 349,8 и 197,6 См·см2/моль. Вычислите степень диссоциации и ионное произведение воды.
- Удельная электрическая проводимость раствора сульфата калия молярной концентрации эквивалентна 0,5 моль/л при 18 °C равна 3,925·10-2См/см. Эквивалентная электрическая проводимость бри бесконечном разбавлении равна 132,6 См·см2/моль. Вычислите кажущуюся степень диссоциации сульфата калия в этом растворе и концентрацию ионов К+ и SO42-.
- Удельное сопротивление раствора хлорида кальция массовой долей 10 % при 18 °C равна 8,764 Ом·см, а плотность 1,0852 г/см3. Вычислите кажущуюся степень диссоциации хлорида кальция в этом растворе и концентрацию ионов кальция и хлора. λ∞=116,5См·см2/моль.
- При 18 °C кажущаяся степень диссоциации раствора хлорида лития молярной концентрации 0.01 моль/л равна 93,13%; эквивалентная электрическая проводимость при бесконечном разбавлении 98,9 См·см2/моль. Найдите удельную электрическую проводимость этого раствора.
Электродные процессы. Гальванические элементы. Аккумуляторы. Окислители и восстановители в природных водах.
Вопросы для самостоятельной подготовки:
- Что такое гальванический элемент? В каких местах и какие скачки потенциалов возникают в гальваническом элементе?
- Как объяснить возникновение скачка потенциалов на границе металл/раствор?
- что такое электродный потенциал металла? От каких факторов зависит его величина?
- Что такое диффузный потенциал? Как объяснить его появление?
- Что такое мембранный потенциал? Как он возникает и каково его биологическое значение?
- Как вычисляется электродвижущая сила гальванического элемента? Что такое стандартный водородный электрод?
- Что такое каломельный электрод?
- Как на опыте определяются потенциалы отдельных электродов?
Задания для самостоятельной работы:
Электрохимические процессы в химических источниках тока
Используя данные по качественному и, возможно, количественному составу химического источника тока, приведенные в Вашем варианте задания, выделите электрохимические системы (или электрохимическую систему), определите стандартные восстановительные потенциалы этих систем (или стандартный восстановительный потенциал этой системы) и выполните следующие задания:
а) вычислите восстановительные потенциалы выделенных Вами электрохимических систем (или восстановительный потенциал выделенной Вами электрохимической системы) при концентрациях, указанных в условии Вашего варианта задания, и если в условии не приведены данные по концентрации электролита, давлению газа, температуре, то следует считать значения соответствующих физических величин стандартными;
б) определите катод и анод, электролиты в данной катодной и анодной зонах гальванического элемента, состав которого приведен в Вашем варианте задания; составьте схему этого гальванического элемента и укажите направление перемещения электронов во внешней его цепи;
в) напишите уравнения электродных процессов полученного гальванического элемента и уравнение токообразущей реакции (или объясните, почему невозможно написать уравнение токообразующей реакции);
г) вычислите ЭДС (электропроводящую силу) этого гальванического элемента и поясните, за счет чего обеспечивается разность потенциалов;
д) определите возможность увеличения ЭДС данного гальванического элемента разными способами: либо за счет замены электропроводов, либо за счет изменения концентрации электролита (увеличения или уменьшения, например в 10 раз), либо за счет изменения рН среды (увеличения или уменьшения, например на 1 единицу рН); в каждом случае приведите примеры с кратким обоснованием и необходимыми расчетами.
| Номер Вари-анта | Качественный состав химического источника тока | Количественный состав химического источника тока | |
| электроды | электролиты | ||
| 1 | Цинковый и водородный | ZnSO4 (p.); H2SO4 | СМ(ZnSO4) = 0,1 моль·л-1 (αкаж.=66%); рН=2,0 |
| 2 | Серебряный и водородный | AgNO3 (p.); H2SO4 | CM(AgNO3)=0,01 (αкаж.=0,93); СН(Н2SO4)=0,02 (αкаж.=0,58) моль·л-1 |
| 3 | Водородные | Растворы КОН | СН(КОН)=1,0 (αкаж.=77%); СН(КОН)=0,1 (αкаж.=91%) моль·л-1 |
| 4 | Серебряные | Растворы AgNO3 | СН(AgNO3)=0,005 (αкаж.=98%); CH(AgNO3)=0,2 (αкаж.=85%) моль·л-1 |
| 5 | Водородные | Растворы НСl | CH(HCl)=0,05 (αкаж.=92%); CH(HCl)=0,18 (αкаж.=88%) моль·л-1 |
| 6 | Водородные | СН3COOH(p.); HCOOH(p.) | CH(CH3COOH)=1,0; CH(HCOOH)=0,001 моль·л-1 |
| 7 | Магниевые | Растворы MgSO4 | CH(MgSO4)=0,001 (αкаж.=87%); CM(MgSO4)=2б0 (αкаж.=68%) моль·л-1 |
| 8 | Никелевый и серебряный | Ni(NO3)2(p.); AgNO3(p.) | СМ(Ni2+)=1·10-4 моль·л-1; γ(Ni2+)=0,92; CM(Ag+)=1·10-1 моль·л-1; γ(Ag+)=0,75 |
| 9 | Медные | Растворы CuSO4 | a(Cu2+)=1,0 моль·л-1; CM(Cu2+)=0,001 моль·л-1 |
| 10 | Золотой и водородный | AuCl3(p.); HCl(p.) | CH(AuCl3)=0,1 (αкаж.=65%); CH(HCl)=0,05 (αкаж.=92%) моль·л-1 |
Методические рекомендации. При выполнении задания Вам потребуются данные таблицы приложения Н, а также, возможно, данные таблиц приложения E, F и G. При расчетах восстановительных потенциалов электрохимических систем используйте активности (а не концентрации) компонентов этих систем. И еще: при составлении схемы гальванического элемента лучше использовать краткую запись концентрации электролита, например: 0,01 М AgNO3, а не СМ(AgNO3) = 0,01 моль·л-1; 0,1 н ZnSO4, а не СН(ZnSO4) = 0,1 моль·л-1.
Электрохимическая коррозия металлов. Методы защиты металлов от коррозии
Шесть различных металлов и два варианта условий коррозии приведены в Вашем варианте задания в таблице. Используя эти данные, выполните следующие задания:
а) определите возможность коррозии металла 1 в условиях 1 и 2, приведите необходимые расчеты (если в условии задания не приведены данные по концентрации электролита, давлению газа, температуре - считайте соответствующие физические величины стандартными) и напишите уравнения соответствующих процессов (не забывайте о склонности некоторых металлов к пассивации в агрессивных средах);
б) определите, как изменится коррозия металла 1 по отношению к исходной, если он находится в контакте:
1) с металлом 2 в условиях 1;
2) с металлом 3 в условиях 2;
составьте схемы работающих при этом коррозионных элементов и напишите уравнения электродных процессов; приведите необходимые расчеты;
в) определите тип защитного металлического покрытия (катодное или анодное), если:
1) металл 1 покрыт металлом 4,
2) металл 1 покрыт металлом 5;
составьте уравнения катодных и анодных процессов, протекающих при нарушении целостности защитного покрытия:
1) металла 1 металлом 4 в условиях коррозии 1,
2) металла 1 металлом 5 в условиях коррозии 2;
г) определите, может ли служить протектором металл 6 при защите металла 1 от коррозии в условиях 1 и 2; напишите уравнения протекающих процессов; приведите необходимые расчеты;
д) предложите наилучшие варианты катодного и анодного защитного покрытия, а также протектора для защиты металла от коррозии в условиях 1 и 2.
| № вар. | Металлы | Условия коррозии при 298 К | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 1 | 2 | |
| 1 | Pb | Ni | Cu | Cd | Ag | Fe | Атмосфера влажного воздуха | Раствор HCl с рН=5,6 |
| 2 | Sn | Zn | Pb | Cr | Cu | Ge | Раствор NaCl в контакте с О2 | Водный раствор с рН=2,0 |
| 3 | Ni | Co | Cu | Zn | Ag | Fe | Атмосфера влажного воздуха | Раствор H2SO4 с рН=4,0 |
| 4 | Co | Fe | Sn | Ti | Au | Pb | Водный раствор с рН=10 в кон. с О2 | Водный раствор с рН=4,5 |
| 5 | Cd | Mn | Ni | Zn | Pt | Al | Атмосфера влажного воздуха | Раствор HNO3 с рН=5,0 |
| 6 | Fe | Mg | Ag | Cr | Ni | Sn | Раствор NaNO3 в контакте с О2 | Водный раствор с рН=6,0 |
| 7 | Zn | Al | Cd | Mn | Sn | Mg | Атмосфера влажного воздуха | Раствор HCl с рН=1,0 |
| 8 | Ge | Sn | Pt | Ni | Pd | Ag | Водный раствор с рН=9 в контакте с О2 | Водный раствор с рН=0,5 |
| 9 | Cu | Ni | Au | Sn | Ag | Fe | Атмосфера влажного воздуха | Раствор H2SO4 с рН=2,0 |
| 10 | Ag | Cr | Pt | Ni | Au | Pd | Водный раствор с рН=9 в контакте с О2 | Водный раствор с рН=5,5 |
Методические рекомендации. При выполнении задания Вам потребуются данные таблицы приложения Н, а также, возможно, данные таблицы Е. Для расчета ЭДС коррозионного элемента (или для сравнения восстановительных потенциалов окислителя и восстановителя) можно использовать стандартные восстановительные потенциалы соответствующих металлов и восстановительные потенциалы кислородного и водородного электродов (точнее, потенциалы процессов, идентичных процессам, протекающим на кислородном и водородном электродах) со стандартным давлением соответствующего газа при стандартной температуре. При расчетах восстановительных потенциалов кислородного и водородного электродов обязательно нужно учитывать лишь рН раствора электролита, т.е. концентрацию ионов Н+ или ОН-.
