Дворникова Наталия Борисовна учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
СодержаниеРастворы. Растворимость. Раздел 3. Физическая химия |
- Шрамкова Наталия Борисовна, доцент учебно-методический комплекс, 525.95kb.
- Плотникова Елена Борисовна учебно-методический комплекс, 484.93kb.
- Ирина Борисовна Бархатова, доцент кафедры вокального искусства института музыки, театра, 252.18kb.
- Швед Наталия Гавриловна, Доцент кафедры связей с общественностью и журналистики ргтэу, 234.14kb.
- Новая система оплаты труда – ключевой механизм модернизации образования горбачева наталия, 76.45kb.
- И. Л. Литвиненко учебно-методический комплекс по дисциплине международный туризм ростов-на-Дону, 398.8kb.
- Учебно-методический комплекс умк учебно-методический комплекс общие основы педагогики, 974.02kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Логика" Ростов-на-Дону 2010 Учебно-методический, 892.49kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Юридическая логика" (для студентов, 1003.39kb.
- И. Д. Алекперов учебно-методический комплекс дисциплины "информатика" Ростов-на-Дону, 952.05kb.
Растворы. Растворимость.
Вопросы для самостоятельной подготовки:
- Приведите примеры растворов, различающихся по агрегатному состоянию. Что принято называть растворителем?
- В чем сущность процесса растворения твердых веществ?
- От чего зависит тепловой эффект растворения?
- Какие растворы называются насыщенными, ненасыщенными?
- Что является мерой растворимости вещества при данных условиях?
- Как зависит растворимость твердых веществ от температуры?
- Как зависит растворимость газов от температуры и парциального давления?
- Что такое кристаллогидраты? Каковы условия их устойчивости?
- Какое практическое значение имеют процессы растворения и кристаллизации?
Задания для самостоятельной работы:
Вариант 1
- В растворе массой 100 г содержится хлорид бария массой 20 г. Какова массовая доля хлорида бария в растворе?
- В 200 г воды растворили 67,2 л хлороводорода (н.у). Определить массовую долю хлороводорода в полученном растворе.
- Молярность раствора серной кислоты равна 4,5 моль/л, его плотность 1,26 г/мл. Определить процентную концентрацию раствора.
Вариант 2
- Сахар массой 5 г растворили в воде массой 20 г. Какова массовая доля сахара в растворе?
- К 40 г раствора фосфата натрия Nа3РО4 с массовой долей 8% прилили 20 г раствора с массовой долей Na3РО4 5%. Какова массовая доля (%) Nа3РО4 в полученном растворе?
- В каком количестве воды нужно растворить 200 г вещества, чтобы получить 15% раствор?
Вариант 3
- Какие массы нитрата калия и воды необходимо взять для приготовления 2 кг раствора с массовой долей нитрата калия, равной 0,05?
- Какие массы кристаллогидрата сульфата натрия Na2SO4 · 10H2O и воды надо взять, чтобы получить раствор массой 71 г с массовой долей сульфата натрия 20%?
- В 200 мл воды растворили 50 л хлороводорода НС1 (н. у.). Какова массовая доля (%) НС1 в этом растворе?
Тема 5. Способы выражения концентрации растворов
Вопросы для самостоятельной подготовки:
- Что показывают различные способы выражения концентрации растворов: нормальная, молярная, моляльная, процентная концентрации?
- Что показывает титр раствора?
- Что такое грамм-эквивалент?
Задания для самостоятельной работы:
Вариант 1
- Сколько нужно вещества для приготовления 50 мл раствора сульфата меди, молярная концентрация которого 0,2 моль/л?
- Сколько серной кислоты требуется для приготовления 2,5 л 0,1 М раствора.
- 30 г вещества растворены в 150 г растворителя. Вычислить массовую долю растворенного вещества.
Вариант 2
- Сколько растворенного вещества следует взять, чтобы приготовить 800 г раствора с массовой долей растворенного вещества, равной 5%?
- В каком количестве 15% раствора содержится 50 кг растворенного вещества?
- Имеется 250 г растворителя. Сколько надо добавить к нему растворенного вещества, чтобы получить 20 % раствор?
Вариант 3
- Требуется приготовить 100 кг 30% раствора хлорида калия из минерала, содержащего 45% примесей. Сколько следует взять этого минерала?
- Сколько сульфата железа содержат 100 мл 12% раствора его, плотность которого равна 1,12 г/моль?
- Плотность 15%-ного (по массе) раствора Н2SО4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
Методические рекомендации. Выполняя задание, необходимо, прежде всего, понимать, что состав раствора не зависит от способа его выражения: при переходе от одного способа к другому не меняется ни количество растворенного вещества, ни объем раствора, ни его масса, ни его плотность. Решать задачи можно самыми разнообразными методами. Например, в общем виде, используя лишь формулы с буквенными обозначениями физических величин, заменяя неизвестные величины эквивалентными им выражениями, содержащими известные величины. Метод краток и точен, но требует хорошей математической подготовки. Другой метод заключается в том, что вводится дополнительное условие. Например: масса раствора, равная 100 граммов, или объем раствора, равный 1 литру. Этот метод более длинен и менее точен, но более нагляден и не требует очень хорошей математической подготовки.
Чтобы выполнить задание, необходимо решить одну из двух задач: либо вычислить массу растворяемого вещества по известному объему приготовляемого раствора, либо вычислить объем приготовляемого раствора по известной массе растворяемого вещества.
Чтобы решить эти задачи необходимо понимать следующее:
- массы твердых веществ при растворении не меняются, если эти вещества не взаимодействуют с водой или не содержат воду, как, например, кристаллогидраты;
- масса приготовленного раствора равна сумме масс растворяемого вещества и воды (в случае взаимодействия растворяемого вещества с водой необходимо учитывать, что формула растворенного вещества отличается от формулы растворяемого вещества, а вода расходуется не только на растворение, но и на химическую реакцию);
- объем приготовленного раствора не равен сумме объемов растворяемого вещества и воды.
Тема 6. Молекулярные растворы
Давление пара растворов. Кипение и кристаллизация растворов. Осмос. Осмотическое давление. Растворимость газов в жидкостях. Летучесть и активность.
Вопросы для самостоятельной подготовки:
- От каких факторов зависит давление насыщенного пара жидкости?
- Объясните, почему давление насыщенного пара раствора нелетучего вещества меньше давления насыщенного пара растворителя.
- Сформулируйте закон Рауля, напишите его математическое выражение и поясните входящие в него члены.
- Что называется температурой замерзания раствора?
- Объясните, почему растворы затвердевают при другой температуре, чем растворитель.
- Сформулируйте закон Рауля для понижения температуры замерзания растворов.
- Что такое криоскопическая постоянная? В чем заключается ее физический смысл?
- В чем сущность криоскопического метода определения относительной молекулярной массы?
- Чем определяется кипение жидкости? Что называется температурой кипения жидкости?
- Как отличается температура кипения растворов нелетучих веществ по сравнению с температурой кипения растворителя?
Задания для самостоятельной работы:
1. Чему равно осмотическое давление 0,5 М раствора глюкозы С6Н12О6 при 25°С?
2. Водно-спиртовый раствор, содержащий 15% спирта (ρ = 0,97 г/мл), кристаллизуется при -10,26°С. Найти молекулярную массу спирта и осмотическое давление раствора при 293 К.
3. В 60 г бензола растворено 2,09 г некоторого вещества, элементарный состав [в % (масс.)] которого: С — 50,69, Н — 4,23 и О — 45,08. Раствор кристаллизуется при 4,25°С. Установить молекулярную формулу вещества. Чистый бензол кристаллизуется при 5,5°С.
4. Вычислить осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 г Н2О при 293 К. Плотность раствора считать равной единице.
5. Вычислить осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 г Н2О при 293 К. Плотность раствора считать равной единице.
6. В 100 г H2О содержится 4,57 г сахарозы С12Н22О12. Найти: а) осмотическое давление при 293 К; б) температуру кристаллизации раствора; в) температуру кипения раствора; г) давление насыщенного пара над раствором при 293 К. Давление насыщенного пара над водой при 293 К равно 2,337 кПа (17,53 мм рт. ст.). Плотность раствора считать равной плотности воды.
7. При растворении 3,24 г серы в 40 г бензола температура кипения последнего повысилась на 0,81 К. Из скольких атомов состоит молекула серы в растворе?
8. Чему равно давление насыщенного пара над 10% раствором карбамида СО(NН2)2 при 100°С?
9. Сколько граммов глюкозы С6Н12О6 должно находиться в 0,5 л раствора, чтобы его осмотическое давление (при той же температуре) было таким же, как раствора, в 1 л которого содержится 9,2 г глицерина С3Н5(ОН)3?
10. Температура кипения водного раствора сахарозы С12Н22О12 равна 101,4°С. Вычислить молярную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор?
Методические рекомендации. Выполнение задания предполагает решение одной или двух несложных задач, одна из которых связана с использованием уравнения, являющегося математическим выражением закона Вант-Гоффа. Обратите внимание, R в этом уравнении – это постоянная величина, совпадающая с универсальной газовой постоянной, она может иметь различные значения:
а) 8,314 Дж·моль-1·К-1 (при этом объем должен быть взят в м3, а давление – в Па);
б) 8,314 кПа·л·моль-1·К-1 (при этом объем должен быть взят в л, а давление – в кПа);
в) 0,0821 атм·л·моль-1·К-1 (при этом объем должен быть взят в л, а давление – в атм);
г) 62400 мм.рт.ст.·мл·моль-1·К-1 (при этом объем должен быть взят в мл, а давление – в мм.рт.ст.).
Если значение осмотического давления π приведено в условии задачи, то необходимо правильно выбрать соответствующее ему (точнее, его единицам измерения) значение R. Если значение осмотического давления π необходимо найти, то Вы вправе использовать то из значений R, которое посчитаете наиболее удобным для расчетов.
Тема 7. Равновесия в растворах электролитов
Растворы электролитов. Ионные равновесия и их смещения. Теория кислот и оснований.
Вопросы для самостоятельной подготовки:
- Назовите основные положения теории электролитической диссоциации.
- Что лежит в основе разделения электролитов на сильные и слабые? Приведите примеры.
- Что называется степенью диссоциации электролита?
- Что называется константой электролитической диссоциации?
- Каким образом можно сместить равновесие электролитической диссоциации?
- Измениться ли степень диссоциации азотистой кислоты, если раствор ее разбавить водой?
- В чем заключается отклонение от закона действия масс, наблюдаемые у сильных электролитов?
- В чем заключается сущность теории сильных электролитов?
- Какие электролиты подвергаются ступенчатой диссоциации?
- Как вычислить степень диссоциации слабого электролита, если известна константа диссоциации и концентрация раствора?
Задания для самостоятельной работы:
- Вычислить рН 0,1 н. раствора уксусной кислоты, содержащего, кроме того, 0,1 моль/л СН3СОONа. Коэффициенты активности ионов считать равными единице.
- Вычислить степень диссоциации кремниевой кислоты H2SiO3 в 0,4 М растворе равна 1,4 · 10-2. Найти константу диссоциации кислоты.
- Степень диссоциации слабой одноосновной кислоты в 0,2 н. растворе равна 0,03. Вычислить значения [Н+] и [ОН-] для этого раствора.
- Вычислить рН 0,01 н. раствора уксусной кислоты, в котором степень диссоциации кислоты равна 0,042.
- Степень диссоциации слабой одноосновной кислоты в 0,3 М растворе равна 7,9 • 10-10. Найти константу диссоциации кислоты.
- Во сколько раз растворимость (в моль/л) Fе(ОН)2 в воде больше растворимости Fе(ОН)3 при 25°С?
- Константа диссоциации угольной кислоты 1,8• 10-5. Найти степень диссоциации кислоты в 0,05 М растворе.
- Степень диссоциации щавелевой кислоты H2C2O4 5,4 • 10-2. Найти степень диссоциации в 0,01 М растворе.
- Степень диссоциации азотистой кислоты HNO2 в 0,01 М раствора равна 4 • 10-2. Найти константу диссоциации кислоты.
- Константа диссоциации гидроксида аммония равна 1,8 • 10-5. Найти степень диссоциации гидроксида аммония в 0,01 М растворе.
Произведение растворимости. Диссоциация воды. Водородный показатель.
Вопросы для самостоятельной подготовки:
- Что называется ионным произведением воды? Как оно определяется?
- Объясните, как зависит величина ионного произведения воды от температуры?
- Как определить водородный показатель? Почему можно ограничиться величиной рН в определение среды?
- Чему равна концентрация ионов водорода и гидроксид – ионов в кислой, нейтральной и щелочной среде?
- Как меняется рН кислого или щелочного раствора при изменении концентрации ионов водорода в 10 раз?
- Что называется произведением растворимости?
- Для растворов каких веществ применимо произведение растворимости?
- Как следует изменять концентрацию ионов в растворе малорастворимого электролита, чтобы увеличить растворимость осадка?
- Что произойдет при добавлении к насыщенному, ненасыщенному, перенасыщенному раствору кристаллов того же электролитов?
- Как надо изменять концентрацию ионов в растворе малорастворимого электролитов, чтобы увеличить выпадение осадка?
Задания для самостоятельной работы:
- Найти молярную концентрацию ионов Н+ в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет: а) 10-4; б) 3,2 · 10-6.
- Определить концентрацию ионов водорода и гидроксид-ионов в растворе, характер его среды, если рН = 11.
- Найти молярную концентрацию ионов ОН- в водных растворах, в которых концентрация ионов водорода (в моль/л) равна: а) 10-3; б) 6,5 · 10-8.
- В 500 мл воды при 18°С растворяется 0,0166 г Аg2СrО4 . Чему равно произведение растворимости этой соли?
- Вычислить рН растворов, в которых концентрация ионов Н+ (в моль/л) равна: а) 2 • 10-7; б) 8,1 • 10-3.
- К 50 мл 0,001 н. раствора НС1 добавили 450 мл 0,0001 н. раствора АgNО3. Выпадет ли осадок хлорида серебра?
- Вычислить рН растворов, в которых концентрация ионов ОН- (в моль/л) равна: а) 4,6 • 10-4; б) 5 • 10-6.
- Вычислить произведение растворимости РbВr2 при 25°С, если растворимость соли при этой температуре равна 1,32 ·10-2 моль/л.
- Концентрация ионов водорода Н+ в растворе 10-14 моль/л. Определить концентрацию гидроксид-ионов, рН и характер среды раствора.
- Вычислить рН водного раствора, в котором концентрация гидроксид-ионов равна 10-2 моль/л.
Смещение равновесий. Гидролиз солей.
Вопросы для самостоятельной подготовки:
- Что называется гидролизом?
- Как влияет температура и разбавление на гидролиз солей?
- Почему не все соли могут гидролизоваться?
- Как можно усилить гидролиз солей?
- Как можно ослабить гидролиз солей?
- Что называется степенью гидролиза?
- Что называется константой гидролиза?
Задания для самостоятельной работы:
Вариант 1
- Напишите уравнение гидролиза для СuNO2, NaCN, HCOONH4, определить рН среды и составьте выражение Кгидр данных веществ.
- Вычислите степень гидролиза в 0,001 М растворе KCN.
- Определите рН 0,05 М раствора Na2CO3.
Вариант 2
1. Напишите уравнение гидролиза для NH4Cl, Fe(NO2)2, CH3COOH, определите рН среды и составьте выражение Кгидр данных веществ.
- Вычислите степень гидролиза в 0,1 М растворе K2CO3.
- Определите рН 0,01 М раствора HCOONa.
Вариант 3.
- Напишите уравнение гидролиза для AlCl3, NH4Cl, NaNO3, определите рН среды и составьте выражение Кгидр данных веществ.
- Вычислите степень гидролиза в 0,1 М растворе K2CO3.
- Определите рН 0,01 М раствора K2SO3.
Методические рекомендации. Для процессов обратимого гидролиза вычисляют константу гидролиза КГ, степень гидролиза h и равновесные концентрации продуктов гидролиза.
Если гидролизу подвергается однозарядный ион, то в зависимости от соотношения концентрации электролита с константой гидролиза проводят расчеты, либо строго, либо приближенно. Если СМ(АВ)/КГ < 100, то ведут строгий расчет по формулам:
а)
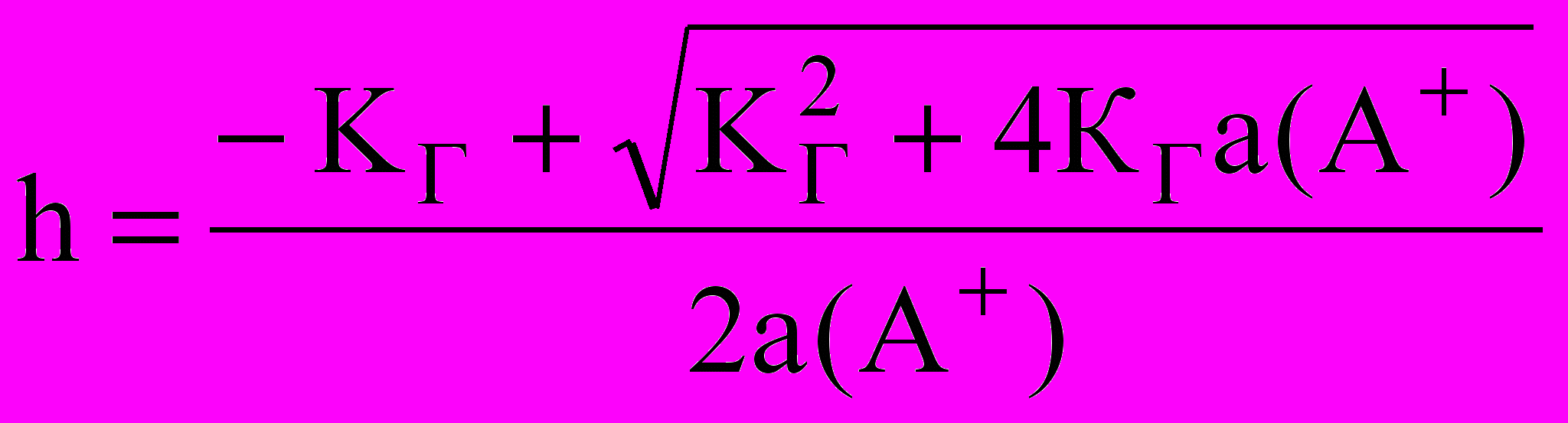 ;
; 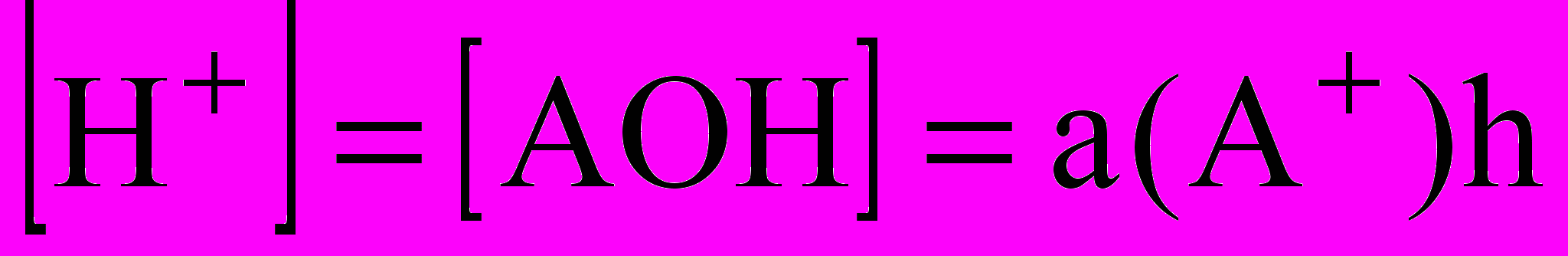 или
или 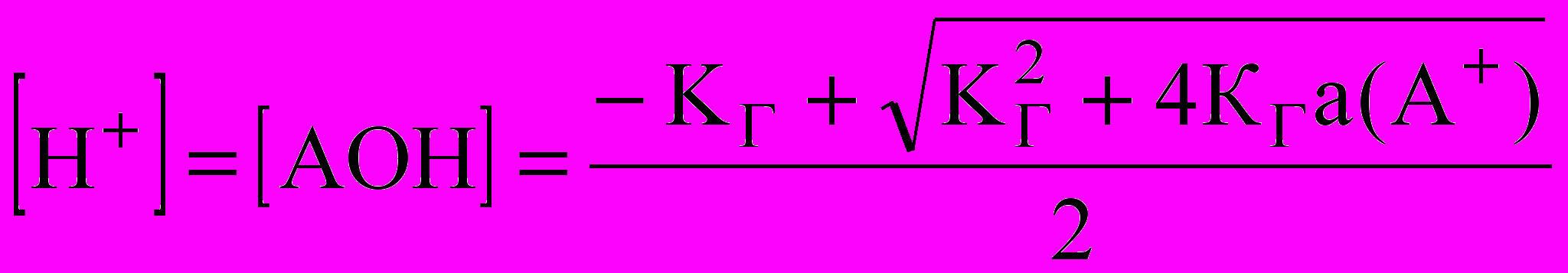 для одностадийного процесса
для одностадийного процесса А+ + Н2O ↔ АОН + Н+, константа гидролиза которого КГ = Кb/Кg(АОН);
б)
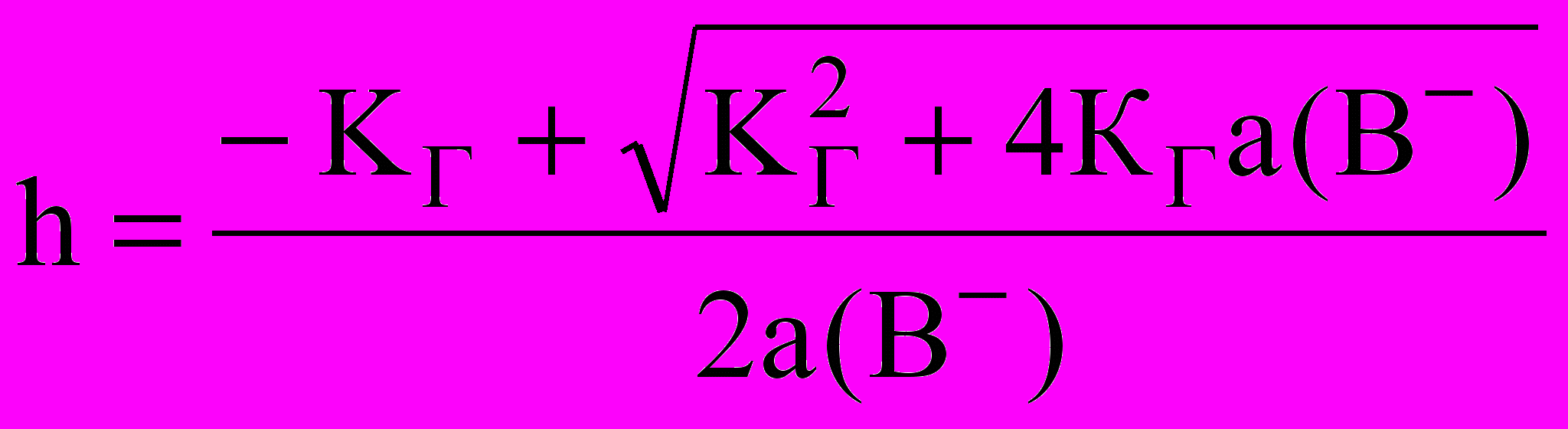 ;
;  или
или 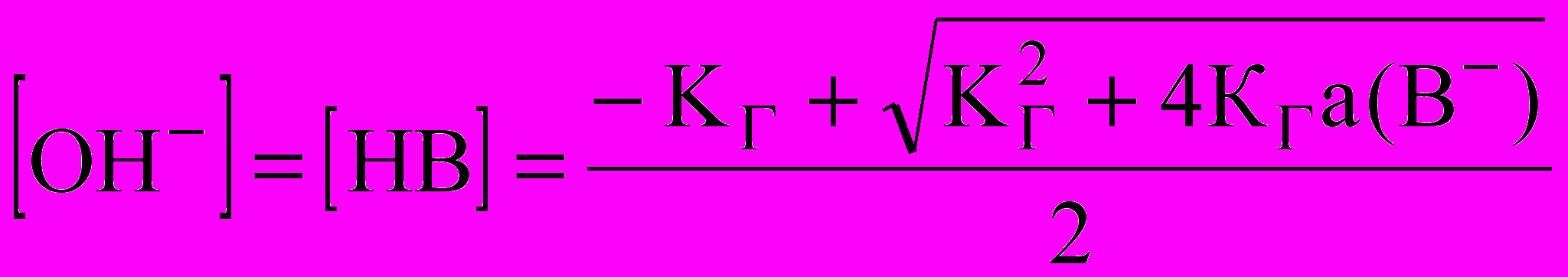 для одностадийного процесса
для одностадийного процесса В- + Н2O ↔ НВ + ОН-, константа гидролиза которого КГ = Кb/Кg(НВ).
Если СМ(АВ)/КГ > 100, то ведут приближенный расчет по формулам:
а)
 ;
; 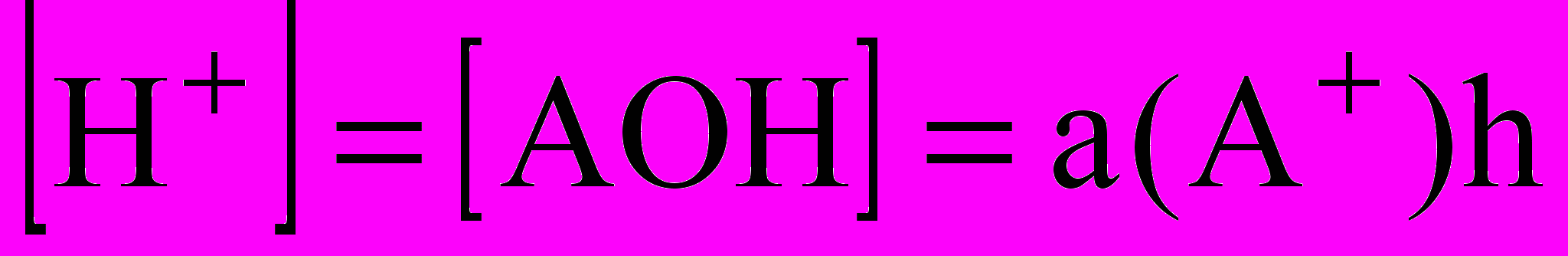 или
или 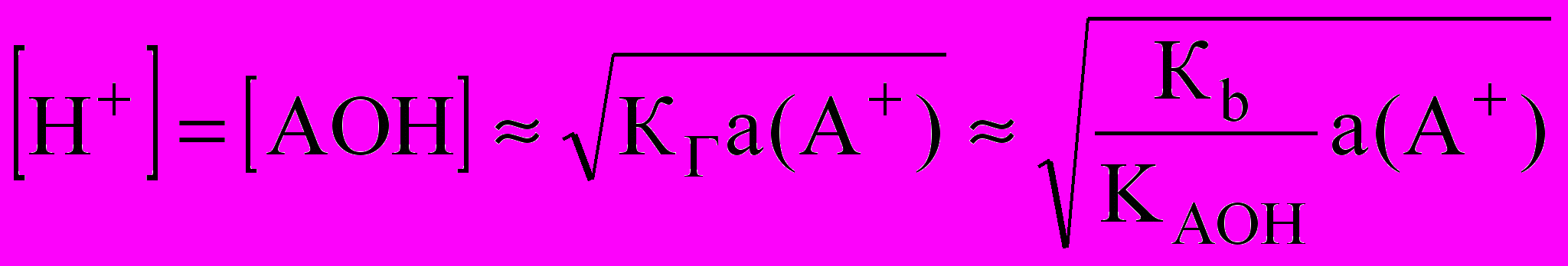 для одностадийного процесса
для одностадийного процесса А+ + Н2O ↔ АОН + Н+;
б)
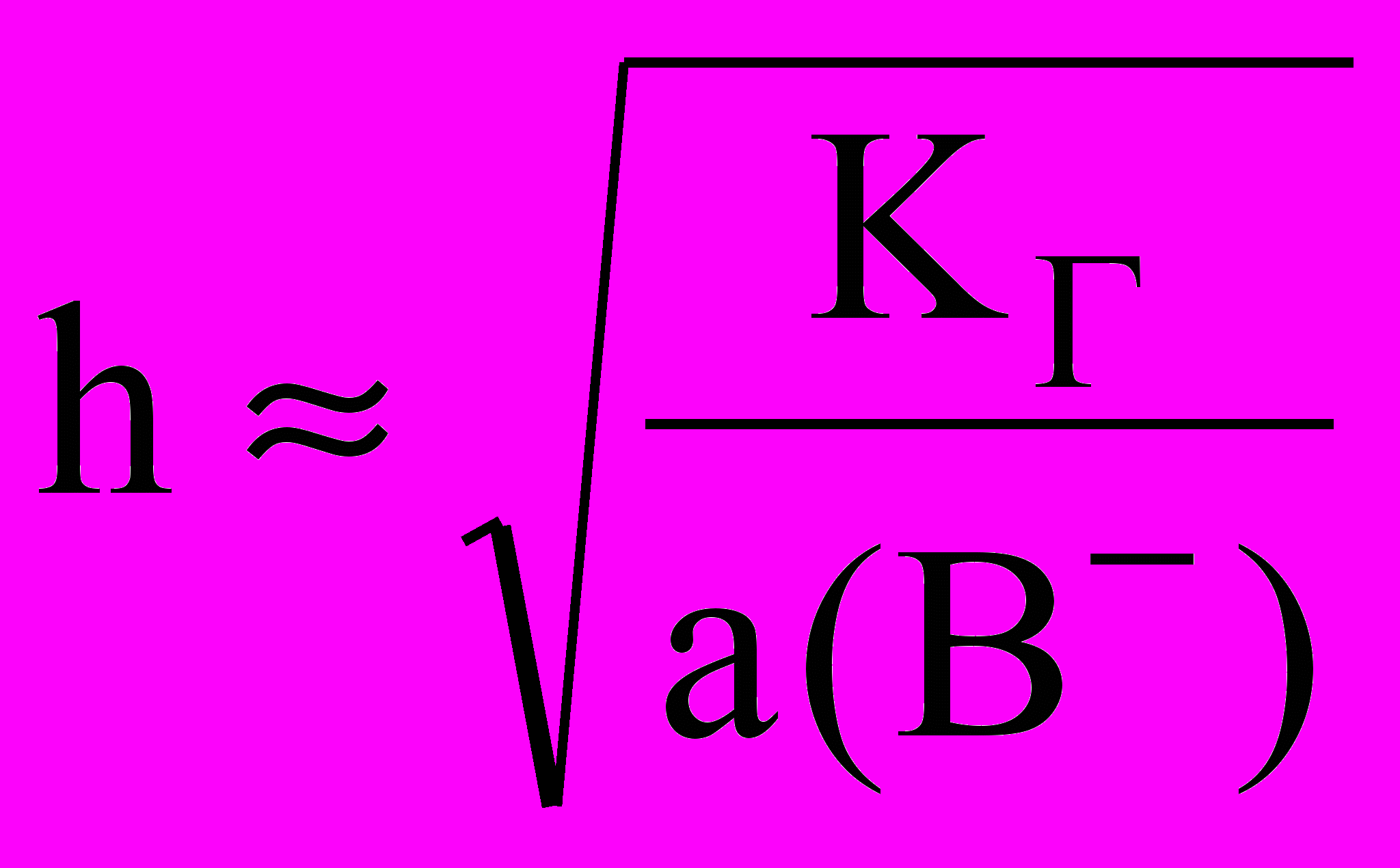 ;
;  или
или 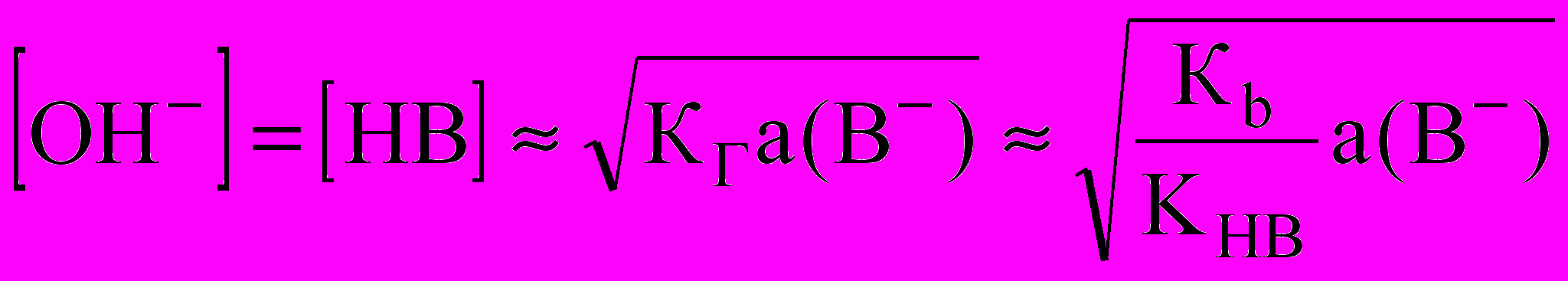 для одностадийного процесса
для одностадийного процесса В- + Н2O ↔ НВ + ОН-.
Гидролиз 2-3 зарядных ионов протекает ступенчато, в 2-3 стадии соответственно. Однако, если константы ступенчатой диссоциации резко различаются по величине между собой, т.е. Кg,3 << Kg,2 << Kg,1, и если продукты гидролиза остаются в растворе, то при обычных условиях гидролиз протекает практически только по первой стадии. Второй и третьей стадиями гидролиза можно пренебречь и приближенно рассматривать степень гидролиза и равновесные концентрации продуктов гидролиза аналогично выводам h, [H+] или [OH-], исходя только из первой стадии гидролиза, при этом используются константы последней ступени диссоциации соответствующих электролитов.
Раздел 3. Физическая химия
Введение
Вводное занятие. Повторение пройденных тем.
Задания для самостоятельной работы:
- Температура азота, находящегося в стальном баллоне под давлением 15,2 МПа, равна 17 0С. Предельное давление для баллона 20,3 МПа. При какой температуре давление азота в баллоне достигнет предельного значения?
- Выразить в граммах массу 1 молекулы аммиака.
- Какой объем займет 2 кг азота при 10 0С и давлении 101,33 кПа?
- Найти простейшую формулу вещества, содержащего 32,39% натрия, 22,54% серы и 45,07% кислорода.
- При давлении 98,7 кПа и температуре 91 0С некоторое количество газа занимает объем 608 мл. Найти объем газа при нормальных условиях.
- Указать Z, A, ē, p, n атома Tl.
- Электронная структура атома 5s25p65d16s2. Что это за элемент? К какому семейству он относится?
- Определите число энергетических уровней и напишите электронные формулы атомов элементов с порядковыми номерами: 13, 31, 79.
- Нарисуйте электронную схему образования молекул: а) оксида натрия; б) водорода; в) азота. Какова степень окисления каждого элемента.
- К какому элементу сдвинута общая электронная пара в соединениях, формулы которых HCl, CO2, NH3, OF2.
