Дворникова Наталия Борисовна учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
- Шрамкова Наталия Борисовна, доцент учебно-методический комплекс, 525.95kb.
- Плотникова Елена Борисовна учебно-методический комплекс, 484.93kb.
- Ирина Борисовна Бархатова, доцент кафедры вокального искусства института музыки, театра, 252.18kb.
- Швед Наталия Гавриловна, Доцент кафедры связей с общественностью и журналистики ргтэу, 234.14kb.
- Новая система оплаты труда – ключевой механизм модернизации образования горбачева наталия, 76.45kb.
- И. Л. Литвиненко учебно-методический комплекс по дисциплине международный туризм ростов-на-Дону, 398.8kb.
- Учебно-методический комплекс умк учебно-методический комплекс общие основы педагогики, 974.02kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Логика" Ростов-на-Дону 2010 Учебно-методический, 892.49kb.
- А. Б. Тазаян Учебно-методический комплекс дисциплины "Юридическая логика" (для студентов, 1003.39kb.
- И. Д. Алекперов учебно-методический комплекс дисциплины "информатика" Ростов-на-Дону, 952.05kb.
Периодический закон Д.И. Менделеева. Современная формулировка периодического закона. Значение периодической системы.
Вопросы для самостоятельной подготовки:
- Дайте определение понятию «элемент».
- Как формулируется периодический закон Д.И. Менделеева?
- Объясните структуру периодической таблицы элементов Д.И. Менделеева. Что такое период, группа элементов? Как в них изменяются свойства элементов?
- Какие элементы называются электронными аналогами?
- Докажите на примере малых периодов, что при последовательном заполнении атомных орбиталей появляется периодичность в структуре внешних электронных слоев.
- Почему третий период имеет 8 элементов, а не 18, как следует из максимальной электронной емкости третьего слоя?
- В чем сходство и отличие в свойствах соединений элементов основной и побочной подгрупп?
- Почему лантаноиды и актиноиды выделяются в отдельные семейства?
Задания для самостоятельной работы:
В каком периоде, в какой группе и какой подгруппе находятся элементы с порядковыми номерами 14, 29, 52, 56, 78?
- Какие элементы главной подгруппы пятой группы являются элементами малых периодов? Напишите их символы, названия и порядковые номера.
- Напишите формулы оксидов всех элементов четвертой группы, в которых эти элементы проявляют высшую валентность.
- В каких группах периодической системы все элементы являются металлами?
- Какие соединения с водородом образуют элементы главной подгруппы VI группы? Назовите наиболее и наименее прочные из них.
- Опишите химические свойства элемента с порядковым номером 23 по его положению в периодической системе.
- Напишите формулы оксидов элементов с порядковым номером 16, 21, 25, 48, 76, в которых эти элементы имеют высшую валентность.
- Какой элемент четвертого периода является наиболее типичным металлом?
Электронная структура атома. Квантовые числа. Принципы заполнения атомных орбиталей. Строение электронной оболочки атомов и свойства элементов
Вопросы для самостоятельной подготовки:
- Какую информацию дает электронная формула элемента?
- Чем отличаются конфигурации внешних электронных слоев у атомов элементов главной и побочной подгрупп третьей – седьмой групп периодической системы?
- Почему у атомов элементов побочных подгруппы первой и шестой группы, как правило, на внешнем слое по одному электрону?
- Какие элементы получили название s-, p-, d-, f- элементов? Где они располагаются в периодической системе элементов? В чем их основные отличия?
- Объясните исходя из электронного строения атомов, каков физический смысл номера периода и номера группы.
- Можно ли, пользуясь периодической таблицей элементов, написать электронную формулу элемента и, наоборот, зная последовательность заполнения атомных орбиталей электронами, указать место данного элемента в периодической системе?
- Что понимают под атомным радиусов?
- Как изменяются атомные радиусы элементов в периодах и в группах?
- Дайте определение энергии ионизации атома. В каких единицах она изменяется?
- Изменяется энергия ионизации атомов в периоде. Что можно сказать об изменении энергии ионизации атомов в группе?
Задания для самостоятельной работы:
- Электронная структура атома 4d75s1. Что это за элемент? К какому семейству он относится?
- Определите количество энергетических уровней и подуровней и запишите электронную формулу атома элемента с порядковым номером 82.
- Указать Z, A, ē, p, n атома Mo.
- Электронная структура атома 6s26p2. Что это за элемент? К какому семейству он относится?
- Определите число энергетических уровней и напишите электронные формулы атомов элементов с порядковыми номерами: 6, 20, 50.
- Указать Z, A, ē, p, n атома Al.
- Электронная структура атома 3d104s1. Что это за элемент? К какому семейству он относится?
- Определите число энергетических уровней и напишите электронные формулы атомов элементов с порядковыми номерами: 11, 25, 53.
- Указать Z, A, ē, p, n атома Sb.
- Электронная структура атома 5f117s2. Что это за элемент? К какому семейству он относится?
Решение задач по темам: «Строение электронной оболочки атома» и «Свойства химического элемента».
Напишите полные электронные конфигурации атомов химических элементов, приведенных в Вашем варианте задания, в их основных состояниях, изобразите орбитальные диаграммы электронных оболочек этих атомов и выполните следующие задания.
1. Определите число протонов, нейтронов и электронов в атоме каждого химического элемента.
2. Определите положение каждого химического элемента в периодической системе (номер периода, номер группы, подгруппу) и семейство химических элементов, к которому он принадлежит. Кратко поясните ответ.
3. Выделите на электронной формуле каждого элемента основные электроны и валентные электроны, напишите характеристическую электронную формулу каждого элемента и укажите энергетический подуровень, электроны которого слабее других связаны с ядром.
4. Определите число занятых электронами орбиталей валентной оболочки атома каждого химического элемента (сколько из них заняты неподеленной электронной парой, сколько – неспаренных электроном?) и число валентных (свободных) орбиталей, в том числе и орбиталей полностью свободных энергетических подуровней.
5. Напишите значения всех квантовых чисел, описывающих энергетическое состояние каждого из валентных электронов атома каждого из приведенных в Вашем задании химических элементов.
6. Определите суммарное абсолютное значение спина каждого подуровня валентной оболочки каждого химического элемента.
7. Определите число неспаренных электронов в атоме каждого химического элемента в основном состоянии. Возможно ли увеличение числа неспаренных электронов при возбуждении атома? Каким образом?
8. Определите, какую ковалентность может проявлять в своих соединениях каждый из элементов, приведенных в Вашем варианте задания.
9. Укажите характерные степени окисления каждого элемента. Поясните, каким образом можно определить (исходя из электронной конфигурации) значения высшей и низшей степени окисления.
10. Какие свойства – металлические или неметаллические – проявляет каждый из элементов, приведенных в Вашем варианте задания? Почему?
Варианты задания приведены в таблице.
| № вар | Химические элементы (наиболее устойчивые изотопы этих элементов) | ||
| 1 | 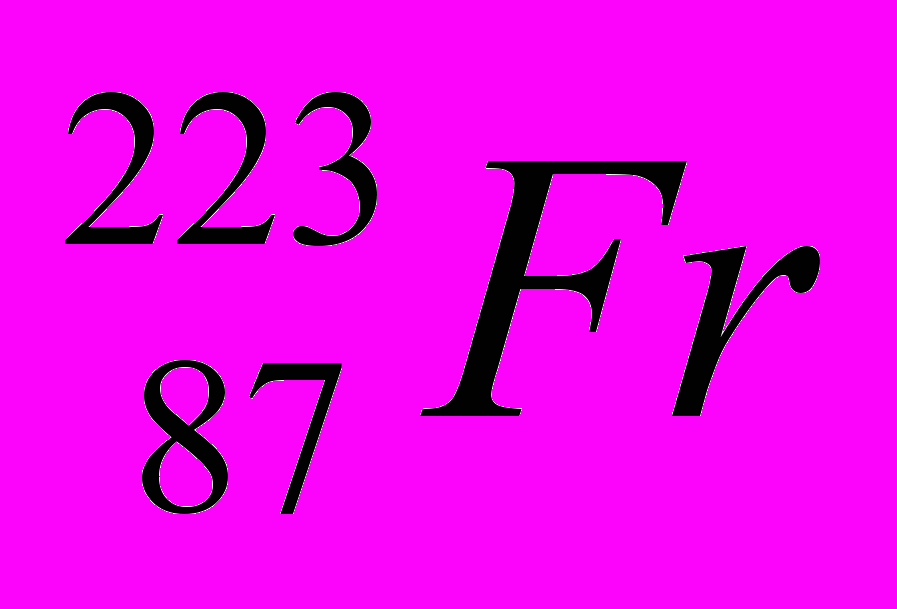 | 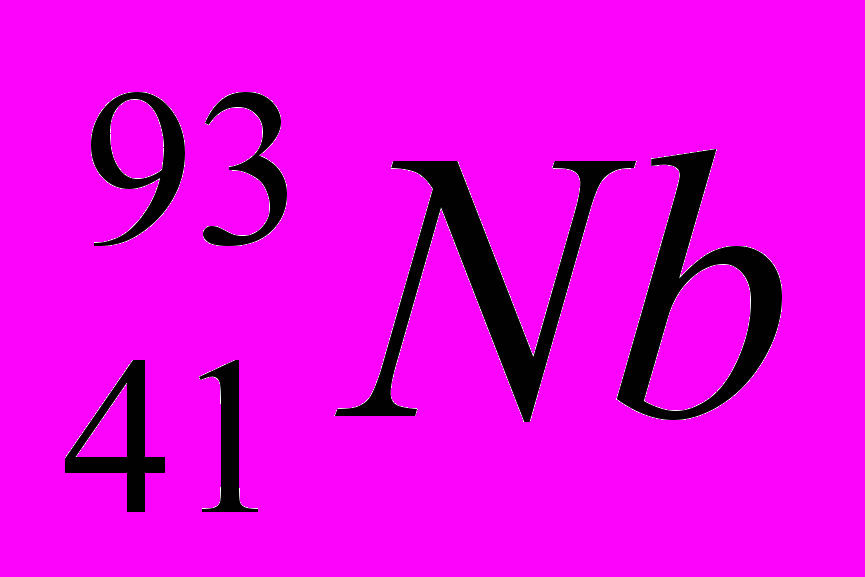 | 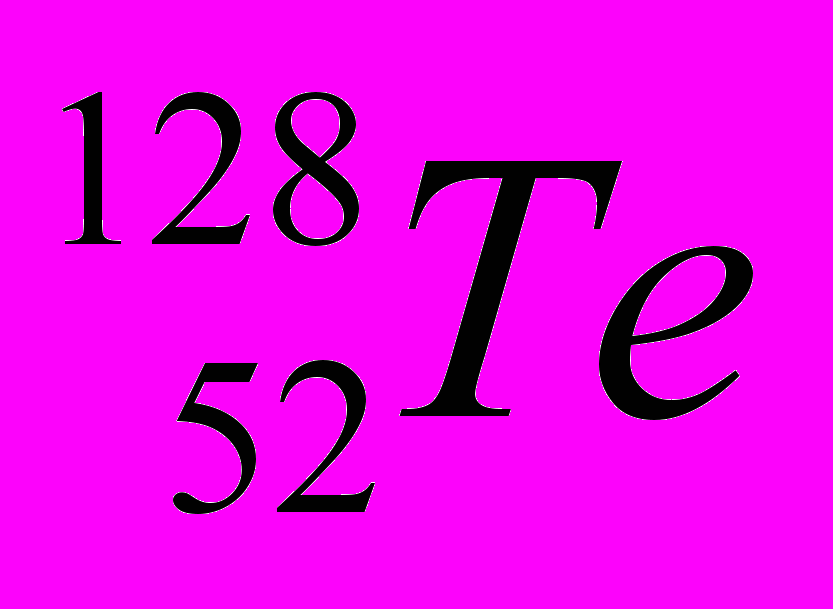 |
| 2 | 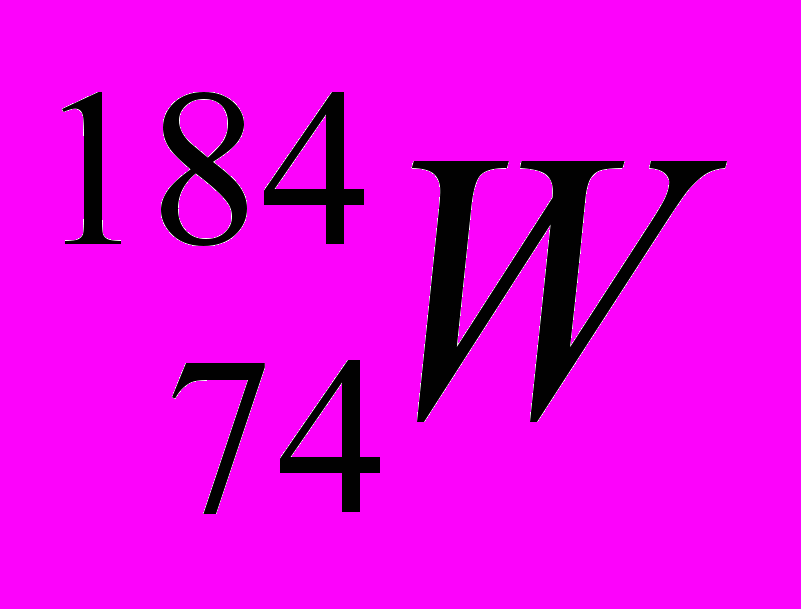 | 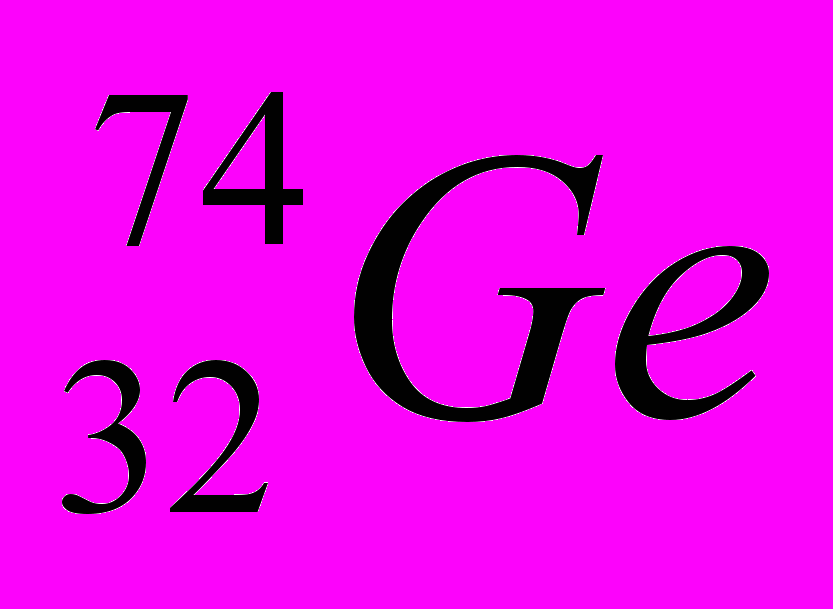 | 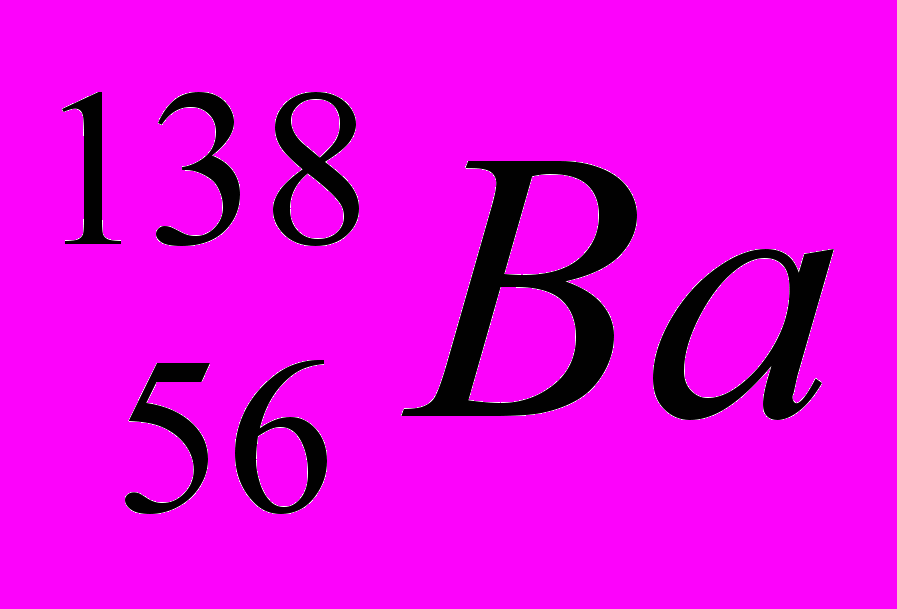 |
| 3 | 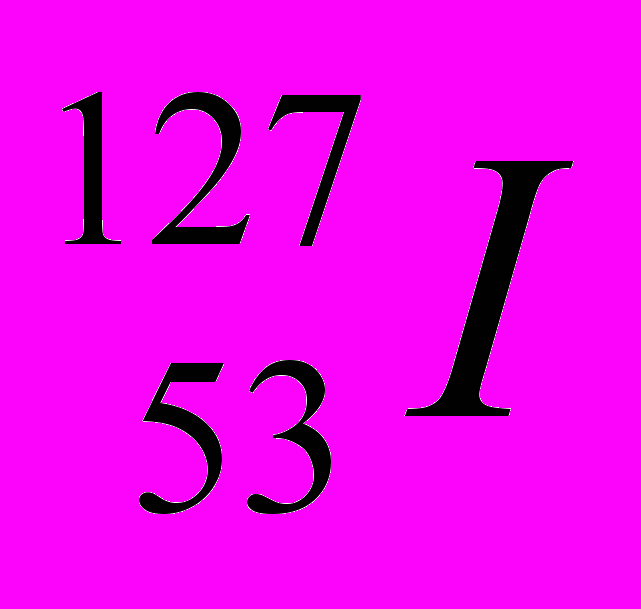 | 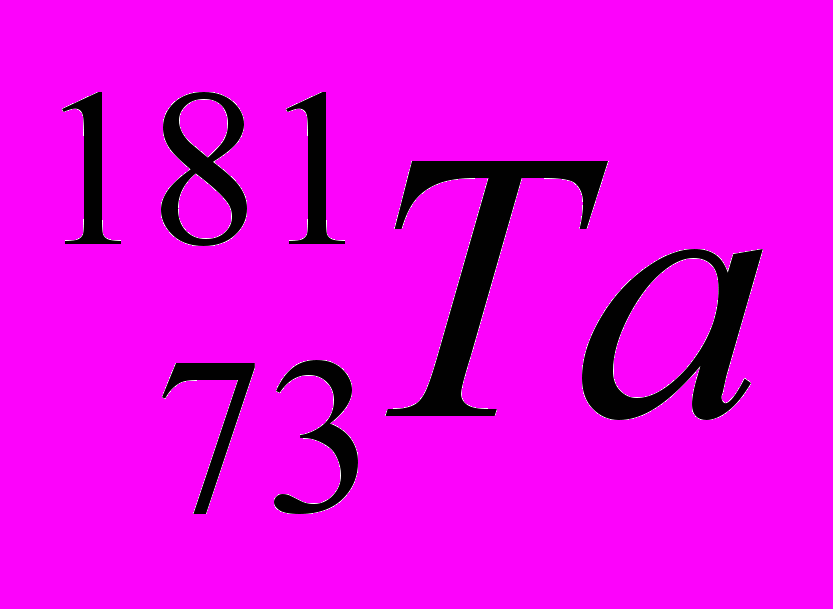 | 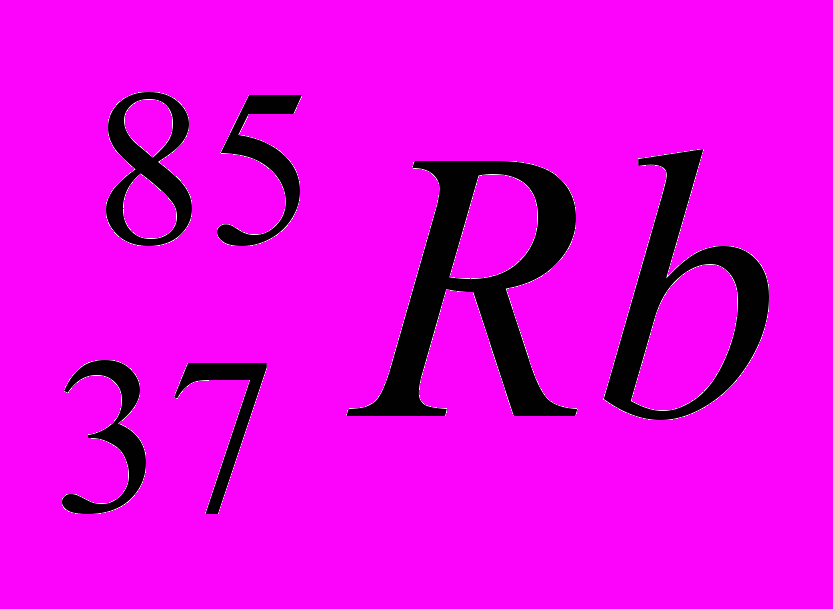 |
| 4 | 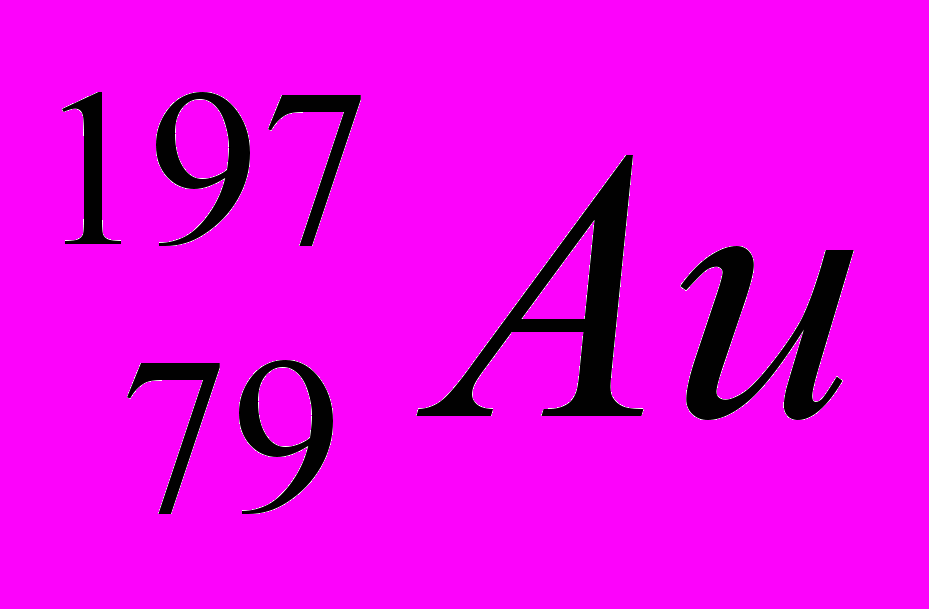 | 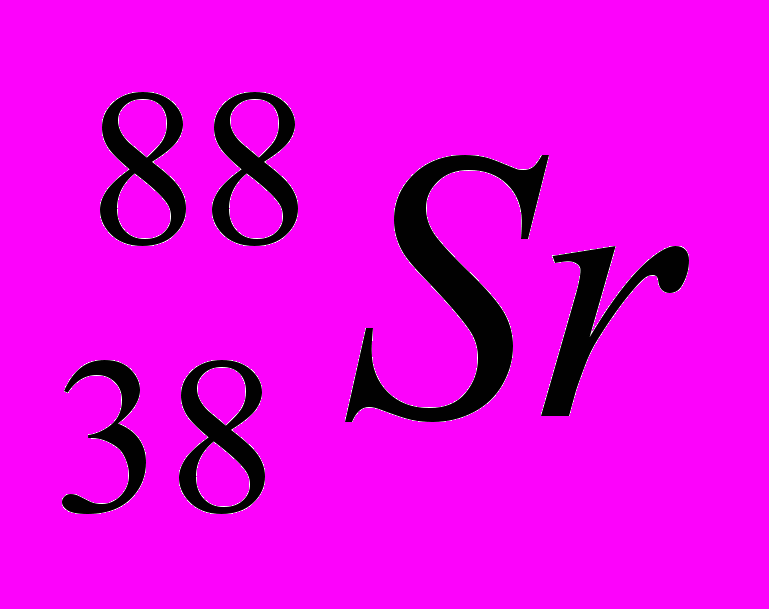 | 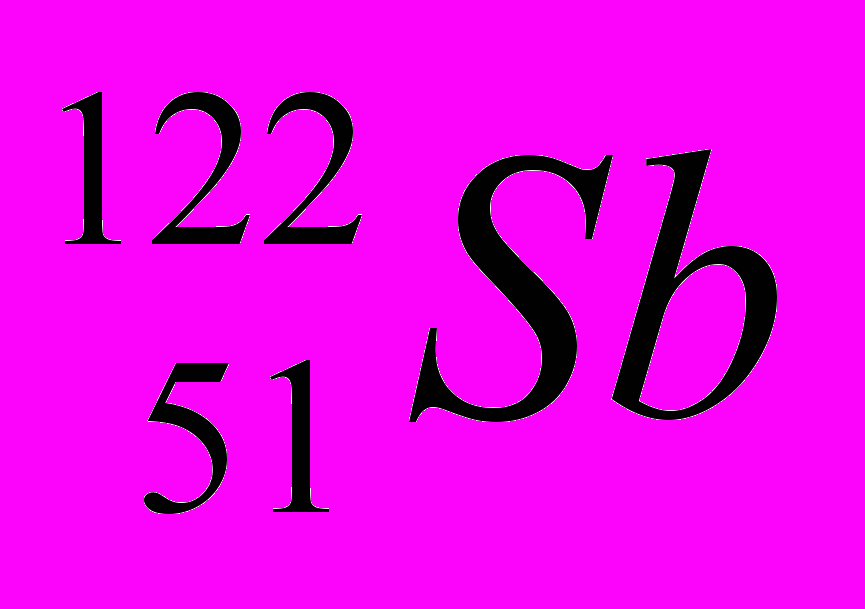 |
| 5 | 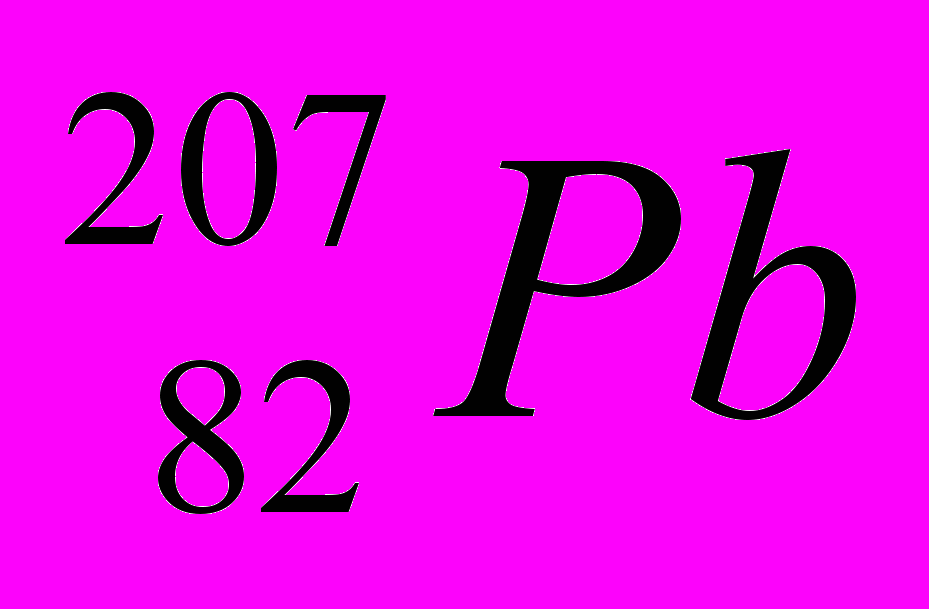 | 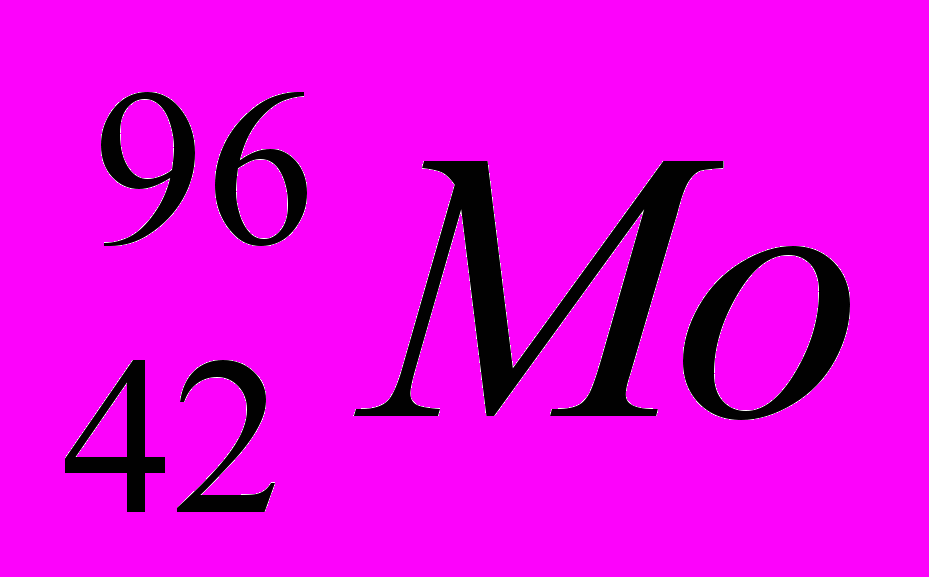 |  |
| 6 | 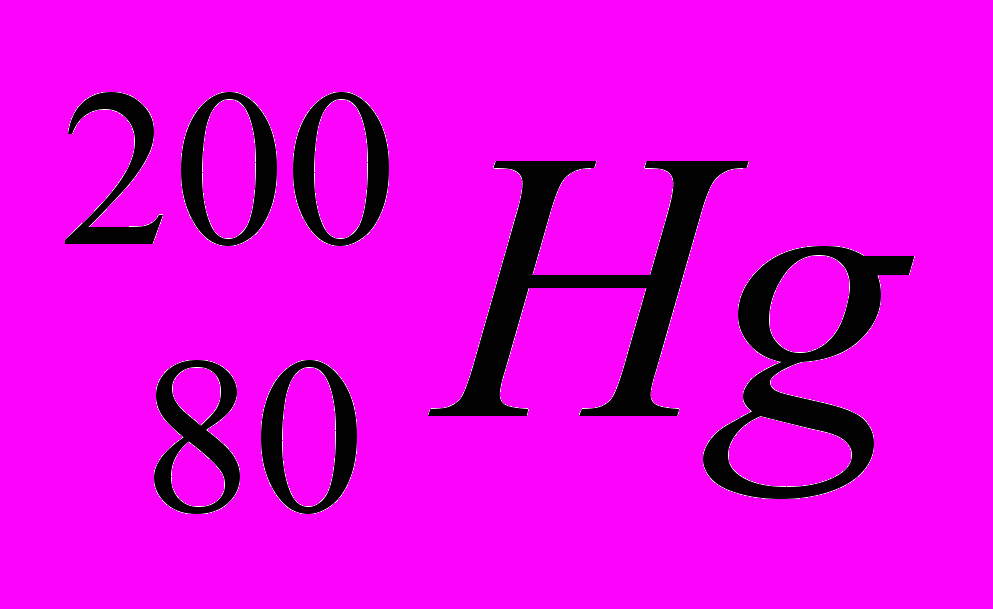 | 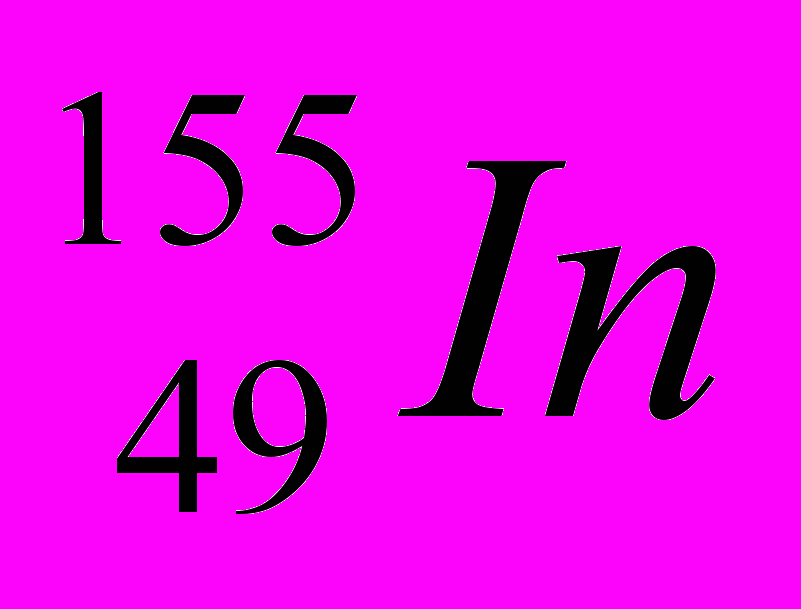 | 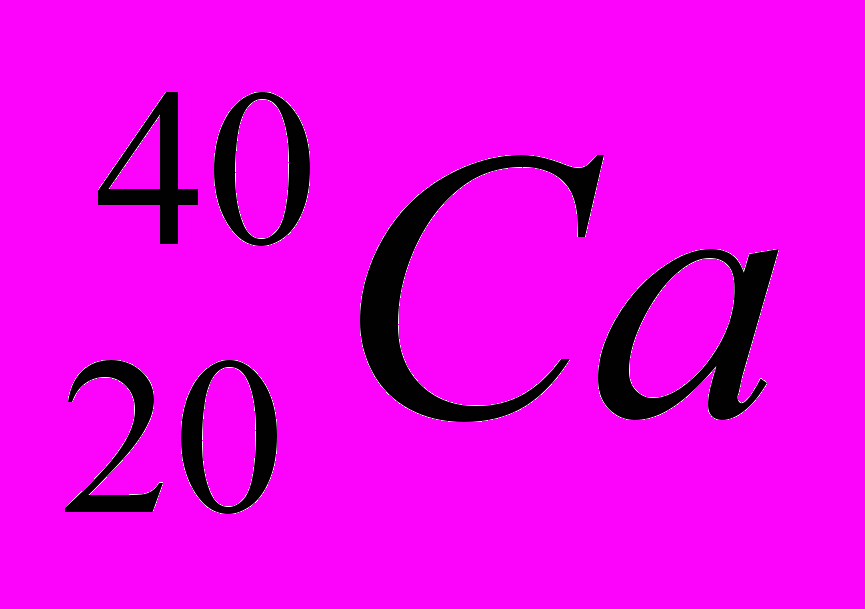 |
| 7 | 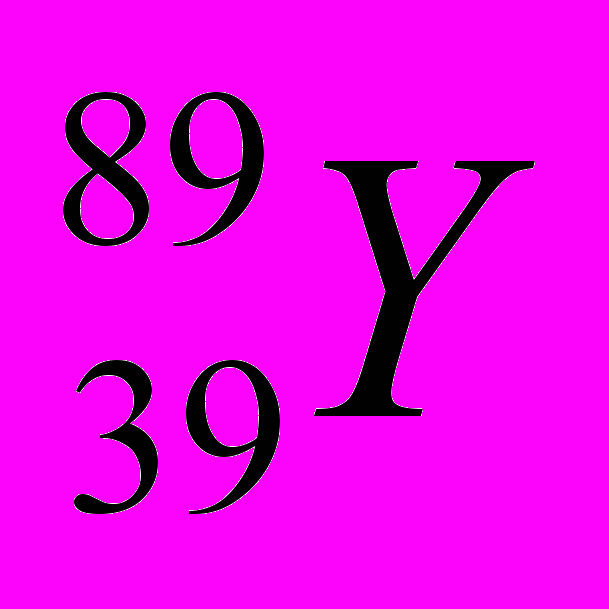 | 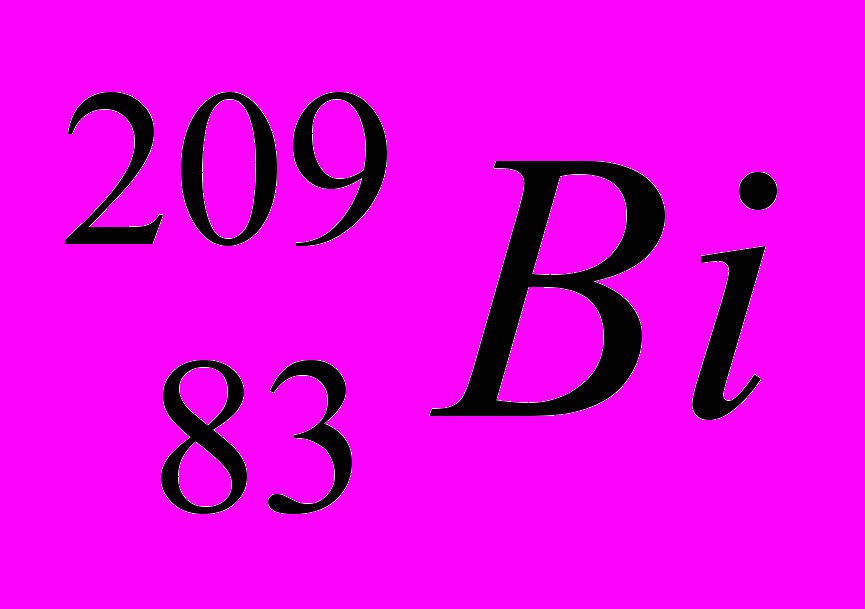 | 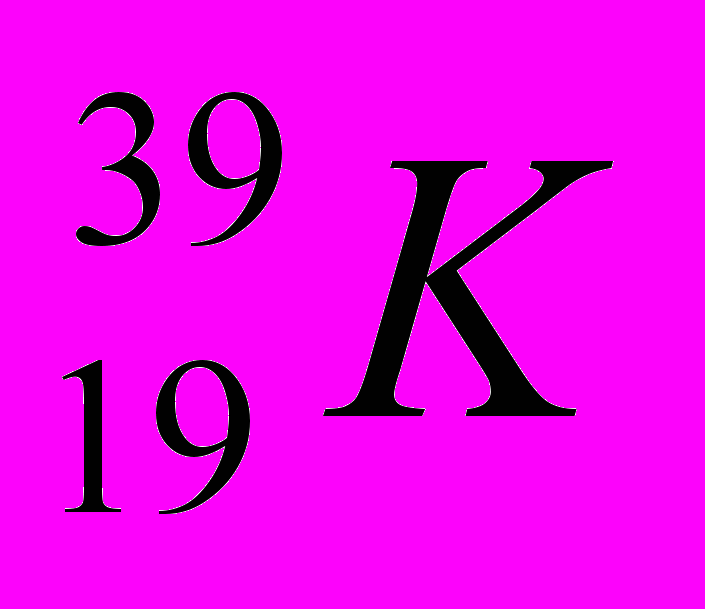 |
| 8 | 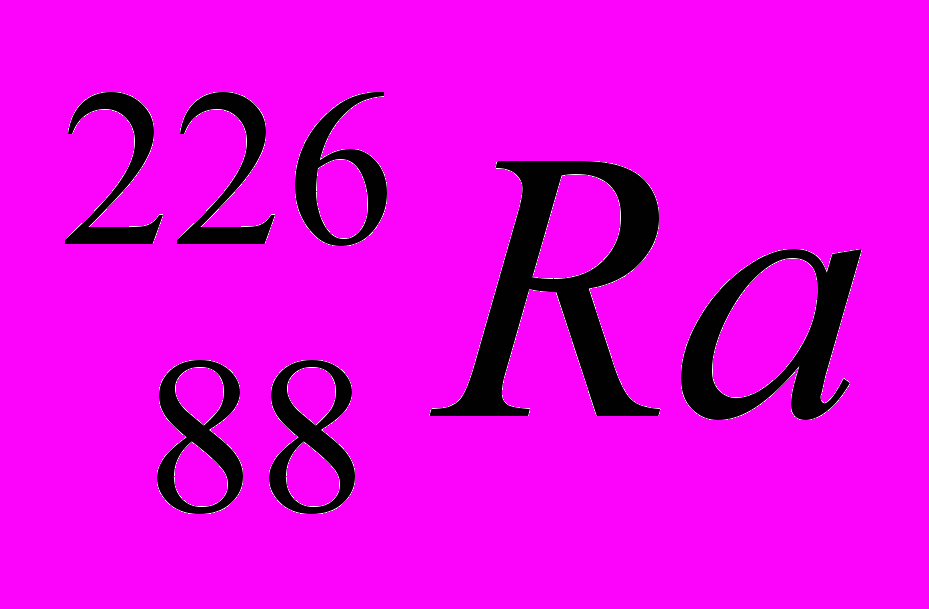 | 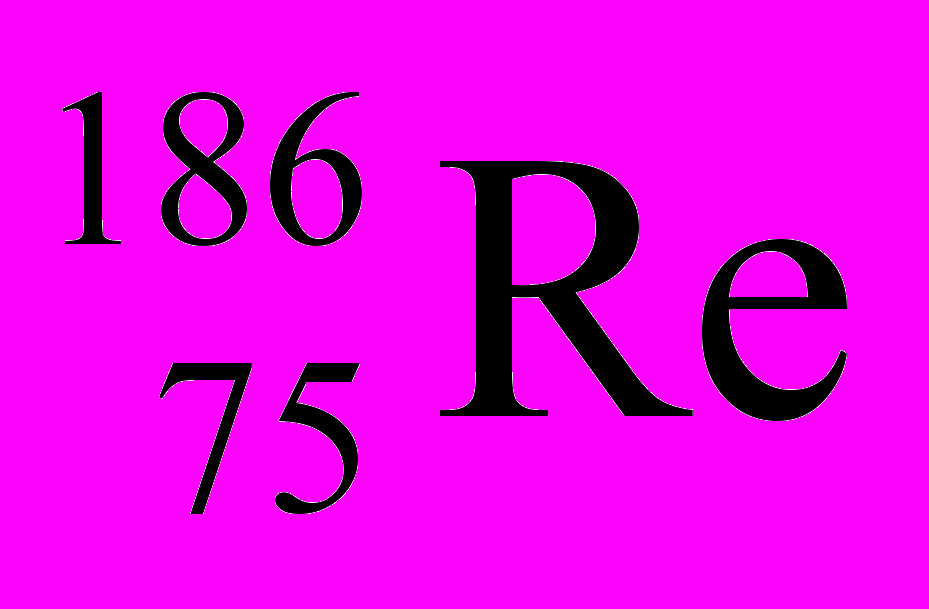 | 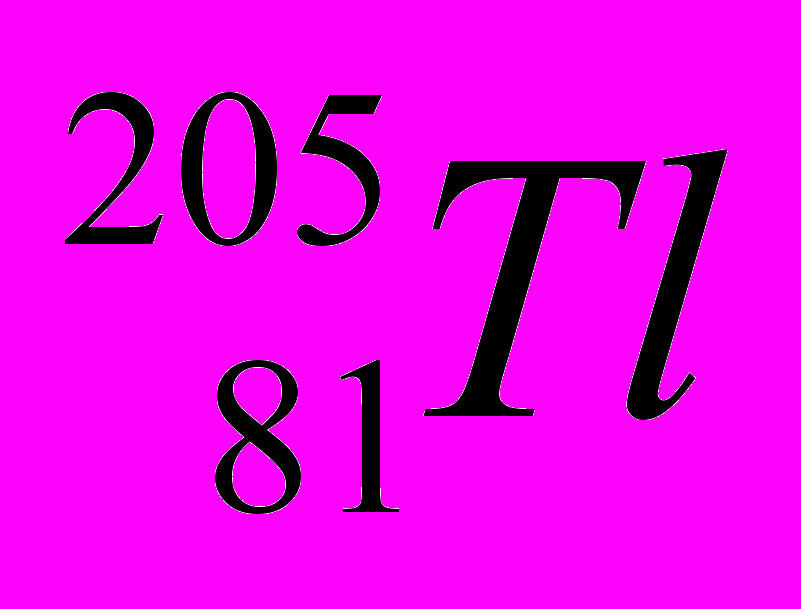 |
| 9 | 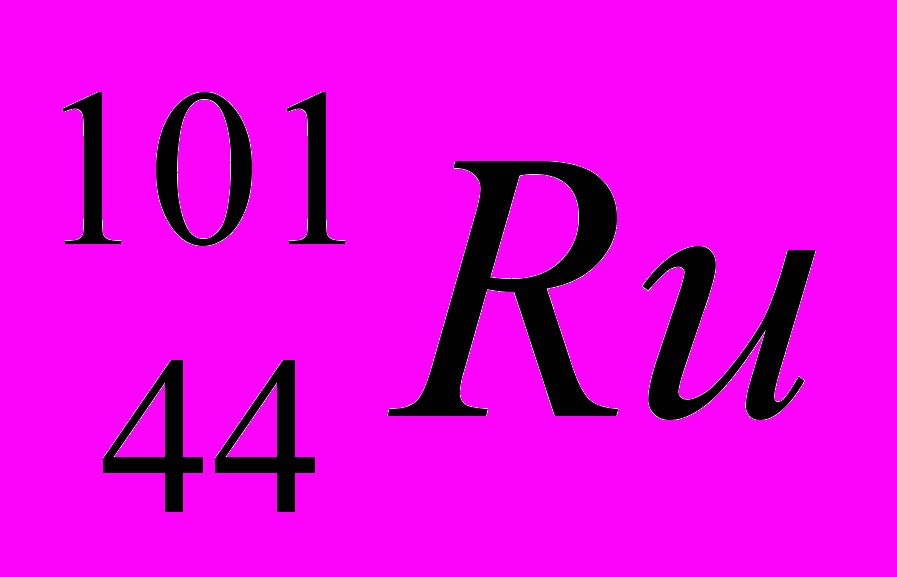 | 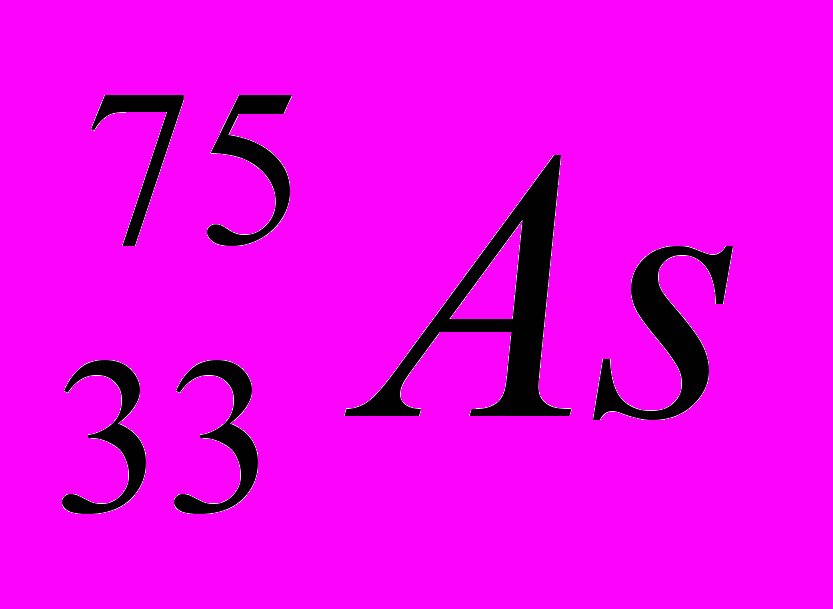 | 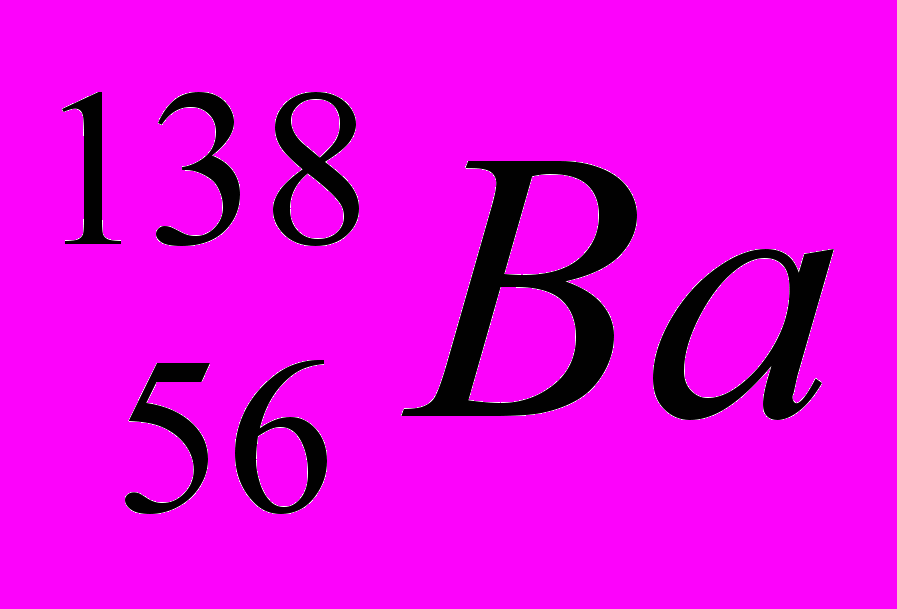 |
| 10 | 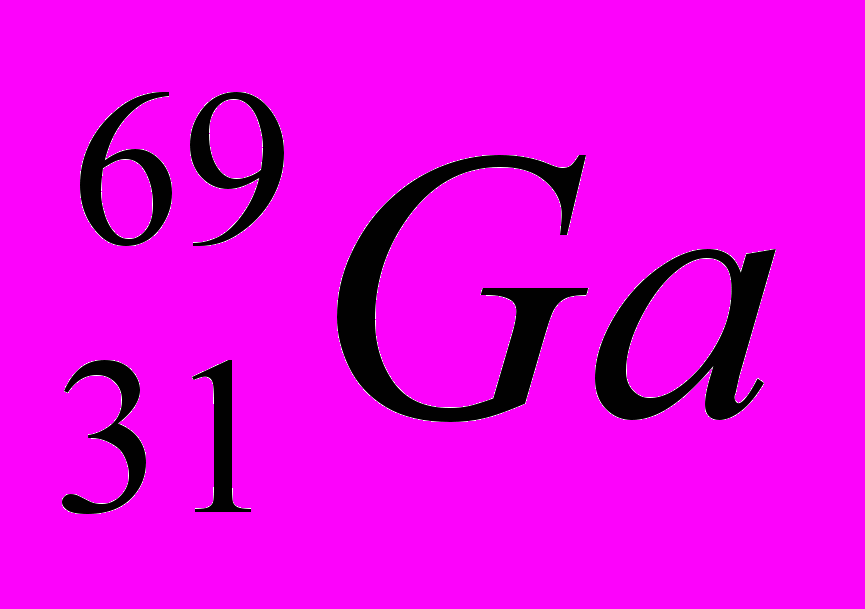 | 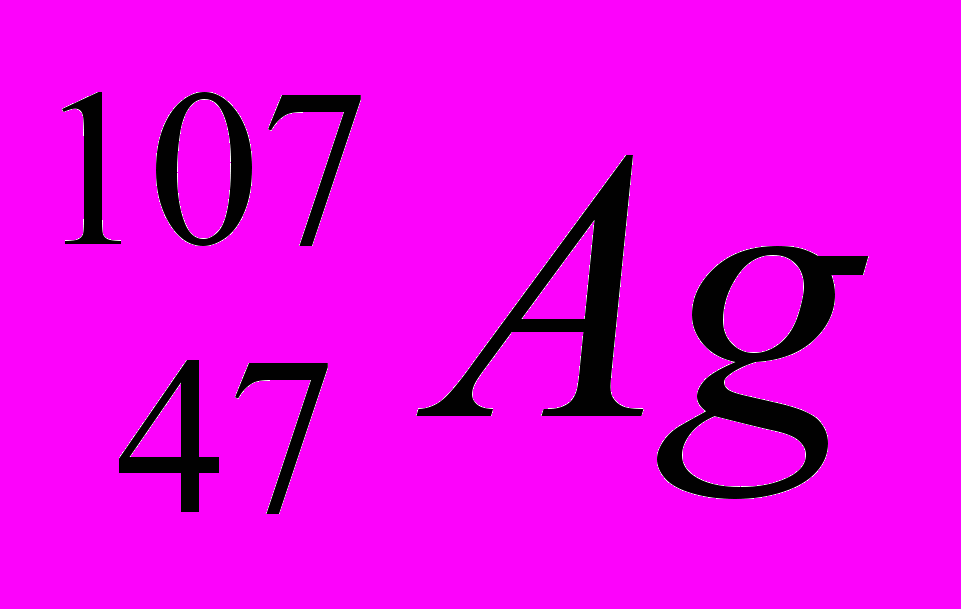 | 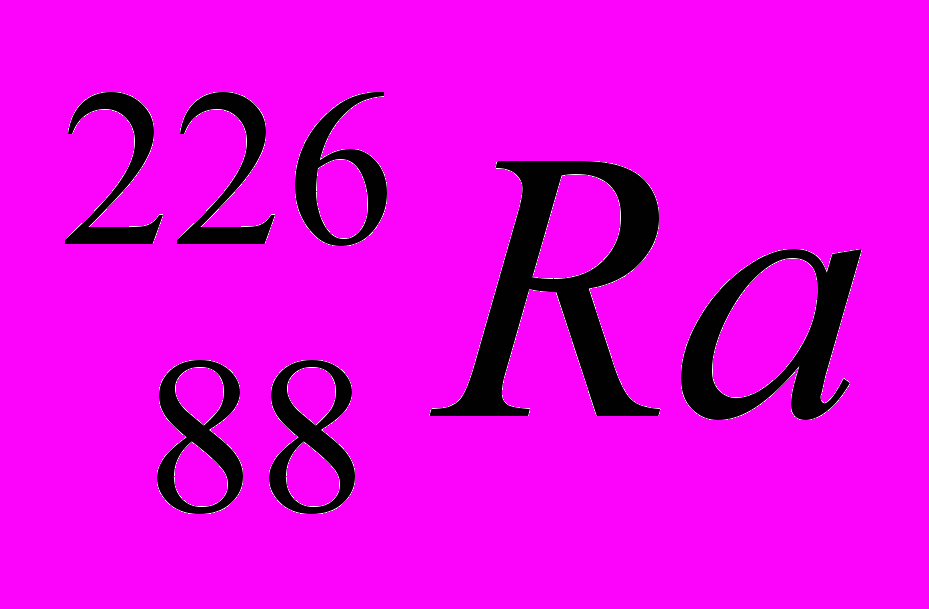 |
Методические рекомендации. Чтобы выполнить задания, необходимо, прежде всего, определить полные электронные конфигурации атомов химических элементов в их основных состояниях. Конечно, полную электронную конфигурацию нужного Вам химического элемента можно найти в учебнике, учебном пособии ли справочнике по химии, но лучше научаться самостоятельно ее определять. Усвоив основные принципы и правила заполнения электронами атомных орбиталей и освоив алгоритмы определения электронной конфигурации атома химического элемента в основном состоянии, Вы убедитесь, что определить (и написать) электронную конфигурацию атома любого химического элемента совсем нетрудно.
Итак, для определения полной электронной конфигурации атома химического элемента в основном состоянии необходимо выполнить ряд последовательных операций:
1) по положению химического элемента в периодической системе определить семейство элементов, к которому он принадлежит, и тип подоболочки, последней заполняющейся электронами в атоме этого элемента;
Так, если элемент находится в главной подгруппе I или II группы, то он принадлежит к семейству s-элементов (является s-элементом), и последней заполняется в его атоме ns-подоболочка (n равно номеру периода). Элементы главных подгрупп III, IV и т. д. до VIII группы включительно являются р-элементами, в их атомах последней заполняется электронами nр-подоболочка, за исключение гелия Не, элемента главной подгруппы VIII группы, являющегося s-элементом с электронной конфигурацией атома в основном состоянии 1s2. Элементы побочных подгрупп всех групп являются d-элементами, в их атомах последней заполняется электронами (n-1)d-подоболочка. Лантаноиды и актиноиды являются f-элементами, в их атомах последней заполняется (n-2)f-подоболочка.
2) по идеализированной последовательности заполнения электронами атомных орбиталей определить все подоболочки, заполняющиеся электронами в атоме данного элемента, и расположить их в порядке заполнения электронами;
Так, если в атоме химического элемента последней заполняется электронами 6р-подоболочка, то электронная оболочка атома этого элемента состоит из подоболочек, заполняющихся электронами в следующей последовательности:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p.
В самом общем виде идеализированная последовательность заполнения электронами атомных орбиталей выглядят так: ns, (n-2)f, (n-1)d, np, где n - последовательно принимает значения от 1 до 7, за исключением 2р-подоболочки, т. к. ее не существует.
3) все подоболочки, кроме последней в полученном ряду, заполнить электронами максимально (с учетом электронной емкости каждого типа подоболочки);
Так, на s-подоболочке максимально могут располагаться 2 электрона (1s2, 2s2, 3s2 и т. д.), на р-подоболочке – 6 электронов (2р6, 3р6, 4р6 и т. д.), на d-подоболочке – 10 электронов (3d10, 4d10, 5d10, 6d10), на f-подоболочке – 14 электронов (4f14, 5f14).
4) последнюю в полученном ряду подоболочку заполнить исходя из числа валентных электронов атома данного элемента, которое у большинства элементов равно номеру группы;
Так, если элемент находится в главной подгруппе I или II группы, то ns-подоболочку занимают собственно 1 или 2 электрона: ns1 или ns2. У элементов главных подгрупп III, IV и т. д. до VIII группы включительно, кроме гелия Не, np-подоболочку заполняют (N- 2)электрона (N – номер группы): np1, np2 и т. д. до np6. У элементов побочных подгрупп III, IV и т. д. до VII группы включительно (n-1)d-подоболочку заполняют, как правило, также (N-2)электрона (за исключением случаев так называемого «проскока» электронов с ns- на (n-1)d-подоболочку): (n-1)d1, (n-1)d2 и т. д. до (n-1)d5. У элементов побочной подгруппы I группы (n-1)d-подоболочку заполняют 10 электронов (а не 9 электронов, вследствие «проскока» электронов с ns- на (n-1)d-подоболочку): (n-1)d10. У элементов побочной подгруппы II группы (n-1)d-подоболочку заполняют также 10 электронов: (n-1)d10. У элементов побочной подгруппы VIII группы число (n-1)d-электронов, как правило, равно числу (n-1)d-элементов в ряду от элемента побочной подгруппы III группы до данного элемента побочной подгруппы VIII группы включительно (за исключением случаев «проскока» электронов с ns- на(n-1)d-подоболочку): (n-1)d6, (n-1)d7, (n-1)d8. В принципе, число (n-1)d-электронов любого d-элемента можно определить по числу (n-1)d-элементов в ряду от элемента побочной подгруппы III группы до данного элемента. Аналогично можно определить число (n-2)f-электронов у f-элементов, т. е. по числу (n-2)f-элементов (лантаноидов иди актиноидов) от начала ряда до данного элемента. Однако и здесь исключений вследствие «проскока» электронов с (n-2)f- на (n-1)d-подоболочку немало.
5) проверить, не нарушается ли идеализированная последовательность заполнения электронами атомных орбиталей у данного d- или f-элемента вследствие эффекта «проскока» электронов с ns- на (n-1)d-подоболочку или с (n-2)f- на (n-1)d-подоболочку соответственно;
Так, идеализированной последовательности заполнения электронами орбиталей отвечает электронная конфигурация атома хрома 24Cr: 1s22s22p63s23p64s23d4. однако энергетически более выгодной, более устойчивой конфигурацией является конфигурация с наполовину заполненной d-подоболочкой. Поэтому у атома хрома в основном состоянии наблюдается «проскок» электрона с 4s- на 3d-подоболочку, и основному состоянию атома хрома соответствует такая конфигурация: 24Cr 1s22s22p63s23p64s13d5.
Эффект «проскока» электронов наблюдается у La (5d16s2) и Ac(6s17s2); у ряда d-элементов: Cr (3d54s1), Cu (3d104s1), Nb (4d45s1), Mo (4d55s1), Ru (4d75s1), Rh (4d85s1), Pd (4d105s0), Ag (4d105s1), Pt (5d96s1), Au (5d106s1); у ряда f-элементов: Gd (4f75d16s2), Th (6d27s1), Pa (5f26d17s2), U (5f36d17s2), Np (5f46d17s2), Cm (5f76d17s2), Bk (5f86d17s2).
6) запишите полную конфигурацию атома данного химического элемента в основном состоянии, располагая заполненные электронные подоболочки не в порядке их заполнения, а в порядке их расположения в атоме.
Так, электронная конфигурация атома хрома в основном состоянии такова 24Cr: 1s22s22p63s23p63d54s1.
Зная полную электронную конфигурацию атома химического элемента в основном состоянии, можно изобразить орбитальную диаграмму электронной оболочки этого атома. Орбитальная диаграмма электронной оболочки атома представляет собой схему с изображением каждой атомной орбитали в виде квантовой ячейки и каждого электрона в виде стрелки, направление которой отражает знак спинового числа. Количество атомных орбиталей определяется количеством энергетических уровней электронов в атом данного элемента в его основном состоянии и количеством энергетических подуровней. Распределяя электроны по атомным орбиталям в соответствии с электронной конфигурацией атома химического элемента, следует обратить особое внимание на распределение валентных электронов по атомным орбиталям одного энергетического подуровня.
Так, схема всех атомарных орбиталей атома хрома Cr в виде квантовых ячеек такова:
Количество энергетических уровней электронов в атоме данного элемента равно номеру периода, в котором находится элемент. Количество энергетических подуровней в энергетическом уровне электрона равно номеру этого энергетического уровня. Количество атомных орбиталей в энергетическом подуровне зависит от типа энергетического подуровня: на s-подуровне находится одна атомная орбиталь, на р-подуровне – три атомных орбитали, на d-подуровне – пять атомных орбиталей, на f-подуровне – семь атомных орбиталей.
Тема 2. Химическая связь и строение вещества
Молекулы. Теория химического строения. Общие представления о химической связи. Виды химической связи. Ковалентная связь. Метод валентных связей.
Вопросы для самостоятельной подготовки:
- Дать определение энергии связи.
- Дать определение дипольному моменту.
- Дать определение степени окисления.
- Как определить степень окисления элемента? Каковы её максимальные значения?
- Укажите примеры соединений, в которых водород имеет положительную и отрицательную степени окисления.
- Дать определение π – связи
- Дать определение гибридизации.
- Что характеризует ковалентность атомов?
- Дать определение длинны связи.
- Дать определение насыщаемости.
Задания для самостоятельной работы:
- Составьте структурные и электронные формулы соединений с водородом следующих элементов: а) брома; б) теллура; в) мышьяка.
- Почему радиус атома кальция (0,197 нм) больше радиуса иона кальция (0,106 нм)? Какова степень окисления в каждом случае?
- Какова степень окисления углерода в оксиде углерода (IV) и изменяется ли она при образовании из углекислого газа угольной кислоты?
- В каком соединении больше выражена полярность связи: H2S, CH4, PH3, HCl?
- Нарисуйте электронную схему образования молекул: а) сульфида магния; б) хлора. Какова степень окисления каждого элемента?
- Составьте структурные и электронные формулы соединений с водородом следующих элементов: а) селена; б) фосфора; в) кремния.
- Изобразите электронную схему строения отрицательного иона водорода (гидрид - иона). Атому, какого инертного газа он подобен?
- Изменяются ли степени окисления при: а) образовании воды из водорода и кислорода; б) образовании аммиака из азота и водорода? Ответ поясните.
- Приведите примеры, когда один и тот же элемент может образовывать различные виды химической связи: ионную, ковалентную полярную и ковалентную неполярную.
- Учитывая положение серы и селена в периодической системе и их электроотрицательность, укажите, какая связь прочнее: Se – H или S – H?
Строение и некоторые свойства молекул
Изобразите пространственные конфигурации молекул, приведенных в Вашем варианте задания, напишите дисплейную (структурную) формулу каждого соединения и выполните следующие задания:
а) определите валентность связевую (ковалентную), степень окисления, координационное число центрального атома каждой молекулы и изобразите орбитальную диаграмму его электронной оболочки, учитывая состояние (основное или возбужденное) при образовании молекул;
б) укажите тип гибридизации орбиталей центрального атома каждой молекулы, тип частицы и форму каждой молекулы, а также число σ- и π - связей в каждой молекуле;
в) определите точное или приближенное (если невозможно определить точное) значение каждого валентного угла в каждой молекуле и обоснуйте Ваш ответ;
г) определите в каждой молекуле наиболее длинную и наиболее короткую химическую связь и обоснуйте Ваш ответ;
д) определите в каждой молекуле наиболее полярную химическую связь и укажите наиболее полярную среди всех связей, ответ обоснуйте, подтвердив расчетом;
е) определите, являются ли молекулы, приведенные в Вашем варианте задания, полярными (μ≠0) или неполярными (μ=0), ответ обоснуйте;
ж) определите тип межмолекулярного взаимодействия, вносящий наиболее существенный вклад при конденсации каждого соединения, и обоснуйте Ваш ответ;
з) рассмотрите возможность центрального атома каждой молекулы участвовать в образовании связей по донорно-акцепторному механизму. Какую функцию он при этом будет выполнять (донора или акцептора)?
| № варианта | Формулы молекул | ||
| 1 | ZnI2 | SnCl2 | S Cl2O |
| 2 | SnF4 | AsBr3 | C Cl2O |
| 3 | SrI2 | BiBr3 | SOF2 |
| 4 | SiCl4 | SF2 | NOBr |
| 5 | HgCl2 | SnF2 | SO2F2 |
| 6 | SnCl4 | PbF2 | HCN |
| 7 | CaCl2 | SO2 | S ClO2 |
| 8 | GeF4 | SCl2 | CCl2O |
| 9 | CdCl2 | PbCl2 | PCl3O |
| 10 | SO3 | H2Se | POF3 |
Методические рекомендации. Чтобы выполнить задание, необходимо, прежде всего, определить пространственные конфигурации молекул. Для этого можно воспользоваться алгоритмом определения пространственных конфигураций простейших молекул (и комплексов) с одним центральным атомом, т.е. совокупностью последовательных операций:
1) определить в молекуле центральный периферический атомы;
Так, если молекула имеет состав АВn, то атом А является центральным, атомы В – периферические. Если положение атомов в молекуле не столь очевидно, то при определении центрального и периферических атомов можно руководствоваться тем, что атомы с большей электроотрицательностью, как правило, являются периферическими, а атомы водорода Н и фтора F всегда являются периферическими.
2) изобразить орбитальные диаграммы валентных оболочек центрального и периферических атомов;
3) по степени окисления центрального атома определить число его электронов, идущих на образование связей по обменному механизму (т.е. неспаренных электронов), состояние центрального атома при образовании молекул (основное или возбужденное состояние) и его электронную конфигурацию, соответствующую этому состоянию;
Так, в молекуле BF3 степень окисления бора +3, следовательно, на образование связей по обменному механизму требуется три неспаренных электрона, поэтому при образовании молекулы атом бора переходит в возбужденное состояние:
5В 1s22s22p1 → 5B* 1s22s12p2
5B…
4) по орбитальной диаграмме валентной оболочки центрального атома в состоянии, предшествующем образованию молекулы, определить наличие или отсутствие орбиталей с неподеленными электронными парами (это же самое можно определить иначе, по разности общего числа валентных электронов и электронов, используемых в связывании по обменному механизму);
Так, в молекуле NH3 три неспаренных электрона атома азота N, требуемые на образование связей по обменному механизму, имеются невозбужденные атомы азота N: 7N… Этими электронами заняты три орбитали валентной оболочки, последняя (четвертая) орбиталь занята неподеленной электронной парой.
5) по значению координационного числа центрального атома определить число орбиталей, содержащих электроны, участвующие в -связывании. В молекулярных ионах BF4- и NH4- четыре орбитали содержат электроны, участвующие в -связывании. В молекуле СО2 две орбитали содержат электроны, участвующие в связывании.
Если координационное число центрального атома меньше числа его неспаренных электронов (определенных по его степени окисления), значит в молекуле помимо -связей, имеются π -связи, образованные по обменному механизму. Например, в молекуле СО2 из четырех электронов, идущих на образование связей по обменному механизму, два электрона участвуют в образовании двух σ - связей, а два электрона – в образовании двух π -связей.
Если координационное число центрального атома больше числа его неспаренных электронов, значит в молекуле (или комплексе) помимо -связей, образованных по обменному механизму, имеются -связи, образованные по донорно-акцепторному механизму. Например, в ионе аммония NH4+ из четырех -связей три образованы по обменному механизму, а одна - по донорно-акцепторному механизму при участии неподеленной электронной пары атома азота (азот при этом играет роль донора электронной пары). А в ионе BF4- из четырех -связей три образованы по обменному механизму, а одна – по донорно-акцепторному при участии вакантной орбитали атома бора (бор при этом играет роль акцептора электронной пары).
6) по числу орбиталей центрального атома, содержащих несвязывающие электронные пары (неподеленные электронные пары, не принимающие участия в образовании связей), и орбиталей, содержащих электроны, участвующие в -образовании, определить число орбиталей, участвующих в гибридизации;
Так, при образовании молекулы BF3 в гибридизации участвуют три орбитали атома бора (орбитали, содержащие электроны, участвующие в связывании). При образовании молекулы NH3 в гибридизации участвуют четыре орбитали атома азота (одна орбиталь содержит несвязывающую электронную пару и три орбитали – электроны, участвующие в -связывании). При образовании молекулы СО2 в гибридизации участвуют две орбитали атома углерода (орбитали, содержащие электроны, участвующие в -связывании). При образовании иона NH4+, как и при образовании иона BF4-, в гибридизации участвуют четыре орбитали центрального атома (орбитали, содержащие атомы, участвующие в -связывании).
7) по числу орбиталей центрального атома, участвующих в гибридизации, определить тип гибридизации; по типу гибридизации орбиталей центрального атома и типу частицы (в общем виде АВn-mЕm, где Е – несвязывающая электронная пара) определить пространственную конфигурацию данной молекулы;
Так, в молекуле СО2 атом углерода имеет две гибридные орбитали, находится в состоянии sp-гибридизации, образует две -связи С–О и не имеет несвязывающих электронных пар, следовательно, молекула СО2 должна быть линейной. В молекуле BF3 атом бора имеет три гибридные орбитали, находится в состоянии sp2-гибридизации, образует три -связи B–F и не имеет несвязывающих электронов, следовательно, молекула BF3 должна иметь форму правильного треугольника. В молекуле NH3 атом азота имеет четыре гибридные орбитали, находится в состоянии sp3-гибридизации, образует три -связи N–H и имеет одну несвязывающую электронную пару, следовательно, молекула NH3 должна иметь форму тригональной пирамиды. В ионах NH4+ и BF4- атомы азота и бора имеют четыре гибридные орбитали каждый, находятся в состоянии sp3-гибридизации, образуют четыре -связи N–H и B–F соответственно и не имеют несвязывающих электронов, следовательно, эти ионы должны иметь форму тертаэдра.
8) по разнице общего количества неспаренных электронов центрального и периферических атомов и электронов центрального и периферических атомов, использованных на образование -связей по обменному механизму, определить возможность π-связывания по обменному механизму, учитывая, при необходимости, делокализации π-связи.
Так, в молекуле СО2 из восьми неспаренных электронов (их имеют в сумме один атом углерода и два атома кислорода) только четыре неспаренных электрона (два электрона атома углерода и по одному электрону двух атомов кислорода) использованы на σ-связывание, следовательно, π-связи в этих молекулах образоваться по обменному механизму не могут.
9) по наличию вакантных валентных орбиталей центрального атома и соответствующего количества орбиталей периферических атомов с неподеленными электронными парами определить возможность дополнительного π-связывания по донорно-акцепторному механизму (при отсутствии пространственных и энергетических затруднений), учитывая, при необходимости, делокализацию π-связи.
Так, в молекуле BF3 после образования трех σ-связей у атома бора остается вакантная 2р-орбиталь, а у каждого из трех атомов фтора - неиспользованные неподеленные 2р-электронные пары, следовательно, между атомом бора и тремя атомами фтора возможно образование одной делокализованной π-связи по донорно-акцепторному механизму. В молекулах NH3 и СО2 после образования σ-связей у центральных атомов вакантных валентных орбиталей не остается, следовательно, дополнительные π-связи в этих молекулах образоваться по донорно-акцепторному механизму не могут.
10) проверить соответствие определенной пространственной конфигурации молекулы значениям длин связей и валентных углов, полученным исходя из магнитных и электронных свойств соединений.
Ионная связь. Металлическая связь. Дальнодействующие связи.
Вопросы для самостоятельной подготовки:
- Дать определение химической связи.
- Какой элемент имеет самую большую электроотрицательность? Почему?
- В результате чего может увеличиваться число неспаренных электронов в атоме?
- Какая связь называется донорно-акцепторной?
- Что обычно представляет собой возбужденное состояние атома при образовании им химической связи?
- Чему равны высшие и низшие степени окисления элементов?
- Какие связи называются σ – связями, какие называются π- связями?
- Чему равны степени окисления элементов в соединения с ионной связью?
- Какая связь называется неполярной, а какая полярной?
- Почему ковалентные связи имеют определенную направленность?
Задания для самостоятельной работы:
- Составьте формулы следующих соединений: а) лития с азотом; б) алюминия с серой; в) фтора с фосфором, в которых электроположительный элемент проявляет максимальную степень окисления.
- Составьте электронно-ионные схемы реакций соединения азота с: а) литием; б) алюминием; в) магнием.
- Составьте формулы хлорной кислоты и оксида хлора (VII) и поставьте над химическим символом каждого атома его степень окисления.
- Зная, что сумма степеней окисления в любом соединении равна нулю, вычислить степени окисления всех элементов в соединениях, формулы которых KMnO4, Na2Cr2O7, NH4NO3.
- Укажите, для какого из соединений, формулы которых H2SO4, HCN, HNO2, PCl3, элемент, обладает наибольшей электроотрицательностью.
- Какова степень окисления углерода в CO и CHCl3?
- Нарисуйте электронную схему образования молекул: а) сульфида магния; б) фтора. Какова степень окисления каждого элемента.
- Проставьте степени окисления элементов в соединениях, формулы которых CrO3, SbCl3, Mn2O7.
- Какой характер имеют связи в молекулах NCl3, CS2, ICl5, NF3, OF2, ClF, CO2?
- Что такое диполь? Что называется длиной диполя?
Строение и некоторые свойства веществ в конденсированном состоянии
Напишите формулы соединений, названия которых приведены в Вашем варианте, укажите степени окисления элементов в этих соединениях и выполните следующее задание:
а) укажите агрегатное состояние каждого соединения при обычных условиях (при выполнении этого и последующих заданий используйте данные из таблицы приложения С);
б) укажите виды всех химических связей, образующих каждое соединение при обычных условиях, и обоснуйте ответ (при необходимости приведите расчеты);
в) укажите соединения, сохраняющие молекулярную структуру при переходе из газообразного состояния в конденсированное, и обоснуйте ответ;
г) укажите структурные частицы кристаллов данных соединений (всех соединений, приведенных в Вашем варианте задания, а не только тех, что находятся в кристаллическом состоянии при обычных условиях) и основные типы связи между структурными частицами, ответ обоснуйте;
д) сравните значения теплоты плавления данных соединений и объясните, почему теплоты одних соединений сопоставимы по порядку с энергией химической связи, а теплоты других – значительно меньше;
е) укажите соединения, обладающие в кристаллическом состоянии электрической проводимостью, а также соединения, которые могут обладать электрической проводимостью в других условиях, ответ обоснуйте;
ж) охарактеризуйте механические свойства кристаллов данных соединений (их твердость или мягкость, пластичность или хрупкость), ответ обоснуйте.
Варианты задания приведены в таблице.
| Номер варианта | Названия химических соединений | ||||
| 1 | Серебро | Аргон | Оксид алюминия | Азотная кислота | Хлорид бария |
| 2 | Алюминий | Мышьяк (серый) | Оксид углерода (II) | Гидроксид цезия | Фторид натрия |
| 3 | Золото | Бром | Оксид бериллия | Бромоводород | Нитрат бария |
| 4 | Барий | Бор | Оксид углерода (IV) | Синильная кислота | Бромид кадмия |
| 5 | Бериллий | Хлор | Оксид висмута (III) | Фтороводород | Сульфат бария |
| 6 | Висмут | Фосфор (красный) | Тяжелая вода | Хлороводород | Нитрат кальция |
| 7 | Кальций | Дейтерий | Оксид кальция | Хлорная кислота | Фторид кадмия |
| 8 | Кобальт | Кремний | Вода | Йодоводород | Сульфат кальция |
| 9 | Хром | Фтор | Оксид меди (II) | Ортофосфорная кислота | Хлорид кадмия |
| 10 | Медь | Сера (моноклинная) | Оксид азота (II) | Гидроксид калия | Хлорид кобальта (II) |
Методические рекомендации. Чтобы выполнить задание, необходимо, прежде всего, определить химические связи, образующие данные соединения. Для этого нужно выполнить ряд последовательных действий:
1) по качественному составу данных соединений определить среди них простые и сложные вещества;
2) по значениям энергии ионизации, сродства к электрону и электроотрицательности атомов элементов, образующих простые вещества, определить металлические и неметаллические элементы и, следовательно, вид связи, образующей металлы и неметаллы.
Так, при взаимодействии одинаковых атомов одного элемента образуется ковалентная неполярная связь, если атомы имеют высокую энергию ионизации и большое сродство к электрону. При взаимодействии одинаковых атомов одного элемента образуется металлическая связь (точнее, преимущественно металлическая связь с большей и меньшей «примесью» ковалентности), если атомы имеют низкую энергию ионизации и малое сродство к электрону;
3) среди сложных веществ выделить двухэлементные и многоэлементные (трех- и четырехэлементные);
4) по разности электроотрицательностей элементов выделить вид связи, образующей каждое двухвалентное состояние;
Так, если разность электроотрицательностей элементов велика (∆ЭО>≈2), происходит сильное смещение связывающих электронов к более электроотрицательному атому, степень ионности такой связи очень велика, и такую связь относят к ионному типу (правильнее рассматривать такую связь как преимущественно ионную с малой «примесью» ковалентности. При меньшей разности электроотрицательностей элементов (∆ЭО<2) степень ионности связи не очень велика или даже мала, и такую связь считают ковалентной полярной.
Кроме того, качественные заключения о типе связи в соединении можно сделать, основываясь на его свойствах, и прежде всего, исходя из его агрегатного состояния при обычных условиях. Если соединение при обычных условиях находится в газообразном или жидком состоянии, то оно имеет молекулярную структуру, и его молекулы образованы ковалентными полярными связями. Если соединение при обычных условиях находится в твердом состоянии, то оно может иметь молекулярную структуру (молекулярные кристаллы с ковалентными полярными связями внутри молекул и более слабыми силами межмолекулярного взаимодействия между ними) или не иметь молекулярной структуры (атомные и ионные кристаллы с ковалентными полярными или ионными связями соответственно). Как правило, молекулярные кристаллы относительно легкоплавки, ионные – относительно тугоплавки, а атомные – очень тугоплавки.
5) по качественному составу, химическому строению и разности электроотрицательностей элементов, образующих связь, определить вид каждой связи в многоэлементном соединении;
Так, гидроксиды имеют два вида связи Э–О и О–Н. У основных гидроксидо (оснований) степень ионности первой из них, как правило, очень велика, поэтому они образуют ионные кристаллы, в которых ионная связь между ионами Эп+ и ОН- является основной, а ковалентная полярная связь О–Н играет второстепенную роль. У амфотерных гидроксидов и кислотных гидроксидов (кислородсодержащих кислот) нет связей с высокой степенью ионности, у них все связи ковалентные полярные (с разной степенью полярности).
Соли с кислородсодержащим кислотным остатком, как правило, имеют два вида связи: ионную – между катионами металла (точнее, сильно поляризованным атомом металла, имеющим значительный положительный заряд) и анионом кислотного остатка, и ковалентную полярную – между элементами кислотного остатка. Ионная связь является основной в соединениях этого типа, а ковалентная полярная – второстепенной.
Определив химические связи в каждом соединении, можно определить тип его кристалла по типу структурных частиц и характеру связи между структурными частицами. Здесь наибольшее затруднение может вызвать определение типа кристалла соединения с ковалентными связями. Соединения с ковалентными связями образую либо молекулярные кристаллы, либо атомные кристаллы. Первые из них характеризуются низкой температурой плавления, а вторые – высокой.
