Предмет биохимии. Химия белка. (Занятия I – IV)
| Вид материала | Документы |
- Курс лекций 1999-2000, 11782.85kb.
- Курс по выбору для предпрофильной подготовки учащихся 9-х классов. (предмет «химия»), 96.19kb.
- Методические рекомендации для подготовки к гиа (9 класс) Русский язык, 157.38kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- «Химия глазами Д. И. Менделеева», 383.59kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- 7 класс химия (1 час в неделю) Календарно-тематическое планирование, 214.58kb.
- Хрипунова Елена Анатольевна Класс 10 Предмет мировая художественная культура Тема учебного, 118.44kb.
- Учебно-методический комплекс учебного занятия по дисциплине «Физическая и коллоидная, 127.59kb.
ТЕМА: «ПРЕДМЕТ БИОХИМИИ. ХИМИЯ БЕЛКА».
(Занятия I – IV)
ЦЕЛЬ: 1) усвоить понятия «жизнь», «живой организм», их важнейшие признаки, изучающиеся в курсе биохимии; 2) изучить строение, функции белков, как важнейших макромолекул живых систем; 3) знать белки плазмы крови, как наиболее доступные лабораторному исследованию в медицинской практике.
ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ: 1. Определить понятие «жизнь» с позиций биохимии, назвать задачи биохимии, в том числе клинической. 2. Назвать функции живого организма. 3. Химическая природа белков (состав, уровни организации и типы связей). 4. Биологическая роль белков (функции в организме). 5. Принципы выделения и разделения белков, определения их молекулярной массы и пространственной конфигурации. 6. Принципы классификации белков. Простые и сложные белки, классы, общая характеристика. 7. Классификация аминокислот (химическая и основанная на их пищевой ценности). 8. Пространственная структура белков. Понятие о нативном и денатурированном белке. 9. Индивидуальные белки сыворотки крови, их функции, содержание, диагностическое значение результатов лабораторного исследования, «белки острой фазы».
ИСТОЧНИКИ: конспекты лекций; учебник биохимии А. Я. Николаева, 1989, с. 5 - 6, 9 - 52.; учебник биохимии А.Ш.Бышевского, О.А.Терсенова, 1994, с. 4-26; учебник биохимии Т.Т.Березкина, Б.Ф.Коровкина, 1998, с. 19-95.
ЗАНЯТИЕ 1.
Усвоить, что:
1. Биохимия изучает химические основы жизнедеятельности, т. е. химические процессы, обеспечивающие существование живого организма.
2. Жизнь с позиций биохимии - макромолекулярная система, для которой характерны определенная соподчиненность организации, способность к воспроизведению, строго регулируемому обмену веществ и энергии.
3. Основная структурная единица всех форм жизни - клетка. При большом разнообразии клеток их объединяет наличие обязательных надмолекулярных образований, которые необходимы для реализации воспроизведения и обмена: мембрана, митохондрии, ядро, рибосомы, лизосомы и аппарат Гольджи (знать функцию каждого из них).
4. При тщательном изучении химического состава этих обязательных образований обнаружено большое разнообразие молекулярных структур, которые можно отнести к ограниченному числу классов: макромолекулы (белки, углеводы, липиды), низкомолекулярные биологически активные органические вещества и минеральные вещества.
5. Предмет биохимии - строение и функции молекул живого и надмолекулярных образований, механизмы извлечения из внешней среды соединений, необходимых для обеспечения обмена веществ и энергии, механизмы самовоспроизведения.
6. Превращения веществ, поступающих в организм из среды, проходят независимо от их химической природы следующие общие стадии: переваривание (деполимеризация), всасывание, транспорт, метаболизм в тканях по пути синтеза или окислительно-восстановительного распада.
7. Частный раздел биохимии - клиническая биохимия - изучает нарушения химических процессов жизнедеятельности и методы их выявления для устранения или исправления (коррекции) .
8. Белковые молекулы - важнейший вид макромолекул живого - представляют собой линейные полимеры или сополимеры, минимальная структурная единица которых - аминокислоты 2О-ти видов.
9. Основной тип связи между остатками аминокислот в белковой молекуле - карбамидная (пептидная).
10. В названии остатка аминокислоты, затратившей на образование пептидной связи карбоксильную группу, окончание изменяется на «ил». Например, аланин образовал дипептид с гистидином за счет карбоксильной группы - «аланилгистидин», если за счет карбоксильной группы гистидина, то «гистидилаланин».
11. В силу второго закона термодинамики молекулы белка принимают сложную пространственную конфигурацию, в которой различают три уровня: первичная, вторичная и третичная структуры (или уровни организации), отличающиеся по типу образующих их связей, а две или более молекул с третичной организацией могут объединяться в агрегаты, которые являются молекулами с четвертичным уровнем организации (структуры).
^ ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ:
1. Подчеркнуть то, что относится к задачам биохимии: 1) Изучение структуры органов; 2) Изучение структуры и функции мембран; 3) Изучение структуры и функции биополимеров; 4) Изучение структуры поливинилстирола; 5) Изучение функции витаминов; 6) Изучение превращений глюкозы в организме; 7) Изучение окислительно-васстановительных процессов в мышцах; 8) Изучение механизма всасывания аминокислот; 9) Изучение распада радиоизотопа серы; 10) Изучение процессов высвобождения энергии из глюкозы в печени.
2. Подчеркнуть в перечне обязательные признаки живой системы: А. Способность перемещаться в пространстве. Б. Распространять звуковые волны. В. Извлекать из среды химические вещества. Г. Воспроизводить живые системы, идентичные по форме и свойствам. Д. Содержать молекулы только в свободном состоянии. Е. Производить работу без притока энергии. Ж. Иметь сложные надмолекулярные структуры. 3. Состоять только из бесклеточного материала. И. Не содержат клеток, имеющих митохондрии.
3. Выбрать к названиям надмолекулярных образований свойственные им функции:
| А – ядро Б – аппарат Гольджи В – мембраны Г – митохондрии Д – рибосомы Е – лизосомы | 1. Выделение клетки в пространстве и образование компартментов 2. Биогенез мембран и лизосом, синтез глико- и фосфолипидов 3. Переваривание сложных молекул и посторонних частиц 4. Локализация носителей генетической информации 5. Энергетический блок 6. Место реализации генетической информации |
4. Выбрать понятия, характеризующие общие стадии обмена веществ в организме, и переписать их в логической последовательности: 1) распад жирной кислоты в печени; 2) метаболизм в тканях; 3) деполимеризация пищевых веществ в желудочно-кишечном тракте; 4) транспорт (всасывание и перенос веществ кровью, трансмембранный перенос); 5) выделение углекислоты легкими.
5. «Собрать» из приведенных фрагментов определение белковой молекулы: 1) разветвленный полимер; 2) гетерополимер, включающий остатки аминокислот и углеводов; 3) линейный полимер из аминокислот; 4) линейный полимер или сополимер из аминокислот, соединенных карбамидными связями; 5) линейный полимер, отличающийся плоской структурой; 6) характеризующийся трехмерной пространственной организацией; 7) с периодическим включением в цепь остатков жирных кислот; 8) в которой различают три уровня и для которого характерна способность объединяться в надмолекулярные образования - четвертичный уровень организации. «Молекула» белка - это ...
6. Вписать виды химических связей, обеспечивающие разные уровни организации белковой молекулы (в виде таблицы).
7. Записать карбамидную связь химическими символами.
8. Написать структурные формулы дипептидов, образованных из глицина и аланина.
9. Написать схематическую формулу полипептида с N-концевым остатком аланина и С-концевым - глицина и наоборот.
10. Перечислить типы связей в молекуле белка в порядке их прочности (от сильных к слабым).
11. Перечислить функции белков.
12. Содержание азота в белках.
13. Принцип количественного определения белка по Къелдалю.
14. Какие вещества дают положительную биуретовую реакцию: а) все аминокислоты, б) глутатион, в) дипептиды, г) трипептиды и белки?
15. С какими соединениями нингидриновый реактив дает цветную реакцию: а) полисахаридами, б) моносахаридами, в) нуклеиновыми кислотами, г) -аминокислотами, д) липидами?
16. Определить понятие “первичная структура белка”.
17. Какова роль ковалентных связей в белках: а) соединяют белковый и небелковый компоненты в молекулах липопротеидов, б) поддерживают -спиралевидную конфигурацию полипептидной цепи, в) используются при соединении аминокислот в белковой молекуле?
18. Типы вторичной укладки белка.
19. Что представляет собой водородная связь? Какие химические элементы и какие белковые группировки способны к образованию водородных связей?
20. Для каких белков характерна -структура полипептидной цепи: а) гемоглобин, б) фиброин шелка, в) миоглобин, г) сывороточный альбумин?
21. Принцип деления белков на глобулярные и фибриллярные.
22. Определите понятие «третичная структура белка» и назовите связи, ее выполняющие.
23. Что представляет собой четвертичная структура белка?
24. Какая структура укладки белка характерна для: а) нативного альбумина; б) денатурированного альбумина; в) гемоглобина; г) коллагена?
^
Лабораторные работы:
- Биуретовая реакция.
- Нингидриновая реакция.
Контрольные задачи:
- Вычислить (в А) длину спирализованных по типу -спиралей участков полипептидной цепи, содержащей 140 аминокислотных остатков, если известно, что неспирализованные участки содержат 35 аминокислотных остатков и что вся цепь вытянута в длину.
- Вычислить, какой процент составляет неспирализованный участок цепи полипептида, если известно, что полипептид содержит 140 аминокислотных остатков и что длина полностью вытянутых спирализованных участков составляет 45 А.
- ^ В каком участке изображенного ниже полипептида могли бы находиться точки изгибов, какие участки могли бы иметь спиралевидную конфигурацию?
Ала-гли-тир-про-мет-фен-цис-ала-цис-ала-гис-ала-цис-фен-гис-про-гис-ала
- ^ Какими способами может образоваться сополимер из следующих пептидов?
а) ала-мет-арг-цис-ала-гли-сер-гли-цис-тре; б) лиз-глу-цис-арг-гли-тре-глу-сер;
- Из 2 мл биологической жидкости полностью осажден белок. Методом Къелдаля в осадке обнаружено 3 мг азота. Каково процентное содержание белка в исследуемой жидкости?
- Исследуемая жидкость при нагревании с нингидрином приобретает фиолетовое окрашивание. Содержатся ли в растворе белки?
- Какое из указанных веществ является пептидом? Дайте ему название.
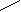 NH2
NH2 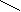 a) C = O
a) C = O
NH2
б) H2N – СH2 – CO – NH – CH – CO – NH – CH – CO – NH – CH – COOH
| | |
CH3 H3C – CH – CH3 CH3
в) H2N – C – O – C – CH2
||
O
- Сколько различных трипептидов можно синтезировать из аминокислот глицина, валина и серина, если использовать каждую аминокислоту один раз?
- Какова роль различных связей и взаимодействий в молекуле белка – ковалентных (А), ионных связей и гидрофобных взаимодействий (Б), внутримолекулярных водородных связей (В), межмолекулярных водородных связей (Г): а) соединение белковой и небелковой составляющей в молекулах липопротеидов, б) присоединение аминокислот в белковой молекуле, в) обеспечение складчатой -структуры полипептидной цепи, г) обеспечение -конфигурации полипептидной цепи?
