Учебное пособие по клинической фармакологии рекомендуется Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов, обучающихся по специальности 040200 Педиатрия
| Вид материала | Учебное пособие |
- С. В. Дьякова стоматология детского возраста издание пятое, переработанное и дополненное, 7200.9kb.
- Учебное пособие для очных отделений многопрофильных медицинских университетов, 1767.78kb.
- Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов, 2417.25kb.
- Учебное пособие Рекомендовано Учебно-методическим объединением по медицинскому и фармацевтическому, 1674.92kb.
- Практикум по патологической физиологии (для студентов лечебного, педиатрического, 1873.79kb.
- Отечественная история, 1627.22kb.
- Николай Петрович Карханин Аськова Л. Н., Братийчук А. Н., Волов Н. В., Петров, 1440.46kb.
- Министерство здравоохранения, 1224.21kb.
- Методическое пособие Ставрополь 2010 г. Государственное образовательное учреждение, 109.45kb.
- Учебное пособие Допущено Учебно-методическим объединением вузов Российской Федерации, 1671.62kb.
^ Фармакодинамика и фармакологические эффекты. Глюкокортикоиды (ГК) тормозят процессы экссудации и этим ограничивают набухание слизистых оболочек, нередко являющееся главной причиной обструкции дыхательных путей, особенно у детей раннего возраста. ГК оказывают пермиссивное действие, т.е. восстанавливают реакцию - адренорецепторов на катехоламины. Кроме того, ГК препятствуют взаимодействию иммуноглобулина Е с Fc-рецептором на поверхности тучных клеток (мастоцитов) и базофилов, но не способны вытеснять его после фиксации. Они тормозят фосфолипазу А2 преимущественно за счет индуцирования синтеза липомодулина, что в конечном итоге приводит к уменьшению образования и выделения многочисленных медиаторов анафилаксии. Синтез липомодулина осуществляется после латентного периода (4-24 ч), поэтому глюкокортикоиды не могут предупредить раннюю реакцию на антиген, но предотвращают инфильтрирование поврежденных аллергическим процессом тканей (в частности, дыхательных путей) клетками воспаления и этим предупреждают возникновение задержанной анафилактической реакции на антиген наиболее тяжело поддающегося терапии варианта бронхообструктивного синдрома.
При синдроме бронхиальной обструкции ингаляционные препараты глюкокортикоидов обеспечивают противоотечный эффект, предупреждают бронхоспазм и несколько снижают продукцию и улучшают эвакуацию густой, вязкой мокроты.
Фармакокинетика. При вдыхании аэрозолей только 10-20% их поступает непосредственно в легкие, основное количество заглатывается и, не оказывая существенного резорбтивного действия (биодоступность составляет всего 10-15%), подвергается биотрансформации в печени. Выделяются препараты в виде метаболитов с желчью (около 70%) и с мочой (около 20%).
Взаимодействие. Синергидной является комбинация глюкокортикоидов с 2-адреномиметиками или с эуфиллином. Фенобарбитал, дифенин, рифампицин ускоряют биотрансформацию глюкокортикоидов.
^ Нежелательные эффекты:
- осиплость голоса, кашель;
- кандидоз ротовой полости (для предупреждения вышеназванных осложнений необходимо тщательное полоскание рта и глотки, а при появлении начальных признаков кандидоза - применение нистатина, леворина и т.п.);
- обострение гастрита, язвенной болезни.
При длительном применении возможно появление системных осложнений (синдром Иценко-Кушинга, угнетение функции коры надпочечников и т.п.).
^ Показания к применению. Ингаляционные препараты глюкокортикоидов не дают быстрого эффекта, поэтому их применяют только при хронической бронхиальной астме:
- для ликвидации приступов удушья при гормонально-зависимой бронхиальной астме;
- при астматическом статусе, развившемся на фоне рефрактерности к адреномиметикам и препаратам теофиллина, при этом глюкокортикоиды надо вводить парентерально или в более легких случаях назначать внутрь.
3. ^ Антигистаминные средства
Биологически активный гистамин высвобождается в ответ на реакцию антиген-антитело; под воздействием некоторых лекарственных средств, а также при ряде патологических состояний (ацидоз, гипоксия, ожог, физическая травма, шок и др.). Гистамин влияет на гистаминовые-1 и гистаминовые–2 рецепторы. Воздействуя на гистаминовые–1 рецепторы, гистамин активирует в клеточной мембране фосфолипазу С, расщепляющую фосфатидилинозитол с освобождением инозитол-3-фосфата и диацилглицерола, способствующих освобождению кальция из эндоплазматического ретикулума гладкомышечных клеток и этим приводящих к их сокращению. Гистамин вызывает сокращение гладкой мускулатуры бронхов, артериол, венул, особенно пред- и посткапиллярных сфинктров, кишечника, матки, а также сократительных элементов в клетках эндотелия. При освобождении больших количеств гистамина возникает бронхоспазм, ограничивается возврат крови к сердцу, уменьшаются сердечный выброс и минутный объем крови, усиливается транссудация жидкой части плазмы через расширенные межклеточные пространства в сосудистой стенке, сгущается кровь, уменьшается объем циркулирующей крови. Все вместе приводит к понижению артериального давления и ухудшению гемоперфузии тканей. Раздражение чувствительных рецепторов кожи вызывает ощущение жжения, зуда и боли.
Для предупреждения возникновения вышеперечисленных эффектов, возникающих при гиперреактивном или “извращенном” иммунном ответе, применяют гистамино1-блокаторы. Эти препараты делят на два поколения:
I-е поколение: дифенгидрамин (димедрол), прометазин (дипразин, пипольфен), хлоропирамин (супрастин), мебгидролин (диазолин), клемастин (тавегил), фенкарол.
II-е поколение: лоратидин (кларитин), терфенадин (теддан, бронал), астемизол (гисманал), акривастин (семпрекс), цетиризин (зиртек), левокабастин (ливостин), азеластин (аллергодил, ринопласт), эбастин (кестин).
В основу деления гистамино –1 блокаторов на поколения положены; длительность действия, фармакокинетические особенности и нежелательные реакции.
^ Фармакодинамика и фармакологические эффекты. Гистаминoлитики блокируют соответствующие рецепторы, чем и обусловлены их фармакологические эффекты (см. выше). Кроме того, хлоропирамин (супрастин), увеличивая связывание гистамина в тучных клетках и белками плазмы крови (гистаминопексию), уменьшает его освобождение, например, в ответ на поступление в организм антигена. Фенкарол активирует диаминоксидазу (гистаминазу), инактивирующую гистамин. Следует отметить, что препараты блокируют только не занятые гистамином рецепторы, они не могут вытеснить медиатор, связавшийся с рецептором, так как их сродство к специфическим рецепторам значительно ниже, чем у гистамина. У гистамин-блокаторов II поколения аффинитет к рецептору несколько больше, чем у препаратов 1-го поколения. Наряду с противогистаминным действием препараты данной группы обладают и другими фармакологическими свойствами. Гистамин-блокаторы 1-го поколения, (особенно выраженно - прометазин (дипразин, пшюльфен), дифенгидрамин (димедрол) и хлоропирамин (супрастин) оказывают седативное (угнетение центральной нервной системы) и М-холинолитическое (атропиноподобное) действие. Прометазин (дипразин, пипольфен) и дифенгидрамин (димедрол) обладают местноанестезирующим эффектом. Дифенгидрамин (димедрол) может блокировать передачу возбуждения в вегетативных ганглиях, что способствует расслаблению гладкомышечных органов. Прометазин (дипразин) является адренолитиком, он способен снижать артериальное давление, особенно при внутривенном введении.
Фармакокинетика. Препараты вводят внутримышечно, внутривенно (капельно) или принимают внутрь. Подкожно их вводить нельзя из-за возникающего сильного раздражения (исключение - клемастин = тавегил). Все гистамино1-литики хорошо всасываются из желудочно-кишечного тракта. Однако биоусвояемость препаратов I поколения составляет всего лишь около 40%, так как они подвергаются биотрансформации в печени до попадания в системный кровоток. Биологическое же усвоение гистамино1-блокаторов II поколения более 95%, они в значительно меньшей степени подвергаются пресистемной элиминации, а их метаболиты частично сохраняют фармакологическую активность. У всех гистамино1-литиков связывание с белками плазмы крови более 90%. Их эффект появляется через 20-40 мин, максимальная концентрация в крови достигается через 2 ч, время сохранения терапевтической концентрации средств I поколения 4-6 ч, а средств II поколения значительно больше, поэтому их кратность назначения соответствует 4 (у тавегила - 2) и 1 разу в сутки, соответственно. Значительно различаются и их периоды полуэлиминации из крови: например, для дифенгидрамина (димедрола) и прометазина (дипразина, пипольфена) он составляет 4-10 ч; для лоратидина - 15-24 ч; для терфенадина - 20 ч, а для астемизола - 5-10 дней.
Большинство препаратов I поколения хорошо проникают в разные ткани, в том числе и через гематоэнцефалический барьер (исключение - диазолин и фенкарол). Объем распределения гистамино1-литиков II поколения больше (примерно 250 л), поэтому, с одной стороны, они еще лучше попадают в разные ткани и органы, но, с другой стороны, за счет особой химической структуры их проникновение в мозг существенно ниже (за исключением цетиризина, создающего в ликворе около 10% от плазменной концентрации). Экскреция неактивных метаболитов и исходных веществ в неизмененном виде происходит с помощью почек и печени. При печеночной недостаточности требуется коррекция режима дозирования.
Взаимодействие. Димедрол и пипольфен усиливают действие местных анестетиков, жаропонижающих средств и холинолитиков; названные препараты, а также хлоропирамин (супрастин) и клемастин (тавегил) потенцируют эффекты снотворных средств, нейролептиков, средств для наркоза и других препаратов, угнетающих центральную нервную систему. Терфенадин и астемизол нельзя (!) назначать вместе с эритромицином и другими гепатотоксичными препаратами (повреждение печени), а также с кетоконазолом, флуконазолом и интраконазолом (возникают кардиомиопатии). Дифенгидрамин (димедрол) и прометазин (дипразин, пипольфен) - индукторы микросомальных ферментов гепатоцитов, поэтому они ускоряют биотрансформацию ряда лекарств, ослабляя их эффекты.
^ Нежелательные эффекты. Гистамино1-литики I поколения (особенно прометазин (дипразин, пипольфен) и дифенгидрамин = димедрол) угнетают центральную нервную систему (вызывая седативное действие, атаксию, головокружение, звон в ушах, двоение в глазах и т.п.) и оказывают М-холинолитическое действие (проявляющееся сухостью во рту, сгущением секрета в дыхательных путях и носоглотке, запором, дизурическими явлениями, обострением глаукомы, тремором конечностей и т.п.). У детей младшего возраста после приема данных препаратов иногда возникают, наоборот, возбуждение и бессонница.
Из гистаминоблокаторов II поколения умеренным М-холинолитическим и седативным действием обладает цетиризин, поэтому и этот препарат не рекомендуют к использованию водителям автотранспорта и пациентам тех профессий, при которых требуется тонкая координация движений, активная умственная деятельность и т.п. У других гиртаминоблокаторов II поколения эти эффекты практически отсутствуют.
При внутривенном введении прометазина (дипразин, пипольфен) нередко наблюдается снижение артериального давления из-за адренолитического действия препарата. Большинство гистаминолитиков раздражают слизистую оболочку желудочно-кишечного тракта, вызывая тошноту, боли в эпигастральной области, диспепсию. Особенно это характерно для прометазина (дипразин, пипольфен), мебгидролина (диазолин) и фенкарола - эти препараты назначают после еды. Терфенадин (в терапевтических дозах), а также астемизол и эбастин (в дозах пограничных с терапевтическими) вызывают кардиотоксическое действие, которое связывают с блокадой калиевых каналов, что приводит к задержке реполяризации желудочков. До возникновения клинически выраженных аритмий на ЭКГ отмечают: удлинение интервала Q-Т, расширение зубца Т, появление полиморфных желудочковых экстрасистол и тахикардии. При использовании астемизола повышается аппетит, у больных увеличивается масса тела. Представители гистамино1-литиков II поколения выгодно отличаются от препаратов I поколения тем, что к ним гораздо позже развивается привыкание (особенно к лоратидину). При использовании “старых” препаратов возникновение толерантности происходит, как правило, на 5-7-е сутки лечения и, кроме того, тогда же они могут сами стать причиной аллергических реакций. Поэтому при необходимости длительного назначения предпочтение отдают гистамино1-блокаторами II поколения или I гистамино1-блокаторы I поколения постоянно чередуют, меняя каждые 5 дней.
^ ОТХАРКИВАЮЩИЕ И МУКОЛИТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
При назначении отхаркивающих лекарственных средств необходимо выполнять следующие условия:
- больной должен дополнительно к физиологической норме выпивать еще 15-20% жидкости на патологические потери;
- больному нельзя назначать препараты, обезвоживающие его организм (например, мочегонные, слабительные и т.п.);
- больному нельзя назначать препараты, тормозящие кашлевой рефлекс (например, кодеин, тусупрекс, глауцин и т.п.) и гистамино1-литики, которые сгущают мокроту (например, димедрол, пипольфен и т.п.).
1. ^ Препараты, способствующие отделению жидкой мокроты
В эту группу включены препараты из лекарственных растений, терпингидрат, калия и натрия йодиды, натрия гидрокарбонат.
^ Фармакодинамика и фармакологические эффекты. Препараты из лекарственных растений (рвотный корень, корень алтея, корень солодки, трава термопсиса), а также синтетический препарат терпингидрат - вызывают слабое раздражение слизистой оболочки желудка, что рефлекторно слегка возбуждает рвотный центр, вызывая начальные признаки его активности, повышает секрецию слюнных и бронхиальных желез, усиливает активность мерцательного эпителия (реснитчатых, бокаловидных, базальных и промежуточных клеток) бронхов и перистальтическое движение бронхиол. В результате повышается мукоцилиарный клиренс, облегчается отхаркивание мокроты. Кроме того, препараты из лекарственных растений обладают способностью обволакивать слизистую оболочку бронхов, оказывают противовоспалительный эффект. Йодиды калия и натрия, натрия гидрокарбонат после ингаляций или всасываясь после приема внутрь и выделяясь слизистой оболочкой дыхательных путей, тоже усиливают функцию мерцательного эпителия и способствуют выделению жидкой мокроты.
^ Нежелательные эффекты. У больных с пыльцевой аллергией препараты из лекарственных растений могут вызвать аллергические реакции. Прием настоя из рвотного корня или травы термопсиса иногда сопровождается рвотой. Кроме того, в связи с содержанием в термопсисе цитизина (Н-холиномиметического алкалоида) высокие его дозы, особенно у детей, вызывают стимуляцию дыхания, сменяющуюся затем его угнетением. Прием препаратов йода может сопровождаться признаками йодизма (насморк, кашель, кожные сыпи, боль в суставах), угнетением функции щитовидной железы и увеличением ее размеров.
2. ^ Препараты, способствующие разжижению мокроты или муколитики
К данной группе препаратов относят ацетилцистеин, трипсин, рибонуклеаза, дезоксирибонуклеаза, бромгексин, амброксол.
^ Фармакодинамика и фармакологические эффекты. Ацетилцистеин дезинтегрирует дисульфидные группы мукополисахаридов, а ферментные препараты (трипсин, рибонуклеаза, дезоксирибонуклеаза) расщепляют молекулы полипептидов, белков. Трипсин действует только в некротизированных тканях и фибринных образованиях, в вязких секретах и экссудатах. В здоровых тканях этот фермент неактивен, так как в них есть его ингибиторы. Вышеназванные препараты в основном уменьшают вязкоэластичные свойства мокроты, разжижают гной. Бромгексин и амброксол - фрагментируют мукопротеины и кислые мукополисахариды бронхиального секрета. Они повышают содержание сурфактанта, а также иммуноглобулина G, лизоцима, секреторного иммуноглобулина А. Эти лекарственные средства главным образом уменьшают адгезивные свойства мокроты, т.е. ее прилипание к поверхности бронхов. Все препараты обладают слабым противовоспалительным эффектом.
Ацетилцистеин.
Фармакокинетика. Препарат применяют путем ингаляций, вводят внутритрахеально, назначают внутрь или внутримышечно. Биоусвоение из желудочно-кишечного тракта составляет примерно 10%, время возникновения максимальной концентрации в крови через 1-3 ч. В печени препарат превращается в активный метаболит цистеин. Элиминация из организма осуществляется с желчью. Период полуэлиминации из крови 1 ч, при циррозе печени - увеличивается до 8 ч и более. Кратность назначения 2-4 раза в день и более.
Взаимодействие. Ацетилцистеин нельзя смешивать с антибиотиками и протеолитическими ферментами, так как происходит инактивация препарата. Необходимо избегать соприкосновения растворов ацетилцистеина с металлами и резиной (образуются сульфиды). После вскрытия ампул раствор препарата может приобретать фиолетово-розовую окраску, что не препятствует его применению.
^ Нежелательные эффекты:
- вызываемая иногда тошнота неприятным запахом препарата;
- аллергические реакции, бронхоспазм;
- легочные геморрагии.
^ Форма выпуска и дозировка: выпускается в виде 20% раствора в ампулах по 5 и 10 мл для ингаляций и в виде 10% раствора в ампулах по 2 мл для инъекций. Применяется в виде ингаляций по 2-5 мл 20% 3-4 раза в день. Внутримышечно вводят детям до года из расчета 10-15 мг/кг 2 раза в день, старше года по 0,5-1 мл 10% раствора 2 раза в день, курсами 3-10 дней. Per os используются шипучие таблетки и порошки: до 2 лет 100 мг 2 раза в день, 2-6 лет 100 мг 3 раза, с 6 лет 200 мг 3 раза .
^ Ферментные препараты (трипсин, рибонуклеаза, дезоксирибонуклеаза).
Фармакокинетика. Препараты применяют путем ингаляций, вводят внутритрахеально, внутрибронхиально и внутримышечно. Назначают их 1-2 раза в день.
Взаимодействие. Ферментные лекарственные средства можно комбинировать с антибиотиками и бронходилататорами.
^ Нежелательные эффекты:
- болезненность и гиперемия в месте инъекции;
- аллергические реакции;
- раздражение слизистых оболочек и охриплость голоса после ингаляций (рекомендуется после процедуры прополоскать ротовую полость и промыть нос теплой водой);
- легочные геморрагии.
^ Форма выпуска и дозировка: Трипсин выпускается в ампулах или герметически закрытых флаконах, содержащих по 0,005 и 0,01 г препарата. Для ингаляций 5-10 мг растворяют в 2-3 мл физ. раствора, в/м детям вводят по 0,0025 г 1 раз в день, курс 6-15 инъекций. Рибонуклеаза выпускается в ампулах или герметически закрытых флаконах по 10, 25, 50 мг. Для ингаляций 25 мг препарата растворяют в 3-4 мл физ. раствора, в/м вводят 5 мг в 1 мл 0,5% раствора новокаина 1 раз в день. Перед началом лечения необходимо проведение кожной пробы на чуствительность к препарату.
^ Бромгексин и амброксол.
Фармакокинетика. Препараты вводят парентерально, ингаляционно и назначают внутрь. Они хорошо всасываются, но биоусвояемость амброксола из желудочно-кишечного тракта составляет 70%, а бромгексина - только 20%, так как последний более интенсивно подвергается пресистемной элиминации. Причем в печени бромгексин превращается в активное вещество амброксол. После орального применения эффект препаратов возникает через 1-2 ч и продолжается 6-12 ч. Экскреция осуществляется главным образом с мочой в виде метаболитов. Период полуэлиминации из тканей 7-15 ч, а из крови около 1 ч.
Взаимодействие. Препараты можно комбинировать с антибиотиками и бронходилататорами.
^ Нежелательные эффекты:
- диспепсические расстройства, обострение язвенной болезни;
- повышение активности трансаминаз в сыворотке крови;
- аллергические реакции, ангионевротический отек;
- при внутривенном введении - чувство оцепенения, артериальная гипотензия, одышка, повышение температуры тела с ознобом.
^ Форма выпуска и дозировка: Бромгексин выпускается в таблетках по 0,008 г и в драже по 0,004 г. Назначают детям ввозрасте 3-5 лет по 0,002 г , 6-14 лет по 0,004 г 3 раза в день. Амброксол выпускается в таблетках по 30 мг (по 1/2 таб 2 раза в день – детям 5 лет и по 1 таб 2 раза в день детям старше 5 лет), в сиропе 15мг/5мл, в растворе для ингаляций 15 мг/2мл (1-2 ингаляции).
^ Нестероидные противовоспалительные препараты
Нестероидные противовоспалительные препараты (НПВП) широко применяются в педиатрической практике. В настоящее время существует не менее 50 различных по структуре лекарственных веществ, классифицируемых как НПВП. Основные из них представлены в табл. 1.
Таблица 3
^ Классификация НПВП
| I. Производные кислот |
| Производные салициловой кислоты •Ацетилсалициловая кислота (Аспирин) •Салициламид •Дифлунисал •Трисалицилат •Бенорилат •Салицилат натрия •Салицилат холина •Салол ^ Производные антраниловой кислоты (фенаматы) •Флуфенамовая кислота •Мефенамовая кислота •Меклофенамовая кислота •Нифлумовая кислота (Доналгин) •Толфенамовая кислота |
| ^ Производные фенилуксусной кислоты •Диклофенак •Фенклофенак •Алклофенак •Фентиазак Производные гетероарилуксусной кислоты •Толметин •Зомепирак •Клоперак •Кеторолак трометамин (Кетанов, Кеторол, Торадол) ^ Производные пропионовой кислоты •Ибупрофен (Бруфен, Нурофен, Бурана, Солпафлекс, Мотрин) •Флурбипрофен (Флугалин, Ансейд) •Кетопрофен (Кетонал, Орувель) •Напроксен (Напросин) •Оксапрозин •Фенопрофен •Фенбуфен •Супрофен •Индопрофен •Тиапрофеновая кислота (Сургам) •Беноксапрофен •Пирпрофен |
| ^ Производные индолуксусной кислоты •Индометацин (Метиндол) •Сулиндак (Клинорил) •Этодолак (Эльдерин)* •Ацеметацин |
| ^ Производные пиразолона •Амидопирин (Пирамидон) •Фенилбутазон (Бутадион) •Метамизол натрия (Анальгин, Спаздолзин) •Оксифенилбутазон •Азапропазон •Фенпразон •Аминофеназон •Пропифеназон Оксикамы •Пироксикам (Хотемин, Фельден, Пирокам) •Изоксикам •Судоксикам •Теноксикам •Мелоксикам (Мовалис)* •Лорноксикам (Ксефокам) |
| II. Некислотные производные |
| •Проквазон •Триамид •Буфексамак •Эпиразол •Набуметон (Роданол)* •Флурпроквазон •Флуфизон •Тиноридин ^ Производные анилина •Парацетамол (Ацетаминофен, Парацет, Эффералган, Дафалган, Пацимол, Памол, Тайленол, Калпол и др.) •Фенацетин Производные сульфонанилидов •Целекоксиб (Целебрекс)* •Нимесулид (Найз, Месулид)* |
| III. Комбинированные препараты |
| •Артротек (диклофенак+мизопростол) •Амбене (фенилбутазон+дексаметазон) •Аспифат (аспирин+сукральфат) •Брустан, Ибуклин (ибупрофен + парацетамол) •Новиган (ибупрофен + амид + кетон) •Томапирин (аспирин + парацетамол) •Пердолан (аспирин + парацетамол + кофеин + кодеина фосфат) •Цитрамон П (аспирин + парацетамол + кофеин) •Колдрекс (парацетамол + кофеин + фенилэфрина г/х + вит. С) •Солпадеин (парацетамол + кофеин + кодеина фосфат) •Пливалгин (парацетамол + пропифеназон + кофеин + кодеина фосфат + фенобарбитал) •Андипал (анальгин + фенобарбитал +дибазол + папаверин) •Пенталгин (анальгин + фенобарбитал + кодеина фосфат + парацетамол + дибазол) •Баралгин, Триган, Спазган, Спазмалгин (питофенона г/х + анальгин + фенпивериния бромид) •Триган Д (парацетамол + дицикломина г/х) •Реопирин, Пирабутол (фенилбутазон + аминофеназон) •Цефекон М (амидопирин + парацетамол + салициламид + фенацетин + кофеин) |
* - высокая селективность к ЦОГ-2
^ Механизм действия. Главным элементом механизма действия НПВП является угнетение синтеза флогогенных (провоспалительных) медиаторов - простагландинов. Ферментативный каскад, в результате которого синтезируются простагландины и другие простаноиды, отражен на рис.1.
В процессе альтерации (1-ой стадии воспаления) из клеточной мембраны высвобождаются фосфолипиды, которые под действием фермента фосфорилазы А2 метаболизируются до арахидоновой кислоты. В свою очередь, арахидоновая кислота метаболизируется двумя путями: циклооксигеназным и липооксигеназным.
В процессе альтерации (1-ой стадии воспаления) из клеточной мембраны высвобождаются фосфолипиды, которые под действием фермента фосфорилазы А2 метаболизируются до арахидоновой кислоты. В свою очередь, арахидоновая кислота метаболизируется двумя путями: циклооксигеназным и липооксигеназным.
^ Рис.1. Метаболизм арахидоновой кислоты
| Фосфолипидный слой клеточной мембраны | |||||||
| |  | Фосфолипаза А2 | |||||
| А р а х и д о н о в а я кислота | |||||||
 | ЦОГ |  | ЛОГ | ||||
| ЭНДОПЕРЕКИСИ | Лейкотриены | ||||||
 |  |  | | | |||
| Проста-гландины | Проста-циклины | Тромбоксан | | | |||
В процессе альтерации (1-ой стадии воспаления) из клеточной мембраны высвобождаются фосфолипиды, которые под действием фермента фосфорилазы А2 метаболизируются до арахидоновой кислоты. В свою очередь, арахидоновая кислота метаболизируется двумя путями: циклооксигеназным и липооксигеназным.
В норме направленность вектора ферментативных превращений циклических эндоперекисей зависит от типа клеток, в которых происходит метаболизм арахидоновой кислоты. Так, в тромбоцитах из большей части циклических эндоперекисей образуются тромбоксаны, в клетках сосудистого эндотелия образуется преимущественно простациклин и т.д. и т.п. Эти медиаторы играют в организме важную физиологическую роль: стимулируют выработку защитной слизи (муцина) в желудке, обеспечивая целостность слизистой ЖКТ, регулируют функцию тромбоцитов, сосудистый тонус, почечный кровоток и др.
^ В условиях патологии они:
- являются медиаторами воспалительной реакции (вызывают локальное расширение сосудов, отек, экссудацию и другие эффекты 2-ой стадии воспаления);
- сенсибилизируют рецепторы к медиаторам боли (гистамин, брадикинин) и понижают порог болевой чувствительности;
- повышают чувствительность гипоталамических центров терморегуляции к действию пирогенов, образующихся в организме под влиянием микробов, вирусов, токсинов. Под действием липооксигеназы (ЛОГ) из арахидоновой кислоты образуются лейкотриены, в том числе медленнореагирующая субстанция анафилаксии (МРСА). НПВП подавляют только ЦОГ, поэтому они блокируют развитие только 2-ой стадии воспаления. Они не влияют на активность фосфорилазы А2, т.е. не ослабляют повреждения клеточных мембран (1-ая фаза воспаления), и не блокируют ЛОГ. Кроме того, они не влияют непосредственно на процессы пролиферации и фиброзирования (3-ая фаза воспаления), однако, ослабляя экссудацию, они опосредованно снижают степень пролиферации.· По силе противовоспалительного действия средних доз различные НПВП могут быть расположены в следующей последовательности: индометацин > флурбипрофен > диклофенак натрия > пироксикам > кетопрофен > напроксен > ибупрофен > амидопирин > аспирин.
По анальгезирующему эффекту НПВП располагаются в несколько иной последовательности: диклофенак натрия > индометацин > флурбипрофен > амидопирин > пироксикам > пирпрофен > напроксен > ибупрофен > аспирин > кетопрофен (НПВП не действуют на механорецепторы, а значит не уменьшают боль, связанную с механическими повреждениями).
По периоду полувыведения из организма НПВП можно разделить на “короткоживущие” (аспирин, диклофенак, флурбипрофен, ибупрофен, индометацин, сургам) и “долгоживущие” (напроксен, пироксикам, фенилбутазон, сулиндак). Препараты с большим периодом полувыведения (14 и более часов) назначают 2 раза в день, а некоторые и 1 раз в день. Существуют также “ретардные” формы “короткоживущих” НПВП, например, ибупрофена (Солпафлекс).
Кроме того, НПВП различаются по степени необратимости ингибирования ЦОГ. Выделяют:
1. Препараты (пироксикам, ибупрофен, сулиндак и др.), ингибирующие ЦОГ путем быстрого и обратимого образования комплекса фермент-ингибитор.
2. Препараты (индометацин, фторбипрофен и др.), также быстро образующие обратимый комплекс фермент-ингибитор, но изменяющие конформацию ЦОГ, что приводит к формированию вторичного стабильного комплекса фермент-ингибитор. После удаления НПВП активность фермента восстанавливается медленнее.
3. Аспирин, который необратимо связывается с ЦОГ и вызывает ковалентную модификацию комплекса фермент-ингибитор.
Существует два изофермента ЦОГ: первый изофермент – ЦОГ-1 (конститутивный, существующий в норме) – контролирует выработку простаноидов регулирующих физиологические функции, а второй – ЦОГ-2 (индуцированный) – участвует в синтезе простагландинов при воспалении (рис.2). ЦОГ-2 в норме отсутствует и образуется под действием тканевых факторов, индуцирующих воспалительную реакцию (цитокины и др.).
^ Рис. 2. Эффекты простагландинов в зависимости от блокады ЦОГ-1 или ЦОГ-2
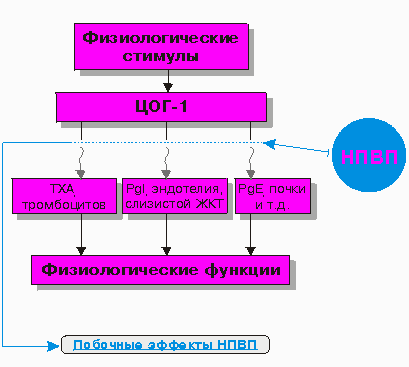
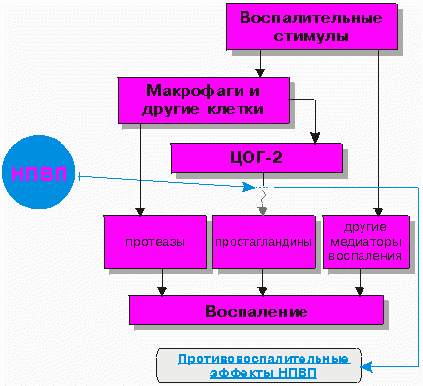
Таким образом можно констатировать, что противовоспалительное действие НПВП обусловлено ингибированием ЦОГ-2, а нежелательные реакции - ингибированием ЦОГ-1. Соотношение активности НПВП в плане блокирования ЦОГ-1 и ЦОГ-2 позволяет судить об их потенциальной токсичности: чем меньше величина коэффициента ЦОГ-1/ЦОГ-2, тем более селективен препарат в отношении ЦОГ-2 и, соответственно, менее токсичен. Это объясняет различия в побочных эффектах различных НПВП.
Так, пироксикам и индометацин имеют большую активность против ЦОГ-1 по сравнению с ЦОГ-2, поэтому они имеют набольшую гастродуоденотоксичность. Напротив, ибупрофен наименее токсичен для ЖКТ и в этом аспекте является “золотым стандартом” для сравнения с другими неселективными НПВП (см. рис.3). Например, у пациентов, принимающих диклофенак и аспирин, вероятность развития гастродуоденопатий соответственно в 2 и 5 раз выше по сравнению с теми, кто принимает ибупрофен. Следует подчеркнуть, что для каждого НПВП относительный риск гастродуоденопатий увеличивается с увеличением дозировки.

^ Рис.3. Частота побочных эффектов НПВП со стороны ЖКТ (%)
Перспективной является разработка нового типа НПВП, обладающих способностью высокоселективно ингибировать ЦОГ-2, т.е. иметь высокую противовоспалительную активность и минимальную токсичность. К таким препаратам относятся нимесулид (Найз) и некоторые другие.
Наибольшее применение НПВП нашли в ревматологии. Эти препараты играют главную роль в патогенетической терапии ревматизма, реактивных артритов и коллагенозов (прежде всего - ЮРА): уменьшается степень артритического синдрома - от снижения воспалительного выпота до профилактики анкилозирования суставов, уменьшается симптоматика серозитов и т.д. Лечение кардитов различной этиологии также не обходится без назначения НПВП: снижается степень экссудативного отека миокарда, восстанавливаются автоматизм и проводимость, повышается чувствительность к кардиотонической терапии.
Однако, в подавляющем большинстве случаев назначения НПВП у детей речь идет о лечении гипертермического синдрома. Патофизиологическим обоснованием этой терапии служит активное вмешательство НПВП в термогенез организма в условиях инфекционного воспаления.
^ Патогенез лихорадки. При воспалительной реакции организма фагоцитирующие клетки крови (нейтрофилы, моноциты) и тканевые макрофаги выделяют интерлейкин-1 (эндогенный пироген); кроме того, доказаны пирогенные свойства эндотоксина Gr-отрицательных возбудителей, обусловленные входящим в их состав липополисахаридом клеточной мембраны. Пирогены достигают преоптической области передней части гипоталамуса и взаимодействует с рецепторами нейронов центра терморегуляции. При этом активизируется циклооксигеназа (ЦОГ), что приводит к повышению внутриклеточного уровня циклического аденозин-3', 5'-монофосфата (цАМФ). Увеличение концентрации цАМФ способствует внутриклеточному накоплению ионов Са, изменению Na/Са-соотношений и перестройке активности центров теплопродукции и теплоотдачи. Это приводит к повышению образования тепловой энергии за счет усиления метаболических процессов и сократительного термогенеза. Одновременно происходит сужение сосудов кожи и подкожной клетчатки, уменьшается скорость периферического сосудистого кровотока, что приводит к снижению теплоотдачи. Устанавливается новый уровень температурного гомеостаза (на более высокой точке), что приводит к повышению температуры тела. Предотвращение активизации церебральных ЦОГ является точкой приложения для НПВП.
^ Клиническая эффективность препарата зависит от вида и особенностей течения заболевания у конкретного больного и его индивидуальной реакции. Индивидуальный подбор НПВП подразумевает оценку функции почек, печени, состояния желудочно-кишечного тракта, наличие сопутствующих заболеваний, которые могут явиться относительным или абсолютным противопоказанием для назначения того или иного НПВП (наличие сосудистых гипертензивных реакций, обструктивной патологии респираторного тракта, аллергии и непереносимости лекарственных веществ).
^ Побочные эффекты.
Поражения желудочно-кишечного тракта относятся к наиболее частым и опасным побочным эффектам НПВП. Они могут проявляться диспепсией (тошнотой, рвотой, эвакуаторными расстройствами), эрозиями желудка, пептическими язвами и желудочно-кишечным кровотечением. НПВП-ассоциированные гастродуоденопатии заметно осложняют противовоспалительную терапию и даже могут угрожать жизни. Наиболее опасны в плане повреждения ЖКТ кетопрофен, индометацин и пироксикам. Повреждение желудка отчасти связано с собственной кислотностью НПВП, которая в сочетании с выраженной кислотностью содержимого желудка приводит к нарушению проницаемости клеток слизистой оболочки и становится непосредственной причиной изъязвления. Это объясняет, почему “обычная” таблетка аспирина токсичнее, чем “быстрорасворимая шипучая” форма. Однако, снижение дозы, переход на парентеральный или ректальный путь введения, использование препаратов в энтеросолюбельной оболочке, защищающей слизистую ЖКТ, слабо влияют на вероятность развития НПВП-гастродуоденопатии, т.к. это не столько местная, сколько системная реакция организма, и НПВП может действовать на слизистую ЖКТ опосредованно (через кровь).
НПВП следует назначать после еды и начинать с наименьшей дозы. После приема препарата в течение 15 мин желательно не ложиться в целях профилактики эзофагита. Нежелателен одновременный прием двух и более НПВП.
^ Факторами риска развития НПВП-гастродуоденопатии являются тяжелые стрессовые ситуации, пептическая язва в анамнезе, кровотечение или перфорация ЖКТ в анамнезе, кишечная инфекция, применение глюкокортикоидов, антикоагулянтов и др. Таким пациентам необходим тщательный клинический контроль. При подозрении на язву (болевой синдром, диспептические явления, кровотечение, анемия) показана ФГДС; выявление эрозивно-язвенных поражений верхнего отдела ЖКТ требует назначения гипосекреторных препаратов (Н2-гистамино-блокаторы, ингибиторы Н+-К+-АТФ-азы) на 4-6, а иногда и более недель.
Нефротоксичность и нарушения ауторегуляции почечного кровотока являются второй по значимости группой нежелательных реакций НПВП, которые проявляются в виде задержки воды, гипернатриемии, роста уровня креатинина в сыворотке крови, повышения артериального давления. НПВП могут вызывать интерстициальный нефрит. Факторами риска развития почечных осложнений являются предшествующая почечная патология, цирроз печени, длительный прием НПВП, прием диуретиков и нефротоксичных антибиотиков. Наиболее токсичны фенилбутазон и индометацин (последний в связи с нефротоксичностью был исключен из схемы лечения нефротического синдрома).
^ Геморрагический синдром может отмечаться при назначении многих НПВП, но наибольшее влияние на гемостаз имеет аспирин - наряду с антиагрегантным эффектом он обладает антикоагулянтным действием (конкурирует с К-зависимыми факторами свертывания крови - II, VII, IX и X). Клиническое значение это имеет для пациентов с тромбоцитопенией (болезнь Верльгофа, СКВ, апластическая анемия, миелодепрессия) или получающих цефалоспорины III поколения (клафоран, роцефин, цефобид и др.), карбокси- и уреидопенициллины (карбенициллин, тикарциллин, пиперациллин, азлоциллин), прямые и непрямые антикоагулянты. Токсичность последних повышается еще и потому, что НПВП вытесняют их из связи с альбумином.
Важно отметить, что назначение НПВП беременным приводит к пролонгации беременности и замедлению процесса родов. Этот эффект обусловлен тем, что простагландины повышают тонус миометрия, а НПВП блокируют этот механизм. Кстати, снижение тонуса миометрия объясняет лечебный эффект НПВП при болезненных менструациях.
Блокада синтеза простагландинов на уровне Ботталова протока способствует его облитерации и разобщению большого и малого кругов кровообращения. Этот эффект, применяемый при лечении ОАП (лево-правый шунт), может быть вреден при синдроме персистирующей фетальной циркуляции (право-левый шунт), когда закрытие Ботталова протока вызывает декомпенсацию легочной гипертензии (в этом случае, наоборот, вводят Pg E1). Нужно также помнить о том, что индометацин наиболее эффективен при рано начатом лечении (в среднем до 10 дней), у детей с массой тела при рождении >1000 г, при в/в введении, при 3-кратном введении.
Противопоказаны НПВП при язвенно-эрозивных поражениях ЖКТ, нарушениях функции почек и печени, тромбоцитопениях(-патиях). Осторожность требуется при применении НПВП у больных бронхиальной астмой (у них возможно развитие синдрома Видаля - “аспириновой триады”, включающей астму, непереносимость НПВП и рецидивирующий полипоз полости носа и придаточных пазух), артериальной гипертензией и сердечной недостаточностью (из-за снижения диуреза и блокады вазодилатирующего эффекта простагландинов).
Остановимся на характеристике отдельных НПВП, наиболее популярных в педиатрической практике.
Нимесулид (Найз, Месулид, Нимулид) является принципиально новым сульфонанилидным НПВП. Препарат селективно ингибирует ЦОГ-2 с индексом селективности против ЦОГ-1 > 1000. Это означает, что нимесулид является наиболее селективным ингибитором ЦОГ-2 из имеющихся в настоящее время, при этом он не менее эффективен, чем другие НПВП, но обладает лучшей переносимостью, особенно в плане гастротоксичности.
Противовоспалительный эффект нимесулида не исчерпывается угнетением ЦОГ-2. Многие костносуставные заболевания являются результатом прогрессирующего изъязвления суставного хряща в результате трех независимых, но тесно связанных процессов:
1) энзиматической деградации;
2) уменьшения синтеза компонентов матрикса;
3) пагубного эффекта свободных кислородных радикалов и других оксидантов.
Двумя основными компонентами хрящевого матрикса являются протеогликаны и коллаген. У больных с артритом наблюдается прогрессирующее истощение протеогликанов и модификация структуры (уменьшение содержания гиалуроновой кислоты), а также нарушение гидратации и структуры коллагена II типа; это обусловлено действием двух ферментов-металлопротеиназ - стромелизина (протеогликаназы) и коллагеназы. Активность этих ферментов контролируется тканевыми ингибиторами металлопротеиназ. Свободные кислородные радикалы и другие оксиданты (окись азота, хлорамины, соляная кислота), образующиеся в нейтрофилах при воздействии миелопероксидазы, не только непосредственно повреждают ткани, но и инактивируют ингибиторы протеаз. Например, a1-антитрипсин - специфический ингибитор эластазы нейтрофилов и других полиморфонуклеарных лейкоцитов; его дефицит (вследствие инактивации) приводит к перевариванию соединительнотканного матрикса.
Нимесулид, повышая уровень цАМФ в результате угнетения фосфодиэстеразы IV типа, ослабляет "инактивирующее" действие оксидантов на ингибиторы протеаз, т.е. обладает косвенным антипротеазным эффектом по отношению к эластазе нейтрофилов, коллагеназе хрящевой ткани и стромелизину. Следовательно, препарат играет важную превентивную роль, препятствуя деградации хрящевого матрикса.
Суммация всех этих факторов: селективного угнетения ЦОГ-2, угнетения фосфодиэстеразы IV типа, удаления свободных оксидантов, предупреждения повышенной активности коллагеназы и эластазы, позволяет заключить, что нимесулид является активным противовоспалительным препаратом, действие которого опосредуется различными механизмами. Наряду с высокой активностью препарата важно подчеркнуть, что он характеризуется хорошей переносимостью, при этом частота возникновения побочных эффектов уменьшается (!) при увеличении продолжительности лечения. Этот аспект представляется весьма важным при длительном лечении артритов разной этиологии.
Важно отметить, что эластаза нейтрофилов считается наиболее мощным протеолитическим ферментом, способным переваривать основные компоненты соединительнотканного матрикса при длительном воспалении дыхательных путей. Это означает, что нимесулид может играть определенную роль в устранении дисбаланса эластазы/антиэластазы при хронических неспецифических воспалительных заболеваниях легких.
Кеторолак (Кеторол, Кетанов) в настоящее время является единственным НПВП, обладающим анальгетическим эффектом на уровне опиоидных наркотических препаратов. Поэтому кеторолак может рассматриваться как альтернатива наркотикам в хирургической и анестезиологической практике, особенно в случаях угрозы формирования наркотической зависимости, депрессии дыхания и в тех ситуациях, когда боль обусловлена воспалительным отеком (например, послеоперационные боли). Токсичность этого препарата реализуется по прошествии нескольких дней, поэтому его не надо применять более недели (что, как правило, совпадает со сроками купирования воспалительного фона).
Анальгин (метамизол натрия) обладает выраженной способностью угнетать гранулоцитопоэз вплоть до фатального агранулоцитоза (эта особенность характерна для всех пиразолонов, в т.ч. амидопирина, бутадиона). В связи с этим, необходимо избегать назначения анальгина детям с иммунодефицитными состояниями (тяжелые инфекции, апластические анемии, миелодепрессия у онкогематологических больных, состояния после тяжелых полостных операций и т.д.). Миелотоксичность стала причиной исключения анальгина и содержащих его комбинированных препаратов (баралгин и т.д.) из фармакопеи ряда западных стран (США, ФРГ и др.). Очевидно, что в ближайшие годы анальгин будет вытеснен и с нашего фармацевтического рынка более эффективными и безопасными НПВП. То же можно сказать и про амидопирин (входит в состав Цефекона), который также может спровоцировать судороги (снижает порог судорожной готовности).
Ибупрофен. Уже отмечалось, что среди неселективных НПВП он является наименее токсичным препаратом. Ибупрофен обладает выраженным обезболивающим и жаропонижающим эффектом; противовоспалительная активность его (в средних дозах) уступает диклофенаку и клинический эффект (например, в ревматологической практике) прослеживается только при длительном приеме (медленное накопление в суставной щели). Тем не менее, противовоспалительная активность ибупрофена играет важное значение при инфекционно-воспалительных заболеваниях ЛОР-органов (стенозирующий ларингит, катаральный отит, гайморит и др.), когда наряду с гипертермическим синдромом педиатру нужно бороться с воспалением. В этом аспекте ибупрофен обладает определенным преимуществом перед парацетамолом, не имеющим противовоспалительного действия. Кроме того, влияя на выработку пирогенов в воспаленных тканях, он снижает “нагрузку” на термочувствительные зоны в гипоталамусе - это объясняет, почему жаропонижающий эффект ибупрофена длится дольше, чем у парацетамола. Ибупрофен в виде сиропа (Нурофен, Бруфен, Ибуфен) - назначается per os в разовой дозе 5 мг/кг - при среднетяжелой лихорадке, 10 мг/кг - при тяжелой гипертермии.
На примере нимесулида и ибупрофена важно затронуть проблему о целесообразности более широкого применения пероральных форм (сиропов и т.п.) для лечения гипертермического синдрома у детей раннего возраста (у более старших детей эффективны и таблетированные препараты). Нельзя без особой необходимости сразу же прибегать к инъекционному пути введения НПВП (ортофену, анальгину и др.)! Правильное применение пероральных форм НПВП (ибупрофен, нимесулид) столь же эффективно, как и инъекций, но несравнимо по безопасности. Речь идет не только о риске постинъекционных осложнений: ребенок воспринимает “уколы” как наказание за то, что “он болеет”.
Следует подчеркнуть преимущества НПВП в виде суспензии (по сравнению с твердой формой):
1) удобство дозирования специальным колпачком или шприцом (без иглы) - не надо дробить и размельчать таблетку;
2) приятные органолептические свойства не вызывают негативной реакции на лечение, что особенно важно для детей раннего возраста;
3) более быстрое и полное всасывание, особенно на “голодный желудок”, означает быстрый жаропонижающий эффект.
Парацетамол (ацетаминофен). Строго говоря, парацетамол не является НПВП, т.к. у него нет противовоспалительного действия: он блокирует только церебральные ЦОГ (“центральный” болеутоляющий и жаропонижающий эффект) и не оказывает действия на синтез простагландинов в воспаленных тканях. Однако, учитывая определенную степень “родства” парацетамола с НПВП, остановимся на некоторых особенностях этого препарата. После приема внутрь парацетамол (лучше - сироп) быстро всасывается в тонком кишечнике (эффект в дозе 10-15 мг/кг массы наступает через 30 минут и продолжается в течение 2-4 часов), из ректальных свечей усваивается только 70-80% парацетамола.
Не желая умалить достоинства парацетамола как стартового антипиретика, следует отметить следующее. Среди населения сложилось мнение (во многом - благодаря рекламе), что парацетамол - безопасный препарат. В то же время, особенности фармакокинетики и токсикология парацетамола характеризуют его как препарат с довольно узким "коридором безопасности". Метаболиты парацетамола, образующиеся при глюкоронизации в печени, оказывают токсическое действие на гепатоциты (вплоть до центролобулярных некрозов печени) и почечные канальцы, но в нормальных условиях при приеме терапевтических доз эти метаболиты инактивируются за счет связывания с глютатионом. Гепатотоксичность возрастает при передозировке (многократное бесконтрольное назначение препарата матерью) или при совместном применении лекарств - индукторов цитохрома Р450 (барбитураты, рифампицин и другие противотуберкулезные препараты, гризеофульвин и т.д.). Поэтому, следует избегать назначения парацетамола детям, больным туберкулезом, эпилепсией или микозами и получающим вышеназванные препараты. Следует также помнить, что парацетамол входит в состав многих комбинированных препаратов (брустан, ибуклин, пердолан, цитрамон П, триган Д и т.д.).
Отметим, что у детей раннего возраста процессы сульфонизации (в результате чего образуются нетоксичные метаболиты парацетамола) превалируют над глюкоронизацией.
В случае отравления парацетамолом немедленно назначают внутрь ацетилцистеин (АЦЦ и т.п.) - антидот токсичных метаболитов парацетамола.
Аспирин (ацетилсалициловая кислота) - "ветеран" среди НПВП (еще в 1763 г. было сделано первое научное сообщение о жаропонижающем действии препарата, полученного из ивовой коры, затем был выделен салицин и синтезированы его аналоги - салицилат натрия и ацетилсалициловая кислота), поэтому его фармакокинетика наиболее изучена. Ранее уже говорилось о том, что “растворимые” формы оказывают несколько меньшее гастротоксическое действие, чем таблетированные. Упоминался также его антикоагулянтный эффект (конкуренция с К-зависимыми факторами свертывания крови). На примере аспирина уместно объяснить антиагрегантное действие НПВП. Этот эффект представляет скорее побочное действие нестероидной терпии и редко используется у детей в лечебных целях (так, для снижения риска повторных тромбозов назначается инъекционная форма ацетилсалициловой кислоты - аспизол, ацелизин). Снижение адгезивно-агрегационных свойств тромбоцитов обусловлено угнетением в них синтеза тромбоксана А2. Не имея ядра (“генетической памяти” о ферментах), тромбоциты не могут выработать новую ЦОГ и синтезировать новый тромбоксан, поэтому снижение их агрегации является необратимым (насколько необратимо ингибирование ЦОГ аспирином) и сохраняется на весь период их жизни (несколько дней). Этим объясняется эффект "малых" доз аспирина: они угнетают функцию тромбоцитов, но практически не влияют на синтез в клетках эндотелия простациклина - вещества, “отталкивающего” тромбоциты и снижающего их адгезию на стенке сосудов.
Важно подчеркнуть, что применение аспирина с противовоспалительной целью оправдано только у старших детей без высокого риска развития НПВП-ассоциированных гастродуоденопатий при невысокой активности воспалительного процесса (например, при ревматизме). При длительном назначении ацетилсалициловой кислоты снижается синтез протеогликана хондроцитами суставного хряща.
Применение аспирина с жаропонижающей целью у детей дошкольного возраста при гриппе, ветряной оспе и др. омрачено угрозой синдрома Рея: возникновения системной жировой дегенерации органов, блока в цикле мочевины, развития гипераммониемии и накопления в крови других токсичных соединений, которые обусловливают клинику острой печеночной знцефалопатии (летальность вследствие отека мозга достигает 40-60%).
Согласно рекомендациям специалистов ВОЗ ацетилсалициловая кислота не должна использоваться как анальгетик-антипиретик у детей в возрасте до 12 лет (WHO, 1993). Польза от ограничения применения аспирина у детей наглядна на примере США: если до ограничения (в 1980 г.) было зарегистрировано 555 случаев данного заболевания, то уже в 1987 г. - только 36, а в 1997 г. - всего 2 случая синдрома Рея. В отечественном Федеральном руководстве для врачей по использованию лекарственных средств (Формулярная система, МЗ РФ, 2000) указано, что применение ацетилсалициловой кислоты противопоказано детям в возрасте до 12 лет, а использование анальгина возможно только при интенсивной терапии.
В связи с вышеизложенным хочется остановится на некоторых рекомендациях по лечению лихорадки инфекционно - воспалительного генеза. Понимая, что повышение температуры тела в ответ на инфекцию является эволюционно-апробированным защитно-приспособительным механизмом организма человека, не следует бороться (особенно с помощью фармакотерапии) с любой инфекционной лихорадкой. Повышение температуры в среднем до 38,5 - 39С, клинически проявляющееся как “розовая лихорадка”, при хорошей переносимости ее ребенком и спокойном преморбидном фоне, не требует назначения НПВП (важно помнить об адекватной гидратации и этиотропной терапии). Бороться с лихорадкой начинают при т.н. “бледной гипертермии”, а также у детей, входящих в группу риска по развитию осложнений при лихорадочных реакциях; это дети:
- в возрасте до 2 мес жизни с температурой выше 38°С;
- с фебрильными судорогами в анамнезе;
- с заболеваниями ЦНС;
- с хронической патологией органов кровообращения;
- с наследственными метаболическими заболеваниями.
Начинать лечение гипертермического синдрома следует с пероральных НПВП (в виде таблеток, сиропов или суспензий). При невысокой лихорадке препаратом выбора является парацетамол. При гектической гипертермии сразу прибегают к более сильным НПВП (нимесулид, ибупрофен). Суппозитории (ректальные свечи) рассматриваются как альтернатива пероральному приему, но препараты в прямой кишке всасываются медленно и неполностью. При невозможности приема per оs (тошнота, рвота) или для неотложной терапии (фебрильные судороги и др.) НПВП назначают парентерально (ортофен в/м, анальгин в/в или в/м). При необходимости одновременно проводят охлаждение физическими методами (обдувание вентилятором, растирание кожи полуспиртовым раствором, лед на магистральные сосуды) и адекватную гидратацию (частое теплое питье предотвращает обезвоживание при обильном потении ребенка и тахипноэ).
При лечении лихорадки недопустимо курсовое применение антипиретиков без серьезного поиска ее причин. При этом возрастает опасность диагностических ошибок, риск пропустить под “маской ОРЗ” симптомы серьезных бактериальных инфекций (пневмония, менинит, пиелонефрит, аппендицит и др.). Кроме того, если ребенок получает антибактериальную терапию, “курсовой” прием жаропонижающих мешает оценке адекватности антибиотикотерапии, т.к. одним из критериев эффективности антимикробных средств является снижение температуры тела. Применение НПВП при «невоспалительных лихорадках» следует признать необоснованным и недопустимым (нет “точки приложения” - ЦОГ).
^ Комбинации НПВП (см. классификацию).
Привлекают внимание следующие комбинации НПВП:
- с глюкокортикоидными (стероидными) противовоспалительными средствами (СПВС). Такая комбинация обусловлена потенциированием противовоспалительного эффекта, необходимого при тяжелых воспалительных заболеваниях (объектом лечения становятся все 3 фазы воспаления). Однако, потенциируются и токсические эффекты, в частности - гастродуоденотоксичность;
- с другими НПВП. Такие комбинации применяются с анальгетической и жаропонижающей целью, т.е. - эпизодически. Для длительного противовоспалительного лечения такие препараты не подходят (потенциируется их гастродуоденотоксичность), предпочтение отдается эффективному монопрепарату (например, нимесулиду, диклофенаку);
- с кофеином, кодеином, фенобарбиталом (усиливается анальгетичекий эффект), с псевдоэфедрином и т.п. (симптоматическое лечение ОРВИ), со спазмолитиками и холиноблокаторами (например, баралгин, новиган и т.п. применяют для купирования болевого синдрома, обусловленного не только воспалением, но и спазмами гладкой мускулатуры);
- с экзогенными простагландинами (мизопростол в препарате “Артротек” снижает гастротоксичность диклофенака) и гастропротекторами (сукральфат снижает гастротоксичность и, отчасти, активность аспирина и др. НПВП);
- с парацетамолом. Последний, не являясь противовоспалительным препаратом, потенциирует обезболивающий и жаропонижающий эффект НПВП. При соответствующих показаниях это позволяет уменьшить разовую дозировку НПВП. Кроме того, парацетамол снижает гастротоксичность аспирина (томапирин), ибупрофена (ибуклин, брустан) и, возможно, других НПВП (убедительных объяснений этого феномена пока нет).
^ Лекарственное взаимодействие. При одновременном применении с непрямыми антикоагулянтами, метотрексатом, дигоксином НПВП способствуют повышению их токсичности (конкурентное вытеснение из связи с альбумином, увеличение концентрации активного препарата). При одновременном применении с глюкокортикоидами повышается риск развития побочных действий со стороны ЖКТ. НПВП ослабляют действие диуретиков (поэтому при необходимости лазикс вводится до НПВП) и гипотензивных препаратов (разнонаправленное действие). Антациды и гипосекреторные препараты несколько снижают абсорбцию пероральных НПВП.
Необходимо помнить, что многие эффекты взаимодействия (потенцирование, ослабление) обусловлены тем, что в комбинированных формах, наряду с НПВП, содержаться другие активные препараты (фенобарбитал, опиоиды, хинин, ганглиоблокаторы, М-холиноблокаторы, -адреномиметики, Н1-гистаминоблокаторы, кофеин и т.д.) и спектр таких препаратов (по принципу “несколько эффектов в одной таблетке”) растет из года в год.
ГЛЮКОКОРТИКОИДЫ
Глюкокортикоиды (ГК) являются стероидными гормонами, которые вырабатываются в коре надпочечников. Данный термин относится также к полусинтетическим препаратам, таким как преднизолон, дексаметазон и другие, которые представляют собой производные гидрокортизона, наиболее активного природного ГК.
В коре надпочечников синтезируются два ГК: кортизон и гидрокортизон (кортизол). Кортизон - биологически неактивное соединение, которое в печени превращается в гидрокортизон. Оба природных ГК обладают минералокортикоидной активностью, но более слабой, чем истинные минералокортикоиды.
Контроль над продукцией ГК осуществляет гипоталамо-гипофизарно-надпочечниковая система. Ключевым органом в регуляции синтеза ГК является гипоталамус, который реагирует на два стимула: уровень гидрокортизона в плазме крови и стресс. При низком уровне ГК крови или стрессовом воздействии (травма, инфекция, физическое напряжение и другие) гипоталамус вырабатывает кортикотропин-рилизинг-фактор (кортиколиберин), который стимулирует выброс адренокортикотропный гормон (АКТГ) из гипофиза. Под действием АКТГ в надпочечниках синтезируются ГК и минералокортикоиды. При избытке ГК в крови гипоталамус прекращает продуцировать кортикотропин-рилизинг-фактор. Таким образом, гипоталамо-гипофизарно-надпочечниковая система функционирует по механизму отрицательной обратной связи. У детей суточная выработка гидрокортизона составляет около 12 мг/м2 поверхности тела.
Выход ГК из надпочечников в кровь в течение суток происходит не равномерно, а в виде 8-12 импульсов, которые подчиняются циркадному ритму. Особенностью циркадного ритма ГК является то, что максимальная секреция гидрокортизона происходит в ранние утренние часы (6-8 часов) с резким ее снижением в вечерние и ночные часы.
Фармакодинамика.
Механизм действия. После прохождения через мембрану клетки ГК в цитоплазме связываются со специфическим стероидным рецептором. Активированный комплекс "ГК-рецептор" проникает в ядро клетки, соединяется с ДНК и стимулирует образование информационной РНК. В результате трансляции РНК на рибосомах синтезируются различные регуляторные белки. Одним из важнейших является липокортин, который ингибирует фермент фосфолипазу-А2 и, тем самым, подавляет синтез простагландинов и лейкотриенов, играющих ключевую роль в развитии воспалительной реакции. Следует, однако, учитывать, что до конца механизм действия ГК не раскрыт.
^
Основные эффекты
Водно-электролитный обмен: Замедление выделения из организма натрия и воды за счет увеличения реабсорбции в дистальном отделе почечных канальцев. Усиление выведения калия. Эти минералокортикоидные эффекты в большей степени присущи природным ГК (кортизону и гидрокортизону), в меньшей – полусинтетическим (преднизону, преднизолону, метилпреднизолону). У фторированных препаратов – триамцинолона, дексаметазона и бетаметазона – минералокортикоидная активность отсутствует. ГК угнетают всасывание кальция в кишечнике, способствуют выходу кальция из костной ткани и усиливают его почечную экскрецию. В результате могут развиваться гипокальциемия и гиперкальциурия.
^ Углеводный обмен: Стимуляция глюконеогенеза в печени, уменьшение проницаемости мембран для глюкозы, гипергликемия, глюкозурия вплоть до развития стероидного диабета. Таким образом, ГК являются контринсулярными гормонами.
^ Белковый обмен: Угнетение синтеза белка, усиление процессов катаболизма, особенно в коже, в мышечной и костной тканях. Это проявляется похуданием, мышечной слабостью, атрофией кожи и мышц, стриями, кровоизлияниями, замедлением заживления ран. Как следствие распада белкового матрикса костей и гипокальциемии развивается остеопороз.
^ Жировой обмен: Перераспределение подкожной жировой клетчатки по кушингоидному типу вследствие того, что в тканях конечностей преобладает липолиз, а в тканях груди, шеи, лица, плечевого пояса - липогенез.
^ Противовоспалительное действие: ГК угнетают все фазы воспаления, независимо от вызвавшей его причины. В их противовоспалительном действии играют роль многие факторы. Одним из ведущих является ингибирование фосфолипазы-А2 и связанное с этим нарушение образования простагландинов и лейкотриенов. ГК стабилизируют клеточные мембраны, мембраны лизосом, уменьшают проницаемость капилляров, тормозят миграцию нейтрофилов и макрофагов в очаг воспаления и их фагоцитарную активность, угнетают пролиферацию фибробластов и синтез коллагена.
^ Иммуномодулирующее и противоаллергическое действие: ГК угнетают пролиферацию лимфоидной ткани и клеточный иммунитет, что лежит в основе их применения при пересадке органов и тканей. ГК тормозят образование и нарушают кинетику Т-лимфоцитов (в большей степени Т-хелперов, чем Т-супрессоров), снижают их цитотоксическую активность. В-лимфоциты более устойчивы к действию ГК, но введение высоких доз метилпреднизолона ведет к снижению концентрации иммуноглобулинов, что связано с первоначальным усилением их катаболизма и последующим торможением синтеза. В то же время, у больных с иммунодефицитом ГК снижают супрессорную активность лимфоцитов, восстанавливая тем самым уровень иммуноглобулинов. ГК препятствуют взаимодействию иммуноглобулинов с тучными клетками, макрофагами, ингибируя высвобождение из них биологически активных веществ.
В последние годы выявлена способность ГК влиять на систему цитокинов, синтез которых моноцитами и макрофагами имеет большое значение для иммунорегуляции и развития воспаления. ГК подавляют выработку так называемых "провоспалительных" цитокинов (интерлейкины 1, 6 и 8, фактор некроза опухолей), которые участвуют в механизмах иммунного ответа, влияя, в частности, на Т-клеточное распознавание антигенов. Этим цитокинам отводят большую роль в патогенезе ревматических заболеваний, бактериального менингита.
^ Сердечно-сосудистая система: ГК повышают чувствительность адренорецепторов к катехоламинам, усиливают прессорное действие ангиотензина-II. Они уменьшают проницаемость капилляров, поддерживают нормальный тонус артериол, сократимость миокарда. Недостаточность коры надпочечников характеризуется низким сердечным выбросом, расширением артериол, слабой реакцией на адреналин. В сочетании с гиповолемией, вызванной дефицитом минералокортикоидов, эти изменения могут вести к сосудистому коллапсу.
Кровь: ГК вызывают лимфоцитопению, моноцитопению и эозинопению. В то же время, они стимулируют образование эритроцитов и тромбоцитов. При интерпретации анализа крови следует учитывать, что после приема даже одной дозы ГК отмечается снижение уровня лимфоцитов, моноцитов, эозинофилов, базофилов с одновременным развитием нейтрофильного лейкоцитоза и, возможно, небольшим сдвигом формулы влево. Число нейтрофилов в среднем повышается на 4000/мм3 (1700-7500/мм3). Максимум изменений в крови отмечается через 4-6 часов, восстановление исходного состояния - через 24 часа. После завершения длительного курса ГК - терапии изменения картины крови сохраняются на протяжении 1-4 недель.
^ Эндокринная система: Отмечается угнетение гипоталамо-гипофизарно-надпочечниковой системы, обусловленное механизмом отрицательной обратной связи. Оно более выражено при длительном применении ГК и/или использовании препаратов, обладающих продолжительным действием. Кроме того, ГК вызывают снижение выработки половых гормонов, которое является результатом прямого ингибирования их синтеза и уменьшения продукции лютеинизирующего гормона гипофиза. Уменьшение уровня половых гормонов рассматривается как один из факторов развития ГК - остеопороза.
