Л. В. Щербакова практикум по аналитической химии барнаул 2004 министерство образования российской федерации алтайский государственный университет химический факультет практикум
| Вид материала | Практикум |
- Практикум Владивосток 2004 Министерство образования и науки Российской Федерации Владивостокский, 628.95kb.
- Практикум Ярославль, 2004 Министерство образования и науки РФ ярославский государственный, 885.94kb.
- Министерство Образования Российской Федерации Московский Государственный Университете, 1997.23kb.
- А. М. Горького Кафедра алгебры и дискретной математики Щербакова В. А. Лабораторный, 418.72kb.
- Анализ воды, 505.46kb.
- Российской Федерации Министерство образования и науки Российской Федерации Государственный, 343.55kb.
- Учебно-практическое пособие Хабаровск, 2001. Министерство образования Российской Федерации, 2795.36kb.
- Практикум ростов-на-Дону 2008 министерство образования и науки российской федерации, 1352.33kb.
- Учебное пособие Министерство общего и профессионального образования Российской Федерации, 936.13kb.
- Российской Федерации Уральский Государственный Университет им. А. М. Горького Философский, 1670.87kb.
А
l1=440 нм
3
l1=440 нм
2

С,Мn в 50 мл
CСr в 50 мл
Рис 2 Зависимость оптической плотности от концентрации Cr в растворе при 440 нм
Рис 1 Зависимость оптической плотности от концентрации Mn в растворе при 540 и 44 и 440 нм
Лабораторная работа №5
Определение содержания сульфат-ионов турбидиметрическим методом
Цель работы: изучение турбидиметрического метода анализа и его применение для определения веществ.
Задание. Определить содержание сульфат-ионов в растворе. Провести статистическую обработку и обсуждение результатов.
Теоретическое введение. Теоретические основы, метрологические характеристики турбидиметрического метода анализа. – См. учебную литературу и лекции.
Обоснование методики. Для определения сульфат-иона применяют метод градуировочного графика. Используют реакцию образования сульфата бария. В качестве стандартного раствора обычно применяют разбавленный раствор серной кислоты, концентрация которого точно известна. Сульфат бария осаждают в сернокислой среде на холоду в присутствии желатина как стабилизатора.
Экспериментальная часть
Аппаратура.
Колориметр фотоэлектрический концентрационный КФК-2.
Приборы и реактивы:
Мерные колбы вместимостью 50, 200 мл;
- Пипетки градуированные вместимостью 5, 10 мл;
- Желатин, 0,5 % раствор, свежеприготовленный;
- Хлорид бария, насыщенный раствор;
- Серная кислота, 0,050 М(1/2 Н2SO4) раствор.
-
Выполнение работы.
В колбу вместимостью 200 мл помещают 5,0 мл 0,050 М раствора серной кислоты, разбавляют до метки дистиллированной водой и перемешивают. Такой раствор содержит 0,060 мг SO42- в 1 мл. Этот раствор служит исходным для приготовления стандартных растворов при построении градуировочного графика.
В мерную колбу вместимостью 50 мл помещают 1,0 мл BaCl2, разбавляют водой и прибавляют 1,5 мл желатина. Перемешивая, вводят определенное количество титрованного раствора серной кислоты, быстро разбавляют дистиллированной водой до метки и содержимое колбы тщательно перемешивают. Через 3 – 5 мин раствор переносят в кювету с толщиной поглощающего слоя 3 см и проводят измерения пропускания (Т,%) не менее 3-х раз при длине волны l=540 нм. Из полученных берут среднее значение.
Аналогично готовят серию стандартных растворов (6 – 8), содержащих 0,060 - 0,60 мг SO42- в 50 мл и измеряют рассеяние света. По полученным данным строят градуировочный график в координатах: пропускание – концентрация сульфат–иона, мг в 50 мл раствора. При работе с анализируемым раствором порядок сливания реактивов сохраняют таким же, каким он был при приготовлении стандартных растворов. Полученный раствор фотометрируют и по градуировочному графику определяют концентрацию SO42- (мг) в исследуемом растворе. Измерения повторяют три раза, проводят статистическую обработку и обсуждение результатов.
Лабораторная работа №6
Определение содержания калия и натрия при совместном присутствии методом фотометрии пламени
Цель работы: изучение метода фотометрии пламени и его применение для количественных определений.
Задание. Определить калий и натрий при совместном присутствии методом градуировочного графика. Провести статистическую обработку и обсуждение результатов.
Теоретическое введение. Теоретические основы, классификация, метрологические характеристики методов атомной спектроскопии. – См. учебную литературу и лекции.
Обоснование методики. Для определения калия и натрия при совместном присутствии предпочтителен метод фотометрии пламени. Спектральные линии натрия и калия, возбуждаемые в пламени, достаточно удалены друг от друга и легко разделяются при помощи светофильтров или монохроматора. При определении натрия используют резонансные линии дублета 589,0 и 589,9 нм, при определении калия – 766,5 и 769,9 нм. В качестве меры селективности при определении одного элемента в присутствии другого используют «фактор специфичности», который показывает, при каком соотношении концентраций мешающего элемента С2 и определяемого элемента С1 сигнал от мешающего элемента будет равен сигналу от определяемого элемента: F = С2/С1. Для пламенных фотометров с интерференционными светофильтрами «фактор специфичности» составляет при определении натрия в присутствии калия 2·102 – 7.8·103 , при определении калия в присутствии натрия – 5 102 .
По серии стандартных растворов известной концентрации для каждого иона в отдельности строят градуировочные прямые, выражающие зависимость интенсивности излучения (измеренную в делениях шкалы по отклонению стрелки гальванометра) от концентрации иона в растворе (см. рис.). Измеряют интенсивности излучения атомов этих элементов в исследуемом растворе и по градуировочным графикам вычисляют их концентрации. Для этого на оси концентраций определяют точку, отвечающую найденному значению интенсивности излучения. Исследуемый раствор анализируют при тех же условиях, при которых строился градуировочный график. Использование градуировочных прямых, полученных при другом режиме работы фотометра, приводит к большим ошибкам.
 Натрий определяют при длине волны 584 нм, калий - 763 нм.
Натрий определяют при длине волны 584 нм, калий - 763 нм.Деление шкалы прибора
1
2
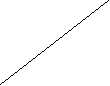
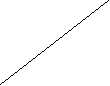


СNa,мкг/мл
СК, мкг/мл
Сх
Сх
Градуировочные графики
Экспериментальная часть
Аппаратура.
Пламенный фотометр.
Приборы и реактивы:
Мерные колбы вместимостью 100 мл – 6 шт;
- Фарфоровые чашки (или стаканы).
- Градуированные пипетки вместимостью 1 мл и 10 мл.
- Промывалка с бидистиллированной водой.
- Хлорид натрия, 5,0·10-3 М раствор.
- Хлорид калия, 5,0·10-3 М раствор.
Выполнение работы.
Анализируемый раствор, содержащий 0,4 – 0,5 мг натрия, 4 – 5 мг калия помещают в мерную колбу, разбавляют бидистиллированной водой до метки и тщательно перемешивают. В мерных колбах готовят стандартные растворы, содержащие от 2 до 8 мкг/мл натрия и от 2 до 20 мкг/мл калия. Фотометрируют стандартные растворы натрия и сразу же после этого определяют содержание натрия в исследуемом растворе. Аналогично фотометрируют растворы, содержащие ионы калия.
Проводят статистическую обработку и обсуждение результатов.
Лабораторная работа №7
Определение содержания родамина 6Ж люминесцентным методом
Цель работы. Изучение люминесцентного метода анализа и его применение для определения веществ.
Задание. Определить содержание родамина 6Ж в растворе. Провести статистическую обработку и обсуждение результатов.
Теоретическое введение. Явление люминесценции, применение люминесценции в аналитической химии. Теоретические основы классификация и метрологические характеристики люминесцентного анализа. – См. учебную литературу и лекции.
Обоснование методики. Родаминовые красители (родамины) относятся к группе ксантеновых красителей, для которых характерна общая структурная формула:
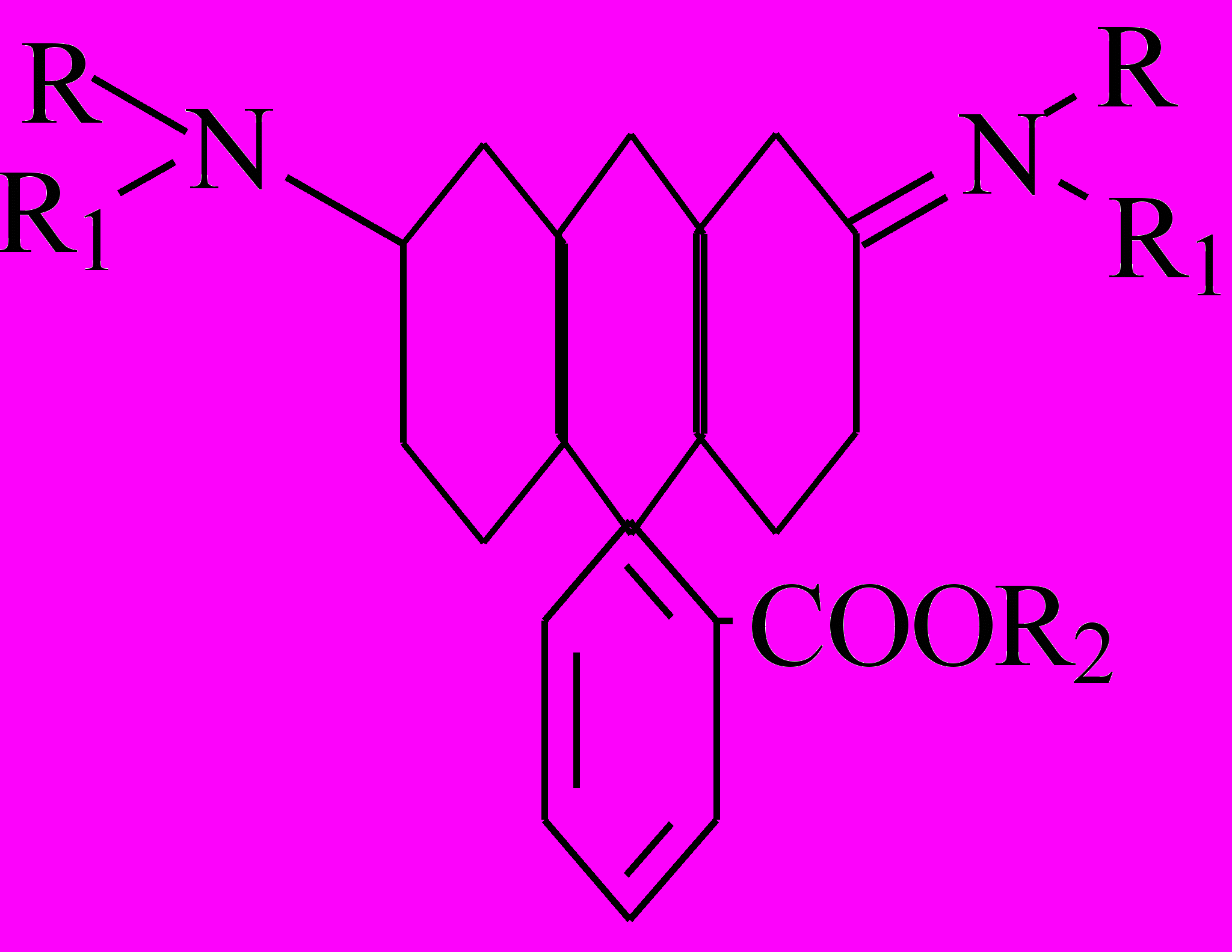
для родамина 6Ж: R=H, R1=R2=C2H5
Родаминовые красители обладают яркой флуоресценцией в жидких растворах (вода, спирты и др.). Такое явление можно объяснить присутствием кислородных мостиков, придающих необходимую «жесткость» родаминам, а, следовательно, и способность к флуоресценции.
Родамины интенсивно поглощают в видимой и менее интенсивно в ультрафиолетовой областях спектра. lвозб.=520 нм, lфл=555 (536-602 нм). Для возбуждения их флуоресценции можно применять как видимый, так и ультрафиолетовый свет. Вышеназванные соединения характеризуются молекулярным типом свечения. Их спектры поглощения и флуоресценции зеркально симметричны.
Экспериментальная часть
Аппаратура.
«Spekol»;
Приборы и реактивы:
Стандартный раствор родамина 10,0 мкг/мл;
- Пробирки мерные вместимостью 10, 15 мл;
- Пипетки вместимостью 1, 5, 10 мл;
- Мерные колбы вместимостью 50, 100 мл.
Выполнение работы.
Подбирают первичный и вторичный светофильтры для определения концентрации родамина 6Ж на «Spekol».
Готовят серию стандартных растворов родамина 6Ж. Для этого в пробирки вносят от 1 до 5 мл исходного раствора, разбавляют водой до объема 10 мл.
Измеряют интенсивность флуоресценции приготовленных растворов на «Spekol». По полученным данным строят градуировочный график в координатах: интенсивность флуоресценции – концентрация родамина (мкг/мл).
Исследуемый раствор получают у преподавателя в колбу вместимостью 50 мл, разбавляют водой до метки. Аликвоту раствора переносят в цилиндр и разбавляют до 10 мл, перемешивают, измеряют интенсивность флуоресценции. Проводят не менее 4-х измерений. Количество родамина в исследуемом растворе определяют по градировочному графику. Проводят статистическую обработку результатов анализа.
Порядок работы на приборе:
1. Включить прибор в сеть 220 В.
2. Включить тумблер на стабилизаторе осветителя.
3. Включить дополнительный усилитель фотоумножителя «Spekol».
4. Прогреть прибор в течение 30 мин.
5. Отъюстировать дополнительный усилитель фотоумножителя. Рычаг на блоке монохроматора в положении «0». Переключатель усиления установить в положение «1000». Поворотную кнопку на «0» повернуть против часовой стрелки до упора (деление шкалы 0 %). Индикаторный прибор покажет 0 % на блоке монохроматора.
6. При помощи поворотной кнопки «0» на блоке дополнительного усилителя в положении переключателя усиления 1000 или 500 установить нулевую точку( 0 %) на индикаторном приборе. Оптический прибор при этом закрыт. Такая установка эффективна для всех ступеней усиления, за исключением ступени «0».
7. Установить возбуждающую длину волны на блоке монохроматора.
8. Установить максимальную концентрацию исследуемого раствора и добиться максимального значения сигнала, отрегулировать длину волны на монохроматоре (чувствительность 1000), l=435 нм или l=542 нм.
9. Поочередно поместить в ход лучей остальные пробы в порядке возрастания концентраций и построить эталонную кривую в координатах: отклонение стрелки прибора – концентрация родамина 6Ж.
10. Поместить в ход лучей исследуемый раствор и, по показаниям прибора, найти на эталонной кривой определяемую концентрацию родамина 6Ж.
Лабораторная работа №8
Определение содержания вольфрама кинетическим методом
Цель работы. Изучение кинетического метода анализа и его применение для определения веществ.
Задание. Определить содержание вольфрама в водном растворе на основе его каталитического действия при окислении I—ионов пероксидом водорода. Провести статистическую обработку и обсуждение результатов.
Обоснование методики: реакция окисления I- иона пероксидом водорода до свободного иода в кислом растворе протекает в соответствии с уравнением:
H2O2 + 2I- + 2H+® I2 + 2H2O.
В отсутствии катализатора эта реакция протекает медленно. В присутствии катализаторов (H2WO4, H2MоO2, соединений тантала, циркония, железа и некоторых других элементов) скорость реакции резко возрастает. Зависимость скорости реакции от концентрации реагирующих веществ выражается уравнением:
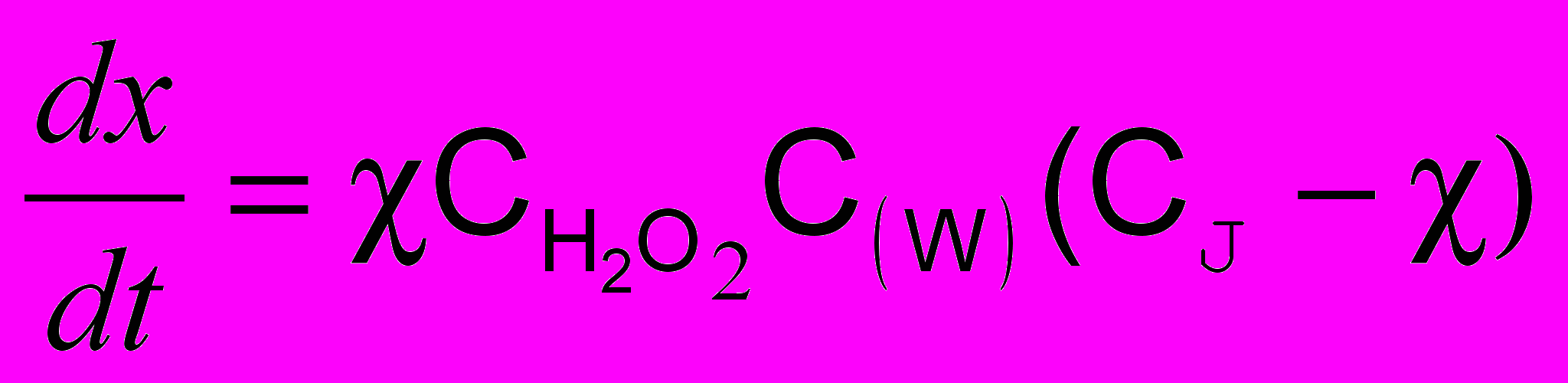 ,
,где х – концентрация выделившегося йода
С
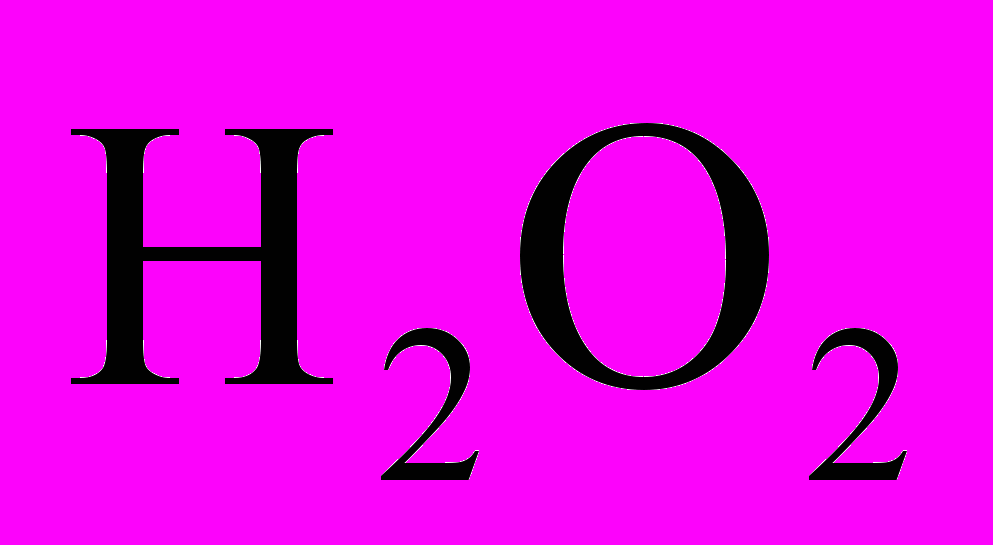 – концентрация пероксида водорода (Н2О2 берут в избытке)
– концентрация пероксида водорода (Н2О2 берут в избытке)С(W) – концентрация вольфрама
С(J) – начальная концентрация йодид-ионов
- константа скорости реакции.
Для измерения скорости реакции (
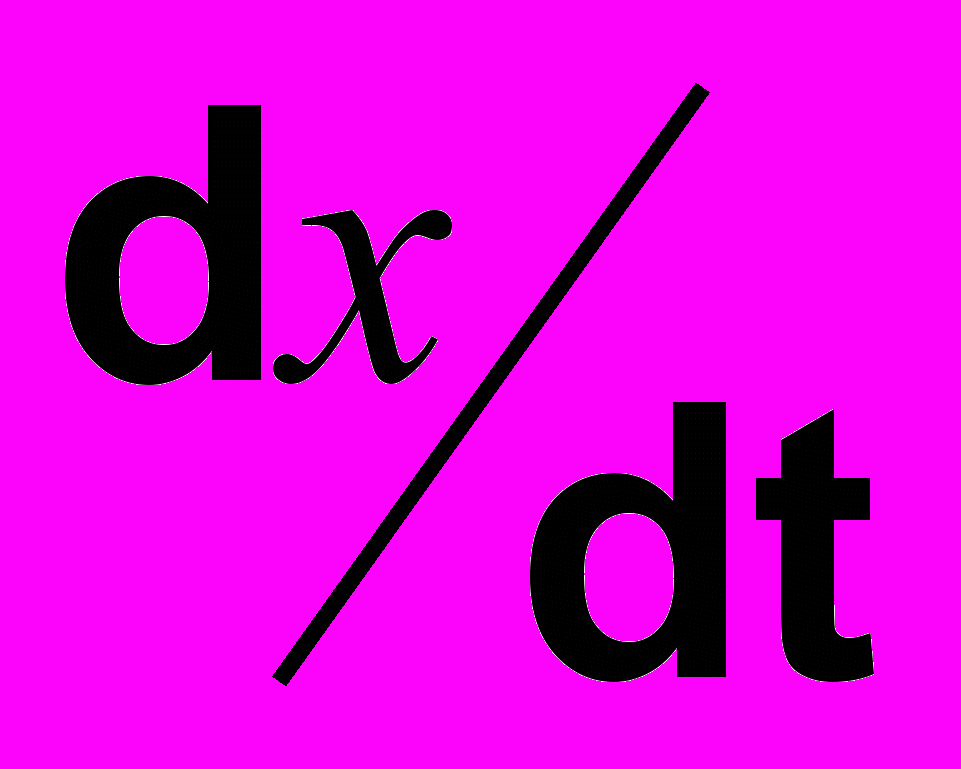 ) можно ограничиться начальным ее периодом, так как при добавлении крахмала определению доступны очень малые концентрации иода (Х). В начальном периоде СI-X можно приравнять к СI и выразить скорость реакции уравнением:
) можно ограничиться начальным ее периодом, так как при добавлении крахмала определению доступны очень малые концентрации иода (Х). В начальном периоде СI-X можно приравнять к СI и выразить скорость реакции уравнением:
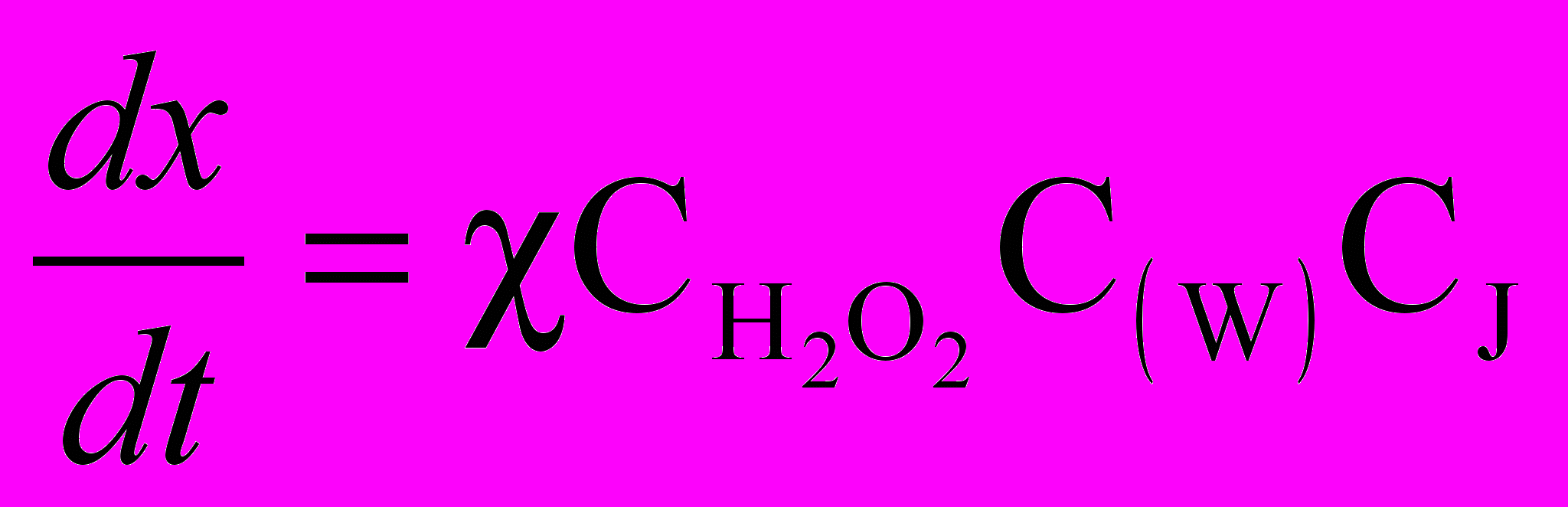
Зависимость концентрации иодида (или пропорциональной ей оптической плотности раствора комплекса иод крахмал) от времени имеет в начальном периоде линейный характер, tg угла наклона прямой время – оптическая плотность пропорционален скорости реакции, а следовательно, и концентрации вольфрама в растворе.
Экспериментальная часть
Аппаратура.
Колориметр фотоэлектрический однолучевой КФО.
Посуда и реактивы:
Мерные колбы вместимостью 50 мл;
- Пипетки вместимостью 1; 5; 10 мл.;
- Стандартный раствор вольфрамата натрия с концентрацией 1,0×10-5 моль/л;
- Пероксид водорода, 0,010 М раствор;
- Иодид калия, 0,0060 М раствор;
- Хлороводородная кислота, 1 М раствор;
- Крахмал 0,2% раствор.
Выполнение работы.
В мерную колбу вместимостью 50 мл(соблюдая указанный порядок) вносят 5 мл раствора хлороводородной кислоты, 5 мл раствора иодида калия, определенный объем раствора вольфрамата натрия и разбавляют объем дистиллированной водой до 35 – 40 мл. Добавляют 5 капель крахмала. Раствор тщательно перемешивают и вносят в него 5 мл раствора H2O2, одновременно включают секундомер. Раствор разбавляют до метки, и часть раствора помещают в кювету фотоэлектроколориметра (толщина поглощающего слоя 5 см). В течение 10 минут, каждые 30 сек, измеряют оптическую плотность раствора, используя светофильтр №3. Температура воздуха в помещении должна быть 18 – 23°С. По результатам измерений строят график в координатах оптическая плотность – время (мин). Определяют tg угла наклона соответствующей прямой и вычисляют концентрацию вольфрама в растворе. Для построения градуировочного графика проводят не менее 3-х опытов, используя раствор вольфрамата натрия различных концентраций. Для этого после внесения растворов хлороводородной кислоты и иодида калия в мерную колбу добавляют соответственно 5; 10; 15 мл стандартного раствора вольфрамата натрия (1,0·10-6 моль/л) и выполняют все операции описанные выше. После нанесения полученных результатов на график: оптическая плотность – время и определения tg углов наклона полученных прямых, строят градуировочный график в координатах: tg угла наклона содержание вольфрама в растворе (5×10-9; 10×10-9; 15×10-9 моль в 50 мл). Все три точки должны лежать на одной прямой.
По градуировочному графику находят концентрацию вольфрама в анализируемом растворе и его содержание мг. Измерения повторяют три раза. Проводят статистическую обработку результатов.
Определению не мешают: Са, Mg, Zn, Ni, Co, Mn, Cl-, NO3-, SO42. Погрешность определения может составлять до 7%..
Список литературы
- Основы аналитической химии. В 2 кн. Кн. 1. Общие вопросы. Методы разделения: Учеб. для вузов /Ю.А. Золотов, Е.Н. Дрохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – 2-е изд., перераб. и доп. – М.: Высш. шк.,1999. – 351 с.: ил.
- Основы аналитической химии. В 2 кн. Кн. 2. Общие вопросы. Методы разделения: Учеб. для вузов /Ю.А. Золотов, Е.Н. Дрохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – 2-е изд., перераб. и доп. – М.: Высш. шк.,1999. – 351 с.: ил.
- Основы аналитической химии. Практическое руководсто: Учеб. пособие для вузов/ В.И. Фадеева, Г.Н. Шеховцова, В.И. Иванов и др. Под ред. Ю.А. Золотова. – М.: Высш. шк., 2001. – 463 с.: ил.
- Крешков А.П. Основы аналиттической химии. Теоретические основы. Количественный анализ, книга вторая, изд-е 4-е, перераб. М.: Химия, 1976. – 480 с.
- Крешков А.П. Основы аналиттической химии. Физические и физико-химические методы анализа (инструментальные метода анализа), книга третья, изд-е 2-е, перераб. М.: Химия, 1977. – 488 с.
- Лурье Ю.Ю. Справочник по аналитической химии: Справ. изд-е – 6-е изд., перераб. и доп. – М.: Химия, 1989. – 448 с.: ил..
- Дёрффель К. Статистика в аналитической химии. Пер. с нем. М.: Мир, 1994. – 268 с.
ПРИЛОЖЕНИЕ 1
Таблица 1
Допустимые отклонения в емкости мерной посуды
| Вместимость, мл | Допустимая максимальная ошибка, мл | ||
| Мерные колбы | Пипетки | Бюретки | |
| 5 10 25 50 100 200 250 500 1000 2000 | - - 0,03 0,05 0,08 0,10 0,12 0,15 0,30 0,50 | 0,01 0,02 0,03 0,05 0,08 - - - - - | 0,01 0,02 0,03 0,05 0,10 - - - - - |
Таблица 2
Результаты статистической обработки
| Xi, % | 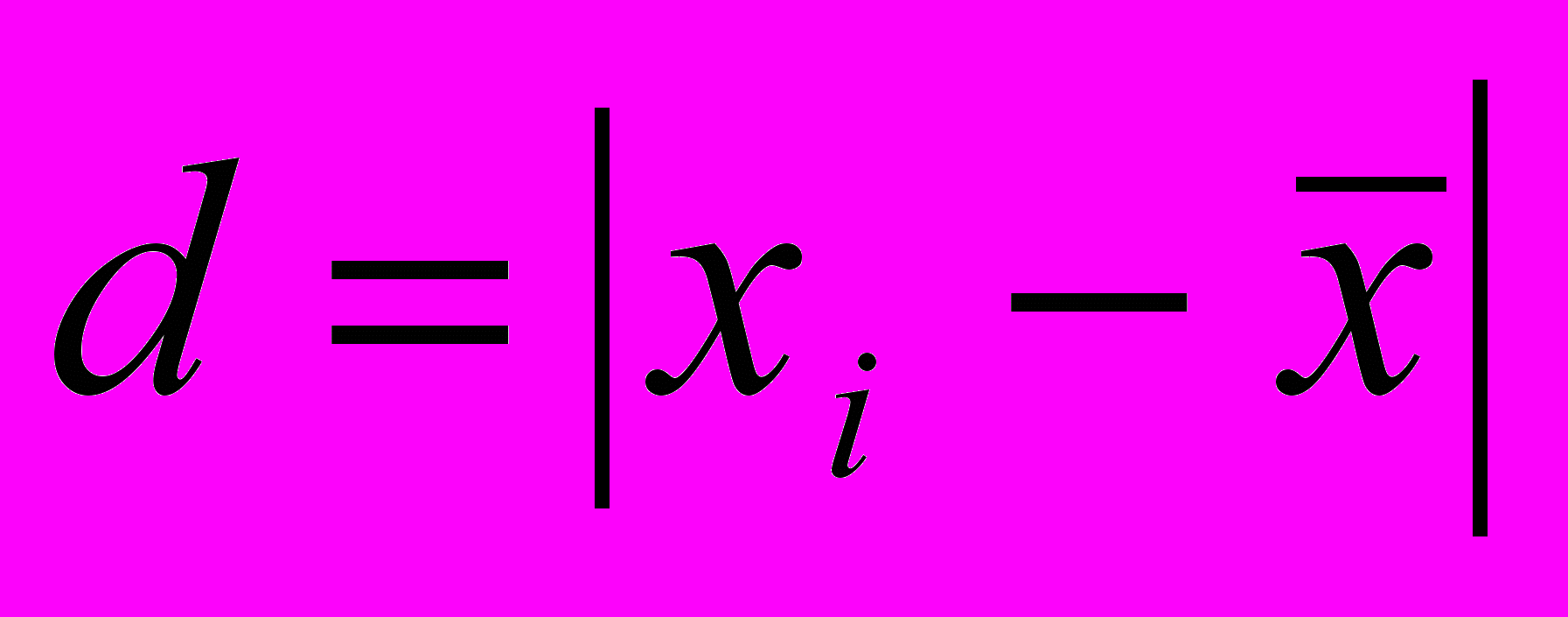 | S | | 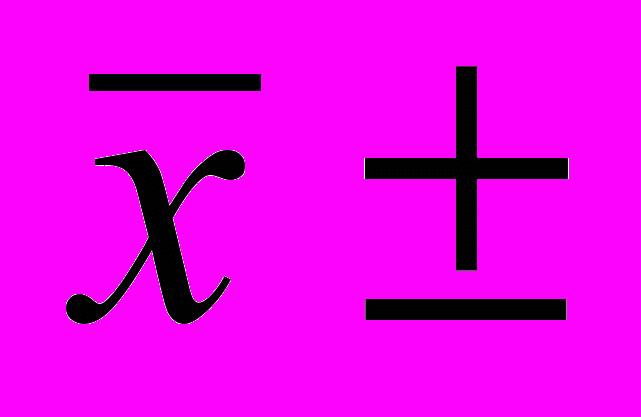 , % , % | 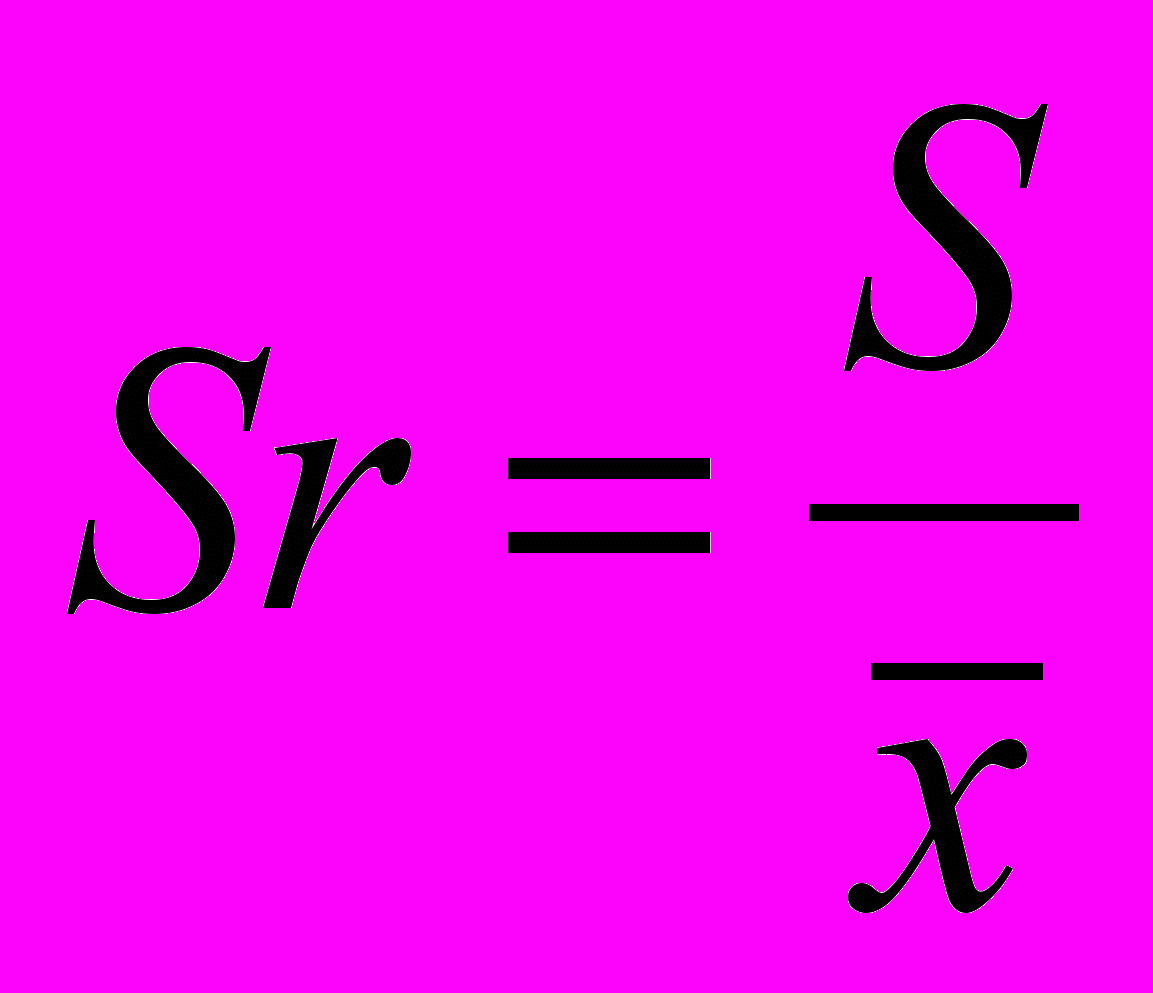 |
| (2,05)3 2,09 (2,12)3 2,16 (2,18)3 2,19 2,25 | (0,08)3 0,04 (0,01)3 0,03 (0,05)3 0,06 0,12 | | | | |
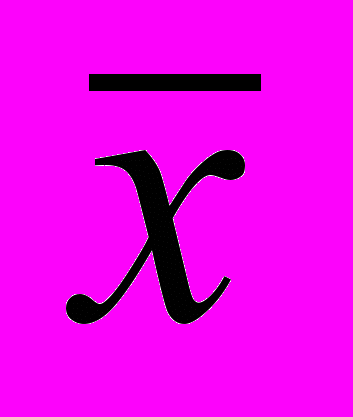 = 2,13 = 2,13 | 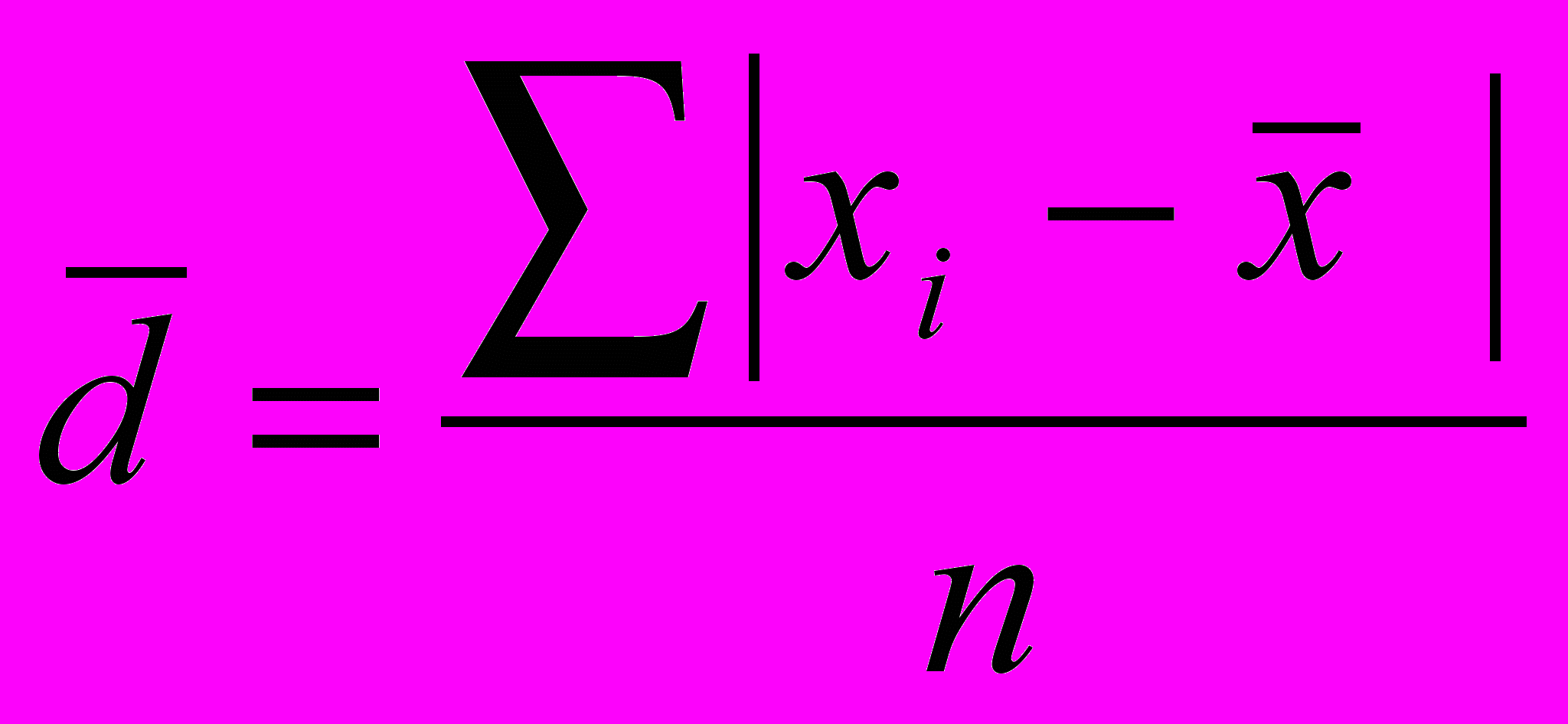 | 0,062 | 0,04 | 2,13 0,04 | 0,03 |
ПРИЛОЖЕНИЕ 2
Структура отчета по лабораторной работе
Лабораторная работа №_____
Название работы
Цель работы:
| |
Задание:
| |
Теоретическое введение:
| |
Методика и ее обоснование:
| Привести уравнения химических и (или) электрохимических реакций! |
Аппаратура:
| Привести схему установки! |
Посуда и реактивы:
| |
Результаты измерений:
| Представлять в виде таблиц! |
Продолжение ПРИЛОЖЕНИЯ 2
Расчеты:
| |
Статистическая обработка результатов:
| |
Обсуждение результатов:
| |
Выводы:
| |
