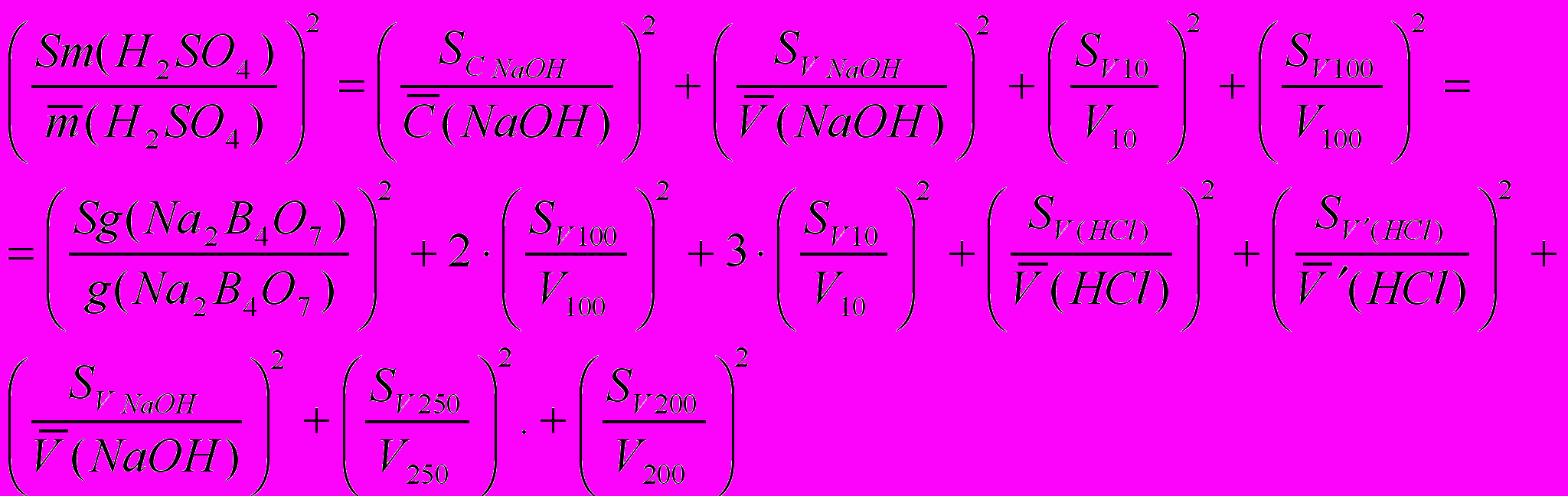Л. В. Щербакова практикум по аналитической химии барнаул 2004 министерство образования российской федерации алтайский государственный университет химический факультет практикум
| Вид материала | Практикум |
- Практикум Владивосток 2004 Министерство образования и науки Российской Федерации Владивостокский, 628.95kb.
- Практикум Ярославль, 2004 Министерство образования и науки РФ ярославский государственный, 885.94kb.
- Министерство Образования Российской Федерации Московский Государственный Университете, 1997.23kb.
- А. М. Горького Кафедра алгебры и дискретной математики Щербакова В. А. Лабораторный, 418.72kb.
- Анализ воды, 505.46kb.
- Российской Федерации Министерство образования и науки Российской Федерации Государственный, 343.55kb.
- Учебно-практическое пособие Хабаровск, 2001. Министерство образования Российской Федерации, 2795.36kb.
- Практикум ростов-на-Дону 2008 министерство образования и науки российской федерации, 1352.33kb.
- Учебное пособие Министерство общего и профессионального образования Российской Федерации, 936.13kb.
- Российской Федерации Уральский Государственный Университет им. А. М. Горького Философский, 1670.87kb.
Определение содержания серной кислоты
Определение основано на титровании стандартным раствором гидроксида натрия раствора серной кислоты неизвестной концентрации. Титр раствора NaOH может быть установлен по титрованному раствору HCl. Титр раствора HCl в свою очередь устанавливают по первичному стандарту - тетраборату натрия. Таким образом, данная работа состоит из нескольких этапов.
I. Установление концентрации раствора HCl
При титровании кислот тетраборатом натрия в растворе протекает реакция
B4O72-+2H++5H2O↔4H3BO3
Приготовление 0,1 М раствора тетрабората натрия. Работа может быть выполнена двумя способами. Если имеется исходный раствор тетрабората с концентрацией, например, 1,000 М, необходимо провести разбавление данного раствора. Если имеется сухое вещество, то предварительно рассчитывают навеску, необходимую для приготовления 100 мл раствора с концентрацией 0,1 М. Так как 1 моль (381,4 г) Na2B4O7.10H2O реагирует с 2 моль HCl, то фактор эквивалентности равен 1/2, масса эквивалента равна 1/2Na2B4O7.10H2O = 381,4/2 = 190,68 г.
Взвешивать на аналитических весах рассчитанную массу тетрабората натрия не имеет смысла, так как это не даёт никаких преимуществ, а времени отнимает много. Поэтому, поместив в бюкс (или на кальку) предварительно взвешенную на технических весах массу тетрабората натрия (1,5-2,0 г) взвешивают бюкс (или кальку) с веществом на аналитических весах с точностью до 0,0002 г. Далее осторожно пересыпают тетраборат натрия через сухую воронку в тщательно вымытую мерную колбу. Бюкс или кальку с оставшимися крупинками тетрабората натрия снова взвешивают и по разности находят массу тетрабората натрия, перенесенного в колбу. Струей горячей дистиллированной воды из промывалки хорошо смывают тетраборат натрия из воронки в колбу.
Заполняют колбу горячей дистиллированной водой до 2/3 ее объема, вынимают воронку и, перемешивая содержимое колбы плавными круговыми движениями, растворяют тетраборат натрия. После этого раствор охлаждают до комнатной температуры и разбавляют до метки дистиллированной водой. Тщательно перемешивают.
Расчёт концентрации полученного раствора
а) титр раствора
Т = m/Vм.к. (г/мл),
где m - масса навески тетрабората натрия, г
Vм.к. - объём мерной колбы, мл
б) молярная концентрация эквивалента
C (1/2Na2B4O7.10H2O) = 1000 Т. /1/2М (Na2B4O7 .10H2O) , моль экв/л,
Приготовление 0,1 М раствора HCl
Готовят раствор HCl в колбе вместимостью 200 мл путем разбавления исходного реагента.
Реагенты:
HCl, 0,1 М раствор;
Na2B4O7 .10H2O 0,1000 М раствор;
Индикатор метиловый оранжевый.
Выполнение определения
- Бюретку заполняют раствором хлороводородной кислоты.
- В колбу для титрования помещают аликвоту (10,00 мл) раствора тетрабората натрия, 2 - 3 капли раствора метилового оранжевого. Колбу с раствором тетрабората натрия помещают под бюретку на лист белой бумаги и приливают из бюретки раствор HCl, непрерывно перемешивая плавными круговыми движениями содержимое колбы.
Титрование заканчивают, когда от одной капли раствора кислоты первоначально желтая окраска титруемого раствора становится розово-красной. Титрование проводят не менее 3 раз. Фиксируют объем по бюретке. Для расчета концентрации HCl используют среднеарифметическое значение объема титранта.
Расчет концентрации HCl
C. (1/2Na2B4O7 .10H2O) . V (Na2B4O7 .10H2O)
С(HCl) = ------------------------------------------------------
V(HCl)
II. Установление концентрации раствора NaOH
Приготовление 0,1 М раствора NaOH
В чистую колбу вместимостью 250 мл вносят рассчитанную массу NaOH, необходимую для приготовления раствора с концентрацией 0,1М, предварительно взвесив щелочь на кальке на технохимических весах, и тщательно перемешивают.
Реагенты
HCl, 0,1000 М раствор;
NaOH 0,1М раствор;
Индикатор метиловый оранжевый.
Выполнение определения
- Бюретку заполняют раствором хлороводородной кислоты.
- В колбу для титрования помещают аликвоту (10,00 мл) раствора NaOH, 2 - 3 капли раствора метилового оранжевого. Колбу с раствором NaOH помещают под бюретку на лист белой бумаги и приливают из бюретки раствор HCl, непрерывно перемешивая плавными круговыми движениями содержимое колбы.
Титрование заканчивают, когда от одной капли раствора кислоты первоначально желтая окраска титруемого раствора становится розово-красной. Титрование проводят не менее 3 раз. Фиксируют объем по бюретке. Для расчета концентрации NaOH используют среднее из 3-х значений объема раствора титранта.
Расчет концентрации NaOH
C. (HCl) . V (HCl)
С(NaOH) = -------------------------------
V (NaOH)
III. Определение содержания серной кислоты
Определение основано на титровании стандартным раствором гидроксида натрия раствора серной кислоты неизвестной концентрации в присутствии метилового оранжевого. При этом протекает реакция:
2NaOH + H 2 SO 4 = Na 2SO 4 + 2H2O.
Масса эквивалента равна 1/2М (H2 SO4) = 98,07/2 = 49,035 г.
Реагенты:
NaOH 0,1000 М раствор;
Контрольная задача с H2 SO4;
Индикатор метиловый оранжевый.
Выполнение определения
1. Получают у преподавателя задачу, содержащую серную кислоту (контрольный раствор), в мерной колбе вместимостью 100,0 мл
2. Разбавляют контрольный раствор до метки дистиллированной водой и тщательно перемешивают.
3. Бюретку заполняют раствором щелочи с точно известной концентрацией.
4. В колбу для титрования помещают аликвоту (10,00 мл) контрольного раствора, 2 - 3 капли раствора метилового оранжевого. Титрование заканчивают, когда от одной капли раствора щелочи первоначально розовая окраска титруемого раствора становится желтой. Фиксируют объем по бюретке. Выполняют не менее 3-х параллельных титрований.
5. Расчет результатов определений

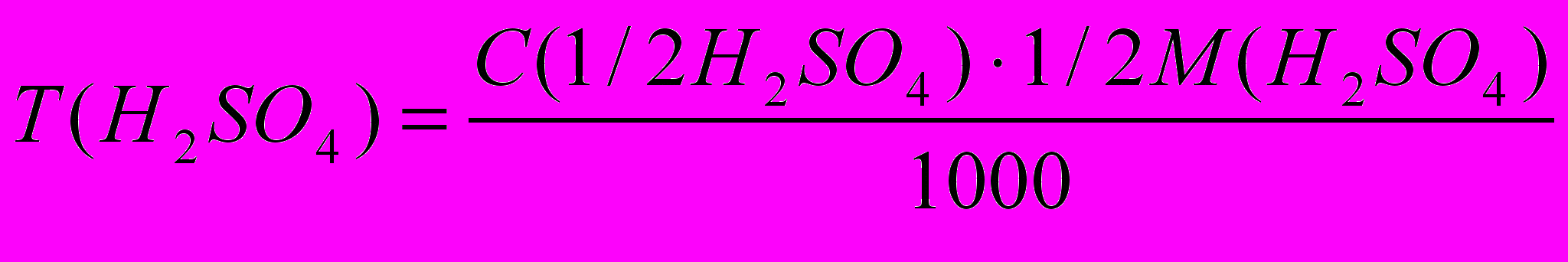
m (H2SО4) = T(H2SО4).Vм.к.
6. Проводят статистическую обработку результатов анализа.

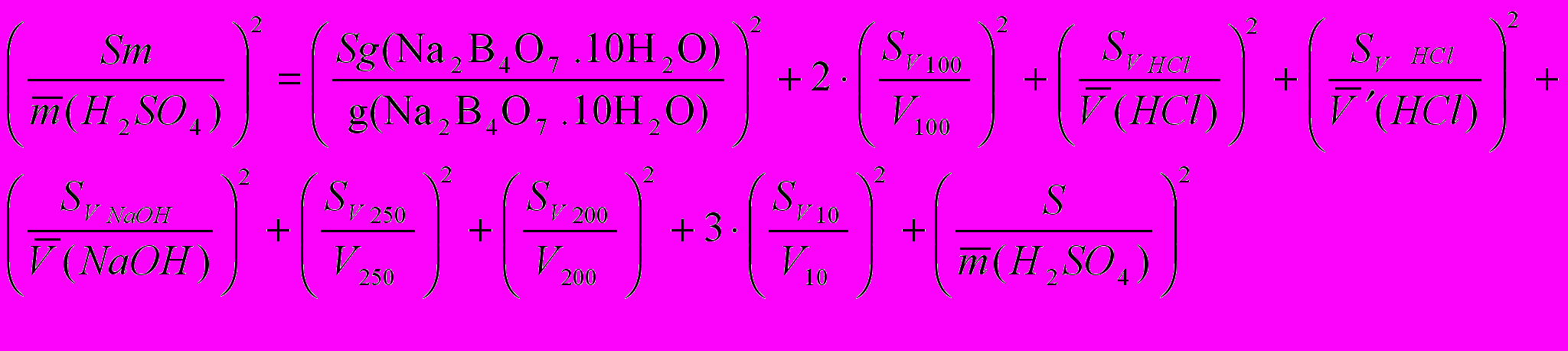 (1)
(1)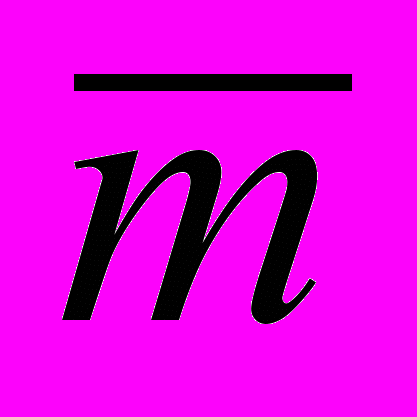 - среднее значение массы серной кислоты;
- среднее значение массы серной кислоты; - ошибка взятия навески тетрабората натрия на аналитических весах; Sg составляет 310-4г;
- ошибка взятия навески тетрабората натрия на аналитических весах; Sg составляет 310-4г;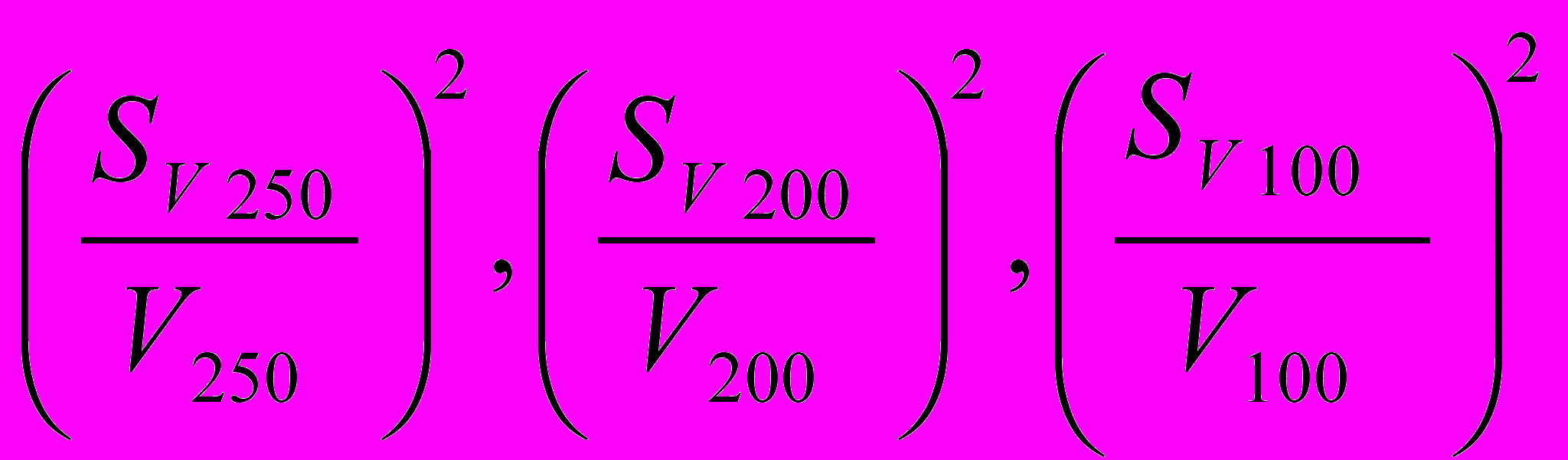 - ошибка калибрования мерных колб (из табл. 1, приложения) ;
- ошибка калибрования мерных колб (из табл. 1, приложения) ;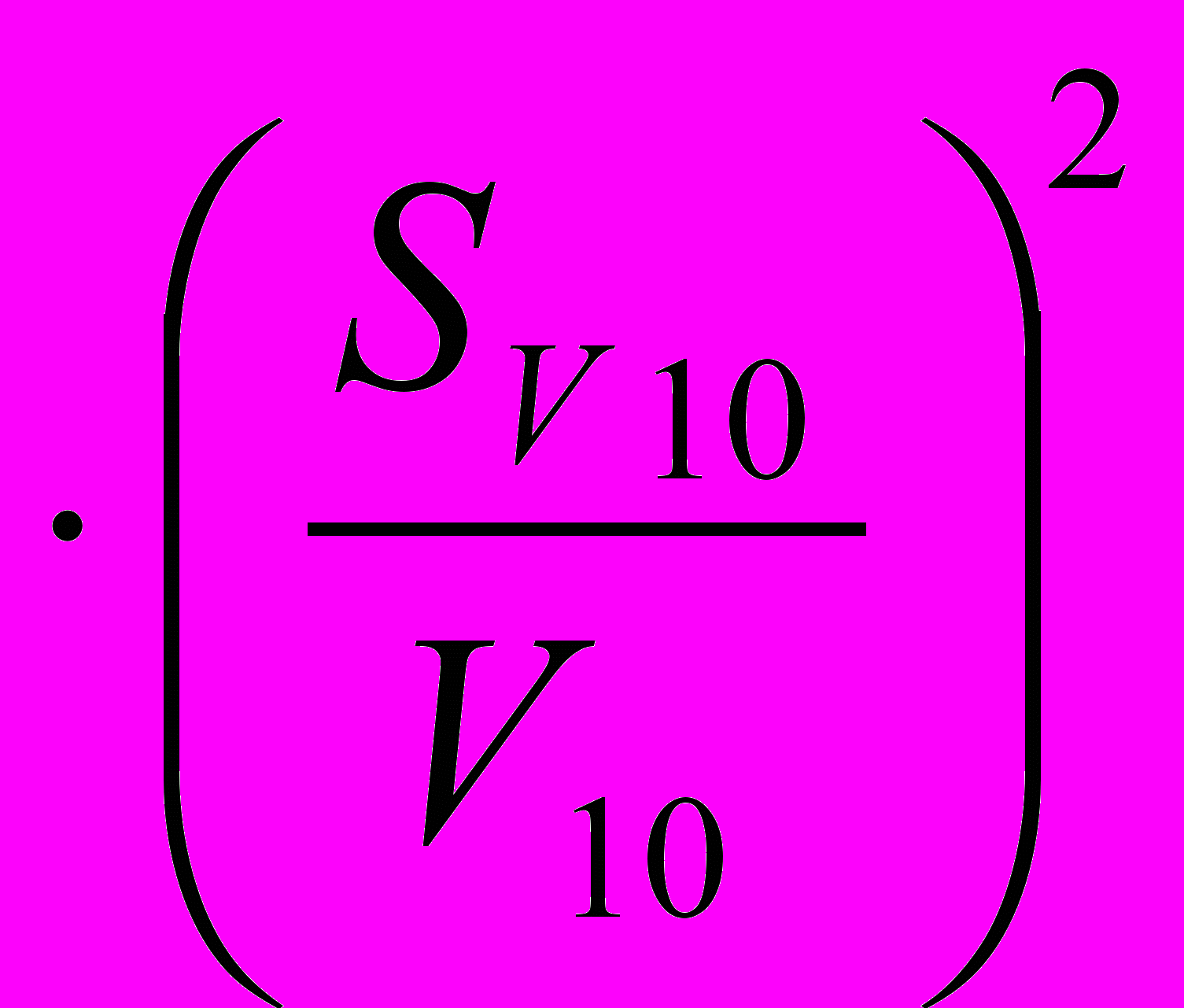 - ошибка калибрования пипетки (из табл. 1);
- ошибка калибрования пипетки (из табл. 1);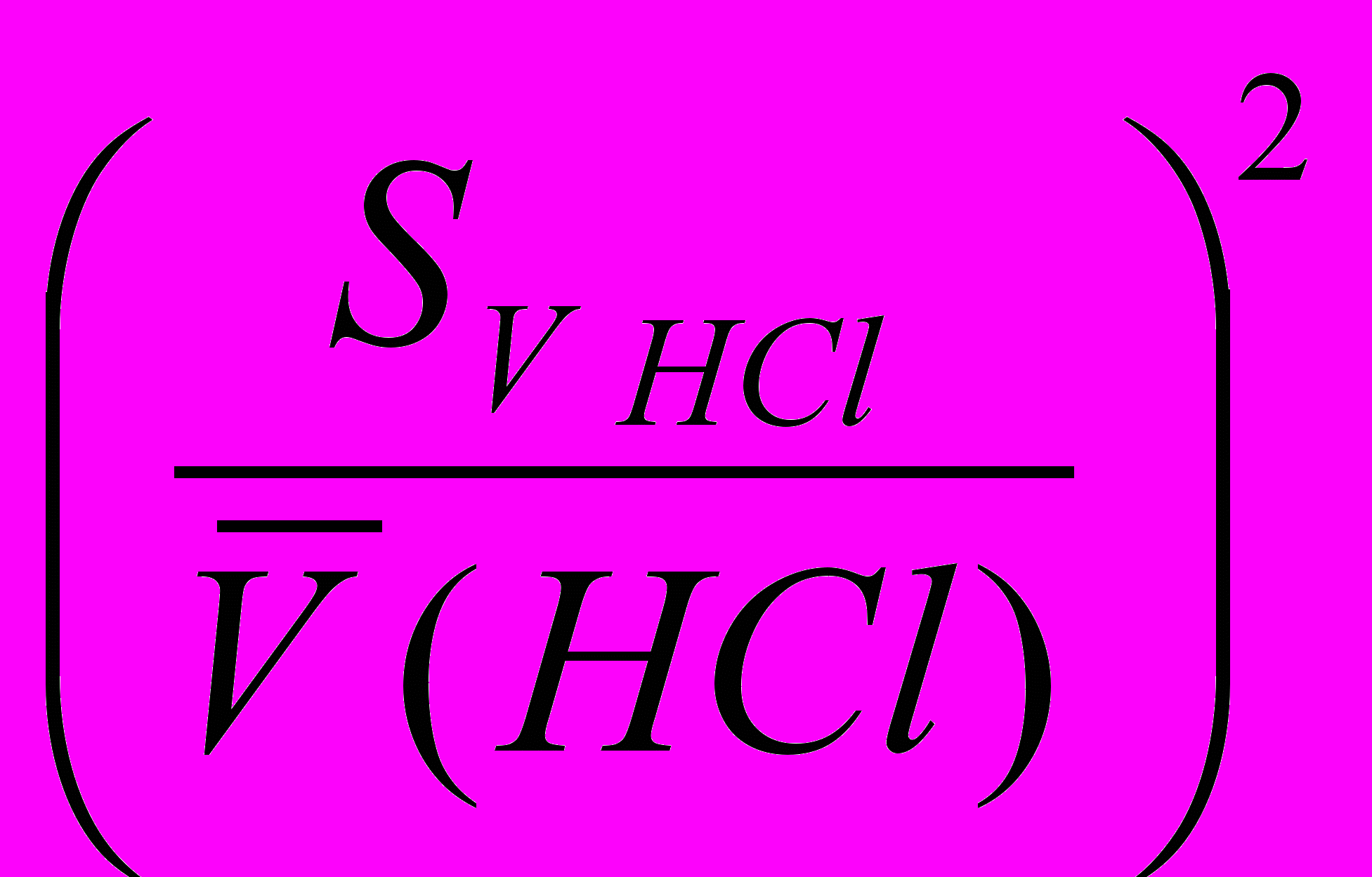 - ошибка определения по бюретке, при титровании тетрабората натрия хлороводородной кислотой (рассчитывают, пользуясь табл. 2);
- ошибка определения по бюретке, при титровании тетрабората натрия хлороводородной кислотой (рассчитывают, пользуясь табл. 2);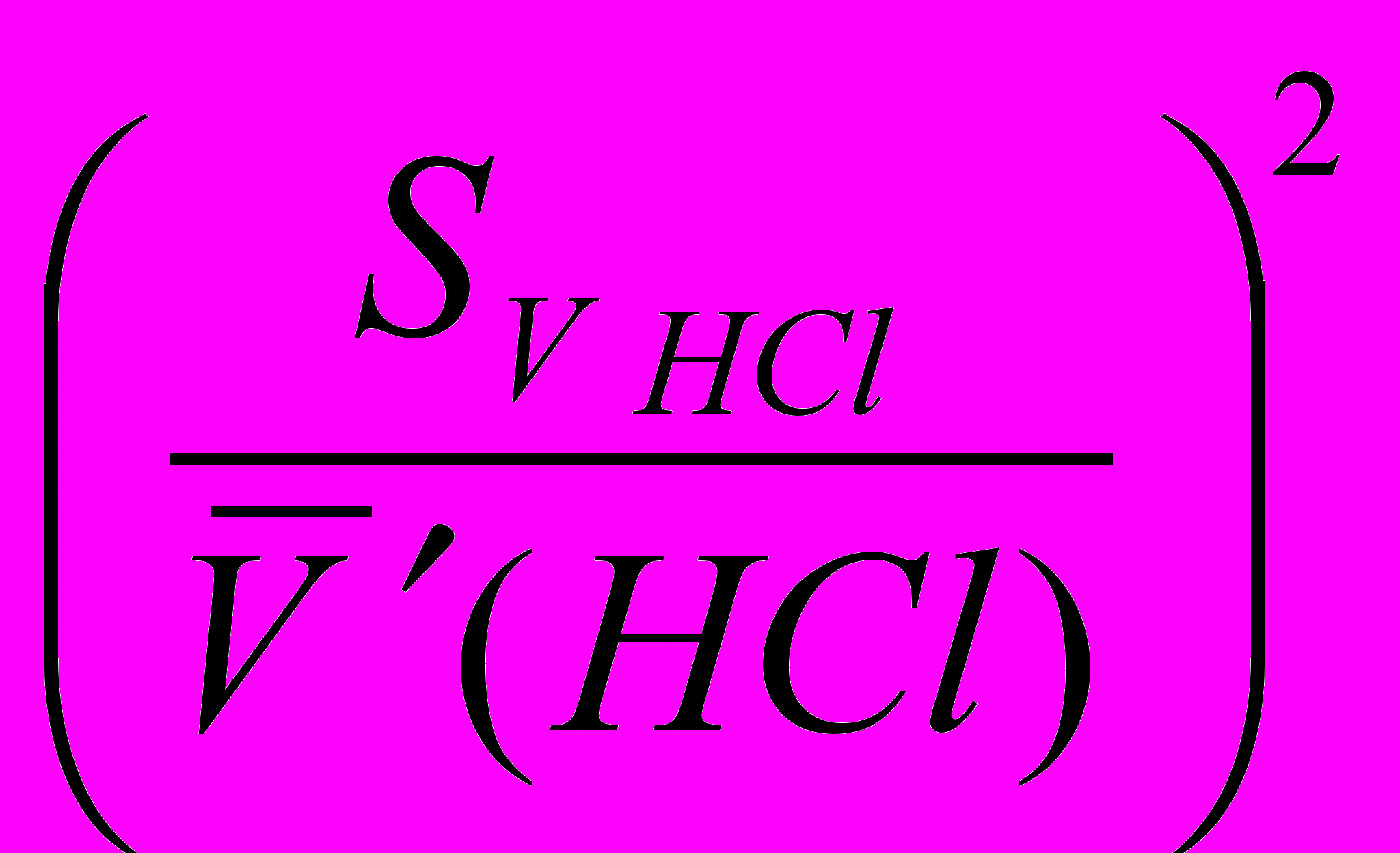 - ошибка определения по бюретке при титровании гидроксида натрия хлороводородной кислотой;
- ошибка определения по бюретке при титровании гидроксида натрия хлороводородной кислотой;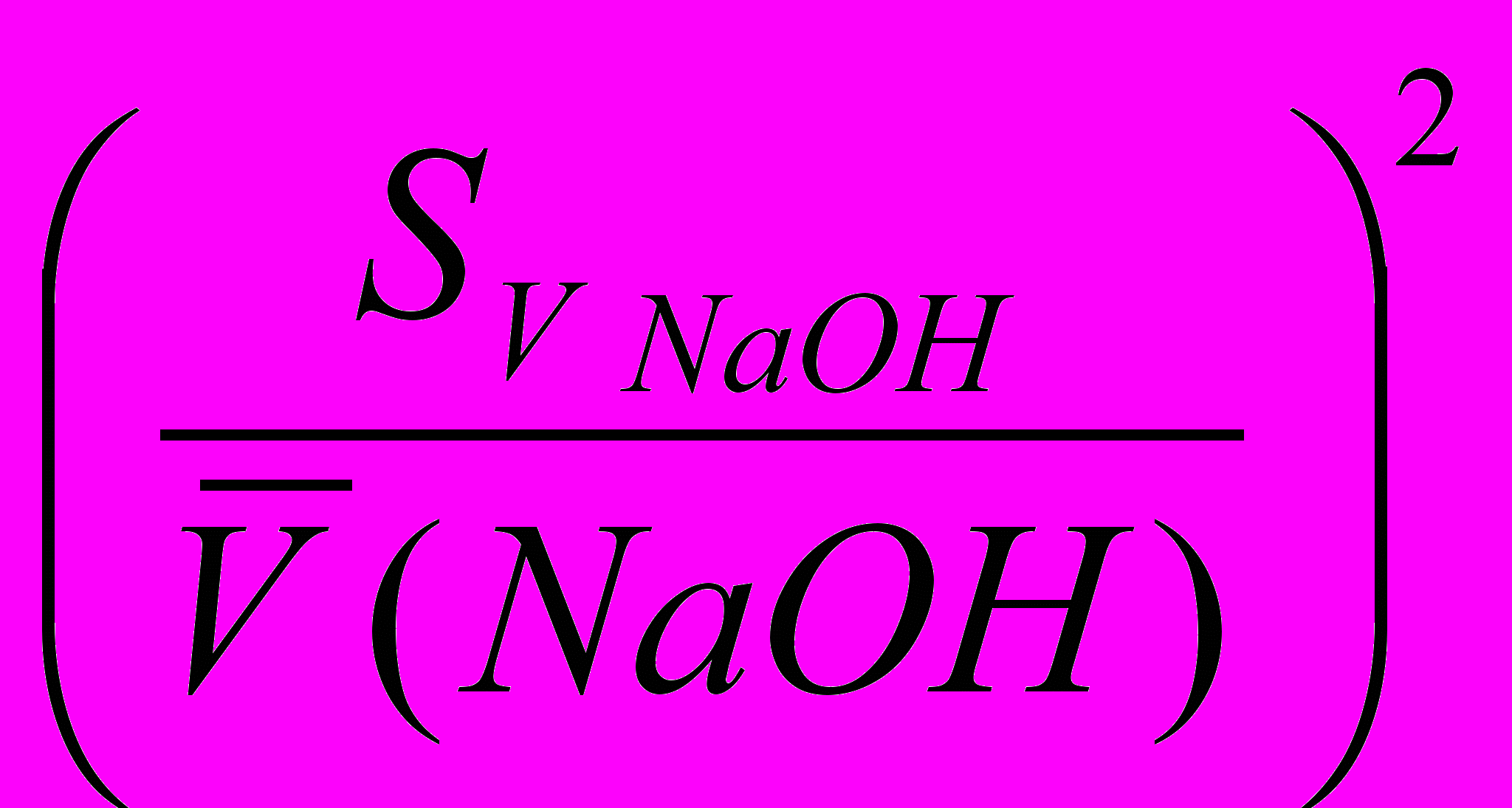 - ошибка определения по бюретке при титровании гидроксида натрия серной кислотой.
- ошибка определения по бюретке при титровании гидроксида натрия серной кислотой.Коэффициенты (2 и 3) показывают, сколько раз использовались колбы или пипетки в процессе титрования.

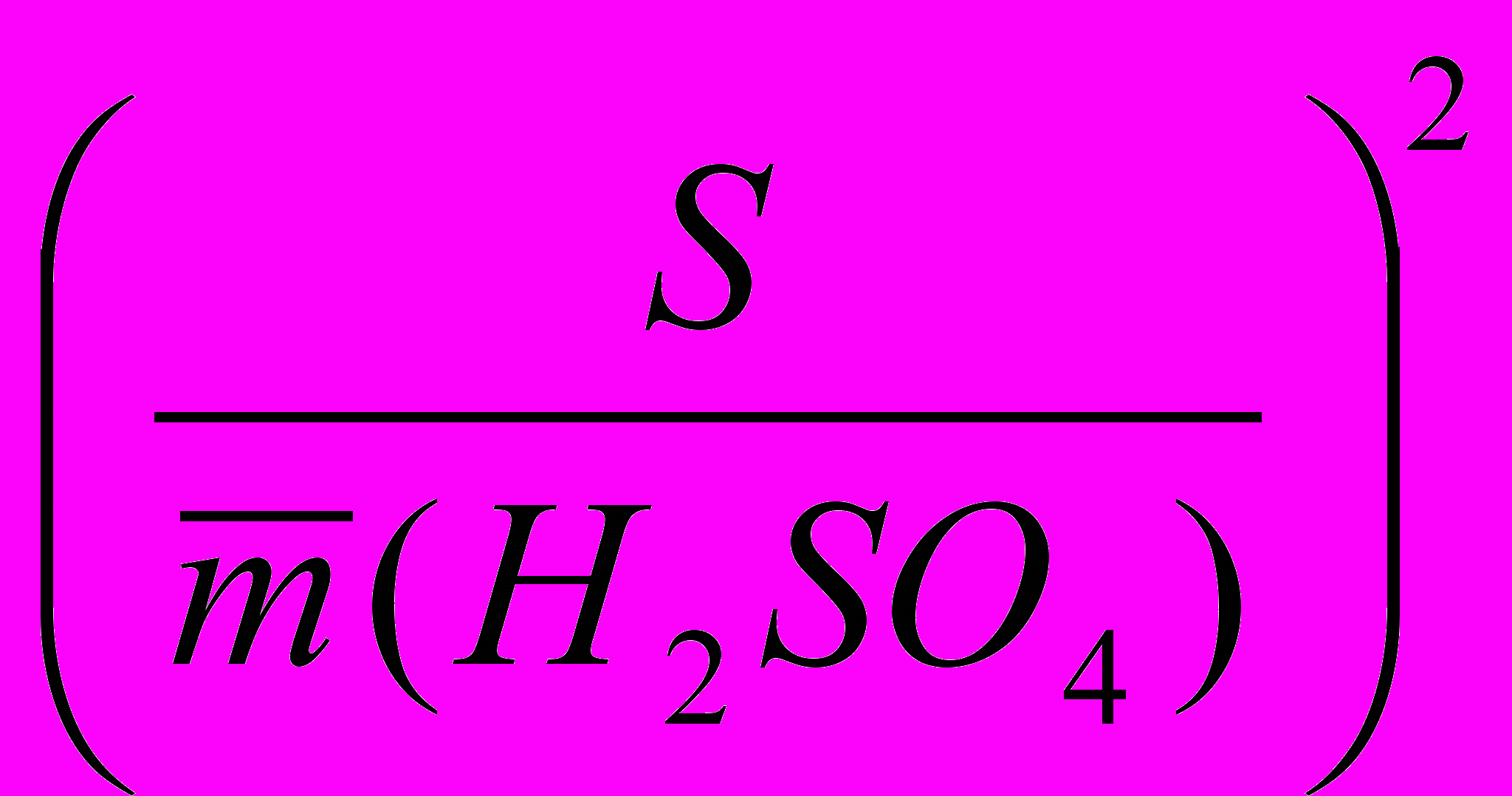 - где
- где 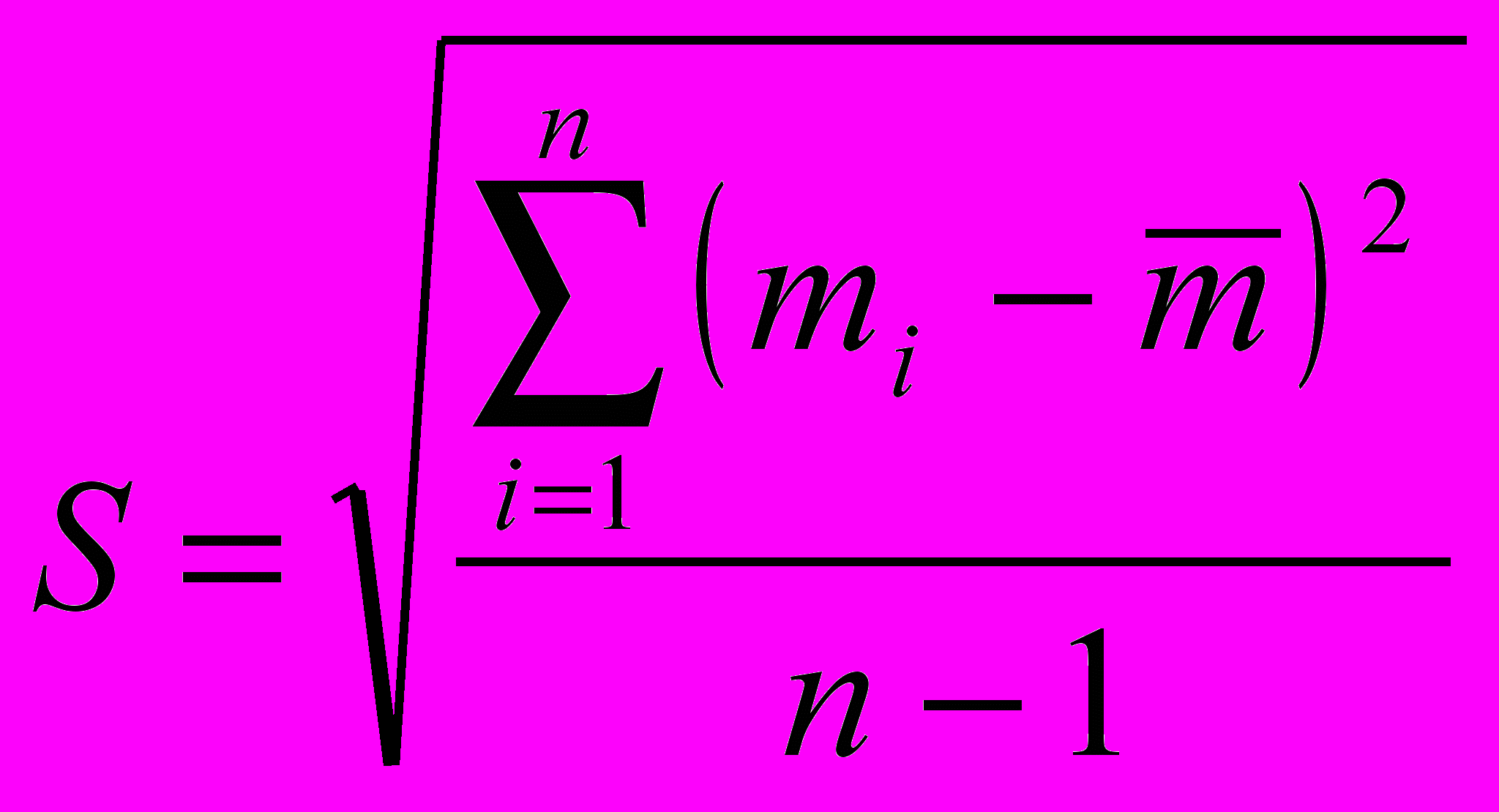
Рассчитав
 , находят Sm, а затем , например,
, находят Sm, а затем , например,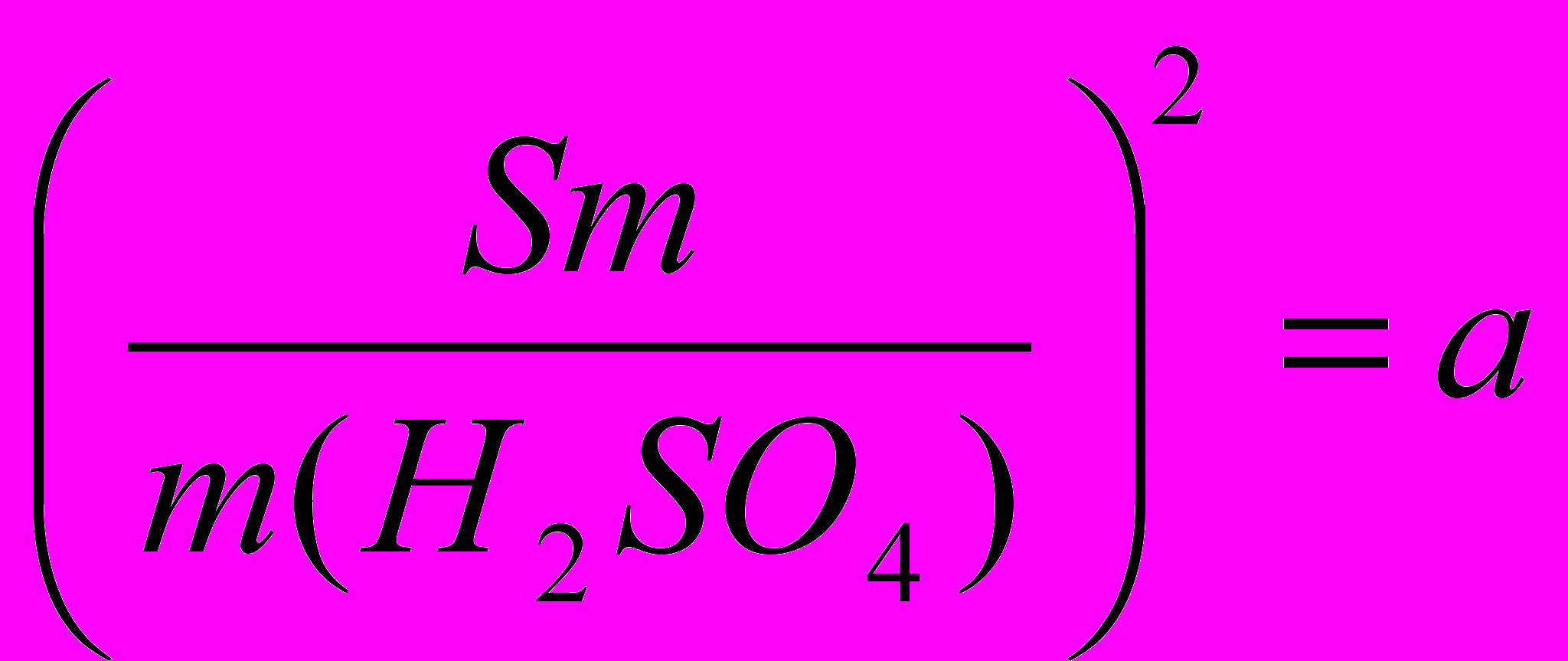 ;
; 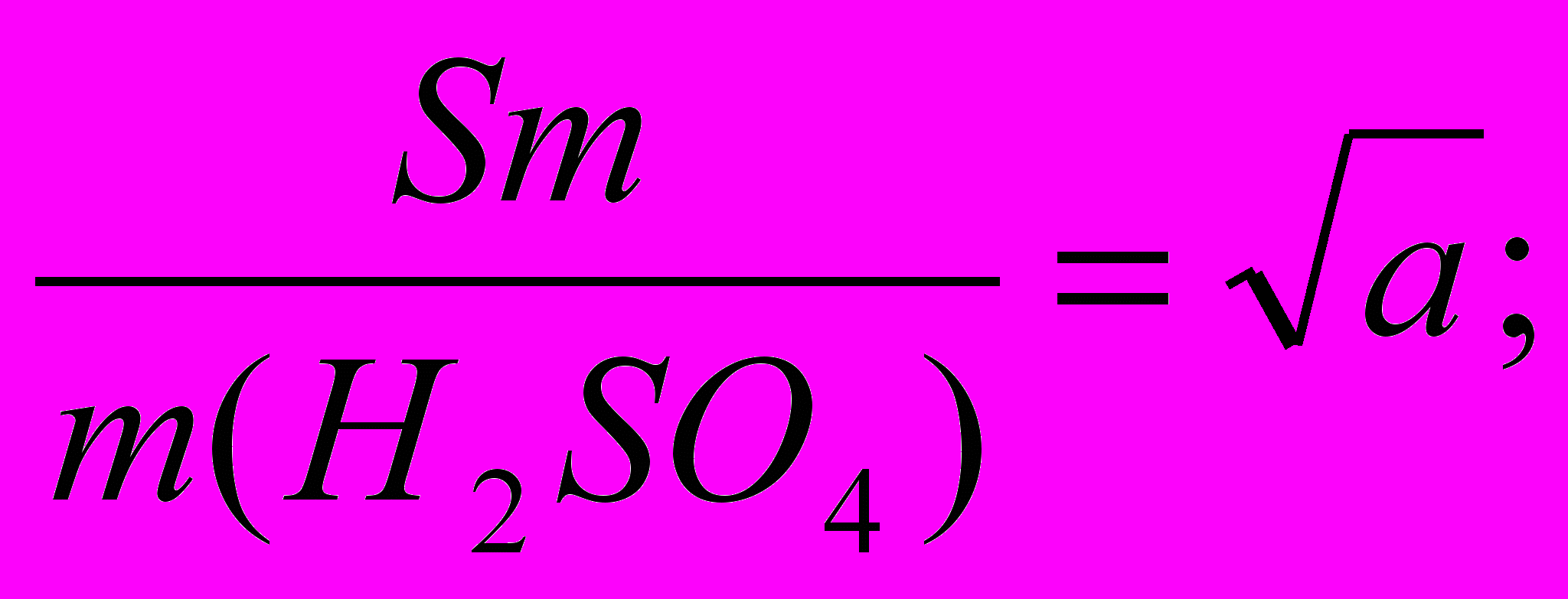
 ;
; 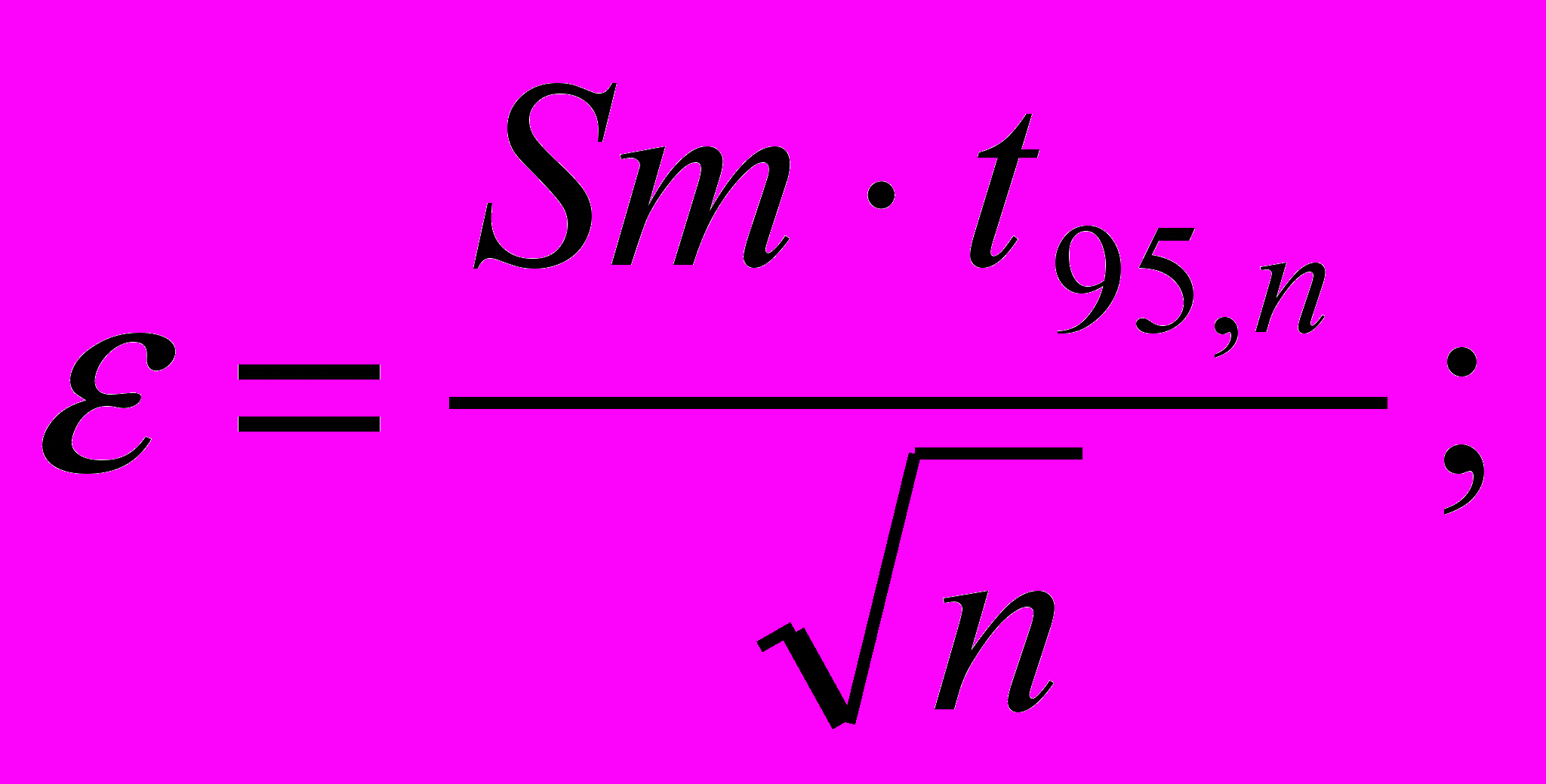
конечный результат массы серной кислоты записывают с учетом доверительного интервала.
Например: если
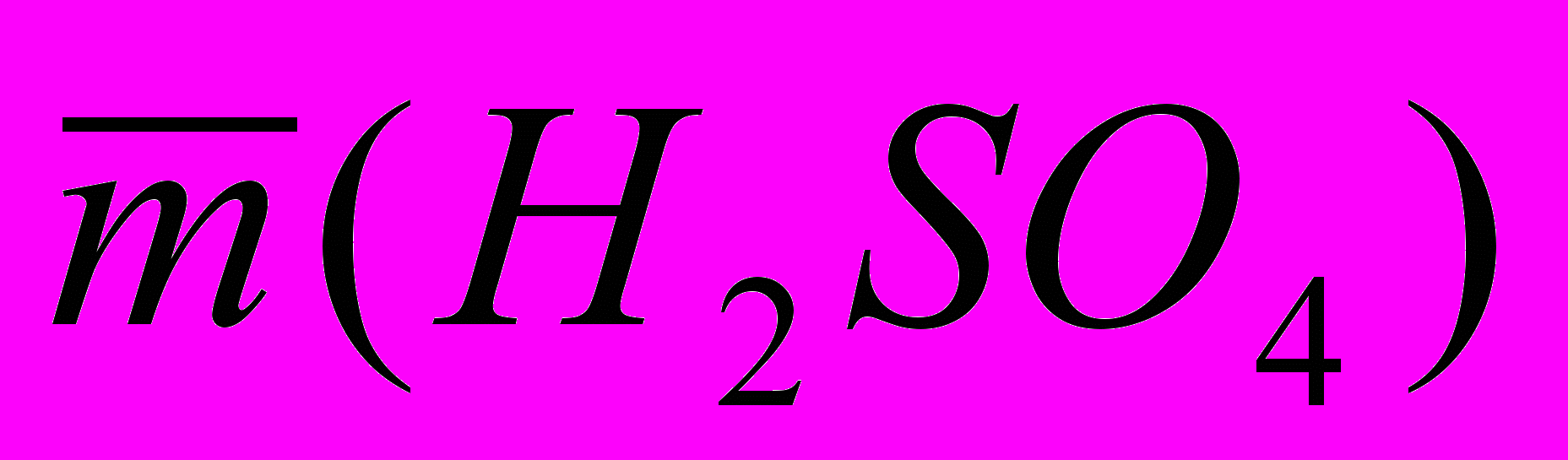 = 0,2234 г, а = 0,002 г, результат записывают в следующем виде (02230,002) г.
= 0,2234 г, а = 0,002 г, результат записывают в следующем виде (02230,002) г.Суммирование ошибок:
1) ошибка стандартизации тетрабората натрия
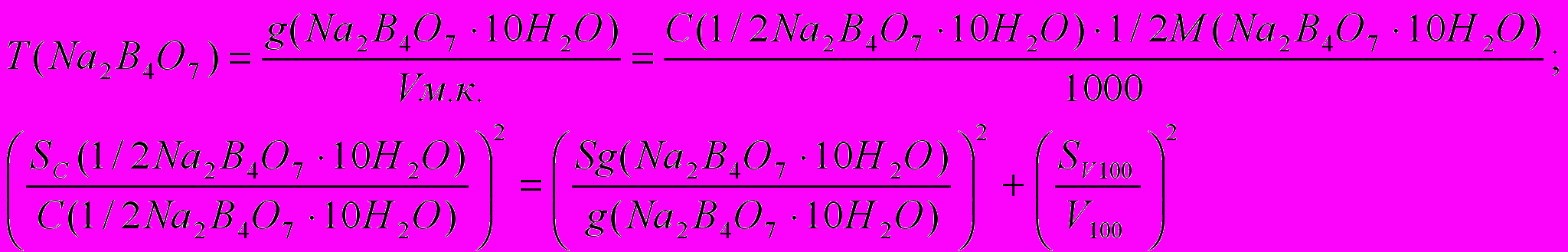
2) ошибка стандартизации хлороводородной кислоты (приготовлена в колбе на 200 мл)
 ,
, где V
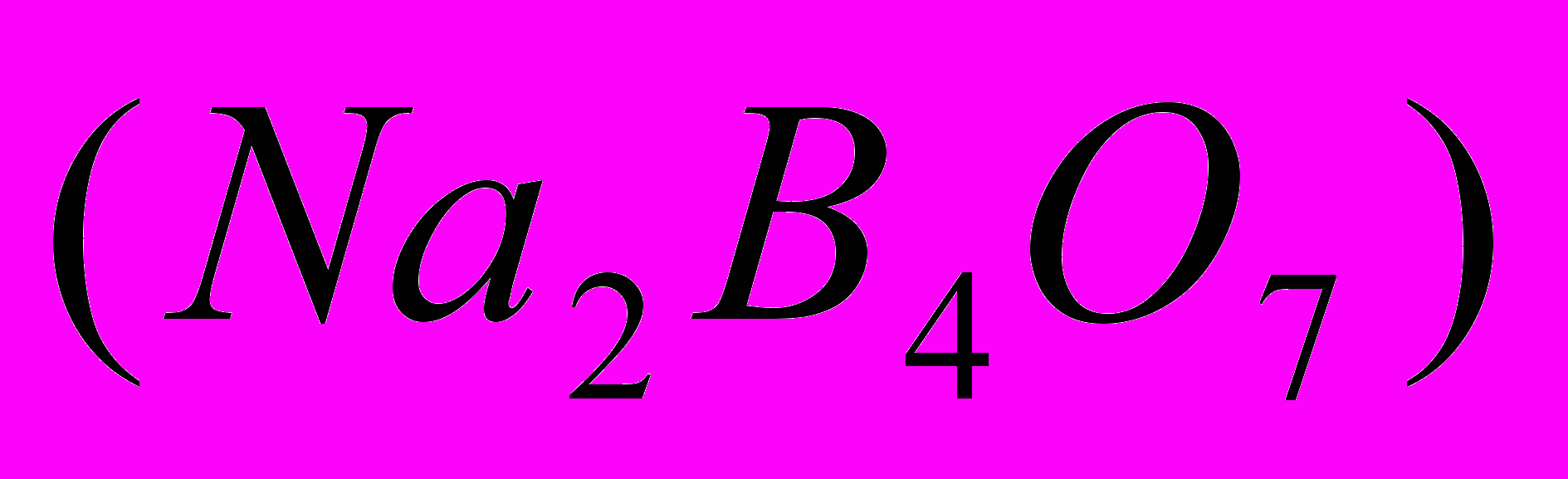 = Vaл. = 10 мл;
= Vaл. = 10 мл; 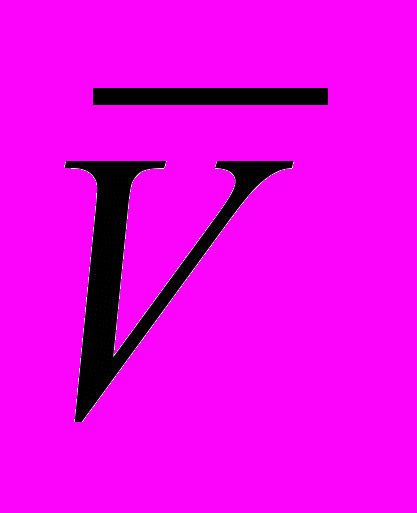 (HCl) – средний объем HCl, пошедшей на титрование тетрабората натрия по бюретке.
(HCl) – средний объем HCl, пошедшей на титрование тетрабората натрия по бюретке.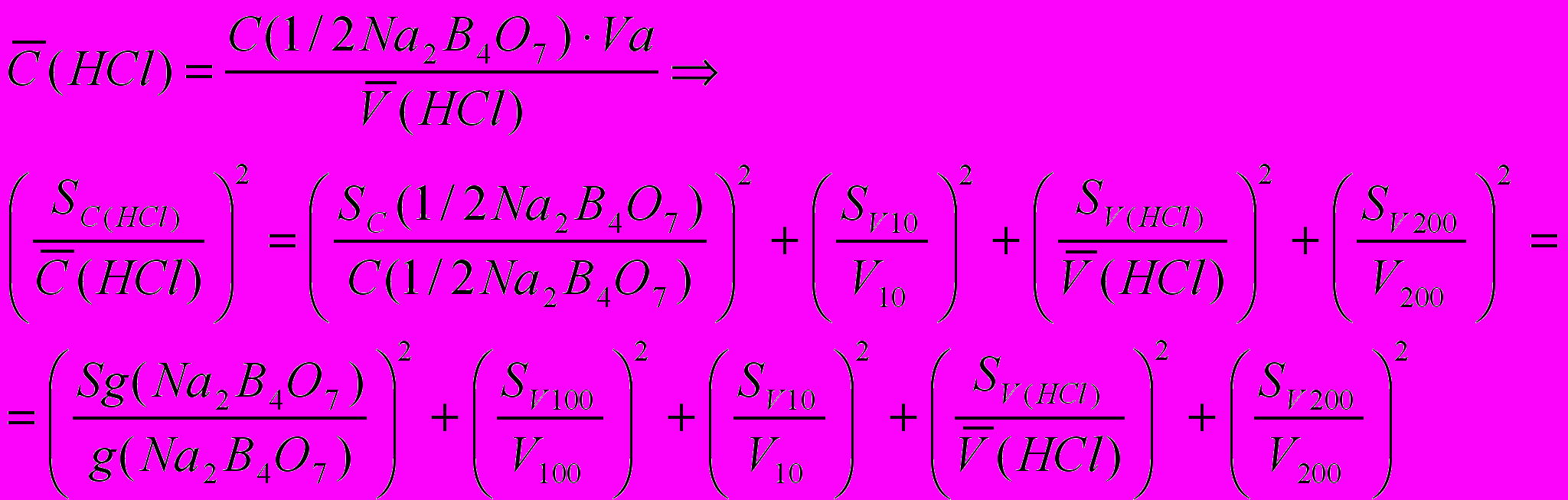
3) ошибка стандартизации гидроксида натрия (NaOH приготовлен в колбе на 250 мл)


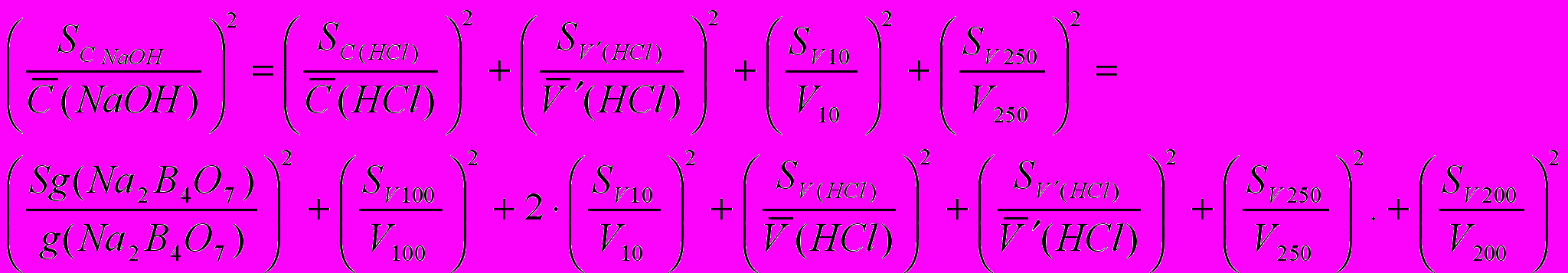
4) ошибка определения серной кислоты
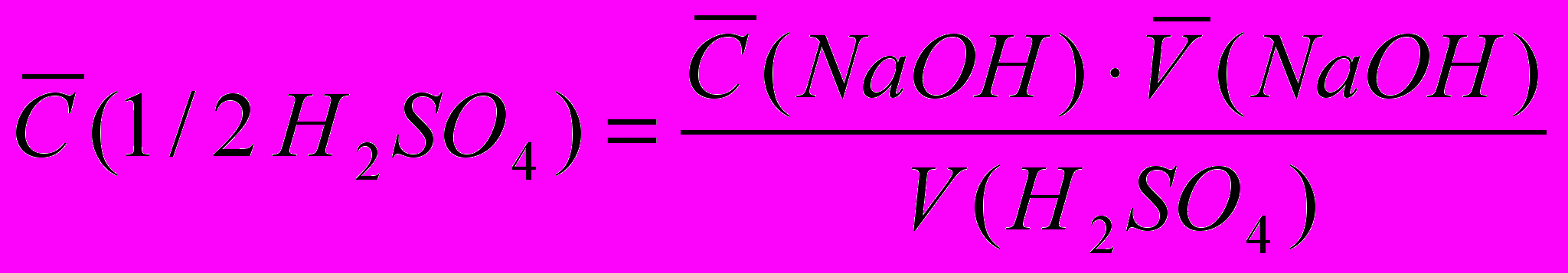
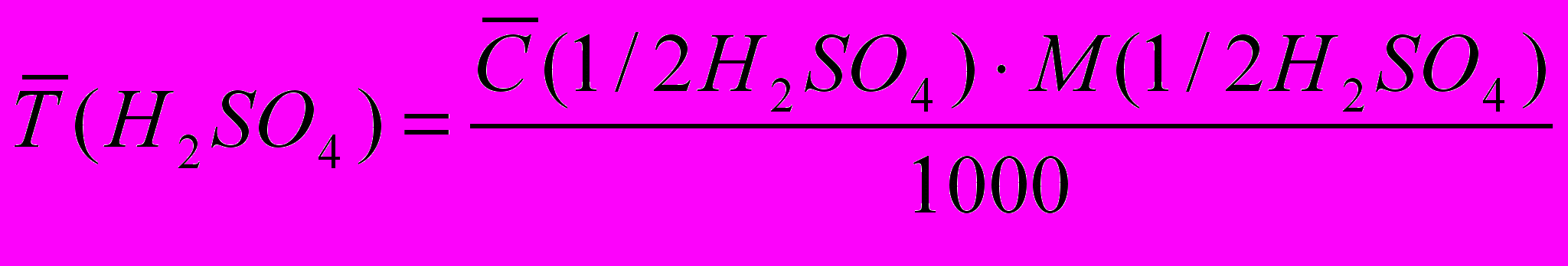
m (H2SО4) = T(H2SО4).Vм.к.