Л. В. Щербакова практикум по аналитической химии барнаул 2004 министерство образования российской федерации алтайский государственный университет химический факультет практикум
| Вид материала | Практикум |
- Практикум Владивосток 2004 Министерство образования и науки Российской Федерации Владивостокский, 628.95kb.
- Практикум Ярославль, 2004 Министерство образования и науки РФ ярославский государственный, 885.94kb.
- Министерство Образования Российской Федерации Московский Государственный Университете, 1997.23kb.
- А. М. Горького Кафедра алгебры и дискретной математики Щербакова В. А. Лабораторный, 418.72kb.
- Анализ воды, 505.46kb.
- Российской Федерации Министерство образования и науки Российской Федерации Государственный, 343.55kb.
- Учебно-практическое пособие Хабаровск, 2001. Министерство образования Российской Федерации, 2795.36kb.
- Практикум ростов-на-Дону 2008 министерство образования и науки российской федерации, 1352.33kb.
- Учебное пособие Министерство общего и профессионального образования Российской Федерации, 936.13kb.
- Российской Федерации Уральский Государственный Университет им. А. М. Горького Философский, 1670.87kb.
Экспериментальная часть
Аппаратура.
амперометрическая установка АУ-4;
платиновый индикаторный электрод;
насыщенный каломельный электрод сравнения.
Посуда и реактивы.
стандартный раствор ферроцианида калия, 0,020 М;
насыщенный раствор сульфата калия;
разбавленная 1 : 1 азотная кислота;
химический стакан вместимостью 50 или 100 мл;
бюретка вместимостью 25 мл;
мерная колба вместимостью 100 мл;
пипетка вместимостью 10 мл.
Порядок работы на амперометрической установке АУ – 4М: Прежде, чем приступить к работе тщательно изучите инструкцию к прибору (разделы 4,1 – 4,5; 7,5). Установка АУ – 4М находится в собранном виде, готовом к работе. Каломельный электрод взбалтывать и менять строго запрещается.
Подготовка и порядок работы:
- Снимите стальной диск с верхней части панели прибора.
- Заполните бюретку и убедитесь, что в капилляре и бюретке нет пузырьков воздуха.
- Блок титрования включите в сеть при помощи шнура с вилкой.
- Тумблер «Сеть» поставьте в положение «Вкл.».
- В титрационный стакан опустите перемешивающий стержень.
- Проверьте работу магнитной мешалки, переключив переключатель «Мотор» в положение 1, 2, 3, 4 и установите нужную скорость.
- Переключатель «Компенсация» должен всегда стоять в положении «0».
- Переключатель «Время между титрованием» и «Время титрования» - «Выкл.»
- Ручку переключателя «Чувствительность гальванометра» установить в положение «4».
- Вращая ручку «Наложение» установите нужное напряжение (0,8 В).
- Опустите индикаторный электрод (Pt) и ключ электрода сравнения в титрационный стакан и приступайте к титрованию.
- Выключается прибор в обратном порядке.
Выполнение работы.
Раствор ZnSO4 или раствор пробы помещают в мерную колбу на 100 мл и доводят до метки дистиллированной водой. В стакан для титрования емкостью 50 мл помещают аликвоту 10 мл и добавляют K2SO4 до 25 мл, опускают индикаторный электрод и ключ каломельного электрода сравнения.
Бюретку заполняют раствором K4[Fe(CN)6], включают магнитную мешалку, устанавливают потенциал (+0,8 В) с помощью ручки «Наложение». Ручку переключателя «Чувствительность гальванометра» устанавливают в положение 4. Гальванометр устанавливают на 10 мА (положение 10). Приступают к титрованию ионов цинка раствором ферроцианида калия, замечая показания микроамперметра после прибавления каждой порции титранта. Строят кривую титрования (для каждого титрования отдельно) в координатах: сила тока (мА) – объем титранта (мл). На каждой прямой должно быть не менее 5 точек. Находят объем титранта соответствующей точки стехиометричности. Титрование проводят не менее 3 – 4 раз. После каждого титрования электрод промывают разбавленной 1 : 1 HNO3 и водой. После окончания работы электроды промывают и вместе с солевым мостиком помещают в титрационный сосуд с водой.
Расчет. Массу Zn в мг вычисляют по формуле:
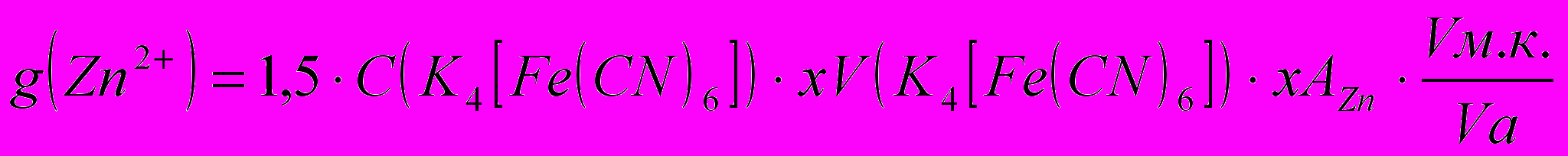
Где, 1,5 – отношение числа молей ZnSO4 к числу молей K4[Fe(CN)6] в уравнении реакции;
C (K4[Fe(CN)6]) – молярная концентрация реагента;
V (K4[Fe(CN)6]) – объем реагента;
AZn – атомный вес цинка (65,37);
Vм.к. – объем колбы (100 мл);
Vа. – объем аликвоты (10 мл).
СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
Лабораторная работа №1
Фотометрическое определение содержания никеля(II) диметилглиоксимом в присутствии окислителей
Цель работы. Изучение фотометрического метода анализа и его применение для анализа однокомпонентных систем.
Задание. Определить содержание никеля (II) в растворе в присутствии иода. Провести статистическую обработку и обсуждение результатов.
Теоретическое введение. Теоретические основы, классификация, метрологические характеристики методов молекулярной спектроскопии. Законы светопоглощения, условия их выполнения, основные причины отклонения от основного закона светопоглощения. Анализ одно- и многокомпонентных систем. – См. учебную литературу и лекции.
Обоснование методики. В щелочной среде (аммиак, щелочь) в присутствии окислителя (бром, иод, пероксид водорода, персульфат аммония) никель (II) образует с диметилглиоксимом (Н2Д) растворимый в воде красно-коричневый комплекс. В результате реакции происходит окисление никеля (II), вероятно, до Ni(III). В зависимости от того, проводится ли реакция в среде аммиака или щелочи, образуются два различных комплекса, отличающихся своими спектральными характеристиками. Комплекс, образующийся в щелочной среде, характеризуется интенсивной полосой поглощения с λ макс. 470 нм и ε макс. = 1.3·104 . Соотношение Ni: H2Д в комплексе равно 1 : 3.
Для аналитических целей лучшим окислителем является иод, так как получающееся в его присутствии комплексное соединение более устойчиво во времени. Избыток иода в растворе не окисляет диметилглиоксим, что позволяет добиваться хорошей воспроизводимости результатов фотометрических определений. Определению никеля мешают большинство элементов. Их чаще всего маскируют тартратами или цитратами.
Экспериментальная часть
Аппаратура:
Колориметр фотоэлектрический концентрационный КФК-2.
Посуда и реактивы:
Пипетки градуированные вместимостью 5;10 мл.;
- Мерные колбы вместимостью 50 мл.;
- Стандартный раствор никеля(II), 0.010 мг/мл.;
- Иод, 0.05 М раствор;
- Диметилглиоксим, 1%-ный раствор в 20 %-ом растворе NaOH.
Выполнение работы.
В 5 мерных колб вместимостью 50,0 мл приливают 20 мл воды, стандартный раствор никеля с содержанием (мг): 0,02; 0,04; 0,06; 0,08 и 0,10 соответственно, 0,5 мл раствора иода, 0,5 мл раствора диметилглиоксима. Содержимое колбы разбавляют дистиллированной водой до метки. Через 10 мин растворы фотометрируют относительно воды и строят градуировочный график.
Аликвотную часть анализируемого раствора помещают в мерную колбу вместимостью 50,0 мл, разбавляют водой до 20 мл и далее проводят те же операции и в той же последовательности, что и при приготовлении растворов, используемых для построения градуировочного графика. Спустя 10 мин после приготовления, раствор фотометрируют относительно воды. Содержание никеля находят по градуировочному графику. Измерения повторяют три раза. Проводят статистическую обработку и обсуждение результатов.
Лабораторная работа №2
Фотометрическое определение содержания меди дифференциальным методом
Цель работы. Изучение дифференциального метода фотометрического анализа и его применение для анализа однокомпонентных систем.
Задание. Выбрать оптимальный раствор сравнения. Определить содержание меди(II). Провести статистическую обработку и обсуждение результатов.
Теоретическое введение. См. лабораторную работу №1.
Обоснование методики. Метод дифференциальной абсорбционной спектроскопии применяют для повышения точности определения высоких концентраций веществ в растворе. При выполнении дифференциальных измерений в качестве раствора сравнения используют раствор определяемого вещества. Точность измерений тем выше, чем ближе концентрации определяемого вещества в анализируемом растворе и растворе сравнения и чем больше условная оптическая плотность последнего. Так как поглощение анализируемого раствора может быть больше или меньше поглощения раствора сравнения, то при дифференциальных измерениях удобнее использовать метод двусторонней дифференциальной абсорбционной спектроскопии. Работа по определению веществ методом дифференциальной абсорбционной спектроскопии включает следующие этапы:
- выбор оптимального раствора сравнения;
- построение градуировочного графика или нахождение значения фактора пересчета;
- определение содержания вещества в анализируемом растворе по результатам измерения его относительной оптической плотности.
Экспериментальная часть
Аппаратура.
Колориметр фотоэлектрический концентрационный КФК-2;
Кюветы стеклянные l = 0,50 см;
Посуда и реактивы:
Пипетки вместимостью 5 и 10 мл;
Колбы мерные вместимостью 50 мл;
Стандартный раствор меди содержащий 2,0 мг/мл меди
Аммиак, 25 % раствор
Выполнение работы.
Определение проводят в виде аммиачного комплексного соединения( = 1102 , = 610 нм). Для приготовления стандартных растворов в 6 мерных колб вместимостью 50 мл вводят по 10 мл дистиллированной воды, стандартный раствор, содержащий медь в количестве, мг: 10,0; 12,0; 14,0; 16,0; 18,0; 20,0, по 5 мл концентрированного раствора аммиака. Объем полученного раствора разбавляют дистиллированной водой до метки, тщательно перемешивают. Выбирают оптимальный раствор сравнения, для этого измеряют оптические плотности каждого последующего из приготовленных растворов относительно предыдущего и вычисляют = Аi/С и произведение iС0,I, где С0,I – концентрация раствора, который в i –ом измерении являлся раствором сравнения.
Для построения градуировочного графика измеряют оптические плотности серии растворов по отношению к раствору, для которого произведение iС0,I имеет максимальное значение. Оптические плотности будут иметь отрицательные значения, если поглощение исследуемого раствора меньше поглощения раствора сравнения. Обычные фотометры не приспособлены для измерения отрицательных значений оптической плотности, последние могут быть получены, если измерять оптическую плотность раствора сравнения относительно исследуемого раствора и брать со знаком « ». Используя полученные значения оптических плотностей строят гадуировочный график в координатах: оптическая плотность - содержание меди, мг.
Определение меди в исследуемом растворе:
Исследуемый раствор получают у преподавателя в мерной колбе вместимостью 50 мл, добавляют 5 мл раствора аммиака, разбавляют дистиллированной водой до метки и тщательно перемешивают. Содержание меди в исследуемом растворе определяют по градуировочному графику. Измерения повторяют три раза, проводят статистическую обработку и обсуждение результатов.
Лабораторная работа №3
Спектрофотометрическое определение содержания железа(III) в присутствии кобальта
Цель работы. Изучение спектрофотометрического метода анализа и его применение для определения содержания в растворе одного окрашенного вещества (салицилата железа) в присутствии другого (соли кобальта).
Задание. Выбрать оптимальный участок спектра для определения железа (III) фотометрическим методом в присутствии кобальта (II). Определить содержание железа (III). Провести статистическую обработку и обсуждение результатов анализа.
Теоретическое введение. См. лабораторную работу №1.
Обоснование методики: Сульфосалициловая кислота образует при рН=4,5 окрашенный комплекс с железом(III). Растворы сульфосалицилового комплекса железа и соли кобальта в среде ацетатного буферного раствора имеют различную окраску. В некоторой области спектра поглощение сульфосалицилатного комплексом железа имеет максимальное значение. Поглощение раствором соли кобальта в этой области спектра практически равно нулю. По оптической плотности исследуемого раствора в данной области рассчитывают концентрацию железа. Пренебрегая поглощением раствора соли кобальта при оптимальном светофильтре, строят градуировачный график в координатах: оптическая плотность – концентрация железа. Затем измеряют оптическую плотность неизвестного раствора и по градуировачному графику определяют концентрацию железа.
Экспериментальная часть
Аппаратура.
Колориметр фотоэлектрический концентрационный КФК-2;
Посуда и реактивы:
Пипетки вместимостью 5,10,20 мл;
Колбы мерные вместимостью 50, 100 мл;
Колбы конические вместимостью 100 мл;
Кюветы стеклянные l = 1,00 см;
Мерные цилиндры вместимостью 25 мл;
Железоаммонийные квасцы (раствор А), с концентрацией железа 1,00 мг/мл.
Сульфосалициловая кислота, 20 %-ный раствор;
Буферный раствор, рН=5,2;
Водный раствор кобальта(II) с титром I0,00 мг/мл.
Выполнение работы.
Подходящий для проведения измерений участок спектра (оптимальный светофильтр) выбирают на основании кривых светопоглощения. Для построения кривых светопоглощения готовят раствор с концентрацией соли железа равной 0,0100 мг/мл (раствор Б). Для приготовления этого раствора помещают 10,0 мл раствора А в мерную колбу вместимостью 100,0 мл и разбавляют дистиллированной водой до метки. Затем в мерную колбу вместимостью 50,0 мл пипеткой вносят 5,00 мл раствора Б, цилиндром прибавляют 5 мл 20 % раствора сульфосалициловой кислоты и 20 мл дистиллированной воды. Добавляют буферный раствор до прекращения видимого изменения окраски и еще небольшой избыток. Объем полученного раствора разбавляют дистиллированной водой до метки, перемешивают и измеряют оптическую плотность при различных светофильтрах фотометра (или при различных длинах волн при использовании спектрофотометра).
В другой мерной колбе на 50 мл к 20 мл раствора соли кобальта прибавляют 5 мл раствора сульфосалициловой кислоты, 20 – 25 мл буферного раствора, доводят объем дистиллированной водой до метки и фотометрируют.
На основании полученных данных строят кривые светопоглощения и находят тот участок спектра, где поглощение сульфосалицилатного комплекса железа максимально, а поглощением соли кобальта можно пренебречь. Используя выбранный светофильтр (в случае спектрофотометра – при найденной длине волны), измеряют оптическую плотность стандартных растворов соли железа для построения градуировочного графика. Для этого готовят 5-6 растворов с концентрацией железа 0,0010 - 0,010 мг/мл путем разбавления точно отмеренного объема железоаммонийных квасцов (0,100 мг/мл) в мерной колбе вместимостью 50 мл. Раствор сульфосалициловой кислоты и буферный раствор прибавляют в тех же количествах, что и при приготовлении растворов для снятия кривой светопоглощения. Измеряют оптическую плотность при выбранном светофильтре (или соответствующей длине волны). На основании полученных данных строят график зависимости оптической плотности от концентрации железа (мг/мл).
Определение железа в исследуемом растворе:
Исследуемый раствор получают у преподавателя в мерной колбе вместимостью 50 мл, разбавляют дистиллированной водой до метки и тщательно перемешивают. Аликвоту раствора (2,50 мл) переносят в мерную колбу вместимостью 50,0 мл и далее поступают так, как при приготовлении растворов для построения градуировочного графика. Раствор фотометрируют и, на основании найденного значения оптической плотности, по градуировочному графику определяют концентрацию железа в исследуемом растворе, а затем его содержание в мг. Измерения повторяют три раза. Проводят статистическую обработку результатов.
Лабораторная работа №4
Спектрофотометрическое определение содержания хрома (VI) и марганца (VII) при совместном присутствии
Цель работы. Спектрофотометрическое определение содержания двух веществ в пробе при наличии в спектре поглощения раствора участка, в котором поглощает одно вещество.
Задание. Определить содержание хрома (VI) и марганца (VII) при совместном присутствии. Провести статистическую обработку и обсуждение результатов анализа.
Теоретическое введение. См. лабораторную работу №1.
Обоснование методики: Для определения хрома и марганца при совместном присутствии, их окисляют соответственно до бихромата и перманганата. Оптическая плотность исследуемого раствора пропорциональна содержанию марганца и хрома. В растворе не должны присутствовать восстановители, в том числе и хлорид-ионы. Так как в спектре имеется участок, в котором поглощает один из компонентов – KMnO4, система уравнений
 А(l2)= e2(l2)lс2
А(l2)= e2(l2)lс2А(l1)= e1(l1)с1l+e2(l1)с2l
упрощается следующим образом:

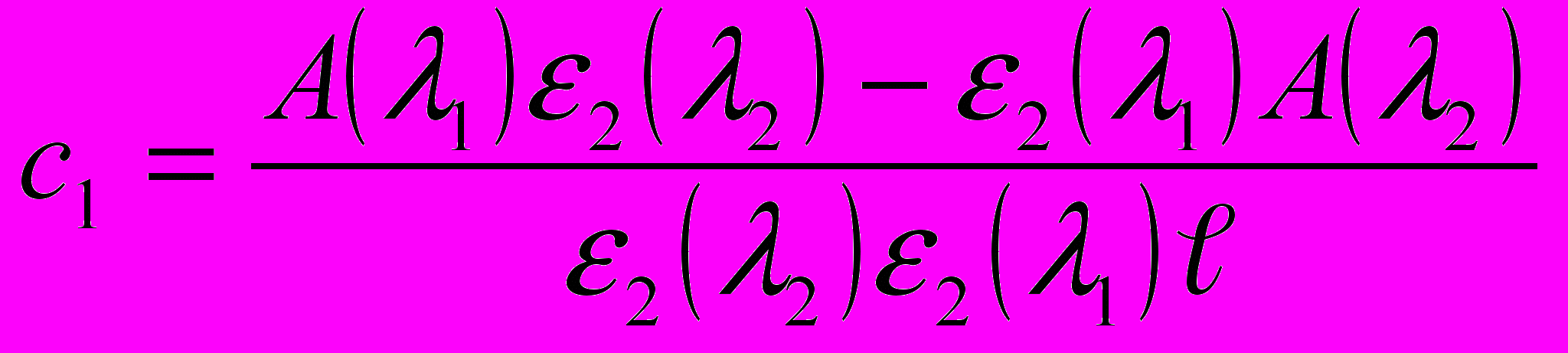

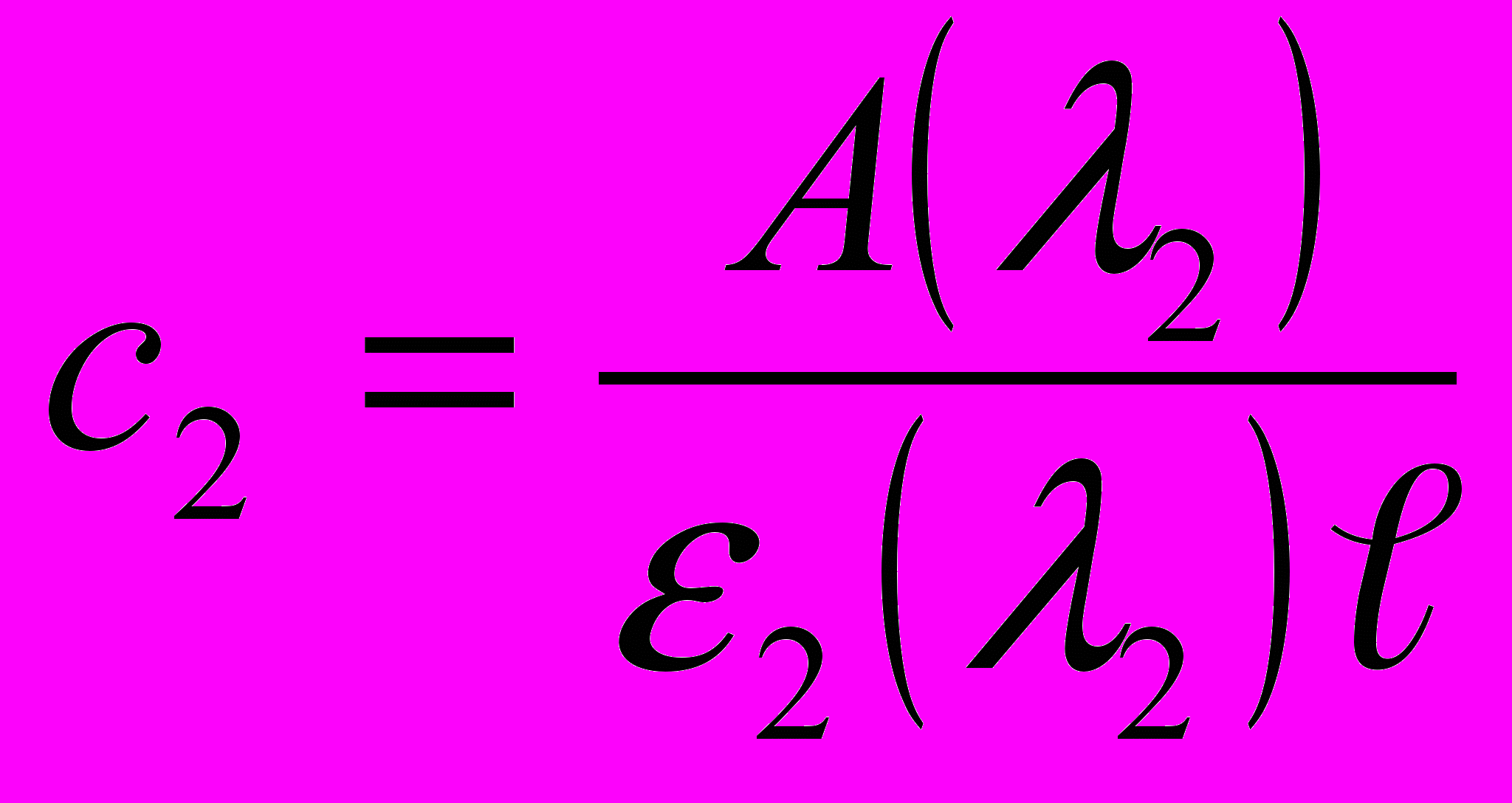 ,
,где с1 и с2 – соответственно концентрации K2Сr2O7 и KМnO4, моль/л.
e1(l1) молярный коэффициент поглощения K2Сr2O7 при l1=440 нм,
e2(l2) молярный коэффициент поглощения KМnO4 при l2=540 нм,
А(l1),А(l2) оптические плотности раствора смеси при l1=440 нм, l2=540 нм
l толщина поглощающего слоя раствора, см.
Для проведения определений применяют метод градуировочного графика. Этот метод применим для определения двух компонентов, когда имеется участок спектра, на котором поглощением одного из компонентов можно пренебречь.
Перед определением строят градуировочный график для K2Сr2O7 при l1=440 нм и для KМnO4 при l2=540 нм и по графику определяют концентрацию марганца Смn, так как влиянием K2Сr2O7 при этой длине волны можно пренебречь.
Измеряют оптическую плотность А(l1) анализируемой смеси при l1=440 нм. Общая оптическая плотность представляет сумму оптических плотностей компонентов:
А(l1)=А1(l1)+ А2(l1) ,
где А1(l1), А2(l1) оптические плотности при поглощении света бихроматом и перманганатом калия при (l1=440 нм) в смеси. Значение А2(l1) определяют по прямой 2 (см. рис. 1 и 2). Концентрацию СMn в исследуемой смеси находят по прямой I. Затем по разности находят:
А1(l1) =А(l1) - А2(l1)
По значению А1(l1) прямой 3 определяют концентрацию Cr в анализируемой смеси.
Экспериментальная часть
Аппаратура.
Колориметр фотоэлектрический концентрационный КФК-2.
Посуда и реактивы:
Пипетки градуированные вместимостью 5;10 мл.;
- Мерные колбы вместимостью 50,0 мл.;
- 0,100 М(1/5 КМnО4) раствор КМnО4. Перед применением 9,1 мл раствора разбавляют водой до 100 мл. Этот раствор содержит 0,100 мг марганца в 1 мл.;
- Раствор К2Сr2О7, с титром хрома 1,00 мг/мл.;
- H2SO4, разбавленный 1:1 раствор.
Выполнение работы.
Готовят стандартный раствор перманганата калия из исходного 0,100 М, для этого градуированной пипеткой вместимостью 10,00 мл 9,10 мл исходного раствора KMnO4 вносят в мерную колбу вместимостью 100,0 мл и разбавляют дистиллированной водой до метки. Для построения градуировочных графиков пипеткой отбирают соответственно 1,00; 2,50; 5,00; 7,50; 10,0 мл стандартного раствора КМnО4 в мерные колбы вместимостью 50,0 мл, добавляют 5 мл H2SO4 и разбавляют дистиллированной водой до метки. Растворы тщательно перемешивают. Измеряют оптические плотности приготовленных стандартных растворов КМnО4 при l1=440 нм и l2=540 нм в кюветах с толщиной поглощающего слоя 1 см. Полученные данные заносят в таблицу:
| Стандартный Раствор | № эталона | Объём эталона | Содержание в 50 мл | Оптическая плотность при 540 нм | Оптическая плотность при 440 нм | |
| | | | Mn | Cr | | |
| КмnО4 | 1 2 3 4 5 | 1,00 2,50 5,00 7,50 10,0 | 0,100 0,250 0,500 0,750 1,00 | | | |
| К2Сr2О7 | 1 2 3 4 5 | 1,00 2,50 5,00 7,50 10,0 | | 1,00 2,50 5,00 7,50 10,0 | | |
Строят градуировочные графики (например: рис. 1, прямые 1 и 2). Аналогично измеряют оптические плотности стандартных растворов бихромата калия при l= 440 нм, данные заносят в таблицу. Строят градуировочный график (например: прямая 3 на рис. 2).
Исследуемый раствор разбавляют до метки дистиллированной водой в колбе вместимостью 50,0 мл и тщательно перемешивают. Аликвоту раствора (5 мл) переносят в колбу вместимостью 50,0 мл, добавляют 5 мл H2SO4, разбавляют дистиллированной водой до метки. Раствор тщательно перемешивают. Измеряют оптическую плотность при 540 и 440 нм. По полученным данным находят содержание Mn и Cr в растворе. Измерения повторяют три раза, проводят статистическую обработку и обсуждение результатов.

l2=540 нм
1
А
